Mécanismes anti-âge et durée de vie plus longue associés à la restriction calorique: données d'études sur des animaux génétiquement modifiés.
Il est bien connu que la restriction calorique (CR) augmente l'espérance de vie et inhibe divers changements physiopathologiques. La CR supprime la signalisation de l'hormone de croissance / facteur de croissance analogue à l'insuline et de mTORC1, active la sirtuine et améliore la régulation redox mitochondriale. Mais les mécanismes exacts sont en discussion. Dans cette revue, nous discutons des mécanismes CR utilisant des données de recherche animale qui ont été génétiquement modifiées conformément aux progrès récents des technologies moléculaires et génétiques, en termes d'hypothèse de réponse adaptative proposée par Holliday en 1989. Nous expliquerons également les effets positifs de la CR, classés selon qu'ils agissent dans des conditions nutritionnelles ou à jeun.
En 1935, la CR a été décrite comme augmentant la longévité chez le rat [1]. CR, également connu sous le nom de restriction alimentaire ou restriction énergétique, est largement utilisé dans la recherche sur le vieillissement comme une manipulation alimentaire forte et facilement reproductible pour prolonger la vie. La CR a été observée chez plusieurs espèces, des levures et nématodes aux mammifères. Chez les mammifères, il a été principalement étudié à l'aide de rongeurs dans lesquels la CR supprime divers changements physiopathologiques liés à l'âge et prolonge la durée de vie moyenne et maximale. Cependant, les effets bénéfiques de la CR disparaissent dans certaines souches et / ou conditions. Une revue récente détaille ces limitations [2]. Le degré auquel la CR exerce des effets bénéfiques dépend de facteurs tels que les espèces de rongeurs, les souches et le moment de l'initiation de la CR. En général, cependant, le CR à long terme commencé à un jeune âge supprime les changements physiopathologiques liés à l'âge et prolonge la longévité chez différents rongeurs. Il est également important que les limitations des nutriments individuels (par exemple, le glucose, les lipides, les protéines) sans restriction énergétique ne provoquent pas de tels effets bénéfiques [3, 4].
Il y a plus de 20 ans, les souris naines Ames qui ont une mutation du gène Prop1 se sont révélées vivre plus longtemps que les souris de type sauvage [5]. Ce fut le premier rapport qu'une mutation génétique unique ou une modification génétique peut prolonger la longévité chez les mammifères. À notre connaissance, plus de 40 souris et rats avec une seule mutation génétique ou modification génétique vivent plus longtemps que les animaux de type sauvage. Parmi ces souris et rats, environ un tiers présentent une signalisation de l'hormone de croissance (GH) / facteur de croissance analogue à l'insuline (IGF1) supprimée. Étant donné que CR supprime également la signalisation GH / IGF1, les effets bénéfiques de CR peuvent être basés sur cela. D'autres mécanismes moléculaires qui ont été proposés pour réguler les effets bénéfiques de la CR comprennent l'inhibition de l'activité de la cible mécaniste du complexe de rapamycine 1 (mTORC1), l'activation de l'autophagie, l'activation du NAD + et du métabolisme de la sirtuine, et une régulation redox accrue des mitochondries [6, 7]. Cependant, ces mécanismes ne sont pas entièrement compris.
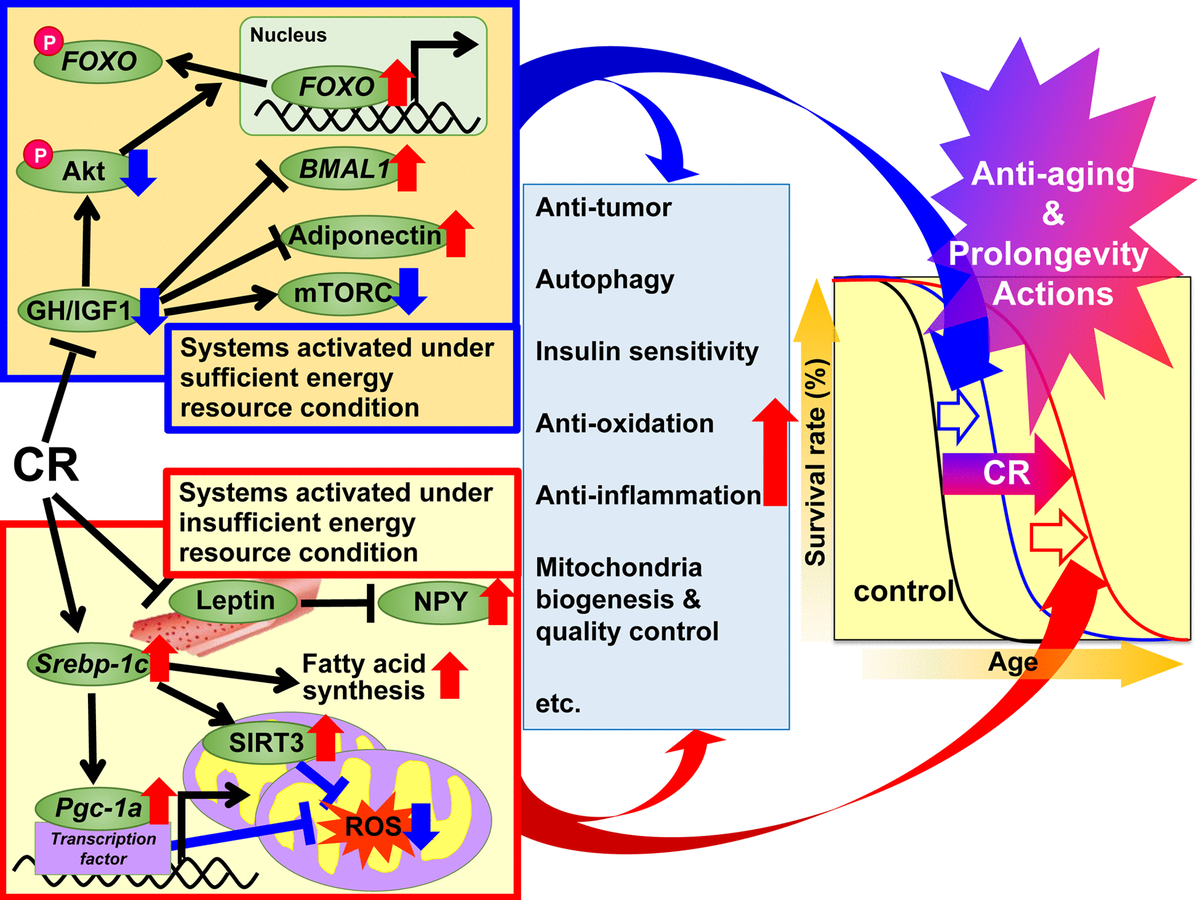 Fig.1. Les mécanismes d'action proposés de la restriction calorique (CR) contre le vieillissement et pour augmenter la durée de vie en fonction de l'hypothèse de réponse adaptative. Il est proposé de diviser les mécanismes de régulation du CR en deux systèmes. Le premier système est activé dans des conditions énergétiques suffisantes, lorsqu'il est possible d'utiliser librement l'énergie et que les animaux grandissent bien, se reproduisent davantage et stockent l'excès d'énergie sous forme de triglycérides (TG) dans le tissu adipeux blanc (WAT) pour une utilisation ultérieure. Ce système comprend l'hormone de croissance (GH) / facteur de croissance analogue à l'insuline 1 (IGF1), Akt, FOXO, mTORC, l'adiponectine et BMAL1. Le deuxième système est activé dans des conditions d'énergie insuffisante, lorsqu'il n'y a aucun avantage d'une utilisation excessive d'énergie, et les animaux suppriment la croissance et la reproduction et utilisent l'énergie économisée pour maintenir la fonction biologique. Ce système comprend de telles voies de signalisation: protéine SREBP-1c, sirtuine (SIRT), protéine PGC-1α, espèces réactives de l'oxygène mitochondrial (ROS), leptine et neuropeptide Y (NPY). Chez les animaux atteints de CR, ces signaux sont efficaces pour consommation d'énergie. De plus, divers signaux et / ou facteurs peuvent contribuer aux effets bénéfiques associés à la RC, y compris les actions antioxydantes, anti-inflammatoires, anti-tumorales et autres actions CR à des degrés divers dans chaque tissu ou organe, et ainsi conduire au rajeunissement et à la prolongation de la vie.
Fig.1. Les mécanismes d'action proposés de la restriction calorique (CR) contre le vieillissement et pour augmenter la durée de vie en fonction de l'hypothèse de réponse adaptative. Il est proposé de diviser les mécanismes de régulation du CR en deux systèmes. Le premier système est activé dans des conditions énergétiques suffisantes, lorsqu'il est possible d'utiliser librement l'énergie et que les animaux grandissent bien, se reproduisent davantage et stockent l'excès d'énergie sous forme de triglycérides (TG) dans le tissu adipeux blanc (WAT) pour une utilisation ultérieure. Ce système comprend l'hormone de croissance (GH) / facteur de croissance analogue à l'insuline 1 (IGF1), Akt, FOXO, mTORC, l'adiponectine et BMAL1. Le deuxième système est activé dans des conditions d'énergie insuffisante, lorsqu'il n'y a aucun avantage d'une utilisation excessive d'énergie, et les animaux suppriment la croissance et la reproduction et utilisent l'énergie économisée pour maintenir la fonction biologique. Ce système comprend de telles voies de signalisation: protéine SREBP-1c, sirtuine (SIRT), protéine PGC-1α, espèces réactives de l'oxygène mitochondrial (ROS), leptine et neuropeptide Y (NPY). Chez les animaux atteints de CR, ces signaux sont efficaces pour consommation d'énergie. De plus, divers signaux et / ou facteurs peuvent contribuer aux effets bénéfiques associés à la RC, y compris les actions antioxydantes, anti-inflammatoires, anti-tumorales et autres actions CR à des degrés divers dans chaque tissu ou organe, et ainsi conduire au rajeunissement et à la prolongation de la vie.Objectifs et mécanismes moléculaires de la RC
Signalisation GH, IGF1 et FOXO1
La GH régule à la hausse la production d'IGF1 principalement dans le foie via le récepteur de la GH (GHR). IGF1 agit sur le récepteur IGF1 puis phosphoryle Akt, sérine / thréonine kinase dans les cellules cibles. La forme phosphorylée d'Akt phosphoryle ensuite les facteurs de transcription de FOXO, facilitant l'exportation nucléaire. Par conséquent, la suppression de la signalisation GH / IGF1 augmente la transcription de l'expression de plusieurs gènes activés par les facteurs de transcription FOXO.
Plusieurs espèces de souris modifiées, le nain Ames, le nain Snell et le knockout GHR (GHR KO), présentent une signalisation GH supprimée et ont une durée de vie prolongée. Ces souris naines ont des phénotypes similaires aux souris CR, y compris la suppression de la signalisation GH / IGF1, une diminution des niveaux d'hormone thyroïdienne, d'insuline et de glucose, une température corporelle plus basse et une obésité réduite. Cependant, le profil d'expression des gènes du foie diffère considérablement entre les souris GHR KO et les souris CR [8]. Nous avons également signalé qu'une partie du profil d'expression génique dans le tissu adipeux blanc (WAT) des rats CR est significativement différente de celle des rats nains à vie portant le transgène antisens GH [9].
Bonkowski et al. ont rapporté que la CR augmente la sensibilité à l'insuline et augmente l'espérance de vie chez les souris de type sauvage, mais pas chez les souris GHR KO [10]. Par conséquent, ils ont suggéré que l'effet de l'augmentation de la durée de vie du CR dépend de la suppression de la signalisation GH / IGF1. Chez les souris naines et les rats nains porteurs du transgène antisens GH, CR a encore augmenté l'espérance de vie [11, 12]. Ces données suggèrent que les actions anti-âge et l'augmentation de l'espérance de vie des CR peuvent être régulées indépendamment du signal GH / IGF1 et indépendamment.
Les facteurs de transcription FOXO chez les mammifères se composent de quatre isoformes, c'est-à-dire FOXO1, 3, 4 et 6. Les souris FOXO1 KO (avec un knock-out de ce gène) ont une durée de vie CR prolongée, mais il n'y avait aucun effet antitumoral associé à CR [13]. Inversement, chez les souris FOXO3 KO, l'ajout de CR a inhibé la tumorigenèse, mais il n'y a pas eu d'augmentation induite par CR dans la durée de vie [14]. Ces différences peuvent être associées à un schéma d'activation différentielle dans les tissus et / ou les cellules des quatre isoformes des facteurs de transcription FOXO induits par CROX.
La protéine BMAL1 est un facteur de transcription impliqué dans la régulation du rythme circadien. Chez les souris BMAL1 KO (éliminées de ce gène), l'apport alimentaire a augmenté, le poids corporel a diminué et les phénotypes vieillissants se sont accélérés. Chez ces mêmes souris, CR n'a pas abaissé les niveaux d'insuline et d'IGF1 et n'a pas augmenté l'espérance de vie. Ce qui indique la participation de BMAL1 à l'effet bénéfique du CR et que cet effet bénéfique dépend de la transmission des signaux GH / IGF1 [15].
Alarme mTOR
La mTOR kinase, sérine / thréonine kinase, a été identifiée comme la molécule cible de la rapamycine. Il forme deux complexes multi-protéiques distincts, appelés mTORC1 et mTORC2. MTORC1 est connu pour être activé par les acides aminés et les facteurs de croissance (par exemple, l'insuline et l'IGF1). L'activation de mTORC1 favorise la synthèse des protéines via la protéine kinase ribosomale S6 1, la synthèse des acides gras via la protéine de liaison régulatrice stéroïdienne (SREBP) 1 et la différenciation des adipocytes par les récepteurs activés par les proliférateurs de peroxysomes (PPARγ). mTORC1 inhibe l'autophagie et la biosynthèse lysosomale par le biais du facteur de transcription EB (TFEB). La fonction de mTORC2 est mal connue, mais on pense qu'elle inclut une augmentation des actions anaboliques et une suppression des actions cataboliques, comme pour mTORC1 [16].
Les souris ayant reçu une régulation négative de la rapamycine mTORC1 pendant une longue période après l'âge moyen ont eu une augmentation de l'espérance de vie [17]. Conformément à cette découverte, les souris transgéniques avec surexpression de la protéine TSC1, qui régule négativement mTORC1, vivent plus longtemps que les souris de type sauvage [18]. De plus, les souris knock-out avec la protéine kinase ribosomale S6 1 et les souris mutantes mTOR ont également vécu plus longtemps que les souris de type sauvage [19, 20].
À notre connaissance, les effets bénéfiques de la CR n'ont pas encore été étudiés chez des souris dont la fonction mTORC1 est défectueuse. Cependant, chez la levure avec inhibition génétique, mTOR CR n'a pas augmenté la durée de vie [21]. L'autophagie est renforcée par l'inhibition de mTORC1. Chez les nématodes déficients en gènes associés à l'autophagie, la CR n'a pas augmenté la durée de vie [22]. Sur la base de ces données, il est probable qu'une diminution de l'activité mTOR et l'activation de l'appareil autophagique soient associées à un effet positif de la RC.
Sirtuins
Sir2 a été découvert comme un nouveau gène impliqué dans la suppression de la transcription chez la levure. Après cela, il a été signalé qu'il joue un rôle clé dans la prolongation de la vie en RC [23, 24]. Sept gènes orthologues des sirtuines, les sirtuines Sirt1 - Sirt7, ont été identifiés chez les mammifères. Les protéines SIRT1, 6 et 7 sont principalement localisées dans le noyau, SIRT2 dans le noyau et le cytoplasme, et SIRT 3, 4 et 5 principalement dans les mitochondries. Les sirtuines catalysent les réactions de désacétylation de diverses protéines, dont les histones, en fonction du NAD [25].
Parmi sept sirtuines de mammifères, SIRT1, 3 et 6 seraient impliqués dans la physiopathologie liée à l'âge et la régulation de la durée de vie [26]. Les souris transgéniques dans lesquelles la protéine SIRT1 était sélectivement surexprimée dans les neurones hypothalamiques avaient une durée de vie plus longue que les souris de type sauvage. [27]. Les souris femelles transgéniques dans lesquelles la protéine SIRT6 était surexprimée avaient une durée de vie plus longue que les souris de type sauvage [28]. Chez les souris âgées, CR a augmenté l'expression de SIRT6 et amélioré l'insuffisance rénale pendant 6 mois. De plus, alors que la surexpression de SIRT6 a supprimé le vieillissement cellulaire en réduisant l'activité du facteur de transcription lié à l'inflammation NF-κB, le knockout SIKT6 a accéléré le vieillissement cellulaire [29]. Chez les souris SIRT3 KO, diverses pathologies liées à l'âge ont été précédemment observées [30]. Bien que la CR ait empêché la perte d'audition liée à l'âge chez les souris de type sauvage, cet effet n'a pas été observé chez les souris SIRT3 KO [31].
Facteur de transcription NRF2
NRF2 se lie aux éléments de la réponse antioxydante pour induire l'expression des gènes cibles en réponse au stress oxydatif et améliore l'expression des gènes impliqués dans les réponses antioxydantes et de détoxication. Dans des conditions physiologiques, NRF2 se lie à la protéine Keap1 dans le cytoplasme, où il se dégrade. Sous stress, y compris le stress oxydatif, après que Keap1 est capturé par p62 phosphorylé, NRF2 se transloque vers le noyau, se lie aux éléments de réponse antioxydants et active la transcription des gènes antioxydants [32].
Étant donné que l'expression de NRF2 diminue avec le vieillissement chez les rongeurs, il est supposé que les niveaux d'espèces réactives de l'oxygène et divers risques de cancer augmentent. Cependant, CR supprime une baisse liée à l'âge de la capacité antioxydante en augmentant l'expression des gènes impliqués dans l'antioxydation et la détoxification. Chez les nématodes, Skn-1, un homologue de NRF2, est indispensable pour que l'action de CR augmente la durée de vie. Les souris knockout NRF2 montrent une diminution de l'expression des gènes impliqués dans la réponse antioxydante et la détoxication, entraînant une oncogenèse accélérée. Le rôle de NRF2 dans les effets bénéfiques de CR a été étudié en utilisant des souris NRF2 KO. Les résultats ont montré que NRF2 est important pour l'effet antitumoral de la CR, mais n'est pas impliqué dans les effets associés à l'espérance de vie et à l'augmentation de la sensibilité à l'insuline CR [33].
Neuropeptide Y (NPY)
Chez les mammifères, les neurones du noyau arqué hypothalamique détectent l'état énergétique à partir des niveaux de circulation hormonale. Le bilan énergétique négatif associé à la CR et la réduction subséquente de la masse grasse augmentent la circulation des niveaux de ghréline et d'adiponectine et réduisent les niveaux de leptine sanguine, d'insuline et d'IGF1. Ces changements hormonaux activent les neurones NPY dans le noyau arqué hypothalamique. La plupart de ces neurones synthétisent la protéine Agrp, affaiblissant l'activité des neurones POMC dans le noyau arqué. Un changement dans l'activité des neurones primaires inhibe les neurones hypothalamiques secondaires qui sécrètent la somatotropine, la gonadotrophine et l'hormone libérant la thyrotropine et active les neurones qui sécrètent l'hormone libérant la corticotropine. Ce changement hypothalamique supprime la signalisation GH / IGF1, la fonction thyroïdienne et la reproduction et active la fonction glucocorticoïde surrénale. La plupart de ces profils de sécrétion neuronale altérés sont observés chez la souris et le rat avec CR [34].
Chez les souris NPY KO assommées, l'ajout de CR n'a pas augmenté l'espérance de vie, provoqué une tolérance au stress oxydatif dans le foie et modifié le profil de la sécrétion des neurones. Cependant, CR a diminué les taux d'insuline et d'IGF1 dans le sang, augmenté les taux sanguins d'adiponectine et de corticostérone et diminué l'expression des gènes impliqués dans l'oxydation bêta du foie. Ainsi, NPY devrait être un facteur clé associé aux actions CR indépendantes GF / IGF1 [35].
Mutation de l'ADN mitochondrial (ADNmt)
On pense que l'accumulation de mutations d'ADNmt est l'un des principaux facteurs de pathogenèse dans les maladies liées à l'âge. Les souris PolgA D257A / D257A portent une mutation dans l'ADNmt polymérase gamma et montrent un développement plus précoce de l'accumulation liée à l'âge des mutations de l'ADNmt et des phénotypes d'âge dans divers tissus [36]. Chez les souris PolgA, D257A / D257A CR n'a pas prolongé la durée de vie, n'a pas affecté l'accumulation de délétion d'ADNmt dans le muscle squelettique et n'a pas amélioré la fonction cardiaque, ce qui a contribué à la sarcopénie. Ces données indiquent que l'accumulation de mutations d'ADNmt peut inhiber les effets bénéfiques de CR [37].
Nos nouveaux résultats: Remodelage CR du tissu adipeux
L'obésité viscérale associée au diabète, à l'hyperlipidémie et à l'hypertension, collectivement appelées «syndrome métabolique», est un facteur de risque connu de développement de maladies athérosclérotiques potentiellement mortelles, notamment l'infarctus du myocarde et l'infarctus cérébral. Le tissu adipeux, initialement supposé être uniquement lié à la fonction énergétique, a récemment été décrit comme un organe endocrinien qui sécrète diverses molécules biologiquement actives appelées adipokines. Les gros adipocytes qui accumulent des triglycérides (TG) augmentent excessivement la sécrétion d'adipokines inflammatoires, y compris le facteur de nécrose tumorale-α (TNF-α) et l'interleukine-6 (IL-6), et diminuent la sécrétion d'adiponectine par rapport aux petits adipocytes, qui s'accumulent moins TG. Ces profils de sécrétion d'adipokine sont directement impliqués dans les pathologies liées à l'âge, notamment la résistance à l'insuline, l'hypertension et l'athérosclérose [38]. De plus, le tissu adipeux et les adipokines ont récemment été signalés comme des acteurs clés dans la régulation de la durée de vie. Par exemple, les souris avec un knockout du récepteur d'insuline dans les adipocytes ont montré une diminution de l'obésité, une augmentation de la biogenèse mitochondriale et une durée de vie plus longue que les souris de type sauvage [39]. Les souris transgéniques avec surexpression d'adiponectine dans le foie ont montré une survie supérieure à celle du contrôle [40]. Les facteurs de transcription PPARγ et CCAAT / protéines de liaison aux amplificateurs α (C / EBPα) et β (C / EBPβ) sont impliqués dans la différenciation des adipocytes. Les souris présentant une décomposition du gène C / EBPβ au locus C / EBP ont montré une biogenèse mitochondriale améliorée et une durée de vie plus longue [41]. En revanche, les souris knock-out PPARγ KO ont une durée de vie plus courte que les témoins [42].
Il a été rapporté que la CR augmente la forme active d'adiponectine chez la souris de tout âge. Cette régulation de l'adiponectine associée au CR dépend de la signalisation GH / IGF1 [43, 44]. Nous avons analysé le changement associé à CR dans l'ordre chronologique et obtenu les résultats suivants. La CR a augmenté l'expression des gènes et / ou des protéines impliqués dans la biosynthèse des acides gras (AF) et la biogenèse mitochondriale dans le tissu adipeux après une phase précoce de CR. Les changements liés à la CR se sont produits plus principalement dans le tissu adipeux que dans d'autres tissus ou organes. Après cela, des changements morphologiques se sont produits, y compris une diminution de la taille des adipocytes et des changements métaboliques dans le foie [45]. Pour clarifier les changements métaboliques liés au CR dans le tissu adipeux qui se sont produits indépendamment du signal GH / IGF1, nous avons ensuite comparé le profil d'expression génique du CR dans le tissu adipeux de rats de type sauvage avec des rats transgéniques recevant ad libitum (AL). Nos résultats ont montré que la CR améliore l'expression des gènes impliqués dans la biosynthèse des acides gras, en particulier dans le principal facteur de transcription de la biosynthèse des acides gras, les gènes régulateurs SREBP-1, indépendamment de GH / IGF1 [9].
Par conséquent, nous avons ensuite comparé l'effet de CR avec divers paramètres, y compris la durée de vie entre les souris KO SREBP-1c KO et les souris de type sauvage. Les souris KO SREBP-1c avaient une durée de vie légèrement plus courte que les souris de type sauvage. Chez les souris de type sauvage avec une durée de vie prolongée, CR a augmenté l'expression des protéines impliquées dans la biosynthèse des acides gras et la biogenèse mitochondriale et supprimé le stress oxydatif. La plupart de ces changements ont été observés principalement dans le tissu adipeux et non dans d'autres tissus. En revanche, l'extension de la vie associée au CR et les modifications du tissu adipeux n'ont pas été observées chez les souris KO SREBP-1c. Il a été rapporté que la protéine PGC-1α est un régulateur clé de la biogenèse mitochondriale induite par CR [46]. Nous avons observé que SREBP-1c se lie au promoteur du gène Pgc-1α, suggérantque SREBP-1c régule directement la transcription de Pgc-1α [47]. De plus, les résultats de l'analyse du protéome du tissu adipeux ont montré que la CR active le cycle pyruvate / malate [48]. En effet, il a été rapporté que la CR active la biosynthèse des acides gras de novo dans le tissu adipeux, mais pas dans le foie [45]. Ces données indiquent que les souris SREBP-1c KO ne peuvent pas utiliser efficacement les graisses dans des conditions CR. Ainsi, le tissu adipeux peut non seulement fonctionner comme tissu de stockage d'énergie, mais peut également jouer le rôle de conversion du glucose en un acide gras plus énergivore via SREBP-1c dans des conditions CR.mais pas dans le foie [45]. Ces données indiquent que les souris SREBP-1c KO ne peuvent pas utiliser efficacement les graisses dans des conditions CR. Ainsi, le tissu adipeux peut non seulement servir de tissu pour stocker l'énergie, mais peut également jouer le rôle de conversion du glucose en un acide gras plus énergivore via SREBP-1c dans des conditions CR.mais pas dans le foie [45]. Ces données indiquent que les souris SREBP-1c KO ne peuvent pas utiliser efficacement les graisses dans des conditions CR. Ainsi, le tissu adipeux peut non seulement servir de tissu pour stocker l'énergie, mais peut également jouer le rôle de conversion du glucose en un acide gras plus énergivore via SREBP-1c dans des conditions CR.CR
En 1989, Holliday a expliqué les effets de l'anti-âge et de l'espérance de vie de la CR du point de vue évolutif des organismes qui ont développé des systèmes de réponse adaptative pour maximiser la survie pendant les périodes de pénurie alimentaire [49, 50]. Sur la base de ce point de vue évolutif, nous avons divisé les actions bénéfiques du CR en deux systèmes; «Systèmes activés dans des conditions de ressources énergétiques suffisantes» et «Systèmes fonctionnant dans des conditions de ressources énergétiques insuffisantes». Le premier est activé in vivo, ce qui permet aux animaux d'utiliser l'énergie gratuitement en fournissant une nutrition abondante. En d'autres termes, lorsqu'il y a beaucoup de nourriture pour une utilisation gratuite de l'énergie, les animaux grandissent bien, se reproduisent davantage et stockent l'excès d'énergie comme la TG dans le tissu adipeux pour une utilisation ultérieure.mais pas tellement qu'ils sont obèses. Le deuxième système est activé dans l'environnement naturel, ce qui ne permet pas la libre utilisation de l'énergie en raison de pénuries alimentaires. En d'autres termes, lorsqu'il n'y a aucun avantage à utiliser gratuitement l'énergie, les animaux inhibent la croissance et la reproduction et utilisent l'énergie économisée de la croissance et de la reproduction pour maintenir la fonction biologique. L'adaptation aux changements environnementaux naturels est une priorité absolue pour la survie des animaux.les animaux inhibent la croissance et la reproduction et utilisent l'énergie économisée de la croissance et de la reproduction pour maintenir la fonction biologique. L'adaptation aux changements environnementaux naturels est une priorité absolue pour la survie des animaux.les animaux inhibent la croissance et la reproduction et utilisent l'énergie économisée de la croissance et de la reproduction pour maintenir la fonction biologique. L'adaptation aux changements environnementaux naturels est une priorité absolue pour la survie des animaux.Sur la base de l'hypothèse de réponse adaptative et des découvertes récentes mentionnées ci-dessus, nous proposons un ensemble de mécanismes pour les effets bénéfiques de la RC.Étant donné que les conditions expérimentales de CR peuvent simuler des conditions énergétiques insuffisantes, nous avons émis l'hypothèse que CR supprime les «systèmes activés dans des conditions énergétiques suffisantes» et active les «systèmes activés dans des conditions énergétiques insuffisantes» et induit de manière additive des actions anti-âge et pour augmenter la durée de vie. Le premier ensemble de systèmes comprend les signaux GH / IGF1, FOXO, mTORC, adiponectine et BMAL1, et CR semble supprimer ces réactions anaboliques. Le deuxième ensemble de systèmes comprend la signalisation SREBP-1c / mitochondries, SIRT et NPY, et, probablement, CR active ces réactions pour une utilisation optimale des ressources énergétiques insuffisantes. De plus, divers signaux et / ou facteurs peuvent contribuer aux effets anti-âge et prolongeant la vie de la CR à des degrés divers avec des antioxydants, anti-inflammatoires,antitumoral et autres actions dans divers tissus.En ce qui concerne les paradigmes de l'intervention alimentaire, non seulement la CR a été appliquée, mais également la restriction énergétique intermittente (IER) et la restriction temporelle nutritionnelle (TRF) [2]. IER comprend généralement le jeûne tous les deux jours ou 2-3 jours par semaine. La TRF, qui est plus populaire dans la recherche sur l'obésité que dans la recherche en biohéronologie, implique généralement de limiter l'accès à la nourriture (riche en graisses) pendant plusieurs heures par jour. Les effets bénéfiques causés par IER ou TRF sont partiellement similaires à ceux causés par CR. Cependant, à notre connaissance, aucune étude n'a utilisé des plans de recherche rigoureux, y compris des calendriers nutritionnels, pour comparer les trois interventions alimentaires. Par conséquent, des études comparatives de CR, IER et TRF pourraient être nécessaires à l'avenir.Perspectives
Des études utilisant des singes montrent que des effets bénéfiques de la CR peuvent également se produire chez l'homme et d'autres mammifères [51]. Les études actuelles sur la RC se concentrent sur deux sujets, à savoir l'identification des mécanismes moléculaires de la CR, ainsi que sur le développement de préparations mimétiques de la CR. Nous pensons que le développement de nouveaux médicaments agissant comme la CR peut être difficile sans comprendre les mécanismes moléculaires de la CR. Pour développer de tels médicaments qui sont applicables à l'homme, des études supplémentaires sur les mécanismes moléculaires de la RC sont nécessaires, en particulier chez les primates. Dans ce rapport, nous proposons de classer et de discuter les mécanismes moléculaires des effets bénéfiques de Cheka selon qu'ils fonctionnent dans des conditions de ressources énergétiques riches ou insuffisantes. De plus amples études sur les mécanismes moléculaires des avantages de la CR devraient également prendre en comptela mesure dans laquelle les signaux / facteurs impliqués contribuent aux actions antioxydantes, anti-inflammatoires, antitumorales et autres CR dans chaque tissu ou organe, et entraînent ainsi un rajeunissement et une augmentation de l'espérance de vie. Des études sur des animaux génétiquement modifiés, axées sur l'un des deux systèmes mentionnés ci-dessus, montrent des différences dans le degré des effets induits par la CR chez des souris d'origine différente et celles qui comparent les effets bénéfiques de la CR avec les facteurs IER ou TRF aideront à clarifier non seulement les autres mécanismes moléculaires de la CR, mais aussi celles liées à l'espérance de vie.et ainsi conduire au rajeunissement et augmenter l'espérance de vie. Des études sur des animaux génétiquement modifiés portant sur l'un des deux systèmes mentionnés ci-dessus montrent des différences dans le degré des effets induits par la CR chez des souris d'origine différente et celles qui comparent les effets bénéfiques de la CR avec des facteurs IER ou TRF aideront à clarifier non seulement les autres mécanismes moléculaires de la CR, mais aussi celles liées à l'espérance de vie.et ainsi conduire au rajeunissement et augmenter l'espérance de vie. Des études sur des animaux génétiquement modifiés portant sur l'un des deux systèmes mentionnés ci-dessus montrent des différences dans le degré des effets induits par la CR chez des souris d'origine différente et celles qui comparent les effets bénéfiques de la CR avec des facteurs IER ou TRF aideront à clarifier non seulement les autres mécanismes moléculaires de la CR, mais aussi celles liées à l'espérance de vie.qui sont liés à l'espérance de vie.qui sont liés à l'espérance de vie.: .
:
Hoshino S, Kobayashi M, Higami Y. Mechanisms of the anti-aging and prolongevity effects of caloric restriction: evidence from studies of genetically modified animals. Aging (Albany NY). 2018 Sep 16.