Augmenter le temps entre les repas et la restriction calorique prolonge la vie
En septembre 2018, une étude de gérontologues américains du National Institute for Aging (NIH) sur l'effet du temps entre les repas sur l'espérance de vie a été publiée dans le magazine Cell Metabolism. Les souris expérimentales ont été divisées en deux groupes. Le premier groupe avait un régime avec une nutrition naturelle (une quantité réduite de glucides et de graisses raffinés et une teneur accrue en protéines et en fibres). Un autre groupe de rongeurs, au contraire, a été soumis à un régime «malsain» - avec une quantité accrue de glucides et de graisses simples et une quantité réduite - de protéines et de fibres. De plus, les souris de chaque groupe ont été divisées en trois sous-groupes, selon la fréquence à laquelle elles ont accès à la nourriture. Le premier sous-groupe de souris avait accès à la nourriture 24h / 24. Le deuxième sous-groupe de souris a été nourri une fois par jour, et le nombre de calories dans leur portion était le même que celui des souris du premier sous-groupe, c'est-à-dire pas dépouillé. Le troisième sous-groupe a reçu un régime réduit de 30% de calories.
Les deuxième et troisième sous-groupes, selon les scientifiques, avaient un appétit plus fort et mangeaient rapidement la nourriture qu'ils apportaient, ce qui entraînait des périodes de jeûne quotidiennes plus longues pour les deux groupes.
 Figure de l'article.
Figure de l'article.
Le premier sous-groupe de souris ( ad libitum ) - nourri de satiété, avec accès à la nourriture 24h / 24
Le deuxième sous-groupe de souris ( nourries aux repas ) - recevait de la nourriture une fois par jour, sans réduire les calories.
Le troisième sous-groupe de souris ( CR, restriction calorique ) - a reçu un régime réduit en calories de 30%.Tout au long de l'étude, les scientifiques ont suivi la santé métabolique des souris jusqu'à la mort naturelle, puis les ont examinées à titre posthume. Il s'est avéré que les souris de deux sous-groupes, nourries une fois par jour et avec un apport calorique limité, amélioraient la santé globale. Ce qui a été mis en évidence par des retards avec des dommages généraux liés au vieillissement du foie et d'autres organes, ainsi qu'une augmentation de l'espérance de vie. Les souris hypocaloriques ont également montré une amélioration significative de la glycémie et des taux d'insuline par rapport aux autres groupes. En général, les souris avaient de tels indicateurs d'espérance de vie. Les souris qui se nourrissaient normalement, sans restriction, ont vécu 104-110 semaines, avec un repas quotidien unique - 115-117 semaines, avec restriction calorique - 132-135 semaines.
Comme l'a montré l'autopsie, les trois groupes de souris avaient les mêmes pathologies, mais des périodes de développement différentes. L'amylose était la principale lésion tissulaire non tumorale et les accumulations d'amyloïdes étaient plus étendues chez les souris à longue durée de vie nourries avec une restriction calorique. Les scientifiques attribuent ce fait à la durée de vie plus longue de ces souris.
Il est à noter que, selon l'observation des chercheurs, la composition du régime alimentaire n'a pas eu d'effet significatif sur l'espérance de vie dans les sous-groupes avec des repas uniques et une restriction calorique. Les scientifiques ont attribué cela au fait que de grands intervalles entre les repas permettaient au corps d'utiliser plus efficacement les mécanismes de récupération: «Une augmentation des périodes quotidiennes de jeûne sans réduire les calories et quel que soit le type de régime consommé a conduit à une amélioration globale de la santé et de la survie des souris mâles. Peut-être que cette longue période quotidienne à jeun vous permet de récupérer et de maintenir des mécanismes qui seraient absents lors d'une exposition prolongée à la nourriture. " [3]
Le régime méditerranéen réduit le risque d'AVC chez les femmes
Un régime méditerranéen peut réduire le risque d'AVC chez les femmes de plus de 40 ans, mais pas chez les hommes, de telles données ont été obtenues dans une nouvelle étude menée par des cardiologues anglais.
Un article du numéro de septembre 2018 du Journal de l'American Cardiology Association décrit un régime riche en poisson, fruits, légumes, noix et haricots, et moins de viande et de produits laitiers, réduit le risque d'AVC chez les femmes à haut risque de maladie cardiaque. maladies vasculaires. Cette étude, selon les scientifiques, est l'une des plus grandes et des plus longues, visant à évaluer les avantages potentiels d'un régime de style méditerranéen pour réduire le risque d'accident vasculaire cérébral. Il montre qu'un tel régime peut être particulièrement efficace chez les femmes de plus de 40 ans, quel que soit l'état de la ménopause ou de l'hormonothérapie substitutive.
Des scientifiques des universités d'East Anglia, d'Aberdeen et de Cambridge, dans le cadre d'une étude EPIC à Norfolk sur une période de 17 ans, ont étudié les régimes alimentaires de 23232 participants et comparé le risque d'AVC en fonction du régime alimentaire des participants.
Les participants qui adhéraient le plus fréquemment au régime méditerranéen avaient un risque réduit d'AVC chez 22% des femmes et 6% des hommes.
«Cette étude nous montre qu'un régime de style méditerranéen riche en poisson, fruits et noix, légumes et haricots, ainsi que moins de viande et de produits laitiers, peut réduire le risque d'AVC chez les femmes de plus de 40 ans. Mais une alimentation saine et équilibrée est importante pour tout le monde, petits et grands. On ne sait pas pourquoi nous avons trouvé des différences entre les femmes et les hommes; il est possible que les composants alimentaires affectent les hommes différemment des femmes. Nous savons également que différents sous-types d'AVC peuvent varier selon les sexes. Notre étude était trop petite pour le tester, mais les deux possibilités méritent une étude plus approfondie à l'avenir », écrivent les chercheurs.
L'American Heart Association, dans ses recommandations, se concentre également sur une alimentation similaire à la diète méditerranéenne: «L'American Heart Association recommande un mode de vie sain et une alimentation qui comprend beaucoup de fruits et légumes, céréales complètes, produits laitiers faibles en gras, poisson, volaille, haricots, non tropicaux. les huiles végétales et les noix, ainsi que les graisses saturées, les gras trans, le sodium, la viande rouge, les bonbons et les boissons sucrées; ces composants alimentaires réduisent les facteurs de risque de maladie cardiaque et d'accident vasculaire cérébral »[4]
MicroRNA-141-3p, molécule de signalisation SDF-1 et dysfonctionnement osseux lié à l'âge
En août 2018, un article a été publié dans le Journal of Gerontology sur la relation entre le microARN-141-3p, la molécule de signalisation SDF-1 (facteur 1 dérivé des cellules stromales) et le vieillissement osseux.
Selon le Fonds international pour l'ostéoporose, environ 30% des femmes ménopausées aux États-Unis et en Europe souffrent d'ostéoporose. Au moins 40% de ces femmes et environ 30% des hommes du même âge ont un risque accru de fractures en raison de la fragilité de leurs os pour les autres.
Les cellules souches mésenchymateuses peuvent se différencier en les principaux composants de notre squelette: les ostéoblastes, les ostéocytes qui forment les os, les cellules du cartilage, les chondrocytes; ainsi que les cellules adipeuses, les adipocytes. Le SDF-1 est une molécule de signalisation clé qui régule la différenciation des cellules souches en ces cellules, ont montré des études. Le SDF-1 a également de nombreuses autres fonctions, notamment aider les cellules souches mésenchymateuses à se mettre au bon endroit pendant la formation ou la restauration des os. De plus, le SDF-1 agit comme un antioxydant, protégeant les cellules contre les effets nocifs du stress oxydatif.
L'importance du SDF-1 dans le maintien d'une santé osseuse normale et le fait que le niveau de cette molécule diminue avec l'âge, ont intéressé les scientifiques à la façon dont il est réglementé. Les scientifiques ont suggéré que la diminution des niveaux de SDF-1 dans au moins l'une des voies dépend du miARN-141-3p.
Des études antérieures ont montré que le rôle du miRNA-141-3p peut être négatif. Il a été constaté que ce miARN inhibe l'activité du transporteur de vitamine C, ce qui n'a pas permis à la vitamine de pénétrer dans les cellules. La vitamine C est également importante pour la santé des os, et sans suffisamment de transporteurs, la vitamine commence plutôt à s'accumuler à l'extérieur de la cellule, où elle provoque un stress oxydatif. Des études animales ont montré que le stress oxydatif dans les cellules souches mésenchymateuses réduit le niveau de SDF-1. En collectant toutes les données disponibles ensemble, les chercheurs ont suggéré puis constaté qu'un stress oxydatif plus élevé augmente l'expression de miRNA-141-3p, ce qui réduit à son tour les niveaux de SDF-1.
Dans les cellules souches mésenchymateuses murines et humaines, il a été constaté que les niveaux de miARN-141-3p sont plus faibles dans les cellules jeunes. Et dans les vieilles cellules, le niveau de ce microARN a augmenté de 3 fois ou plus. Pour les niveaux de la molécule SDF-1, un phénomène fondamentalement opposé a été trouvé - une diminution multiple avec l'âge. L'ajout de microARN-141 aux cellules souches a entraîné une baisse des niveaux de SDF-1. Les conséquences de ceci sont un autre changement d'âge: la production de plus d'ostéoclastes osseux, au détriment des ostéoblastes. Il a également été noté que les cellules souches mésenchymateuses se différenciaient davantage en cellules graisseuses, ce qui est également généralement associé à l'âge.
Dans le cadre d'un test complet de leur hypothèse, les scientifiques ont d'abord ajouté du miRNA-141-3p aux cellules, et la fonction osseuse observée s'est détériorée, puis ils ont utilisé un inhibiteur de ce micro ARN, et il y a eu une amélioration.
Selon les chercheurs, des médicaments cliniques, tels que le médicament utilisé pour inhiber le miARN-141-3p, pourraient un jour être un moyen efficace d'aider les cellules souches mésenchymateuses à rester fonctionnelles, quel que soit leur âge ou d'autres conditions: «Un inhibiteur normalise la fonction os. Nous pensons qu'un inhibiteur de niveau clinique peut nous aider à faire de même chez l'homme. »
L'étape suivante, les scientifiques prévoient de passer à des modèles animaux et d'examiner de nombreux autres facteurs impliqués dans le vieillissement osseux. Et découvrez également si des niveaux plus élevés d'activité physique, qui ont tendance à diminuer avec l'âge, peuvent aider à rétablir un équilibre plus sain de miRNA-141-3p et de SDF-1. Il est également prévu d'étudier d'autres membres de la famille des microARN-141 pour leur participation au processus de vieillissement [5].
Comment les «mauvaises» bactéries gagnent dans l'intestin
En septembre 2018, un article de scientifiques anglais publié dans la revue PLOS Pathogens, qui décrivait le mécanisme de colonisation par des bactéries intestinales pathogènes après la prise d'antibiotiques.
Il est déjà connu que les antibiotiques perturbent la flore protectrice naturelle des intestins, rendant les gens sensibles à la bactérie Clostridium difficile. L'infection par ce pathogène (CDI) provoque la plupart des épidémies diarrhéiques associées à l'antibiothérapie et peut entraîner des maladies et des complications potentiellement mortelles. C. difficile peut entraîner une perte de poids dangereuse et un affaiblissement pendant une courte période de temps Il est maintenant très important de mieux comprendre comment C. difficile peut affecter le microbiote intestinal et perturber l'homéostasie intestinale. La reproduction de cette bactérie se produit dans des conditions où les antibiotiques tuent d'autres agents pathogènes.
C. difficile est un anaérobie gram positif formant des spores qui a été exposé à des conditions difficiles pendant de longues périodes. Le traitement antibiotique dirigé contre cette bactérie ne donne pas le résultat souhaité. 35% des patients sont à nouveau susceptibles de récidiver d'une infection à C. difficile. ces faits ont incité les scientifiques à examiner de plus près cette bactérie afin de comprendre ce qui la rend si faiblement vulnérable.
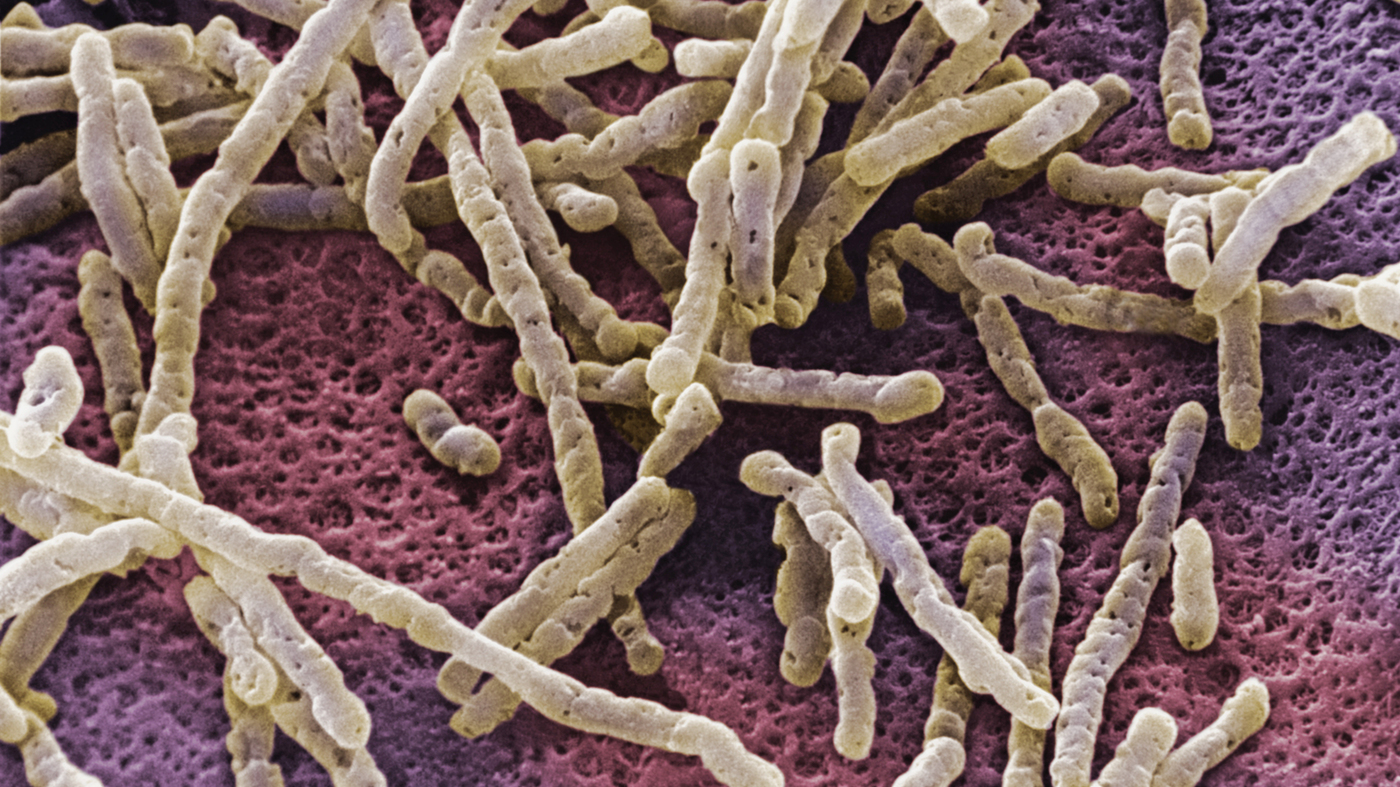 Bactéries Clostridium difficile
Bactéries Clostridium difficileIl s'est avéré que Clostridium difficile avait une arme secrète. Parmi les autres bactéries intestinales, l'une des caractéristiques de C. difficile est sa capacité à produire un composé de paracrésol (p-crésol) par fermentation de tyrosine. Le p-crésol a un effet néfaste sur les bactéries intestinales protectrices naturelles. Les scientifiques ont découvert que le p-crésol cible sélectivement certaines bactéries dans les intestins et altère leur capacité de croissance. Cela a créé des avantages concurrentiels pour C. difficile.
Pour preuve, les scientifiques ont examiné des souches mutantes de C. difficile qui ne pouvaient pas produire de p-crésol. Ces bactéries étaient moins capables de rivaliser avec d'autres types de microbiote intestinal et étaient donc moins capables de recoloniser l'intestin après une infection primaire. «Notre étude fournit une nouvelle compréhension des effets de la production de p-crésol sur la microflore intestinale saine et comment elle contribue à la survie et à la pathogenèse de Clostridium difficile. Nous avons constaté que le principal pathogène intestinal, Clostridium difficile, produit l'agent bactériostatique paracrésol, qui aide à contrôler le microbiote intestinal et offre à C. difficile des avantages de croissance compétitifs, en particulier après la consommation d'antibiotiques. Ce symptôme unique d'un agent pathogène peut fournir une nouvelle cible médicamenteuse pour réduire les infections causées par C. difficile »[6]
La protéine NLRP12 et les bactéries Lachnospiraceae protègent contre l'obésité et la résistance à l'insuline
Dans une autre étude liée à la microflore intestinale, les scientifiques ont décrit la fonction anti-inflammatoire de la protéine NLRP12, qui a eu un effet positif sur la prévention de l'obésité et du diabète. Le NLRP12 a contribué à la croissance de colonies de "bonnes" bactéries intestinales, les Lachnospiraceae, qui produisent de petites molécules de butyrate et de propionate. Ces substances, à leur tour, ont un effet positif sur la santé intestinale et inhibent le développement de l'obésité et de la résistance à l'insuline.
Chez l'homme, la NLRP12 est produite par plusieurs types de cellules immunitaires et semble fonctionner comme un frein à une inflammation excessive. Des travaux antérieurs ont montré que les souris knock-out Nlrp12 sont très sensibles à l'inflammation, y compris l'inflammation expérimentale du côlon (colite) et le cancer du côlon associé.
Dans cette étude, les scientifiques ont nourri des souris knockout au gène Nlrp12 (Nlrp12-knockout) et des souris normales avec des aliments riches en graisses pendant plusieurs mois. Les souris knockout Nlrp12 ne mangeaient et ne buvaient pas plus que leurs homologues en bonne santé, mais accumulaient beaucoup plus de graisse et gagnaient beaucoup de poids. Les souris knock-out ont également montré des signes de résistance à l'insuline, qui est associée à une capacité réduite à absorber le glucose et, en règle générale, suit le développement de l'obésité.
L'absence de Nlrp12 chez ces souris a entraîné une augmentation des signes d'inflammation dans les intestins et les amas graisseux, mais il n'était pas clair comment cela avait entraîné une augmentation de l'excès de poids. Au stade suivant, les souris knockout Nlrp12 ont été divisées en deux groupes, dont l'un a été traité avec des antibiotiques. En conséquence, une perte de poids a été observée chez les souris de ce groupe, ce qui a permis aux scientifiques de suggérer que les bactéries intestinales sont impliquées dans le développement de l'obésité. D'autres tests ont montré que lorsque les souris knock-out Nlrp12 étaient maintenues dans des conditions exemptes de bactéries, les souris ne prenaient pas de poids et l'absence de Nlrp12 n'affectait pas. Cela a montré, selon les scientifiques, que les «mauvaises» bactéries provoquaient une prise de poids excessive lors d'un régime riche en graisses. Il est à noter que les souris KO étaient également protégées de l'obésité lorsqu'elles vivaient avec des souris témoins, ce qui suggère que les «bonnes» bactéries des souris témoins ont été éliminées et ont contribué à les protéger.
Les chercheurs ont également introduit des bactéries Lachnospiraceae bénéfiques pour les souris knockout Nlrp12 et ont constaté que ces bactéries réduisaient l'inflammation intestinale, éliminaient l'hégémonie des bactéries nocives d'Erysipelotrichaceae et augmentaient la diversité du microbiote. Les lachnospiracées protégeaient également de manière significative les animaux de l'obésité et de la résistance à la kinsuline associée. Les lachnospiracées contiennent des enzymes qui convertissent les glucides et les fibres en petites molécules appelées acides gras à chaîne courte (AGCC). Les scientifiques ont remarqué que deux d'entre eux, en particulier le butyrate et le propionate, se sont révélés être beaucoup plus importants lorsque la quantité de lachnospiracées dans l'intestin a augmenté. Le butyrate et le propionate sont connus pour avoir des propriétés anti-inflammatoires qui contribuent à la santé intestinale. Les chercheurs ont donné du butyrate et du propionate à des souris knockout Nlrp12 et ont découvert qu'ils protégeaient les animaux en l'absence de Nlrp12 ainsi que des bactéries Lachnospiraceae.
«Tous les changements inflammatoires et métaboliques que nous avons observés chez les souris knockout Nlrp12 pendant le régime riche en graisses ont été significativement inversés lorsque nous les avons réapprovisionnés en Lachnospiraceae. L'obésité dépend de l'inflammation, et pas seulement de la suralimentation et du manque d'exercice, et cette étude suggère que de «bonnes» bactéries dans l'intestin aident à maintenir un poids santé. Chez la souris, le NLRP12 réduit l'inflammation dans les intestins et les tissus adipeux. Il est également connu que les personnes obèses ont des niveaux d'expression NLRP12 réduits », écrivent les chercheurs [7].
Une molécule a été trouvée qui pourrait prévenir la maladie de Parkinson
En septembre de cette année, un article de scientifiques espagnols sur une nouvelle molécule qui pourrait aider à prévenir les neurodégénérescences a été publié dans PNAS.
À l'aide d'un test de dépistage performant récemment développé, ils ont identifié SynuClean-D, un petit composé qui inhibe l'agrégation de la α-synucléine, détruit les fibrilles amyloïdes matures, empêche la propagation des fibrilles et inverse la dégénérescence des neurones dopaminergiques dans le modèle animal de la maladie de Parkinson.Les événements moléculaires provoquant le développement de la maladie de Parkinson conduisent à une agrégation anormale de la protéine α-synucléine dans les neurones dopaminergiques. L'agrégation Α-Syn est également trouvée dans les oligodendrocytes chez les patients atteints d'atrophie systémique multiple (AMS). α-Syn est une protéine qui est exprimée en quantités importantes dans le cerveau. On pense que la fonction α-Syn est liée au mouvement des vésicules. Cette protéine est le composant principal des corps de Levy et des neurites dans la maladie de Parkinson.Pour détecter SynuClean-D, une méthodologie a été développée pour indexer les inhibiteurs d'agrégation de α-synucléine parmi des milliers de molécules différentes. Après identification par des scientifiques, un test biophysique in vitro de l'activité inhibitrice de SynuClean-D a été effectué, des tests ont été effectués pour déterminer le mécanisme d'action de SynuClean-D dans des cultures de cellules neurales humaines avant de tester cette substance dans des modèles animaux. Deux types de vers Caenorhabditis elegans ont été pris comme modèle. Ils expriment l'α-synucléine dans les muscles et dans les neurones dopaminergiques. Des expériences ont montré que l'administration d'un inhibiteur identifié, SynuClean-D, réduisait l'agrégation des protéines, améliorait la motilité animale et le protégeait de la dégénérescence neurale.«Tout semble indiquer que la molécule que nous avons identifiée, SynuClean-D, pourrait fournir à l'avenir des applications thérapeutiques pour le traitement de pathologies neurodégénératives telles que la maladie de Parkinson. En général, SynuClean-D semble être une molécule prometteuse pour une intervention thérapeutique dans la maladie de Parkinson », écrivent les chercheurs. [8].Le β-hydroxybutyrate ralentit le vieillissement des vaisseaux sanguins
En septembre, un article de scientifiques américains sur la prévention des pathologies cardiovasculaires liées à l'âge a été publié dans la revue Molecular Cell. La molécule, qui est produite pendant le jeûne ou la restriction calorique, a un effet anti-âge sur le système vasculaire, ce qui peut réduire l'apparition et la gravité des maladies humaines associées aux vaisseaux sanguins, selon une étude menée par l'Université de Géorgie.À mesure que les gens vieillissent, ils sont plus sensibles aux maladies comme le cancer, les maladies cardiovasculaires ou la maladie d'Alzheimer. L'âge est le facteur de risque le plus important pour les maladies humaines. La partie la plus importante du vieillissement est le vieillissement vasculaire. Avec l'âge, les vaisseaux sanguins deviennent très sensibles à diverses blessures, l'étude du vieillissement vasculaire est donc très importante.Dans ce travail, les scientifiques ont étudié le mécanisme peu connu de l'effet positif de la restriction calorique (réduction de la nourriture ou de la famine) sur les processus liés à l'âge. Les chercheurs ont identifié une petite molécule importante qui est produite pendant le stress et les carences nutritionnelles - le β-hydroxybutyrate. Cette substance est un type de corps cétonique et est produite par le foie à partir d'acides gras pendant les périodes de faible consommation alimentaire, les régimes limitant les glucides, le jeûne et l'exercice physique intense et prolongé.Les chercheurs ont suivi toute la chaîne des effets positifs du β-hydroxybutyrate. Initialement, il a agi sur la ribonucléoprotéine nucléaire A1 (hnRNP A1) comme cible de liaison directe. Dans l'étape suivante, hnRNP A1 a amélioré l'expression du facteur de transcription Oct4. Eh bien, le 4 octobre a augmenté les niveaux de Lamin B1, un facteur clé pour contrer les dommages à l'ADN liés à l'âge. Le jeûne et l'injection intrapéritonéale de β-hydroxybutyrate ont activé Oct4 et la vitamine B1 à la fois dans le muscle lisse vasculaire et dans les cellules endothéliales chez la souris in vivo. Les scientifiques ont conclu que le β-hydroxybutyrate a un effet anti-âge dans les cellules vasculaires en activant la voie de la Lamin B1 en induisant le hnRNP A1 et Oct4. [9]Une consommation d'alcool très faible et excessive augmente le risque de démence
En août 2018, un article de chercheurs français et anglais a été publié sur l'effet de différentes doses d'alcool sur le développement de la démence. 9087 participants âgés de 35 à 55 ans, dont l'observation a duré 23 ans dans l'étude Whitehall II, qui a examiné l'impact des facteurs sociaux, comportementaux et biologiques sur la santé à long terme, ont été divisés en trois groupes. Le premier groupe de participants était composé de personnes pratiquement non alcoolisées (les scientifiques les ont classées comme abcès, c'est-à-dire abstinence). Le deuxième groupe de participants a consommé de 1 à 14 unités standard d'alcool (unité) par semaine. Une unité d'alcool contient en moyenne environ 12 grammes d'alcool pur. En ce qui concerne l'alcool, le deuxième groupe, qui boit modérément, semble-t-il, a pris une bouteille de bière ou un verre de vin par jour.Et le troisième groupe a consommé plus de 14 unités d'alcool par semaine.Comme le montrent les résultats des observations à long terme, les personnes les plus à risque de démence étaient les personnes qui ne buvaient presque pas d'alcool (catégorie des abcès) ou buvaient plus de 14 unités par semaine. Si le lien avec le groupe buveur est logique et explicable, alors tomber dans la catégorie de risque pour le développement de neuropathologies de non-buveurs a été une surprise pour les scientifiques.L'analyse a montré que le risque excessif de démence associé à l'abstinence d'alcool à l'âge adulte s'explique en partie par les maladies cardiométaboliques, qui étaient un facteur concomitant chez les non-buveurs. Les auteurs soulignent que leurs résultats ne doivent pas être considérés comme un appel aux non-buveurs à commencer à boire de l'alcool: «Nos résultats renforcent la preuve qu'une consommation excessive d'alcool est un facteur de risque de démence et encouragent l'utilisation de seuils de consommation d'alcool inférieurs dans les lignes directrices pour promouvoir santé cognitive dans la vieillesse. Et nos résultats ne devraient pas motiver les personnes qui ne boivent pas à commencer à boire, étant donné les conséquences négatives connues de la consommation d'alcool sur la mortalité, les troubles neuropsychiatriques,cirrhose du foie et cancer »[1]Parallèlement à cela, en août de la même année, un autre article a été publié décrivant que, très probablement, il n'y avait pas de dose sûre d'alcool. Dans le cadre d'une étude à grande échelle de l'étude sur le fardeau mondial des maladies, des blessures et des facteurs de risque 2016, les scientifiques ont analysé les données contenues dans 694 articles scientifiques sur la consommation d'alcool aux niveaux individuel et de la population, ainsi que 592 études prospectives et rétrospectives sur le risque de consommation d'alcool. Les données obtenues ont montré que pour améliorer la santé, il est préférable de ne pas boire du tout: "Le niveau de consommation d'alcool, qui minimise les atteintes à la santé, est nul." [2]
Préparé par Alexey Rzheshevsky.Les références
- Séverine Sabia, Aurore Fayosse, Julien Dumurgier, Aline Dugravot, Tasnime Akbaraly, Annie Britton, Mika Kivimäki, Archana Singh-Manoux. Alcohol consumption and risk of dementia: 23 year follow-up of Whitehall II cohort study. BMJ, 2018;
- GBD 2016 Alcohol Collaborators. Alcohol use and burden for 195 countries and territories, 1990-2016: a systematic analysis for the Global Burden of Disease Study 2016. Lancet. 2018 Sep 22;392(10152):1015-1035.
- Mitchell SJ, Bernier M et al… Daily Fasting Improves Health and Survival in Male Mice Independent of Diet Composition and Calories. Cell Metab. 2018 Aug 24. pii: S1550-4131(18)30512-6.
- Katherine E. Paterson, Phyo K. Myint Amy Jennings, Lucy KM Bain,Marleen AH Lentjes, Kay-Tee Khaw, and Ailsa A. Welch. The Mediterranean Diet Reduces Risk of Incident Stroke in a Population with Varying Cardiovascular Disease Risk Profiles. Stroke, September 20, 2018.
- Sudharsan Periyasamy-Thandavan, John Burke, Bharati Mendhe, Galina Kondrikova, Ravindra Kolhe, Monte Hunter, Carlos M Isales, Mark W Hamrick, William D Hill, Sadanand Fulzele. MicroRNA-141-3p negatively modulates SDF-1 expression in age dependent pathophysiology of human and murine bone marrow stromal cells. The Journals of Gerontology: Series A, 2018
- Ian J. Passmore, Marine PM Letertre, Mark D. Preston, Irene Bianconi, Mark A. Harrison, Fauzy Nasher, Harparkash Kaur, Huynh A. Hong, Simon D. Baines, Simon M. Cutting, Jonathan R. Swann, Brendan W. Wren, Lisa F. Dawson. Para-cresol production by Clostridium difficile affects microbial diversity and membrane integrity of Gram-negative bacteria. PLOS Pathogens, 2018; 14 (9): e1007191
- Truax AD, Chen L et al. The Inhibitory Innate Immune Sensor NLRP12 Maintains a Threshold against Obesity by Regulating Gut Microbiota Homeostasis. Cell Host Microbe. 2018 Sep 12;24(3):364-378.e6.
- Jordi Pujols, Samuel Peña-Díaz, Diana F.Lázaro, Francesca Peccati, Francisca Pinheiro, Danilo González, Anita Carija, Susanna Navarro, María Conde-Giménez, Jesús García, Salvador Guardiola, Ernest Gavier Javt, Xavi Javt, Marc, Javier , Tiago Fleming Outeiro, Esther Dalfó, Salvador Ventura. Une petite molécule inhibe l'agrégation de l'a-synucléine, perturbe les fibrilles amyloïdes et empêche la dégénérescence des neurones dopaminergiques. Proc Natl Acad Sci US A. 2018 sept. 24 pii: 201804198.
- Han YM, Bedarida T, Ding Y, Somba BK, Lu Q, Wang Q, Song P, Zou MH. Le β-hydroxybutyrate prévient la sénescence vasculaire grâce à la régulation positive médiée par hnRNP A1 d'Oct4. Mol Cell. 20 sept. 2018; 71 (6): 1064-1078.e5.