Les cellules sénescentes (anciennes) sont aujourd'hui appelées cellules dans lesquelles le cycle cellulaire est arrêté sous l'influence de divers facteurs (stress ou épuisement de la ressource de division). Par conséquent, ces cellules ne se divisent pas et ne sont pas mises à jour.
La conférence Cell Senescence in Cancer and Aging à l'Université de Cambridge a donné la définition suivante du vieillissement cellulaire: «Le
vieillissement cellulaire fait référence à l'arrêt prolongé de la prolifération causée par divers déclencheurs moléculaires, y compris l'activation des oncogènes, ainsi que des divisions cellulaires excessives. De plus, les cellules sénescentes sont caractérisées par la sécrétion d'un certain nombre de régulateurs stromaux et régulateurs inflammatoires (appelés «associés au vieillissement du phénotype sérotore»), qui affectent le fonctionnement des cellules voisines, y compris immunocompétentes. Un certain nombre de faits convaincants indiquent que le vieillissement cellulaire est un mécanisme efficace pour supprimer la croissance tumorale. Dans le même temps, le vieillissement cellulaire peut contribuer au vieillissement des tissus et de l'organisme tout entier . »
En raison de divers mécanismes causaux, on distingue trois types de vieillissement cellulaire.
Le tout premier au début des années 60 du siècle dernier a été découvert le vieillissement réplicatif cellulaire. Dans le travail déjà célèbre, les gérontologues américains L. Hayflick et P. Moorhead, dans des expériences avec des fibroblastes humains en culture, ont établi que les cellules ne se divisent pas indéfiniment et qu'il y a une limite à la division cellulaire (appelée plus tard la limite ou limite Hayflick) [1]. Après 10 ans, le biologiste soviétique Alexei Olovnikov a donné une explication logique à ce phénomène, liant la limite des divisions cellulaires à un raccourcissement progressif des sections terminales de l'ADN, les télomères. Cela est dû au fait que l'enzyme télomérase, capable d'augmenter les télomères après leur raccourcissement, n'est pas active dans la plupart des cellules somatiques. Une fois les télomères raccourcis à un niveau critique, une réponse aux dommages à l'ADN (DDR) se produit, à la suite de laquelle le cycle cellulaire s'arrête et la cellule devient sénescente. On sait que les facteurs externes affectant négativement la santé et la longévité (obésité, manque d'exercice, stress) ont également un effet négatif sur le raccourcissement des télomères [2]. De plus, une accélération de la réduction de la longueur des télomères est observée chez les patients atteints de maladies neurodégénératives, telles que la maladie d'Alzheimer [3].
Pour la plupart des cellules, on pense que la limite de Hayflick est d'environ 50 divisions, après quoi la cellule cesse de se diviser. Pour distinguer le vieillissement du corps dans son ensemble du vieillissement cellulaire, Hayflick et Moorhead ont introduit un terme spécial à la révolution scientifique, qui fait référence au vieillissement cellulaire - sénescence (contrairement au vieillissement - vieillissement).
En plus du vieillissement réplicatif, le vieillissement cellulaire peut également être causé par d'autres facteurs qui induisent prématurément le vieillissement cellulaire, quelle que soit la longueur des télomères. Ces facteurs constituent les deuxième et troisième types de vieillissement cellulaire.
Ainsi, l'activation d'oncogènes tels que RAS et RAF provoque un vieillissement cellulaire appelé sénescence cellulaire induite par oncogène (OIS). Cette forme de vieillissement cellulaire est associée à une suppression tumorale. Les études génomiques comparatives des cellules avec vieillissement réplicatif et OIS montrent que, bien qu'il existe des changements généraux dans l'expression des gènes entre ces deux espèces par rapport aux cellules proliférantes, il existe également des différences significatives [4]. Il est connu que les dommages à l'ADN associés aux espèces réactives de l'oxygène (ROS) jouent un rôle important dans les mécanismes du vieillissement de l'OIS. ERK kinase est également activement impliquée dans la survenue d'OIS, stimulant la dégradation des protéines nécessaires à la progression du cycle cellulaire. Le rôle de la réponse aux dommages à l'ADN (DDR) dans ce type de vieillissement cellulaire n'a pas été clarifié. Les oncogènes mutants, tels que H-Ras G12V, sont connus pour avoir le potentiel d'activer les voies moléculaires du vieillissement cellulaire associées à la kinase p38 MAPK et au facteur de transcription NF-kB, indépendamment des dommages à l'ADN. Le gène oncogénique Ras peut également contribuer à la régulation positive de p53 via p19ARF et au vieillissement cellulaire indépendamment des dommages à l'ADN. [5]. Par conséquent, la stimulation du vieillissement cellulaire de l'OIS n'est pas exclue même en l'absence de dommages à l'ADN.
Un troisième type de vieillissement cellulaire, également indépendant de la longueur des télomères, est la sénescence prématurée induite par le stress (SIPS). Elle survient en réponse à des facteurs de stress de nature diverse: rayonnement ionisant et ultraviolet, augmentation du niveau de ROS, médicaments chimiothérapeutiques. Contrairement au vieillissement OIS, la survenue de SIPS dépend complètement de la réponse aux dommages à l'ADN (DDR). Sur le plan phénotypique, le SIPS et la sénescence cellulaire réplicative sont largement similaires, mais peuvent différer au niveau de l'expression des protéines. Le rôle des SIPS dans le vieillissement général du corps n'est pas encore clairement défini - l'augmentation de l'expression des antioxydants et la suppression des ROS, les principaux facteurs de l'apparition des SIPS, n'ont pas entraîné d'augmentation de la durée de vie [6].
Les mécanismes moléculaires de l'arrêt du cycle cellulaire dans les cellules sénescentes sont activement étudiés aujourd'hui. Il est connu que le degré de dommages à l'ADN affecte le cycle cellulaire de différentes manières. Ainsi, des dommages modérés à l'ADN peuvent provoquer un arrêt temporaire de la croissance, des dommages importants à l'ADN provoquent la mort programmée des cellules, des dommages persistants à l'ADN provoquent le vieillissement des cellules. Les déterminants moléculaires (les principaux facteurs) qui régissent la transition de la suspension temporaire de la croissance à l'arrêt irréversible du cycle sont complexes et ne sont pas encore entièrement décrits. Il est connu que les dommages à l'ADN activent initialement la voie p53-p21, qui arrête le cycle cellulaire. Ensuite, si les dommages à l'ADN ne sont pas réparés, la cellule entre en apoptose ou devient sénescente. Dans le second cas, le rôle clé est joué par la protéine p16 INK4a, qui régule la préservation à long terme de l'arrêt du cycle cellulaire par la voie de signalisation pRb-E2F (protéine de rétinoblastome, facteur de transcription pRb –E2F) et les changements dans la structure de la chromatine [7].
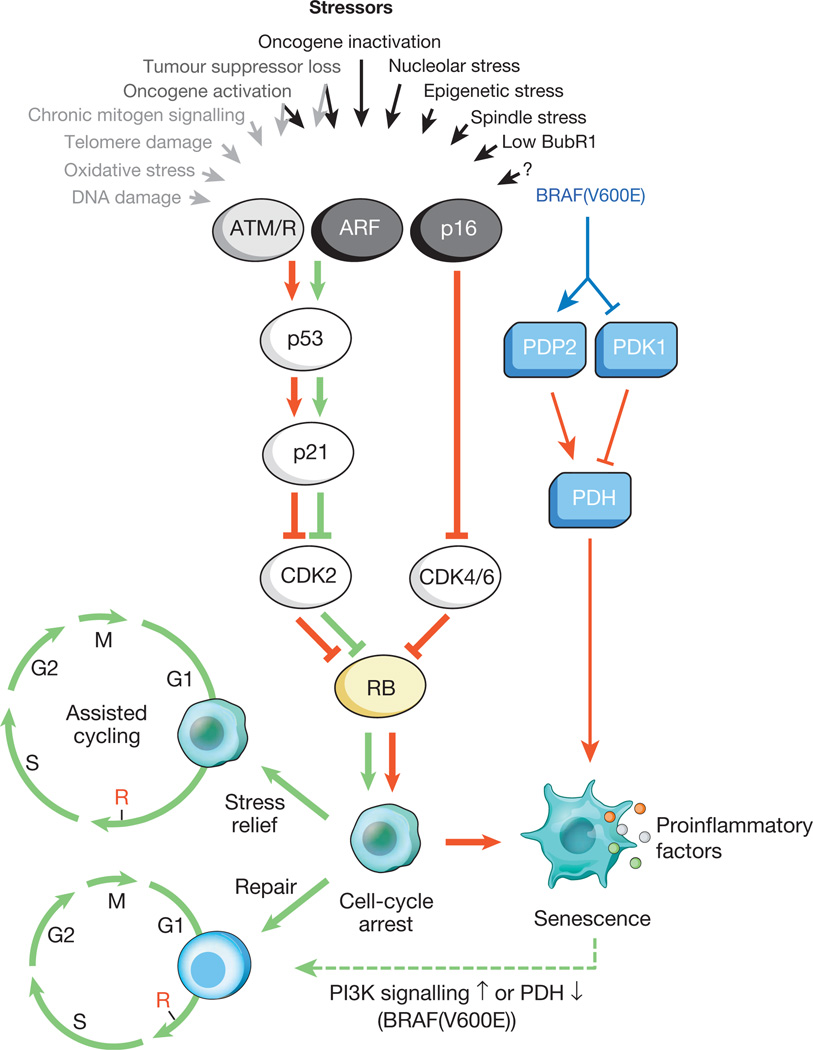
Fig.1.
Stimuli causant le vieillissement cellulaire et les principales voies effectricesUne variété de contraintes intracellulaires et externes peuvent activer le programme de vieillissement cellulaire. Ces facteurs de stress capturent diverses cascades de signalisation cellulaire et activent finalement p53 et p16 INK4a. Les types de stress qui activent la signalisation p53 via DDR sont indiqués par un texte gris et des flèches (ROS (ROS) provoquent une réponse aux dommages de l'ADN (DDR), perturbent la transcription des gènes et la réplication de l'ADN, ainsi que le raccourcissement des télomères). La p53 activée induit la p21, qui provoque un arrêt temporaire du cycle cellulaire en inhibant la cycline E-Cdk2. p16 INK4a inhibe également la progression du cycle cellulaire, mais le fait en ciblant les complexes de cycline D-Cdk4 et de cycline D-Cdk6. P21 et p16 INK4a agissent tous deux pour empêcher l'inactivation de Rb, ce qui conduit à une répression continue des gènes cibles E2F nécessaires au début de la phase S. Avec un stress sévère (flèches rouges), les cellules temporairement bloquées entrent dans la phase d'arrêt du cycle cellulaire. Les cellules susceptibles d'être légèrement endommagées peuvent être restaurées avec succès et reprendre un cycle normal. Ainsi, la voie p53-p21 peut soit antagoniser soit synergiser avec p16 INK4a dans la vieillesse en fonction du type et du niveau de stress. BRAF (V600E) est associé au vieillissement par la voie métabolique effectrice. BRAF (V600E) active la PDH en induisant PDP2 et en inhibant l'expression de PDK1, favorisant un passage de la glycolyse à la phosphorylation oxydative, qui provoque un stress redox vieillissant. Les cellules en cours de vieillissement induisent une transcription inflammatoire indépendamment du stress inducteur lié au vieillissement (les points colorés représentent divers facteurs SASP). Les flèches rouges et vertes, respectivement, indiquent une activité qui favorise le vieillissement et «anti-âge». La flèche verte en pointillés indique le mécanisme de «changement de vieillissement».Il est connu que les cellules sénescentes influencent activement leur microenvironnement (les tissus qui les entourent), sécrétant un certain nombre de molécules actives: cytokines pro-inflammatoires, chimiokines, facteurs de croissance, protéases (un total d'environ 40 types différents de molécules). Ces substances ont été combinées en un seul groupe - le phénotype sécrétoire associé à la sénescence (SASP) associé au vieillissement cellulaire. Il est connu que les facteurs SASP participent activement au remodelage des tissus dans le développement embryonnaire. De plus, sous leur influence, le corps de la mère et l'embryon sont reconstruits. On pense que la nature évolutive de la SASP est associée à un certain nombre de mécanismes de défense: suppression tumorale, récupération après un traumatisme et régénération tissulaire.
L'effet physiologique simplifié du SASP peut être décrit comme suit. Les molécules pro-inflammatoires sécrétées forment un foyer d'inflammation autour des cellules sénescentes à éliminer. Ce qui attire les cellules du système immunitaire à cet endroit pour éliminer les cellules vieillissantes. Les métalloprotéases matricielles SASP (MMP-1, MMP-10, MMP-3) et les sérine protéases remodèlent la matrice extracellulaire pour faciliter la pénétration des cellules du système immunitaire vers les cellules vieillissantes. Et enfin, les facteurs de croissance sécrétés stimulent la prolifération des cellules voisines pour remplacer les cellules sénescentes éloignées.
Il est décrit comment le mécanisme SASP devrait fonctionner normalement, dans un corps jeune et en bonne santé. Mais avec l'âge et avec des écarts, son efficacité peut diminuer de manière significative, ce qui provoque l'accumulation de cellules sénescentes dans les tissus et, par conséquent, une sécrétion prolongée des facteurs pro-inflammatoires SASP. Qui s'accompagne de l'apparition de foyers d'inflammation chronique. De plus, il est connu qu'une activité SASP prolongée agit comme une infection sur les cellules normales. Les molécules actives sécrétées par les cellules sénescentes pénètrent dans l'espace extracellulaire et, agissant sur les cellules normales voisines, déclenchent l'arrêt du cycle cellulaire et l'arrêt de la prolifération. Ce qui accélère considérablement le développement du vieillissement cellulaire dans les tissus.
De plus, la sécrétion prolongée des facteurs SASP par le vieillissement des cellules est associée au développement de pathologies liées à l'âge. Ainsi, la sécrétion accrue de métalloprotéases matricielles par les cellules sénescentes stimule le développement des maladies coronariennes, de l'ostéoporose et de l'arthrose. Les cellules musculaires lisses sénescentes sont impliquées dans le développement de l'athérosclérose, par la sécrétion d'un grand nombre de cytokines pro-inflammatoires. La sécrétion prolongée du facteur pro-inflammatoire TNF-α par les cellules T sénescentes est impliquée dans les processus associés à la dysfonction osseuse. De plus, il est connu qu'une augmentation du niveau d'IL-6 pro-inflammatoire est associée à la résistance à l'insuline, au diabète, à l'athérosclérose et aux maladies du foie. Pour désigner tous ces processus associés à l'inflammation chronique systémique et au vieillissement, dans lesquels les facteurs SASP jouent un rôle clé, un terme spécial a été introduit - l'inflammation. En outre, le double rôle du SASP dans la cancérogenèse a été décrit - son activité de suppression et de promotion des tumeurs [8].
En relation avec le double rôle du vieillissement cellulaire décrit ci-dessus chez les jeunes et les moins jeunes, certains scientifiques considèrent le vieillissement cellulaire comme un exemple de pléiotropie antagoniste évolutive, qui est toujours formulée avec humour par l'expression «utiliser maintenant - payer plus tard». Selon cette théorie, les processus qui se sont enracinés dans l'évolution pour augmenter la survie des jeunes organismes peuvent avoir des effets nocifs cumulatifs chez les personnes âgées. Ainsi, les mécanismes associés aux cellules sénescentes à un jeune âge sont impliqués dans la grossesse, la récupération des blessures et la protection contre les tumeurs. Plus tard, les mêmes mécanismes provoquent une inflammation systémique, une dégénérescence tissulaire et le développement de pathologies [9].
Parmi le pool de cellules du corps vieillissantes, les auteurs du concept SENS mettent en évidence deux types associés au tissu adipeux: les préadipocytes et les cellules viscérales du tissu adipeux. Et ce n'est pas un hasard, car aujourd'hui, on sait que la graisse viscérale est métaboliquement active et libère un certain nombre de molécules actives - les adipokines. Qui, à leur tour, sont associées au développement d'un certain nombre de pathologies liées à l'âge (résistance à l'insuline, diabète, maladies cardiovasculaires). Les auteurs du SENS se concentrent également sur la détérioration du système immunitaire liée à l'âge. À leur avis, cela est dû à la surcharge du corps par le vieillissement des cellules et, en réponse, à la surproduction de tueurs T qui détruisent les cellules sénescentes au détriment d'autres types de cellules immunitaires. Ce qui rend un corps vieillissant vulnérable à diverses infections.
Les auteurs de SENS voient une solution au problème de l'accumulation de cellules sénescentes dans deux directions. Le premier est le développement de médicaments toxiques pour les vieilles cellules ou provoquant leur apoptose, mais inoffensifs pour les cellules saines et normales. Et la deuxième direction est la recherche de stimulants du système immunitaire pour rechercher et tuer sélectivement les cellules cibles vieillissantes. Selon les développeurs de SENS, la façon la plus probable d'attaquer sélectivement ces cellules anormales serait d'utiliser les molécules distinctives qui se trouvent sur leurs surfaces. En effet, différents types de cellules ont des différences de surfaces. Par conséquent, la première étape est l'identification et l'orientation des marqueurs de surface cellulaire spécifiques aux cellules sénescentes à éliminer. Cette stratégie n'est pas abstraite, mais constitue déjà la base de certains traitements contre le cancer qui bloquent la croissance cellulaire et attirent les cellules immunitaires pour les détruire [10].
Des études ont montré que les cellules sénescentes s'accumulent avec l'âge dans divers tissus [11]. Il a également été décrit que l'élimination des cellules sénescentes qui s'accumulent dans un modèle de souris vieillissant rapidement empêche l'apparition de trois phénotypes principaux vieillissants (cataracte, sarcopénie, perte de graisse sous-cutanée) [12]. À cet égard, il est bien évident qu'il est nécessaire d'identifier des biomarqueurs fiables et efficaces du vieillissement cellulaire. Qui sont nécessaires en premier lieu pour suivre les effets des médicaments sénolytiques potentiels.
Le plus souvent, la bêta-galactosidase associée à la sénescence, SA-β-Gal, est utilisée comme biomarqueur des cellules sénescentes. L'enzyme β-galactosidase est une hydrolase lysosomale qui décompose le bêta-galactose terminal de ses composés (lactose, kératine sulfates, sphingolipides, etc.). En 1995, il a été décrit que l'expression de SA-β-Gal augmentait significativement dans les cellules sénescentes. Une méthode immunohistochimique est utilisée pour déterminer son contenu dans les tissus vieillissants. Comme méthode alternative pour déterminer l'activité de SA-β-gal dans les cellules, la cytométrie en flux est utilisée en utilisant le 5-dodécanoylaminofluorescéine di-β-D-galactopyranoside comme substrat.
Cependant, l'utilisation de SA-β-Gal en tant que biomarqueur du vieillissement cellulaire a ses propres limites, car cette enzyme peut donner des faux positifs, augmentant l'expression non seulement dans les cellules vieillissantes, mais aussi dans les cellules "jeunes", pour lesquelles, pour diverses raisons, la prolifération est limitée. Par conséquent, il est aujourd'hui recommandé d'utiliser SA-β-Gal avec d'autres marqueurs du vieillissement cellulaire.
En 2017, la cytologie israélienne a développé une nouvelle technologie plus efficace basée sur la cytométrie en flux à l'aide du cytomètre ImageStreamX. Cette méthode a permis la détection de SA-β-Gal dans les tissus avec une efficacité de plus de 80%. Pour augmenter l'efficacité de l'analyse, les scientifiques, avec SA-β-Gal, ont déterminé plusieurs autres biomarqueurs du vieillissement cellulaire - les protéines HMGB1 et γH2AX. HMGB1 est une protéine du groupe des protéines nucléaires non histones HMG, dans les cellules sénescentes, elle quitte le noyau et se déplace dans l'espace extracellulaire. γH2AX, la forme phosphorylée de l'histone H2AX, est un marqueur reconnu pour les dommages précoces à l'ADN et le vieillissement cellulaire. De plus, une nouvelle méthode des scientifiques israéliens a permis de déterminer les cellules vieillissantes par leur taille accrue. Selon les chercheurs, leur technologie peut être utilisée pour déterminer rapidement et efficacement l'efficacité de nouveaux composés pharmaceutiques qui seront spécifiquement conçus pour éliminer les cellules vieillissantes des tissus. [13].
Les foyers d'hétérochromatine (SAHF) associés au vieillissement cellulaire peuvent également être un autre biomarqueur du vieillissement. Les SAHF sont des structures d'hétérochromatine spéciales qui se forment dans les noyaux des cellules vieillissantes. Leur formation est associée à une hétérochromatisation irréversible associée à l'inactivation des gènes impliqués dans le cycle cellulaire localisés sur ce site (MCM3, PCNA, Cycline A). SAHF peut être vu au microscope après coloration avec un colorant DAPI spécial. De plus, une expression accrue de la protéine de leucémie promyélocytaire (LMP) dans les cellules sénescentes a été décrite, ce qui peut également être un marqueur supplémentaire du vieillissement cellulaire [14].
Des chercheurs américains ont décrit la protéine p16 INK4a des cellules T du sang périphérique humain comme un biomarqueur du vieillissement cellulaire. p16 INK4a, comme décrit ci-dessus, participe activement à l'arrêt du cycle cellulaire des cellules sénescentes. L'expression de p16 INK4a est augmentée dans les cellules sénescentes et, comme il s'est avéré, était significativement associée au tabagisme et à l'inactivité physique. De plus, l'expression de p16 INK4a a été associée à une concentration d'IL-6 plasmatique, un marqueur de l'inflammation liée à l'âge. Selon les scientifiques, l'expression de p16 INK4a est un biomarqueur du sang périphérique facilement mesurable pour déterminer le vieillissement cellulaire [15].Annexe 1.Biomarqueurs du vieillissement cellulaire.1. Associé au vieillissement cellulaire β-galactosidase (bêta-galactosidase associée à la sénescence, SA-β-Gal).2. Protéine HMGB1 (protéine du groupe à haute mobilité B1).3. Histone phosphorylée γH2AX.4. Associé aux foyers d'hétérochromatine de vieillissement cellulaire (SAHF).5. Leucémie promyélocytaire protéique (LMP).6. Protéine p16 INK4a.Auteur: Alexey Rzheshevsky.Les références1. L.HayflickP.S.Moorhead. The serial cultivation of human diploid cell strains. Exp Cell Res. 1961 Dec;25:585-621.
2. Epel ES, Blackburn EH, Lin J, Dhabhar FS, Adler NE, Morrow JD, Cawthon RM. Accelerated telomere shortening in response to life stress. Proc Natl Acad Sci US A. 2004 Dec 7;101(49):17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Telomere shortening in T cells correlates with Alzheimer's disease status. Neurobiol Aging. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.