L'histoire des biomarqueurs épigénétiques a commencé en 2013. Puis pionnier dans ce sens, spécialiste de la génétique et de la biostatistique, un employé de l'Université de Californie à Los Angeles, Steve Horvath, a présenté sa nouvelle méthode révolutionnaire de détermination de l'âge biologique, appelée "horloge épigénétique". Comme son nom l'indique, cette méthode était basée sur des changements dans l'épigénome, à savoir la méthylation de l'ADN.
La méthylation de l'ADN est l'un des mécanismes épigénétiques de régulation de l'expression des gènes. Pendant la méthylation, le groupe méthyle des enzymes spéciales CH3 se lie à l'une des bases de l'ADN, la cytosine. En conséquence, la 5-méthylcytosine est formée et l'expression des gènes est inactivée - le processus de transcription est bloqué. Comme vous le savez aujourd'hui, la méthylation de l'ADN est un processus dynamique. Il peut changer sous l'influence de facteurs externes, est associé au développement d'un certain nombre de pathologies et peut être hérité par plusieurs générations futures. La méthylation joue un rôle clé dans la désactivation de l'ADN étranger, ainsi que dans les processus de développement et de vieillissement. Les changements liés à l'âge dans la méthylation décrits comme «dérive épigénétique» sont décrits. Ainsi, avec l'âge, une hypométhylation (déméthylation) et une instabilité chromosomique associée sont observées. En outre, avec le vieillissement, le processus inverse se produit également - l'hyperméthylation de certaines régions promotrices, y compris certains gènes suppresseurs de tumeurs, qui est associée au développement de pathologies [1]. En général, on pense aujourd'hui que les changements de méthylation jouent un rôle clé dans le vieillissement.
Sur la base du fait que l'âge chronologique est associé à des changements prévisibles de l'épigénome, de l'hypo- et de l'hyperméthylation dans de nombreuses régions du génome, la première génération de biomarqueurs de vieillissement épigénétique basée sur la méthylation de l'ADN a été développée. En 2011, le premier article de scientifiques de l'Université de Californie à Los Angeles, intitulé «Prédicteur épigénétique de l'âge», a montré que la méthylation de l'ADN a une relation claire avec l'âge. En 2013, Steve Horvat, à l'aide d'une technique d'apprentissage automatique assistée par ordinateur, a identifié 353 sites de méthylation fortement corrélés à l'âge chronologique d'une personne, qui ont constitué la base de la première «horloge épigénétique» ou «horloge croate» [2].
L'importance de cette découverte est difficile à surestimer. Il faut dire que la success story de S. Horvat est pleine de drame non inventé. Selon les mémoires d'Horvat lui-même, au début, ils ne voulaient pas accepter son article sur une nouvelle méthode épigénétique de mesure de l'âge dans plus d'un des magazines. Il devait constamment entendre la critique des critiques: "c'est trop beau pour être vrai". Mais Horvath n'a pas abandonné et a consacré tout son temps à finaliser la nouvelle méthode: "J'ai écrit à chaque temps libre, comme si c'était la dernière fois pour terminer mon article." Juste avant la fin du travail dans la famille croate, une catastrophe s'est produite - sa fille récemment née est décédée. Mais cela n'a pas dérangé le scientifique obstiné. La dernière édition de son article a de nouveau été rejetée par Genome Biology. Et après avoir reçu un autre commentaire critique des examinateurs, Horvath, dans ses souvenirs, a fait trois choses qui ne devraient pas être faites: «Après avoir lu les commentaires des examinateurs, j'ai passé les 10 minutes suivantes à faire trois choses qui ne devraient jamais être faites. Tout d'abord, je suis allé au réfrigérateur et j'ai bu trois bouteilles de bière aussi vite que possible. Deuxièmement, je suis retourné à l'ordinateur et j'ai écrit une lettre à l'éditeur. Troisièmement, je l'ai envoyé. " Et cette fois, la fortune lui sourit, son article est accepté.

Comment une «horloge épigénétique» peut-elle être utile? Selon l'auteur de la découverte, cette méthode peut jouer un rôle important dans l'évaluation de l'efficacité des interventions anti-âge, car elle peut réduire considérablement le délai d'attente pour les résultats. En outre, il est supposé que les sites de méthylation identifiés par la Croatie ne sont pas seulement des marqueurs, mais également des participants actifs au vieillissement (au moins certains). Ce qui donne aux chercheurs une cible thérapeutique potentielle dans la lutte contre le vieillissement et les pathologies liées à l'âge. De plus, cette nouvelle méthode peut être utile dans le cadre d'une procédure pénale, lorsque des échantillons d'âge sont requis à partir d'échantillons de tissus. Mais, bien entendu, l '«horloge épigénétique» a acquis la plus grande importance par la suite dans la prévision des maladies et l'augmentation du risque de mortalité.
Il s'est avéré que «l'horloge épigénétique» a montré une valeur de «zéro» dans la tige embryonnaire et induit des cellules pluripotentes, des spermatozoïdes, des ovules et des cellules placentaires. Et pendant les 5 premières années de la vie - un cours accéléré associé au développement du corps. À 21 ans, l '«horloge épigénétique» ralentit progressivement, puis passe à une vitesse plus ou moins uniforme, modifiant ses performances sous l'influence de facteurs externes. De plus, il s'est avéré que différents tissus vieillissent à des vitesses différentes. Le tissu mammaire chez la femme était le plus sensible au vieillissement. Du point de vue de l'épigénétique, le cerveau vieillit le plus lentement, tandis que les cellules sanguines et osseuses présentent un vieillissement légèrement accéléré [3].
Dans le même 2013, un article a été publié par des scientifiques chinois et américains qui présentait une autre version de «l'horloge épigénétique» - «horloge Hannum». Gregory Hannum, bio-ingénieur à l'Université de Californie à l'Université de Californie à San Diego, et ses collègues ont étudié les profils de méthylation de l'ADN de 450 000 dinucléotides CpG à partir de cellules sanguines de personnes âgées de 19 à 101 ans, identifiant 71 sites de méthylation les plus corrélés avec l'âge [4]. La principale différence entre «l'horloge Hannum» et «l'horloge Horvat» est leur spécificité: les échantillons d'ADN sont prélevés dans les cellules sanguines et non dans aucun tissu, comme la méthode croate.
Assez rapidement, la valeur principale de «l'horloge épigénétique» est devenue claire. La comparaison de leurs progrès avec l'âge chronologique est d'une grande valeur pronostique pour évaluer le risque de mortalité toutes causes confondues et le développement de nombreuses pathologies. Si "l'horloge épigénétique" est pressée - il y a des maladies, un vieillissement accéléré et un raccourcissement de la durée de vie. S'ils vont plus lentement que l'âge chronologique, il y a de bonnes chances de longévité. Des études ont montré que «l'horloge épigénétique» a une forte corrélation avec la mortalité de toutes causes et maladies liées à l'âge.En 2015, Horvat et ses collègues ont mené des études pour déterminer la relation entre le cancer du poumon et l'âge épigénétique. Après avoir analysé les données de 2 029 personnes, il a été constaté que l'accélération de l'âge épigénétique était associée à un risque accru de cancer du poumon, et cette relation était plus forte chez les fumeurs et les personnes de plus de 70 ans: «Les résultats ont montré que les indicateurs standardisés de l'accélération de l'âge épigénétique (IEAA) étaient significativement associée à l'incidence du cancer du poumon (HR: 1,50, P = 3,4 × 10 -3). De plus, nous avons montré que l'association peut être encore plus forte chez les personnes âgées (70 ans ou plus) ou celles qui sont actuellement des fumeurs. En général, nos résultats montrent que l'IEEA peut être un biomarqueur utile pour évaluer la sensibilité au cancer du poumon du point de vue du vieillissement biologique »[5].
La même année, un autre groupe de chercheurs a établi la relation entre «l'âge épigénétique» et le risque de décès toutes causes confondues chez les personnes de plus de 60 ans. Pour l'analyse, nous avons pris les données de quatre études (4658 personnes au total), dont l'âge moyen des participants était respectivement de 79,1, 69,5, 66,3 et 72,9 ans. L'âge épigénétique a été déterminé par deux méthodes: «l'horloge croate» (basée sur 353 sites de méthylation CpG) et «l'horloge Hannum» (basée sur 71 sites de méthylation CpG). Les deux méthodes ont montré une forte corrélation l'une avec l'autre, bien que les ensembles de base ne correspondent qu'à 6 sites CpG. Les résultats de l'étude ont montré que l'accélération de «l'âge épigénétique» par rapport à la chronologie de 5 ans augmentait le risque de mortalité chez l'homme de 16%. Les auteurs ont conclu: «Les taux de vieillissement accéléré dérivés de la méthylation de l'ADN sont des facteurs héréditaires qui prédisent la mortalité, indépendamment de l'état de santé, des facteurs liés au mode de vie ou des facteurs génétiques connus. Par conséquent, on peut supposer que l'âge prévu de méthylation de l'ADN est une «horloge épigénétique» qui mesure l'âge biologique qui va de pair, mais pas toujours en parallèle avec l'âge chronologique, et peut donner des prévisions de l'espérance de vie »[6].
En 2016, des oncologues allemands ont mené une étude décrivant la relation entre le vieillissement épigénétique accéléré et la mortalité par cancer et maladies cardiovasculaires et toutes autres causes. Pour leur travail, ils ont utilisé «l'horloge épigénétique» d'Horvath et Hannum. L'âge de méthylation de l'ADN a été évalué dans une cohorte de 1863 personnes âgées participant à l'étude ESTHER avec un âge moyen de 62,5 ans. Les résultats ont montré qu'un âge épigénétique supérieur à chronologique était associé à une mortalité plus élevée. Une accélération de 5 ans de «l'âge épigénétique» déterminée par la méthode croate a entraîné une augmentation de la mortalité de 22% et de 16% en utilisant la méthode Hannum [7].
En 2016, une grande équipe internationale de chercheurs dirigée par Steve Horvath a mené une méta-analyse à grande échelle dans laquelle les données de 13089 personnes de trois groupes raciaux / ethniques ont été examinées: blanches, hispaniques et afro-américaines. L'âge épigénétique ici a également été déterminé par deux méthodes: «l'horloge croate» et «l'horloge Hannum». Ces travaux ont montré qu'une accélération de «l'horloge épigénétique» d'un an (par rapport à l'âge chronologique) augmentait le risque de mortalité toutes causes confondues à 4%. De plus, l'effet inverse a également été observé: le ralentissement des «heures épigénétiques» a entraîné une diminution du risque de mortalité. En outre, les chercheurs ont enregistré un phénomène intéressant: «Nous avons constaté que 5% des personnes ont un âge biologique plus rapide, ce qui réduit la durée de vie. Le vieillissement accéléré augmente le risque de décès de ces personnes de 50% à tout âge adulte. »[8, 9].
Un certain nombre de facteurs externes affectant le cours de "l'horloge épigénétique" sont également déjà connus. En 2017, Horvath et ses collègues ont décrit la relation entre l'alimentation, l'alcool, l'éducation et l'exercice physique au cours du temps épigénétique. Selon les auteurs eux-mêmes, leur travail a confirmé la vérité connue depuis longtemps: un régime avec des légumes, du poisson et de la viande maigre, une consommation modérée d'alcool, l'activité physique et l'éducation ralentissent le cours du temps épigénétique et contribuent à prolonger la vie. Des niveaux élevés d'insuline et de glucose, de protéines C-réactives et de triglycérides, ainsi qu'un excès de poids corporel et une pression artérielle élevée ont accéléré le vieillissement de l'épigénome. Dans la même étude, les scientifiques n'ont pas trouvé d'effet positif de la metformine, un médicament antidébasique, sur le cours du temps épigénétique [10]. La même année, des chercheurs finlandais ont démontré une fois de plus la relation entre l'obésité et le vieillissement épigénétique accéléré [11]
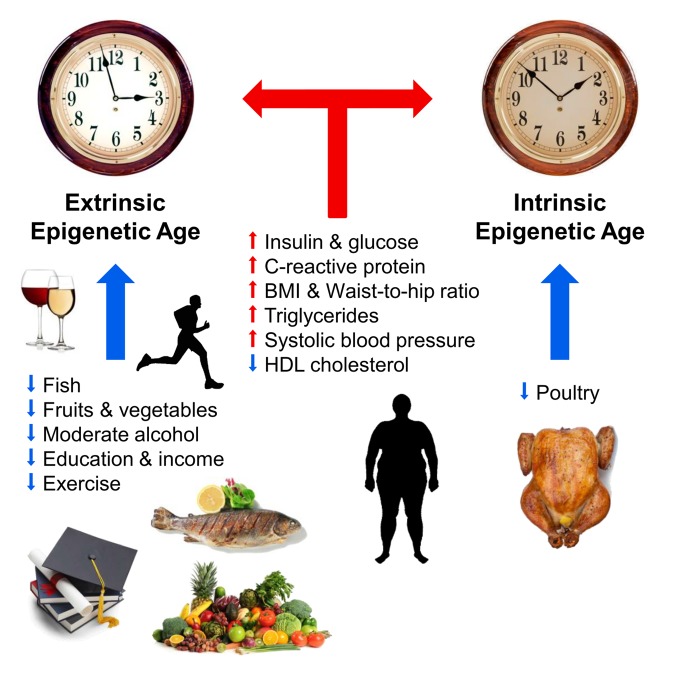
Fig. 1
Facteurs affectant l'âge épigénétique (à partir de [10]).
Les flèches bleues et rouges indiquent respectivement les facteurs qui ralentissent et accélèrent le vieillissement. L'horloge symbolise l'horloge épigénétique externe (horloge épigénétique extrinsèque, une version étendue de la méthode Hannum) et l'horloge épigénétique interne (horloge épigénétique intrinsèque, horloge croate). Effets positifs sur le cours du temps épigénétique (ralentissement): poisson, volaille, légumes et fruits, lipoprotéines de haute densité, alcool modéré, formation et activité physique. Affecter négativement le cours du temps épigénétique (accélérer): niveaux élevés d'insuline, de glucose, de protéine C-réactive, de triglycérides, d'hypertension artérielle, d'augmentation du poids corporel et d'un rapport incorrect de la taille et des hanches.Différentes équipes de recherche ont réalisé des travaux décrivant la relation entre l'évolution du temps épigénétique et les fonctions physiques et cognitives, les syndromes de Down et de Werner, l'infection à VIH, la maladie d'Alzheimer et la ménopause [12-17]. Une relation claire entre la longévité et le ralentissement de «l'horloge épigénétique» a également été démontrée en utilisant l'exemple des centenaires italiens de 100 ans [18]. Pendant longtemps, Steve Horvath n'a pas pu utiliser sa méthode pour prédire l'évolution accélérée de l'âge biologique au cours de la progeria de Hutchinson-Guildford. Mais cette année, ce problème a été résolu: ses collègues et lui ont créé des «horloges épigénétiques» à base de fibroblastes, composées de 391 sites CpG, appelées «horloges peau-sang» [19].
La prochaine étape dans le travail de S. Horvat a été le développement d'un biomarqueur du vieillissement plus efficace, avec des capacités de diagnostic améliorées qui prédisent le risque de mortalité de diverses causes et le développement de maladies liées à l'âge. Selon Horvath, l'inconvénient des «horloges épigénétiques» précédentes était que l'utilisation de l'âge chronologique comme norme pour déterminer les écarts d'âge peut exclure les sites CpG dont les profils de méthylation ne montrent pas de changements forts et dépendant du temps. Au lieu de cela, ils ne montrent que la différence entre l'âge biologique et l'âge chronologique. Ainsi, il est important non seulement de capturer les CpG qui affichent la différence avec le temps chronologique, mais aussi ceux qui montrent des différences de risque et d'état physiologique chez les personnes du même âge chronologique. En 2018, un nouveau biomarqueur appelé DNAm PhenoAge, a été créé.
Au premier stade, l'équipe de S. Horvath a analysé sur un large échantillon de personnes, 9926 personnes, participants à l'étude NHANES III, la relation de 42 biomarqueurs cliniques et l'âge chronologique avec le risque de mortalité. En conséquence, 9 biomarqueurs ont été déterminés pour prédire l'âge phénotypique:
1. Albumine
2. Créatinine
3. Glucose
4. Protéine C réactive
5. Pourcentage de lymphocytes
6. Le volume moyen de globules rouges
7. La largeur de la distribution des globules rouges
8. Numération des globules blancs
9. Phosphatase alcaline.Ils ont ensuite validé les biomarqueurs sélectionnés - vérifié leur modèle d'âge phénotypique dans un autre échantillon de personnes (6209 personnes). La vérification a montré une corrélation entre l'augmentation de l'âge phénotypique et le risque accru de mortalité toutes causes confondues: une augmentation d'un an de l'âge phénotypique était associée à une augmentation de 9% du risque de mortalité toutes causes confondues, 9% d'augmentation du risque de mortalité par maladies liées au vieillissement, 10% d'augmentation du risque de mortalité par maladie cardiaque les maladies vasculaires, une augmentation de 7% du risque de décès par cancer, une augmentation de 20% du risque de décès par diabète et une augmentation de 9% du risque de décès par maladies respiratoires.
Au deuxième stade de l'étude, les auteurs ont associé la méthylation de l'ADN à l'âge phénotypique. Les scientifiques ont identifié les sites GpC méthylés associés à ces 9 biomarqueurs cliniques qui prédisent l'âge phénotypique. Ils ont identifié 513 CpG de ces sites qui prédisaient l'âge phénotypique. Un nouveau marqueur épigénétique a été nommé DNAm PhenoAge. Le test a montré une précision assez élevée du nouveau biomarqueur: entre 1998 et 2007, la variation moyenne de l'ADNm PhenoAge était de 8,51 ans, tandis que la variation moyenne de l'âge phénotypique clinique était de 8,88 ans.
Après cela, les chercheurs ont testé leur nouveau marqueur biologique en utilisant les données de 4 grandes études, Women's Health Initiative (n = 4207), Framingham Heart Study (n = 2553), Normative Aging Study (n = 657) et Jackson Heart Study (n = 1747). Les résultats ont montré que l'ADNm PhenoAge était significativement associé à un risque de mortalité ultérieur dans toutes les études (indépendamment de l'âge chronologique): une augmentation d'un an de l'ADNm PhenoAge était associée à une augmentation du risque de mortalité toutes causes confondues de 4,5%.
L'analyse génétique de l'ADNm PhenoAge a montré que les 513 sites CpG qui y sont utilisés ont 41 CpG identiques à l'horloge croate et 6 CpG identiques à l'horloge Hannum. Cinq CpG identiques ont été trouvés dans les trois méthodes épigénétiques. 149 CpG de DNAm PhenoAge sont situés dans des grappes de dinucléotides CpG (îles CpG).
Toutes les données obtenues lors de l'étude de Steve Horvath et de son équipe ont montré que le nouveau biomarqueur a une grande valeur prédictive pour déterminer les risques de maladies liées à l'âge et le risque de mortalité. «
En utilisant un processus innovant en deux étapes, nous avons développé un nouveau biomarqueur épigénétique vieillissant, DNAm PhenoAge, qui a dépassé de loin les biomarqueurs précédents en termes de prédictions pour une variété de facteurs de vieillissement, y compris la mortalité toutes causes confondues, le cancer, la santé générale, le fonctionnement physique et la maladie d'Alzheimer. Bien que ce biomarqueur ait été développé à l'aide de données sur le sang total, il est fortement corrélé avec l'âge dans chaque tissu et cellule testés. Sur la base d'une analyse transcriptionnelle approfondie dans des cellules triées, nous avons constaté qu'une augmentation de l'âge épigénétique par rapport à l'âge chronologique est associée à une activation accrue des voies pro-inflammatoires et d'interféron et à une diminution de l'activation des mécanismes transcriptionnels / traductionnels, de la réponse aux dommages à l'ADN et aux signatures mitochondriales. En général, ce biomarqueur épigénétique unique du vieillissement est capable de couvrir les risques de nombreux résultats divers dans différents tissus et cellules et de fournir une compréhension des voies importantes du vieillissement »[20].Auteur: Alexey Rzheshevsky.Les références- .., .., .. . . 2011. 42, 1–21;
- Horvath S. DNA methylation age of human tissues and cell types. Genome Biol. 2013. 14, R115.
- Josh Mitteldorf. Methylation Aging Clock: An Update. February 14, 2018.
- Hannum, G; Guinney, J; Zhao, L; Zhang, L; Hughes, G; Sadda, S; Klotzle, B; Bibikova, M; Fan, JB; Gao, Y; Deconde, R; Chen, M; Rajapakse, I; Friend, S; Ideker, T; Zhang, K (2013). Genome-wide methylation profiles reveal quantitative views of human aging rates. Mol Cell. 49: 359–367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015; 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhävä J, Mononen N, Kähönen M, Raitakari OT, Hervonen A, Jylhä M, Lehtimäki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015; 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015; 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015; 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer's disease related cognitive functioning. Aging (Albany NY). 2015; 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D'Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015; 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.