L'utilisation de l'intelligence artificielle pour établir des diagnostics approche à grands pas. Et encore plus proche qu'il n'y paraît. En effet, immédiatement deux équipes de recherche des deux côtés de l'Atlantique ont réussi à résoudre le problème de la «boîte noire» de l'IA en médecine.
Le problème avec la boîte noire est que le système d'IA lors de la livraison des résultats, et en médecine, il diagnostique et recommande une thérapie supplémentaire, ne fournit pas la justification qui, en particulier, nécessite la US Food and Drug Administration (FDA) .
En décembre de l'année dernière, le Massachusetts General Hospital (Massachusetts General Hospital) a indiqué qu'il était capable d'enseigner l'IA pour «expliquer» le diagnostic de saignement intracrânien. Cinq mois plus tôt, la société britannique DeepMind, acquise par Google en 2014, avait annoncé une percée similaire dans le diagnostic des maladies oculaires.
La tâche principale des deux équipes était d'enseigner au système à évaluer les images des scanners et à prendre des décisions comme le fait un médecin spécialiste.
Atlas des signes
Des médecins du département de radiologie du Massachusetts Hospital, ainsi que des étudiants diplômés de Harvard Engineering and Applied Sciences, ont développé un modèle d'IA qui peut classer l'hémorragie intracrânienne, selon un communiqué de presse sur le site Web de l'hôpital. Pour former le système, l'équipe a utilisé 904 tomodensitogrammes (tomodensitométrie), qui contenaient chacun environ 40 images individuelles. Une équipe de cinq neuroradiologues a marqué chacune des images pour la présence d'un des cinq sous-types d'hémorragie, en fonction de la localisation, ainsi que l'absence d'hémorragie en soi. Pour améliorer la précision de ce système d'apprentissage en profondeur, l'équipe a intégré des actions qui imitent le processus d'analyse d'images par un radiologue, qui comprend l'ajustement de paramètres tels que le contraste et la luminosité pour révéler des différences cachées, et le défilement des sections adjacentes du scanner pour déterminer si quelque chose est vraiment apparu dans une image, reflète un vrai problème ou ne parle-t-il de rien de distorsion.
Immédiatement après la création du modèle de système, les chercheurs l'ont testé avec deux ensembles distincts de tomodensitogrammes: 100 scans avec hémorragie intracrânienne et 100 sans, pris avant le développement du système, et 79 scans avec hémorragie et 117 sans, pris après la création du modèle. Dans le cas du premier ensemble de données pris auparavant, le modèle était précis pour déterminer et classer les saignements intracrâniens au niveau de l'analyse effectuée par le radiologue. En analysant le deuxième ensemble, elle a prouvé qu'il peut être encore mieux qu'une personne qui n'est pas experte dans ce domaine.
Pour résoudre le problème de la «boîte noire», l'équipe a fait vérifier le système et enregistrer les images de l'ensemble de données d'entraînement qui représentent le plus clairement les symptômes caractéristiques de chacun des cinq sous-types d'hémorragie. À l'aide de cet atlas de caractéristiques distinctives, le système peut représenter un groupe d'images similaires à celui utilisé dans l'analyse des tomodensitogrammes afin d'expliquer les motifs pour lesquels les décisions ont été prises.
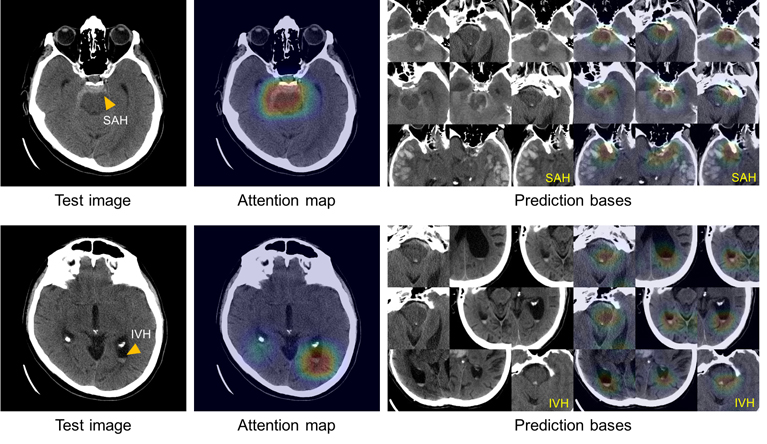
Cette illustration montre la capacité du système à expliquer le diagnostic d'hémorragies sous-arachnoïdiennes (en haut à gauche) et intraventriculaires (en bas à gauche), montrant des images présentant des symptômes similaires (à droite) de l'atlas d'images utilisées pour entraîner le système.
«La reconnaissance rapide de l'hémorragie intracrânienne, suivie d'un traitement approprié immédiat des patients présentant des symptômes d'AVC aigu, peut minimiser les effets graves sur la santé et prévenir la mort», a déclaré le co-auteur de l'étude, le radiologue Michael Leo. - Dans de nombreux laboratoires, il n'y a pas de neuroradiologues spécialement formés, en particulier la nuit ou le week-end, ce qui oblige les non-spécialistes à décider si les symptômes du patient sont causés par une hémorragie ou non. La disponibilité d'un «deuxième avis virtuel» fiable, formé par des neuroradiologues, pourrait améliorer les résultats des non-spécialistes et aider à garantir que les patients reçoivent le bon traitement. »
Carte de segmentation des tissus
En août 2018, la société britannique DeepMind a publié une étude sur la ressource Nature Medicine dans laquelle elle a déclaré avoir résolu le problème de la «boîte noire» en développant un modèle d'IA pouvant fonctionner à un niveau médical professionnel, ce qui n'exclut cependant pas les personnes du processus de traitement, mais, au contraire, aide les médecins à être plus efficaces, comme dans le cas décrit ci-dessus.
Selon une étude publiée , l'équipe DeepMind a travaillé dans le domaine des maladies ophtalmiques en collaboration avec le centre de lutte contre les maladies ophtalmiques du Moorfields Eye Hospital et a développé un modèle pour le diagnostic des images 3D de tomographie optique cohérente (OCT). Il a été possible d'ouvrir la «boîte noire» en créant deux réseaux de neurones distincts travaillant ensemble. La première, la segmentation à l'aide de l'architecture convolutionnelle tridimensionnelle (U-Net), transforme les scans OCT bruts en une carte de segmentation du tissu oculaire. Pour la formation, 877 scanners cliniques OCT ont été utilisés, chacun ayant 128 sections, seuls trois représentants ont été segmentés manuellement. Le réseau de segmentation trouve divers symptômes (hémorragies, lésions focales, etc.) et crée une carte. Selon Mustafa Suleiman, chef de l'IA appliquée, sur le blog de l'entreprise, cela aide les optométristes à accéder à la façon dont le système «pense».
Le deuxième réseau neuronal, qui classe, analyse la carte proposée et fournit des diagnostics et des recommandations de traitement au personnel soignant. Les développeurs considèrent qu'il est fondamentalement important que le réseau affiche des recommandations sous forme de pourcentages, permettant aux médecins d'évaluer la «confiance» du système dans son analyse. «Cette caractéristique est essentielle, car les optométristes jouent un rôle clé dans la prise de décisions concernant le traitement que les patients recevront», explique Mustafa Suleiman. Selon lui, la caractéristique clé du système, qui le rend utile dans la pratique, est la possibilité pour les médecins d'étudier attentivement les recommandations de l'IA. Le système est conçu pour aider à prévenir la perte complète de la vision en accélérant le diagnostic de maladies telles que la rétinopathie diabétique, la dégénérescence maculaire liée à l'âge et plusieurs dizaines d'autres maladies.

Description de l'illustration. Obtention de calculs à l'aide d'un complexe de segmentation et de classification de réseaux. L'illustration montre comment un complexe de 5 échantillons d'un réseau segmenté et 5 échantillons d'un réseau de classification sont utilisés ensemble pour créer 25 prévisions pour un balayage. Chaque échantillon de réseau segmenté fournit initialement une carte segmentée d'hypothèses basées sur le PTOM étudié. Pour chacune des cinq hypothèses, les modèles du réseau de classification fournissent une probabilité pour chaque marqueur. Ici, le marqueur de l'emplacement de l'atrophie est présenté en détail.
Les deux équipes de recherche expriment l'espoir que les systèmes développés par elles ne remplaceront pas les médecins, mais les aideront à être plus efficaces dans la prise de décisions, ce qui signifie qu'elles aideront à aider plus de patients en peu de temps. La prochaine étape consiste à utiliser les développements directement dans les scanners hospitaliers.