
Il était une fois un grand-père et une femme. Et ils avaient un poulet Ryaba. Le poulet a déposé un testicule, mais pas simple, mais génétiquement modifié. Un virage inattendu, non? Mais c'est précisément ce qui sera discuté aujourd'hui. Les produits pharmaceutiques ont beaucoup changé au cours des dernières dizaines, voire des centaines d'années. Nous n'utilisons plus de sangsues et ne considérons pas la lobotomie comme un excellent remède contre la migraine. Il existe maintenant un grand nombre de médicaments qui peuvent guérir une grande variété de maladies. Ces médicaments sont naturellement à la base de certains composés chimiques dont la production est parfois lourde de difficultés. Et puis les scientifiques ont eu une idée géniale - pourquoi avons-nous besoin de tous ces bio-générateurs complexes, si vous pouvez utiliser des poulets. Oui, vous avez bien entendu, ce sont les poulets qui porteront les œufs contenant les composés chimiques nécessaires, tels que les protéines. Comment les scientifiques ont changé les poulets pour atteindre ces objectifs, ce qui en est ressorti et si nous ne devons pas avoir peur de capturer la planète avec des poules carnivores génétiquement modifiées de deux mètres, nous apprend le rapport du groupe de recherche. Allons-y.
Base d'étudeIl convient de commencer par le fait que l'utilisation d'animaux comme bioréacteurs n'est pas quelque chose de révolutionnaire. Par exemple, Antithrombin III - un médicament obtenu à partir de lait de chèvres génétiquement modifiées (GM) a été approuvé pour utilisation en 2006. En d'autres termes, les chèvres ont agi comme un "laboratoire" produisant du lait, qui comprenait le composé chimique utilisé dans la préparation.
Cependant, selon les scientifiques, l'utilisation de gros animaux à de telles fins est assez coûteuse, compte tenu du petit nombre de descendants, d'une longue période de gestation, puis de la croissance, etc. C'est pourquoi ils ont tourné leur attention vers les poulets, et aussi parce que les œufs de poule contiennent une quantité suffisante de protéines. L'œuf de poule moyen de 60 g contient environ 3,5 grammes de protéines. En un an, une poule peut pondre environ 300 œufs. Nous ajoutons ici la garde bon marché des poulets et la croissance rapide du nombre dans des conditions normales.
De plus, en plus des avantages économiques, les scientifiques en notent d'autres plus scientifiques. Ainsi, chez les poulets et les humains, les schémas de glycosylation, le processus d'addition de sucres aux molécules organiques, sont très proches. Et cela signifie qu'il y aura une faible immunogénicité des préparations de protéines d'oeuf qui nécessitent une glycosylation pour s'activer.
Tout cela semble très, très intéressant, mais nous savons que jusqu'à présent, les œufs de poule sont davantage utilisés pour l'omelette que comme source de bases médicinales. Autrement dit, les poulets de cette étude ne sont pas simples (non, pas d'or, bien que d'un point de vue financier cela puisse être) et génétiquement modifiés.
Les scientifiques notent qu'auparavant, les lentivirus étaient utilisés pour effectuer des modifications des gènes du poulet, car ils transfèrent parfaitement les informations génétiques à la cellule hôte. L'expression du transgène peut être limitée dans l'oviducte en utilisant la séquence du gène de l'ovalbumine (albumine d'albumine d'oeuf). Cette méthode a permis la création de deux protéines biologiquement actives dans la protéine d'oeuf, cependant, le niveau d'expression était significativement inférieur à 1 g / l. Et cela ne suffit pas pour qu'une telle technique soit attractive d'un point de vue commercial et industriel.
Dans cette étude, les scientifiques ont décidé de mettre en œuvre une méthode plus avancée de production de deux nouvelles protéines, dont un dimère de cytokine, ainsi qu'une méthode de purification améliorée. L'interféron α2a, une préparation biologique brevetée pour le traitement de certaines formes de cancer et d'hépatite (déjà obsolètes), a été utilisé comme modèle.
Le principal participant à l'étude était le facteur de stimulation des colonies de macrophages (CSF1), qui est un faisceau à 4 hélices, c'est-à-dire qu'il est structurellement similaire à de nombreuses cytokines, y compris l'insuline, l'hormone de croissance, le lactogène placentaire, etc. Eh bien, le principal "producteur" de l'étude sont les poules. Quels résultats ont été montrés par les expériences et nous continuerons à réfléchir.
Résultats de recherche Image n ° 1
Image n ° 10,5 kb (mille paires de nucléotides / mille bases appariées) de la séquence codante de l'interféron α2a a été synthétisé et cloné dans le vecteur lentiviral du virus de l'anémie infectieuse équine défectif pour la réplication des chevaux avec le promoteur EREOVA.
Pour augmenter le degré d'expression, 0,9 TPN de la séquence du promoteur de l'ovalbumine a été ajoutée entre l'élément de réponse aux œstrogènes et l'élément régulateur dépendant des stéroïdes (
1a ). C'est ce vecteur lentiviral qui a permis d'obtenir des oiseaux transgéniques, parmi lesquels un mâle (G1) a été révélé, qui est porteur d'un transgène intact (entier / intact). En conséquence, c'est à partir de ce mâle que la lignée d'oiseaux transgéniques (progéniture) est allée.
Grâce à l'utilisation d'anticorps qui répondent à l'interféron α humain, la présence d'interféron α2a dans la protéine d'oeuf des poulets testés (
1b ) a été détectée à l'aide d'un immunotransfert protéique.
L'immunoblot de protéines * est une méthode analytique pour déterminer la présence de protéines dans un échantillon.
Quantitativement, α2a a été décrit en utilisant un test immuno-enzymatique, lorsque les anticorps se lient à des antigènes spécifiques, ce qui permet de déterminer leur quantité.
Pour confirmer l'activité biologique, avant le processus de nettoyage, les scientifiques ont placé le blanc d'oeuf dilué sur un transfecteur cellulaire avec le gène rapporteur de l'élément de réponse stimulé par l'interféron qui contrôle l'expression de la luciférase (
1c ).
Gène rapporteur * - rejoint les séquences régulatrices d'autres gènes pour étudier les manifestations des gènes dans les cultures cellulaires.
Luciferase * - enzymes oxydantes qui déclenchent une réaction, dont l'une des caractéristiques est la bioluminescence.
Après toutes les vérifications, le processus de nettoyage a commencé, qui consistait en:
- clarification de l'ovomucine (glycoprotéine dans la protéine d'oeuf) en abaissant le pH;
- élimination de l'ovomucine à l'aide d'une centrifugeuse;
- purification de l'interféron α2a en utilisant la capture HiTrap Blue et une chromatographie d'exclusion de taille supplémentaire.
Le degré de purification (> 95%) a été confirmé par électrophorèse des protéines sur gel de polyacrylamide (
1d ).
Il a été possible d'obtenir 15 mg d'interféron α2a à partir de 100 ml de protéine d'oeuf, ce qui représente environ 60% du volume d'interféron α2a (25 mg) détecté par immunodosage enzymatique (
1e ).
Vous avez peut-être une question - mais qu'en est-il des maladies qui peuvent passer des poulets aux humains en utilisant cet interféron α2a. Les scientifiques ont vérifié cela, et plus précisément, les propriétés antivirales de α2a en introduisant le virus de type A H1N1 dans des cellules préalablement traitées avec α2a. Et les résultats de cette analyse étaient plus que positifs (
1f ) - l'activité antivirale de l'interféron des protéines d'oeuf était de 1x10
9 U / mg, ce qui est un ordre de grandeur supérieur à celui des protéines produites en raison des bactéries.
 Image n ° 2
Image n ° 2CSF1 est l'une des protéines les plus importantes dans la différenciation, la prolifération et le fonctionnement des macrophages.
La séquence codante du porc CSF1, combinée avec F
c , a été synthétisée (pCSF1-F
c ) et clonée dans le vecteur lentiviral pLenti6 (isolé du VIH) entre le promoteur EREOVA2 et l'élément régulateur post-transcriptionnel du virus de l'hépatite de la marmotte commune (
2a ).
F c * (fragment cristallisant d'immunoglobuline) fait partie d'une molécule d'immunoglobuline qui interagit avec le récepteur F c à la surface cellulaire et avec certaines protéines.
Après le retrait du mâle (G0), qui est devenu la base d'une nouvelle lignée de descendants, parmi lesquels un transgène intact a été révélé chez deux femelles et un mâle. Ces individus ont ensuite participé à l'élevage de la progéniture de la prochaine génération (G2). L'électrophorèse sur protéine de gel de polyacrylamide a confirmé la présence de pCSF1-F
c dans la protéine d'oeuf (
2b ).
Le CSF1 de porc a été exprimé dans des cellules Ba / F3. Cela a conduit au fait que l'existence même de ces cellules dépendait de CSF1-F
c . Ainsi, il a été possible d'évaluer la viabilité cellulaire de la protéine d'oeuf test, qui était assez élevée par rapport au groupe témoin (protéine d'œufs ordinaires), où le taux de survie était presque nul (
2c ).
Ensuite, la protéine d'oeuf de pCSF1-F
des oeufs a été purifiée de l'ovomucine et transférée à l'état surnageant (surnageant, liquide au-dessus du résidu sec), comme le montre l'image
2d .
La forme dimérique active de pCSF1-F
c a été purifiée par absorption de MabSelect SuRe et polissage supplémentaire en utilisant une chromatographie d'exclusion stérique (
2e ). Le taux de pureté était supérieur à 97%.
En conséquence, le poids moléculaire moyen était d'environ 95,1 kDa (kilodaltons), la monodispersité de la protéine était également satisfaisante - Mw / Mn = 1,011 (Mw est le poids moléculaire moyen en poids, Mn est le poids moléculaire moyen en nombre). L'analyse du modèle de copolymère a montré la présence de 85,6 kDa de protéine et 9,5 kDa d'oligosaccharide.
La viabilité cellulaire a également été testée - certains œufs ont été placés au réfrigérateur à -20 ° C pendant 1 mois, et une partie pour la même période, mais à -80 ° C. Dans les deux cas, les cellules ont survécu (
2 g ), ce qui indique la possibilité d'un stockage à long terme et leur utilisation ultérieure avant même la purification sans perte d'activité.
Une analyse a également été faite de la capacité des protéines purifiées à interagir avec le récepteur CSF1. Cela a été fait en utilisant des cellules de moelle osseuse de souris et les résultats ont été satisfaisants (
2h ).
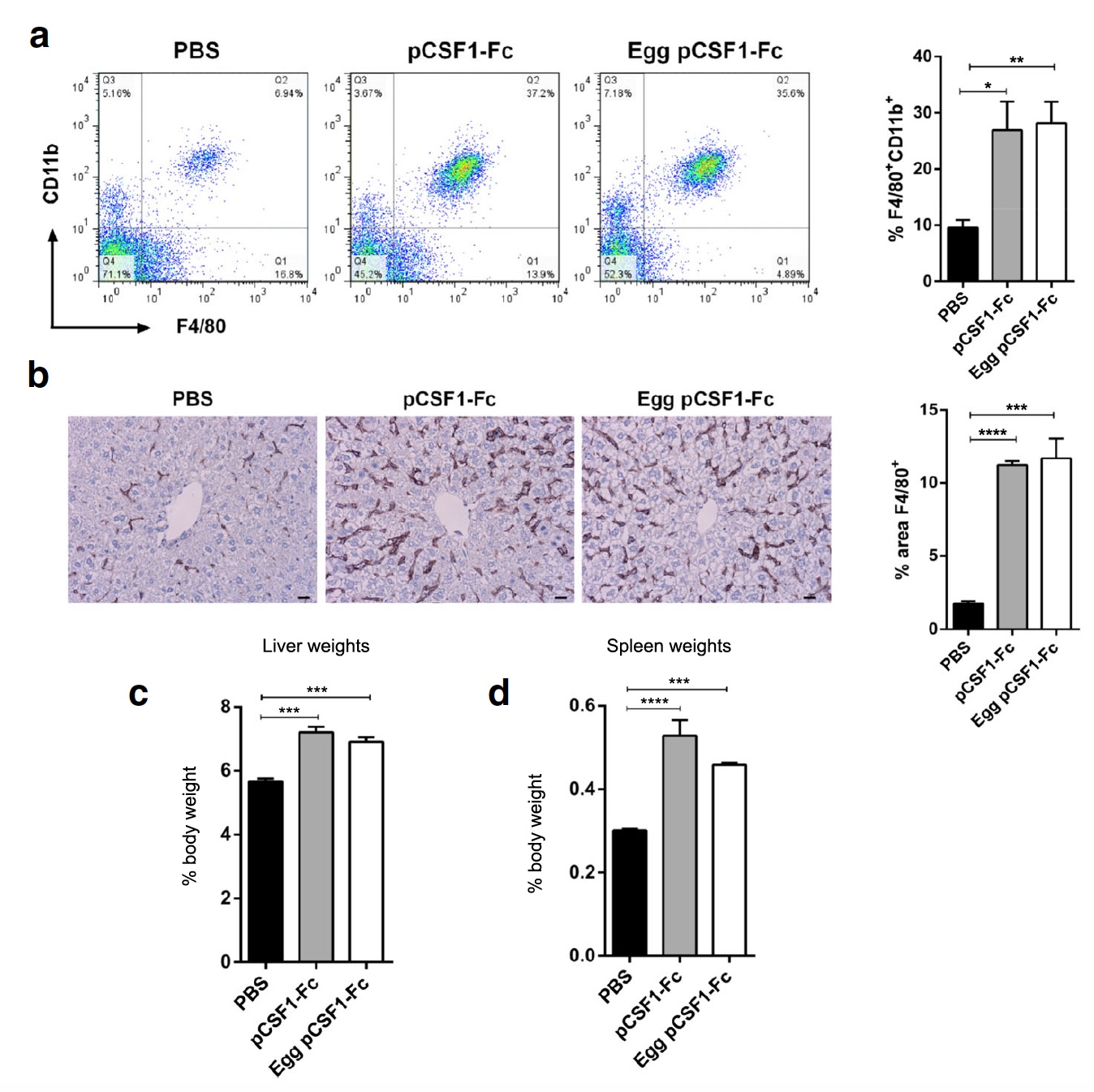 Image n ° 3
Image n ° 3Ensuite, les scientifiques ont décidé de tester l'activité de pCSF1-F
c à partir de protéines d'oeuf dans des conditions de terrain, c'est-à-dire chez des rats de laboratoire auxquels on a injecté 1 μg / g de contrôle ou de protéine pCSF1-F
c purifiée. Après cela, le poids et l'histologie du foie, de la rate et du sang des rats ont été vérifiés. Les deux variantes de pCSF1-F
c ont entraîné une augmentation du nombre de cellules F4 / 80
+ CD11b
+ dans le sang (
3a ) et des macrophages de tissus F4 / 80
+ dans le foie (
3b ). Une augmentation significative du poids du foie et de la rate a également été observée (
3c et
3d ).
 Image n ° 4
Image n ° 4Les tests, analyses et expériences ci-dessus ont montré de très bons résultats. Maintenant, il ne reste plus qu'à prouver que de telles méthodes peuvent permettre la production d'une cytokine humaine, qui peut être utilisée dans les médicaments.
Les scientifiques notent que pCSF1-F
c présente une bonne activité dans les cellules humaines et peut être immunogène. Pour confirmer cela, des rats de laboratoire ont été immunisés avec la protéine CSF1-F
c pour produire des anticorps monoclonaux qui réagissent de manière croisée avec le CSF1 humain.
Avant d'effectuer des tests réels et d'analyser leurs résultats, les scientifiques ont préparé des poulets exprimant la protéine CSF1-F
c humaine (hCSF1-F
c ). Pour ce faire, nous avons utilisé la technique et le système vectoriel décrits précédemment. Chez deux poulets, un transgène intact a été révélé qui présentait l'expression protéique nécessaire de 1 mg / ml (
4a ). Suivi du processus de nettoyage ci-dessus (
4b ). Le taux de survie de hCSF1-F
c purifié était également élevé, même après séchage et réduction sous vide (
4c ).
Pour une connaissance plus détaillée des nuances de l'étude, je vous recommande fortement de consulter le
rapport des scientifiques .
ÉpilogueLe résultat de cette étude est la confirmation que l'interféron α2a et le CSF1-F
c sont parfaitement synthétisés en tant que composants du blanc d'oeuf régulier. L'extraction de ces protéines ne nécessite pas non plus d'efforts particuliers, mais uniquement des techniques chromatographiques standard. Les protéines obtenues sont actives à la fois en laboratoire et dans le corps d'un sujet vivant (rat).
Beaucoup sont très sceptiques quant aux modifications génétiques. Certains ont même peur de cette phrase et de tout ce qui peut y être lié. Cependant, cela ne vaut que peu de compréhension des perspectives que peuvent apporter les modifications des gènes humains, de la manière dont les peurs et les dogmes dépassés sont dissipés. Dans ce cas particulier, nous avons examiné une étude dans laquelle les scientifiques ont littéralement forcé les poulets à pondre des œufs avec des protéines humaines, qui peuvent être utilisées pour produire à moindre coût, efficacement et rapidement les composants nécessaires à la création de médicaments. Peut-être que ces poules ne portent pas d'œufs d'or, mais leur valeur est beaucoup plus élevée.
Et, bien sûr, vendredi hors sujet:
Un peu de musique avant le week-end :)
Merci d'avoir regardé, restez curieux et passez un excellent week-end à tous, les gars.
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir des matériaux plus intéressants? Soutenez-nous en passant une commande ou en le recommandant à vos amis, une
réduction de 30% pour les utilisateurs Habr sur un analogue unique de serveurs d'entrée de gamme que nous avons inventés pour vous: Toute la vérité sur VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbps à partir de 20 $ ou comment diviser le serveur? (les options sont disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbit / s jusqu'au printemps gratuitement lors du paiement pendant
six mois, vous pouvez commander
ici .
Dell R730xd 2 fois moins cher? Nous avons seulement
2 x Intel Dodeca-Core Xeon E5-2650v4 128 Go DDR4 6x480 Go SSD 1 Gbps 100 TV à partir de 249 $ aux Pays-Bas et aux États-Unis! Pour en savoir plus sur la
création d'un bâtiment d'infrastructure. classe utilisant des serveurs Dell R730xd E5-2650 v4 coûtant 9 000 euros pour un sou?