Nous vous avons déjà
parlé de la circulation de microARN, mais il y a une autre chose tout aussi cool - l'ADN extracellulaire circulant (ADN sans cellule anglais, ADN circulant). Il a été ouvert en 1948. Maintenant, l'intérêt pour elle s'est intensifié, et c'est en fait la question.
L'ADN extracellulaire (cfDNA) se trouve dans plusieurs fluides corporels: dans le plasma et le sérum, l'urine, la salive, le liquide synovial, péritonéal et cérébrospinal.
Nous examinerons les caractéristiques de l'ADNcf dans deux fluides: le sang et l'urine. Il est clair que c'est plus pratique pour le diagnostic.
Sources de cfDNA dans le corps
Comme il est devenu connu, le cfDNA circule dans le sang en tant que partie des corps apoptotiques, des microvésicules, des nucléosomes, des exosomes, des complexes de nucléoprotéines avec des protéines sanguines et, vraisemblablement, sous forme libre.
On pense que les causes de l'ADNcf dans le sang sont les processus de mort cellulaire, la maturation des globules rouges, la sécrétion d'ADN par les cellules, ainsi que les bactéries et les virus. On constate tout de suite que la dernière source, l'ADN des bactéries et des virus, apporte une contribution très insignifiante au pool total d'ADN circulant, et le niveau d'ADN exogène lors des infections ne dépasse pas plusieurs dizaines de pkg / ml. Alors que, selon les données modernes, le niveau normal de cfDNA dans un corps sain est de 3 à 44 ng / ml dans le plasma et de 50 à 100 ng / ml dans le sérum sanguin.
Une partie importante de l'ADNcf dans le corps est susceptible de résulter de la mort cellulaire lors de l'apoptose, de la nécrose et de la netose. Une centaine de milliards de cellules meurent chaque jour chez un adulte par mort cellulaire programmée (apoptose), à la suite de quoi environ 1 g d'ADN est dégradé par jour.
Au cours de l'apoptose, l'ADN nucléaire est clivé par une enzyme spéciale, la DNase. Après cela, des fragments d'ADN d'une longueur d'un nucléosome multiple apparaissent (180-200 pb, paires bp-nucléotides), qui doivent être éliminés par les macrophages dans le cadre des corps apoptotiques (emballage spécial après l'apoptose). Tout le monde sait que les paires de nucléotides (adénine-thymine et guanine-cytosine) de notre ADN sont répétées trois milliards de fois. Les nucléosomes sont des structures spéciales de la chromatine, constituées de protéines d'histones, sur lesquelles un brin d'ADN est enroulé un tour et demi.
Ensuite, la chose étrange se produit. Pour des raisons inconnues, une partie de l'ADN des cellules mortes évite de rencontrer des macrophages et pénètre dans la circulation sanguine. À différents moments, des expériences ont été menées confirmant la nature apoptotique du cfDNA [1,2].
Lorsque l'ADNcf de donneurs sains est séparé par électrophorèse sur gel, des bandes correspondant à des longueurs de fragments de 180-200 pb sont détectées. et des longueurs qui sont multiples de ce nombre, ce qui correspond au clivage internucléosomique de la chromatine lors de l'apoptose. La détection de l'ADN fœtal dans le sang de la mère parle également en faveur de l'apoptose comme source d'ADNcc [3].
Normalement, la nécrose contribue moins à l'apparition de l'ADNc, augmentant son nombre dans les blessures graves. L'ADNc nécrotique dans le plasma est détecté sous la forme de fragments plus longs - de plus de 10 000 pb de longueur. En utilisant la PCR (amplification en chaîne par polymérase), il est possible de faire la distinction entre de longs fragments de cfDNA résultant de la nécrose et des fragments plus courts dus à l'apoptose.
En plus de l'apoptose et de la nécrose, il existe un autre type de mort cellulaire peu connu, qui est une source de cfDNA - la netose (NETosis).
Avec la netose, les cellules neutrophiles éjectent des structures spéciales en réseau, des pièges à neutrophiles extracellulaires (NET, Neutrophil Extracellular Trap), dont la tâche est de désactiver le pathogène qui est entré dans le corps: virus, champignons et bactéries. Dans ce cas, le neutrophile meurt, jetant de l'ADN, des histones, diverses protéines et enzymes dans l'espace extracellulaire. Il est connu que le processus NET est parfois de nature pathologique, contribuant au développement de la thrombose, des maladies cardiovasculaires et auto-immunes, ainsi que du cancer.
Récemment, en 2018, il a été découvert qu'en cas d'infection par le VIH, des neutrophiles hyperactifs, le mécanisme NET et une netose se produisent. En conséquence, il y a eu une mort étendue des cellules immunitaires capturées par des réseaux de neutrophiles, des cellules T CD4 + et CD8 +, des cellules B et des monocytes, et le développement de pathologies cardiovasculaires concomitantes [4].
Une autre source potentielle de cfDNA est la sécrétion d'ADN par les cellules normales et tumorales. En 1972, des preuves ont été obtenues de la libération active d'ADN par les lymphocytes dans le milieu extracellulaire [5].
La présence d'un phénomène tel que la libération d'ADN par les cellules dans le milieu extracellulaire suggère l'existence de mécanismes spéciaux pour le transfert d'ADN à travers la membrane cellulaire. Au cours des études, il a été constaté que la libération d'ADN des lymphocytes se produit avec l'action active de la trypsine, de la pronase et de la plasmine dans le contexte d'une carence en ions Ca2 + et Mg2 +. Un excès d'ions calcium inhibe la sortie d'ADN de la cellule [6].
Selon les biochimistes russes de l'Université d'État de Kazan, une autre source probable d'ADNc dans le sang pourrait être une forme totalement inconnue d'ADN cytoplasmique, différente de l'ADN nucléaire et mitochondrial - ADN associé à la membrane des lymphocytes diploïdes humains (ADN associé à la membrane dans le cytoplasme des lymphocytes humains diploïdes ) [7].
Malgré le fait que ce type d'ADN ait été découvert en 1971, il reste encore inexploré, et il n'y a que quelques travaux des mêmes auteurs sur lui, bien que dans PNAS et Nature.
Selon l'hypothèse d'Abramova Z.I. et al., une partie de l'ADNcf peut être formée à partir de cet ADN cytoplasmique, comme l'indiquent les traits caractéristiques de certains fragments de l'ADNcf, différents du nucléaire et du mitochondrial [6].
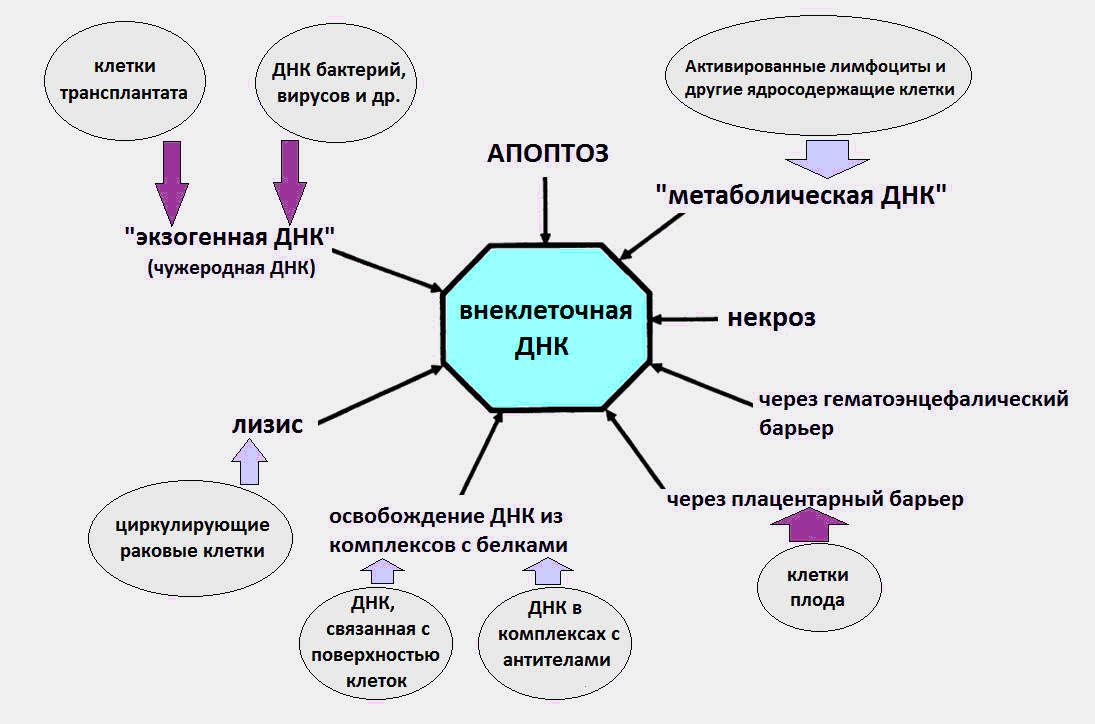 Fig. 1 Les différentes façons dont le cfDNA pénètre dans la circulation.
Fig. 1 Les différentes façons dont le cfDNA pénètre dans la circulation.Plus de détails sur tous les aspects de la biologie de l'ADNcf (effets immunomodulateurs, réception de l'ADNcf à la surface cellulaire, etc.) peuvent être trouvés dans une revue détaillée du professeur Kozlov V.A. (Institut de recherche en immunologie clinique SB RAMS) [8].
L'ADN extracellulaire comme biomarqueur pour diverses pathologies
La logique suggère que les niveaux de cfDNA devraient changer avec les pathologies qui accompagnent la mort des cellules de masse. Un certain nombre d'études ont montré une augmentation significative des niveaux d'ADNcf avec le développement de maladies auto-immunes (lupus érythémateux disséminé, sclérodermie systémique, polyarthrite rhumatoïde, etc.) et qu'il existe des caractéristiques de l'ADNcf typiques d'une certaine pathologie auto-immune [8-10].
On sait également que dans l'infarctus aigu du myocarde, qui accompagne la mort des cellules cardiaques par le type de nécrose et d'apoptose, les niveaux de cfDNA augmentent également. Et cela avait une valeur diagnostique potentielle, car les patients qui ont développé des complications avaient des niveaux plus élevés que ceux qui se rétablissaient mieux [11].
Chez les patients qui ont subi un accident vasculaire cérébral aigu, la concentration d'ADNcf dans le plasma sanguin, mesurée dans les 24 heures, est en corrélation avec la gravité de l'AVC et peut servir de prédicteur de la mortalité et de la gravité des résultats, même chez les patients qui n'ont pas de changements visibles détectés par les méthodes de neuroimagerie [12,13] .
Il est connu que le cfDNA est caractérisé par la présence d'un grand nombre de séquences guanine-cytosine (GC), qui sont plus résistantes à la destruction par les nucléases que les fragments d'ADN adénine-thymine. Ainsi, le contenu d'une séquence spécifique enrichie en GC du génome - la région transcrite de la répétition ribosomale - dans le cfDNA est plusieurs fois plus élevé que le contenu de cette répétition dans l'ADN nucléaire [14].
Et dans les pathologies chroniques accompagnées d'une activation de la mort cellulaire (maladie coronarienne, hypertension artérielle, pathologies auto-immunes), le contenu de ces séquences marqueurs riches en GC dans le fcDNA sanguin augmente de 10 fois ou plus [15]. Cela permet d'utiliser les paramètres de l'ADN ribosomique enrichi en GC dans le cadre de l'ADNc comme biomarqueur d'un processus pathologique chronique.
Dans la lutte contre le cancer, la tâche consiste à détecter une tumeur le plus tôt possible. Ici, le cfDNA est d'un intérêt extrême en tant que biomarqueur de la tumorigenèse.
Des mutations ponctuelles dans le fcDNA tumoral ont été détectées dans le sang des patients bien avant le diagnostic [16].
À propos des niveaux de cfDNA en oncologie, recherche de mutations spécifiques à l'ADNc dans la cancérogenèse, telles que les oncogènes KRAS, HER2, BRCA1, APC, PIK3CA, BRAF, etc., en utilisant l'ADN mitochondrial comme marqueur dans l'ADNc, en étudiant les changements génétiques et épigénétiques caractéristiques les ADNcf, tels que l'hypométhylation d'éléments mobiles en aluminium, en cas de tumeurs, l'utilisation de l '"indice d'intégrité" de l'ADNc et d'autres aspects peuvent être trouvés dans les travaux de Vasilyeva et al., Gonzalez-Masia et al. [17, 18].
Il a été établi que le cfDNA est caractérisé par un état d'oxydation beaucoup plus fort sous l'influence d'espèces réactives de l'oxygène (ROS) que l'ADN nucléaire.
Ainsi, le contenu du marqueur d'oxydation de l'ADN bien connu, 8-ohodG, dans la composition de l'ADN nucléaire normalement et pour diverses pathologies varie de 1 à 10 par million de nucléotides, et le contenu de ce marqueur dans le cfDNA est de 300 ou plus par million de nucléotides [19].
Une forte augmentation de la teneur en 8 ohdG de l'ADNcf a été constatée en oncologie et dans les maladies cardiovasculaires, qui s'accompagnent de stress oxydatif, et peuvent atteindre des valeurs de 3000 8-oxodG par million de nucléotides [20].
En général, on pense que les niveaux de 8 ohdG dans le cfDNA sont un marqueur sensible du stress oxydatif total dans le corps.
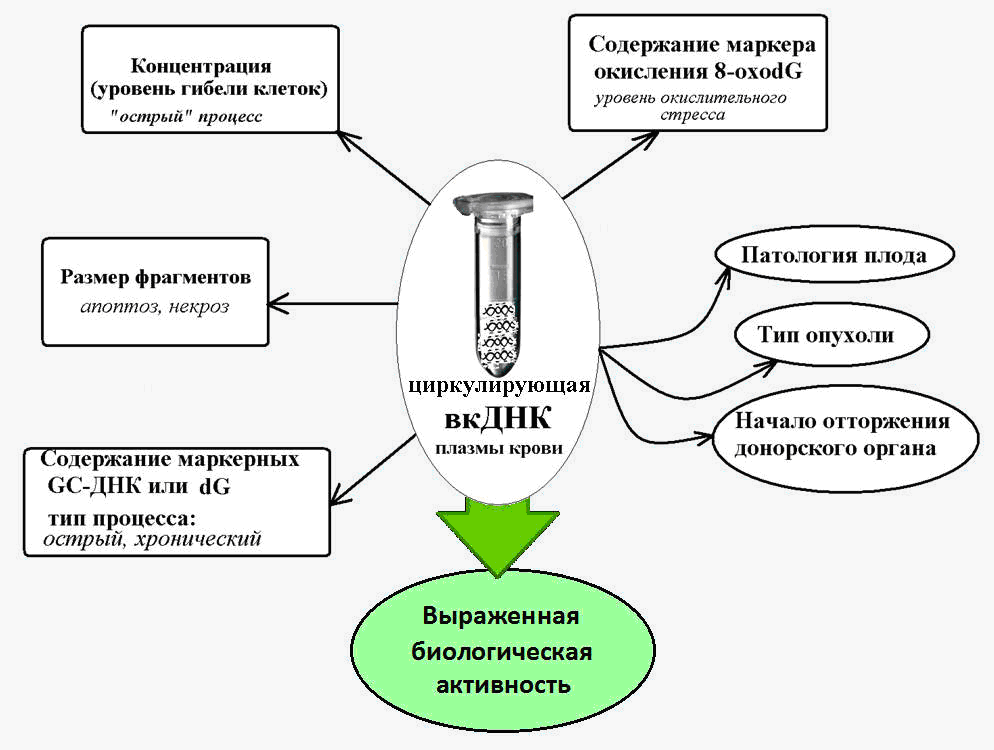 Fig. 2. ADN extracellulaire circulant - un marqueur dans diverses conditions pathologiques, accompagné d'une augmentation de la mort cellulaire.
Fig. 2. ADN extracellulaire circulant - un marqueur dans diverses conditions pathologiques, accompagné d'une augmentation de la mort cellulaire.L'ADN extracellulaire comme élément mobile
Une percée majeure et très importante dans les études sur le rôle de l'ADNcf dans les processus internes s'est produite il y a 3 ans. En 2015, un groupe de chercheurs a fait une découverte passionnante qui a montré que le cfDNA, comme les éléments génétiques mobiles, est capable d'envahir l'ADN nucléaire et de provoquer des mutations dans le génome [21]. Tout cela est très surprenant.
Dans des travaux antérieurs, il avait déjà été démontré que l'ADN tumoral du sang pouvait avoir la capacité de s'intégrer dans l'ADN nucléaire. Des fibroblastes de souris ont été placés dans du plasma prélevé sur des patients atteints de cancer du côlon, après quoi des oncogènes K-ras et des gènes de la protéine p53 impliqués dans l'apoptose ont été détectés dans l'ADN des cellules de souris, et les cellules elles-mêmes ont été transformées en oncogène (ont causé le cancer chez des souris saines) [22 ]. Cela indique que l'ADN du plasma a été absorbé et intégré par les cellules qui y sont placées. Ce phénomène présumé - l'absorption par des cellules saines d'oncogènes de l'ADNc v circulant dans le sang - peut être responsable du processus de métastase et est appelé «génomestase».
Dans un autre travail, des données ont été fournies sur l'absorption et l'intégration de fragments du gène DYS14 spécifiques du chromosome Y dans le cerveau d'une femme portant un fœtus masculin [23].
Dans une étude de 2015, les scientifiques ont observé comment les cfDNA marqués par fluorescence prélevés sur des patients cancéreux et des personnes en bonne santé étaient facilement insérés dans l'ADN nucléaire des fibroblastes murins dans des expériences in vitro (c'est-à-dire en dehors d'un organisme vivant, dans des cultures cellulaires). De plus, le cfDNA humain a été localisé dans les noyaux des cellules de souris pendant plusieurs minutes, et près de 100% des noyaux des cellules de souris ont montré des signaux fluorescents pendant 30 minutes.
Le séquençage de l'ensemble du génome des cellules de souris a montré la présence de fragments d'ADN humain, y compris les éléments mobiles caractéristiques d'Alu. De plus, les auteurs ont trouvé l'induction de foyers γ-H2AX résultant de dommages à l'ADN, ainsi qu'une augmentation de l'activité de la caspase-3 et de l'expression des gènes ATM, p53, p21, GADD-34 et ADN ligase. Ce qui, ensemble, indique une instabilité accrue du génome, une activation de la réponse aux dommages à l'ADN et une apoptose.
Les auteurs ont ensuite testé l'effet de l'ADNc vc étranger in vivo sur un organisme vivant. Des souris ont été injectées par voie intraveineuse avec de l'ADNc humain, dont des fragments ont ensuite été trouvés dans le cœur, les poumons, le foie et le cerveau de souris qui ont été sacrifiées 7 jours après l'injection.
De plus, les particules d'ADN humain administrées aux souris ont pu traverser la barrière hémato-encéphalique et pénétrer le cerveau. Comme dans le cas des cellules en culture, l'administration intraveineuse de cfDNA a provoqué l'induction de γ-H2AX, la caspase-3 proapoptotique et l'activation de la réponse aux dommages à l'ADN. Et c'est la réponse aux dommages à l'ADN, selon les scientifiques, qui joue un rôle central dans l'intégration du cfDNA dans le nucléaire.
L'ADN nucléaire perçoit l'introduction de l'extracellulaire comme une rupture à double brin et commence à se «patcher» lui-même, incorporant l'ADN circulant dans sa composition: «L'activation de la réponse aux dommages à l'ADN combine plusieurs cfDNA hétérogènes et la chromatine fragmentée dans de longs concatémères par une connexion non homologue des extrémités dans le cadre du processus de récupération.»
En conséquence, les auteurs arrivent à la conclusion paradoxale: «Étant omniprésents et se produisant constamment, les dommages à l'ADN nucléaire causés par l'ADN extracellulaire circulant peuvent être la principale cause du vieillissement associé aux anomalies du vieillissement et à la mort ultime du corps. Ainsi, l'ADN, peut-être, joue un rôle paradoxal en tant que gardien des fondements de la vie et destructeur de la vie elle-même. »
Il va sans dire que cette conclusion est tout à fait contraire à toutes les idées sur le vieillissement aujourd'hui.
La logique suggère que cette hypothèse correspondrait à la dépendance suivante: plus la durée de vie d'une espèce est longue, moins l'individu de cette forme d'ADN et / ou moins dangereux pour cette espèce.
Mais jusqu'à ce qu'une telle étude comparative soit terminée, il reste à supposer que dans les espèces à longue durée de vie (humains) et à courte durée de vie (souris), des ADNcf sont produits, vraisemblablement, en quantités relativement comparables. Et la découverte de concentrations accrues de ces molécules chez les personnes âgées pourrait bien être, au contraire, une conséquence du processus de vieillissement, et non sa cause.
Bien que ce soit une conséquence qui peut renforcer la cause. Lisez l'article de Belikov.
De plus, les auteurs de la découverte suggèrent d'attribuer le cfDNA à une autre classe d'éléments génétiques mobiles. Et puis, peut-être, une large participation à l'évolution d'un processus tel que le transfert horizontal de gènes, tant chez les invertébrés que chez les vertébrés représentants du monde animal, trouvera son explication. Grâce à quoi, selon l'une des dernières données, le génome humain pourrait emprunter plusieurs dizaines de gènes à d'autres espèces [24]
Une question très importante reste ouverte: comment exactement les ADNcf pénètrent-ils dans la cellule? Les hypothèses existantes incluent la suggestion que les particules contenant de l'ADN peuvent pénétrer les cellules à travers les pores de la membrane, ainsi que par différents types d'endocytose, la macropinocytose dépendante des protéoglycanes ou lors de l'interaction avec des protéines membranaires.
ADN extracellulaire pour l'obésité, l'inflammation, les rayons X et le stress de toutes sortes
Une autre découverte intéressante a été faite un an plus tard par des chercheurs japonais. Ils ont pu décrire la participation active de l'ADNcf, qui est apparu dans le sang à la suite de la mort des adipocytes chez les personnes obèses, dans le développement de l'inflammation et de la résistance à l'insuline. Le facteur clé interagissant avec le cfDNA dans ces processus était la molécule d'immunité innée Toll-like receptor 9 (TLR9) [25].
Non sans intrigue de la part des scientifiques russes de l'Institut de biophysique théorique et expérimentale de l'Académie russe des sciences. Ils ont découvert que l'irradiation aux rayons X et le médicament antidiabétique metformine provoquent une augmentation de l'excrétion urinaire de l'ADNcf (nucléaire et mitochondrial) chez le rat.
Leurs données ont montré qu'avant les expériences, la quantité d'ADNc fcc nucléaire était 40% plus élevée et celle de l'ADNc mitochondrial était 50% plus élevée dans l'urine des rats âgés par rapport aux rats jeunes.
12 heures après l'irradiation, la teneur en i-fcDNA et mt-fcDNA dans l'urine des jeunes rats a augmenté respectivement de 200% et 460% par rapport au témoin, tandis que dans l'urine des rats âgés, elle a augmenté de 250% et 720%.
6 heures après l'administration de metformine à d'autres rats, la quantité d'i-cfDNA et de mt-fcDNA dans l'urine des jeunes rats a augmenté de 25% et 55% et de 50% et 160% dans l'urine des rats âgés.
Selon les auteurs, ces données suggèrent que les rayons X et la metformine provoquent une augmentation significative de l'ADNcf dans l'urine de rat (en particulier les anciens), causée par la mort cellulaire active dans les tissus. Ces résultats suggèrent également que la metformine pourrait agir comme un sénolytique, initiant la mort de vieilles cellules contenant des troubles structurels et fonctionnels [26].
En octobre de l'année dernière, les scientifiques ont suivi la relation entre les niveaux d'ADNcf et le stress mental et l'activité physique chez les jeunes âgés de 18 à 36 ans. Les résultats ont montré une double augmentation de cfDNA après un stress psychosocial de laboratoire aigu (TSST) et une multiplication par cinq de cfDNA après exercice sur le tapis roulant (avec la réalisation de l'épuisement du tapis roulant).
Une quantité accrue de fragments plus courts de cfDNA, caractéristique de l'apoptose, dans le sang après épuisement physique a également été enregistrée.
L'ADN mitochondrial extracellulaire a montré la même augmentation après les deux charges de stress. De plus, les profils de méthylation de l'ADNcf utilisés dans ce travail comme marqueur pour différentes origines cellulaires étaient significativement différents pour différents tests de stress.
Pour l'analyse de la méthylation, les scientifiques ont sélectionné le gène HOXA5 activement impliqué dans le développement embryonnaire en raison de la spécificité de sa méthylation dans différents types de cellules. Ainsi, il se caractérise par une hyperméthylation dans les cellules musculaires, une hypométhylation dans les cellules du cerveau, à partir de lignées cellulaires de l'hippocampe et des neurones en culture, et une méthylation différentielle dans les cellules sanguines.La méthylation du gène HOXA5 dans l'ADNcf a diminué immédiatement après le stress psychosocial et a augmenté après le stress physique, ce qui, selon les auteurs, indique diverses sources cellulaires de libération active d'ADN nucléaire. [27].ADN extracellulaire et vieillissement
Maintenant, l'essentiel. Examinons la relation entre les niveaux et les caractéristiques spécifiques de l'ADNc avec le vieillissement.Les premiers travaux qui ont montré cette relation ont été publiés en 2011-2013. Les microbiologistes et immunologistes finlandais de l'Université de Tampere ont étudié les indices cfDNA chez les centenaires de plus de 90 ans, les participants à l'étude Vitality 90+ et les jeunes (âgés de 22 à 37 ans) en tant que groupe témoin.Les résultats de leurs travaux ont montré que la concentration de cfDNA dans les foies longs était significativement plus élevée que chez les jeunes. Il y avait également des différences caractéristiques dans l'ADNcf: chez les personnes âgées, il était davantage représenté par des fragments de faible poids moléculaire, chez les jeunes, il était représenté par des fragments plus élevés de poids moléculaire, c'est-à-dire plus longs.Dans les études suivantes, le même groupe a montré que les niveaux d'ADNc avaient une relation claire avec les marqueurs de l'inflammation (corrélés positivement avec les niveaux de protéine C-réactive, l'amyloïde sérique A (SAA), etc.) et la mortalité chez les personnes de plus de 90 ans. Et aussi le fait que des niveaux plus élevés d'ADNcf total et hypométhylé étaient associés à une inflammation systémique et au développement d'une asthénie sénile (fragilité) [28-30].Deux des études récentes les plus récentes sur le cfDNA et le vieillissement ont montré des changements épigénétiques caractéristiques de cet ADN.Dans l'un d'eux, une équipe de scientifiques a analysé comment la méthylation des éléments génétiques mobiles LINE-1 et Alu dans l'ADNcf des personnes en bonne santé âgées de 23 à 61 ans change avec l'âge.L'élément LINE-1 a une longueur d'environ 6 000 pb, tandis que les fragments de haut poids moléculaire de l'ADNcf, par comparaison, ont une taille de plus de 10 000 pbLIGNE-1 fait référence aux rétro-éléments, c'est-à-dire aux éléments mobiles qui utilisent la transcription inverse pour leur reproduction, le transfert d'informations génétiques de l'ARN à l'ADN. LINE-1 est le seul élément mobile du génome connu aujourd'hui qui conserve la capacité de reproduire et de déplacer ses copies dans le génome. Il s'agit également de la structure mobile humaine la plus nombreuse: les copies de LINE-1 occupent une énorme proportion dans l'ADN - un cinquième du génome entier.Le deuxième élément, Alu, ne peut pas se multiplier et faire de nouvelles insertions dans le génome à lui seul, et dans ce processus dépend de l'appareil génétique de l'élément LINE-1 (pour plus de détails sur les rétroéléments du génome, voir l'article dans la revue Popular Mechanics " Retroviruses: la" cinquième colonne d'ADN ").Les résultats de l'étude ont montré qu'avec le vieillissement, il y avait une diminution significative de la méthylation des rétroéléments LINE-1 et Alu, et ce processus était sensiblement plus intense chez les fumeurs.Comme on l'a constaté aujourd'hui, l'activité des éléments LINE-1 et Alu, capables d'insérer leurs copies dans le génome, contribue à une part importante des maladies génétiques humaines et du cancer. Plus de 100 insertions (insertions) médiées par LINE-1 qui conduisent à des maladies génétiques humaines sont connues, et plusieurs insertions LINE-1 qui interrompent les gènes suppresseurs de tumeurs et provoquent le cancer ont été trouvées [31].Dans une deuxième étude, les scientifiques ont confirmé une diminution de la méthylation des éléments LINE-1 et Alu dans l'ADNcf avec l'âge. De plus, parmi les 4 groupes de l'étude (long-foies sains de plus de 100 ans, long-foies malsains de plus de 100 ans, personnes âgées (71 ans) et jeunes (25 ans)), les longes sains avec des jeunes et les personnes âgées avec des foies longs malsains avaient des caractéristiques similaires:«Constamment dans notre étude, nous avons noté une plus grande similitude dans les profils de l'ADNcf, à la fois globalement et localement entre les foies longs jeunes et sains, contrairement aux foies longs et malsains. Par conséquent, notre étude suggère que le profilage de l'ADNc fc peut être utilisé non seulement comme biomarqueur de l'âge, mais aussi comme prédicteur de la santé globale. » [32].Ainsi, l'ADN extracellulaire circulant s'est avéré être étroitement lié à l'état de santé et aux processus qui se produisent dans l'organisme pendant le vieillissement: stress oxydatif, inflammation et pathologies liées à l'âge.Les méthodes de recherche modernes, telles que la PCR quantitative en temps réel, permettent d'utiliser le cfDNA comme biomarqueur très sensible des processus liés au vieillissement.Des études ont montré la grande valeur potentielle de l'analyse de l'ADNcf dans le diagnostic du cancer, de la transplantologie, des maladies cardiovasculaires et rénales, de la fibrose, du diagnostic prénatal (pendant la grossesse), des blessures et de la septicémie, ainsi qu'en médecine du sport.Les données selon lesquelles l'ADNcf peut présenter les propriétés d'un élément mobile et s'intégrer dans l'ADN nucléaire, affectant ainsi le développement de pathologies associées aux mutations et au vieillissement en général, présentent également un intérêt certain.Tout cela nécessite des recherches et des raffinements supplémentaires.Examen préparé par: Alexey Rzheshevsky et un petit Mikhail BatinLes références- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.