Dans cet article, nous essaierons de considérer deux mécanismes de vieillissement et approches de leur thérapie: les cellules sénescentes (également appelées décrépites) et leur destruction, ainsi que les cellules souches et leur restauration et leur reconstitution. Peut-être que la lutte contre les cellules décrépites et l'augmentation du pool de cellules souches sont des approches complémentaires qui pourraient donner un résultat cumulatif. De plus, de telles thérapies sont désormais à la pointe de la recherche, certaines sont déjà utilisées dans les hôpitaux, la plupart seront mises en pratique dans les années à venir.
Senolitics - tueurs de cellules décrépites
Dans une
revue précédente, nous avons parlé en détail des cellules sénescentes et de la façon dont les scientifiques ont découvert ces cellules mortes. Mais en bref, ces cellules surviennent après des dommages, au cas où la cellule ne pourrait pas guérir les dommages, et en même temps ne pourrait pas démarrer le processus d'apoptose et se détruire.
Une cellule décrépite ne peut pas se diviser, elle remplit mal ses fonctions, et le plus désagréable est qu'elle libère des substances de signalisation qui aident les cellules environnantes à se décrépiter aussi. À ce jour, la meilleure approche pour bloquer ce mécanisme de vieillissement est considérée comme la destruction des cellules sénescentes, car même dans l'ancien corps, il y en a peu et aucune fonction importante ne sera perdue. Pour éliminer ces cellules, des préparations spéciales ont été développées appelées «sénolytiques» (de
sénile - décrépit et
lytique - destructrice).
Le début de ces études a été posé en 2011. Ensuite, James Kirkland et ses collègues ont mené une expérience d'une complexité et d'une élégance surprenantes. Ils ont développé une lignée de souris transgéniques spécialement modifiées INK-ATTAC (apoptose liée à l'INK par activation ciblée de Caspase).
Les cellules de ces rongeurs étaient sujettes à l'apoptose, au suicide cellulaire associé à la protéine p16 Ink4a et à l'activation ciblée de la caspase. La protéine p16 Ink4a montre précisément son activité dans les cellules décrépites, bloquant la capacité des cellules à se diviser. Et donc, l'apoptose a eu un effet «sénolytique» ciblé, sans affecter les cellules normales. L'activation de l'apoptose déclenchant la caspase s'est produite après l'administration du médicament spécial AP20187 à des souris.
Les résultats de
ces études ont montré que l'élimination des cellules sénescentes du corps retardait le développement de pathologies liées à l'âge: «
Dans le tissu adipeux, le muscle squelettique et les cellules oculaires dans lesquelles p16 Ink4a favorise l'acquisition de pathologies liées à l'âge, l'élimination des cellules exprimant p16 (Ink4a) a retardé le début des processus pathologiques. De plus, un retard en fin de vie a affaibli la progression des troubles liés à l'âge déjà établis. Ces données indiquent que le vieillissement cellulaire est causalement associé à des pathologies liées à l'âge et que l'élimination des cellules vieillissantes peut prévenir ou ralentir le dysfonctionnement des tissus et prolonger la santé. "
 James Kirkland MD, PhD
James Kirkland MD, PhDAprès cela, James Kirkland est devenu un véritable leader dans l'étude de la sénolitique et a en fait monopolisé ce domaine de recherche pendant les cinq prochaines années, publiant constamment dans les meilleures revues du monde toutes les nouvelles molécules à activité sénolytique.
En 2014, les scientifiques ont décrit l'un des mécanismes qui régule le vieillissement cellulaire et peut être utilisé dans le traitement de la sénescence. Leur travail était axé sur la protéine DBC1 (Deleted in Breast Cancer 1), qui régule plusieurs protéines nucléaires, dont le gène bien connu du régulateur du vieillissement SIRT1. Il modifie l'activité dans divers tissus: avec une diminution de l'expression de DBC1, l'activité SIRT1 augmente et vice versa. Il est connu qu'un régime alimentaire à haute teneur en matières grasses améliore l'expression de DBC1, réduisant l'expression de SIRT1 dans le foie et entraînant sa défaite, la stéatohépatite.
De plus, il est connu que les protéines SIRT1 peuvent inhiber le vieillissement cellulaire. Les pré-adipocytes des souris knock-out DBC1 après 12 semaines de régime riche en graisses
ont montré moins de signes de vieillissement cellulaire . Ils avaient des niveaux inférieurs de p16 Ink4a impliqués dans l'arrêt du cycle, ainsi que des marqueurs du phénotype sécrétoire lié au vieillissement (SASP): MCP-1, TNF-α et IL-6. Ces substances sont exactement le même ensemble de molécules nocives qui provoquent le vieillissement de toutes les cellules voisines.
De plus, une plus petite quantité de γ-H2AX, un marqueur connu de dommages à l'ADN, a été détectée dans les préadipocytes.
 Le mécanisme d'interaction des gènes DBC1 et SIRT1 et quelle thérapie vise
Le mécanisme d'interaction des gènes DBC1 et SIRT1 et quelle thérapie viseEn 2017,
un article de scientifiques de Harvard
publié dans la meilleure revue scientifique Science décrivant une méthode pour inhiber le DBC1 en administrant à des souris le mononucléotide nicotinamide (NMN). En outre, il a été constaté que la suppression de DBC1 a également un effet bénéfique sur l'activation du système de réparation de l'ADN après un dommage. Soit dit en passant, sous sa forme naturelle, l'enzyme NMN, qui a été administrée aux souris, se trouve dans le brocoli.
Il est important de comprendre que dans certains cas, le transfert de la cellule à l'état de décrépitude, qui rend la protéine DBC1, peut empêcher la cellule de dégénérer en tumeur. Par conséquent, les scientifiques ont continué de mettre l'accent sur la recherche principale sur la suppression de la protéine p16 (Ink4a).
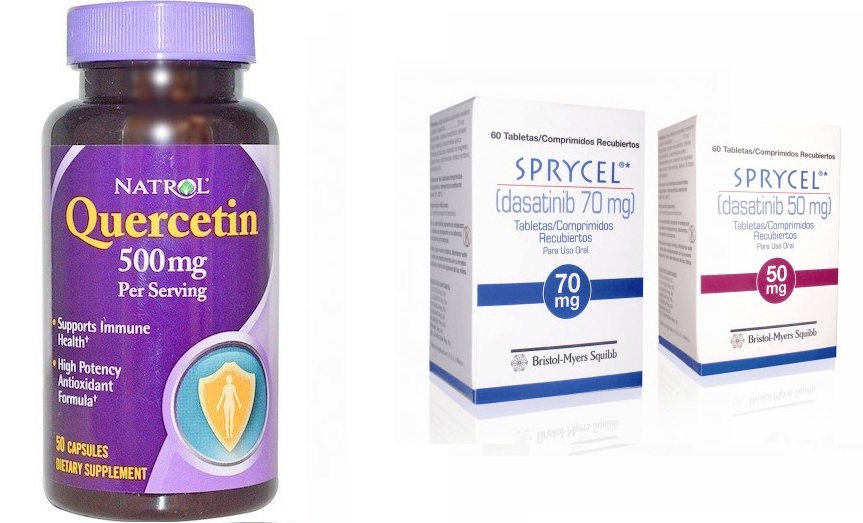
C'est pour tuer les cellules avec ce marqueur que le premier médicament sénolytique a été découvert. Il s'agissait d'une combinaison de deux substances: le dasatinib, un agent antitumoral à action ciblée, et la quercétine, un flavonoïde aux propriétés antioxydantes et anti-inflammatoires.
Au cours de l'étude, les scientifiques ont testé 46 médicaments potentiels visant à activer le suicide cellulaire, l'apoptose, dans les cellules vieillissantes. En conséquence, le dasatinib et la quercétine ont donné les meilleurs résultats.
Quercétine et dasatinib
Initialement, une combinaison de ces médicaments (dasatinib 5 mg / kg et quercétine 50 mg / kg) a été administrée par voie orale à de vieilles souris (âgées de 24 mois).
Après 5 jours dans les préadipocytes et les cellules endothéliales, une diminution des niveaux de marqueurs de vieillissement cellulaire, une forme spéciale de bêta-galactosidase (SA-βgal) et d'ARNm du gène p16, a été observée. De plus, chez les vieilles souris, les fonctions cardiovasculaires et physiques se sont améliorées.
Les scientifiques ont ensuite testé les effets du dasatinib et de la quercétine sur un modèle murin de vieillissement accéléré. L'introduction de sénolytiques chez ces souris a entraîné une diminution de l'expression des marqueurs du vieillissement dans plusieurs tissus, une diminution et un affaiblissement des signes du vieillissement ont été observés en général: courbure de la colonne vertébrale, tremblements, incontinence urinaire, altération de la marche, paralysie du membre postérieur, etc. diminuée. La durée de vie saine augmente.
Le dasatinib et la quercétine ont également éliminé les cellules sénescentes des tissus irradiés par rayonnement.
Toutes les données obtenues
nous ont permis d'affirmer que
«les sénolytiques peuvent être utilisés à l'avenir pour prévenir les maladies cardiovasculaires, l'asthénie sénile, ainsi que pour une récupération retardée ou un dysfonctionnement après chimiothérapie ou radiothérapie, troubles neurodégénératifs, ostéoporose, ostéoarthrite, autres maladies des os et des articulations et pathologies indésirables liés au vieillissement chronologique »Des
études ultérieures
ont confirmé et élargi les résultats sur les propriétés sénolytiques du dasatinib et de la quercétine. Le traitement des rongeurs avec du dasatinib et de la quercétine a amélioré la fraction d'éjection du cœur et augmenté la réactivité vasculaire chez les souris âgées après une cure de 3 jours. Leur administration a également réduit la calcification vasculaire et amélioré l'état vasculaire dans un régime hypercholestérolémique riche en graisses.
Le dasatinib et la quercétine ont amélioré la fonction pulmonaire et réduit la fibrose pulmonaire dans un modèle murin de fibrose pulmonaire idiopathique, réduit la stéatose hépatique causée par un régime riche en graisses et réduit l'ostéoporose chez les vieilles souris.
Dans le modèle murin du syndrome progéroïde humain, le dasatinib et la quercétine ont réduit la fragilité, l'ostéoporose, la perte de glycosaminoglycanes dans les disques intervertébraux et la spondylose.
Récemment, en janvier de cette année, les résultats de la première étude pilote ouverte de Senolytics chez l'homme ont été
publiés . La combinaison du dasatinib et de la quercétine a amélioré les performances physiques des personnes âgées atteintes de fibrose pulmonaire idiopathique.
NavitoklaksEn 2016, Kirkland et ses collègues ont présenté un autre médicament sénolytique potentiel, Navitoclax (ABT263). Navitolax est un inhibiteur des protéines de la famille Bcl-2, impliquées dans la régulation de l'apoptose, et fait l'objet d'essais cliniques en tant que médicament antitumoral.
Il s'est
avéré que le navitolax, supprimant l'activité des protéines Bcl, stimulait l'apoptose dans certaines vieilles cellules. Il a agi comme sénolytique sur les cellules endothéliales de la veine ombilicale humaine (HUVEC), sur les fibroblastes pulmonaires humains (IMR90) et les fibroblastes embryonnaires de souris (MEF), mais n'a pas exercé d'effet sénolytique sur les préadipocytes humains.
La même année, un autre groupe de scientifiques a décrit l'effet du navitolax lors d'expériences sur le vieillissement normal et l'exposition à des radiations de rongeurs. L'administration orale de navitolax à des souris irradiées et vieillissantes a éliminé efficacement les cellules sénescentes, y compris les cellules souches hématopoïétiques de la moelle osseuse et les cellules souches musculaires vieillissantes. Les auteurs ont tiré la
conclusion suivante de leur étude: «
Nos résultats montrent que la purification sélective des cellules sénescentes à l'aide d'un agent pharmacologique est utile en partie à cause du rajeunissement des vieilles cellules souches dans divers tissus. Ainsi, les médicaments sénolytiques peuvent représenter une nouvelle classe d'agents anti-âge et atténuer les effets des radiations . »
En 2017, la capacité de navitolax à influencer le développement de la fibrose a
été démontrée . Navitolax a éliminé les myofibroblastes résistants à l'apoptose qui étaient impliqués dans la formation de fibrose dans le modèle murin de sclérodermie (une maladie auto-immune caractérisée par une fibrose multi-organes).
Tocotriénols
En outre, au cours des trois dernières années, l'effet sénolytique des tocotriénols, produits chimiques de la famille de la vitamine E, a été décrit en détail. Pendant longtemps, les tocotriénols ont été dans l'ombre d'autres produits chimiques de la même famille, les tocophérols, et leur étude active a commencé très récemment. Il s'est avéré que les tocotriénols ont un grand potentiel dans la lutte contre diverses maladies et le vieillissement. Ils ont une activité antioxydante et neuroprotectrice prononcée.
Leur capacité à avoir un effet protecteur sur les neurones et à atténuer les symptômes de la maladie de Parkinson a été démontrée. De plus, les
tocotriénols peuvent aider à prévenir la perte osseuse associée à l'ostéoporose et la survenue d'ulcères d'estomac et de gastrite dus au stress. De plus, les tocotriénols ont un effet préventif sur le développement de pathologies cardiovasculaires et ont des propriétés antitumorales, stimulant l'apoptose dans les cellules cancéreuses.
C'est leur dernière propriété, l'induction de l'apoptose, et a permis aux scientifiques de considérer les tocotriénols comme des sénolytiques potentiels. Pour cela,
un certain nombre d' études ont été
menées qui ont
montré leur
efficacité sénolytique . Sur la base de ce qui précède, il ne semble pas du tout accidentel que dans le titre de l'un des articles scientifiques, les tocotriénols soient désignés comme «vitamine du 21e siècle» avec de grandes
capacités cliniques .
Il ne serait peut-être pas exagéré de dire que les tocotriénols ont l'un des potentiels les plus importants en tant qu'agents sénolytiques.
Une autre classe de sénolytiques trouvée par James Kirkland et ses collègues est l'inhibiteur de la protéine Hsp90 (Heat shock protein 90). Hsp90 appartient à la famille des protéines de choc thermique. Ils remplissent la fonction de chaperons dans le corps (du français. Shaperon - nounou), participant au repliement (repliement dans la structure correcte), à la dégradation et à la stabilisation de la protéine, à la correction des erreurs dans la structure protéique.
Mais, comme cela arrive souvent, Hsp90 a un double rôle dans le corps: utile et pas très. En plus de protéger les protéines vitales, Hsp90 soutient les protéines impliquées dans la cancérogenèse - il stabilise plusieurs facteurs oncogènes instables, tels que les mutants EGFR, BRAF et HER2, ainsi que certains facteurs anti-apoptotiques, empêchant l'élimination des cellules «endommagées».
Cyrland et ses collègues ont découvert que les inhibiteurs (c'est-à-dire les suppresseurs d'activité) de la protéine Hsp90 (geldanamycine, tanespimycine, 17-DMAG, etc.) ont également des propriétés sénolytiques. Le mécanisme par lequel les inhibiteurs de Hsp90 ont éliminé les vieilles cellules comprenait une exposition à la forme activée de la protéine kinase AKT, qui supprime l'apoptose en affectant MTOR, NF-kB, Foxo3a et d'autres voies de signalisation dans les cellules cancéreuses et anciennes.
L'introduction de souris transgéniques avec vieillissement accéléré de l'un des inhibiteurs de Hsp90, le 17-DMAG, a adouci et retardé l'apparition de plusieurs de leurs symptômes liés à l'âge: cyphose, dystonie, tremblements, mauvaise fourrure, ataxie, trouble de la marche, etc. Selon les auteurs de l'étude, leurs résultats montrent que la protéine HSP90 est une cible moléculaire valable pour
tuer les cellules sénescentes .
Et enfin, l'une des dernières découvertes sur le «Front Senolitique» est le Senolitic Fisetin, introduit en septembre de cette année par le même Kirkland et son équipe. La fisétine est un flavonoïde bien connu présent dans de nombreux légumes, fruits et baies (concombres, fraises, kakis, raisins, oignons, etc.).
L'objectif de cette étude, selon les auteurs, était d'identifier un autre flavonoïde aux propriétés sénolytiques plus fortes que la quercétine. Un total de 10 flavonoïdes ont été analysés. Dans les fibroblastes embryonnaires murins sénescents et dans les fibroblastes humains, la fisétine a réduit le plus efficacement les niveaux de marqueurs du vieillissement cellulaire. Ensuite, il a été examiné chez les animaux.
Dans un modèle de souris progéroïde, l'administration de fisétine a réduit de manière significative l'expression des marqueurs de vieillissement cellulaire dans tous les tissus. Il y a également eu une diminution de l'expression des facteurs p16 Ink4a, p21 Cip1 et SASP dans les cellules T CD3 + du sang périphérique, un type de cellule qui montre une augmentation régulière de l'expression de p16 INK4a chez les personnes âgées. De plus, la fisétine a réduit le stress oxydatif dans le foie en agissant comme antioxydant et en augmentant les niveaux d'un autre antioxydant, le glutathion intracellulaire.
Chez les vieilles souris vieillissant normalement, la fisétine a également réduit les marqueurs du vieillissement cellulaire, mais, surtout, a provoqué une augmentation de la durée de vie des rongeurs. Les auteurs de cet ouvrage sont très enthousiastes à l'idée de leur découverte: «Nos résultats montrent que la fisétine cible plusieurs, mais pas tous les types de cellules vieillissantes du corps. De plus, en diminuant le pourcentage de cellules vieillissantes, la fisétine réduit l'expression des marqueurs de vieillissement dans plusieurs organes. Cela conduit à une amélioration de l'homéostasie tissulaire et à une diminution de multiples pathologies liées à l'âge, ce qui est cohérent avec l'effet sur le processus de vieillissement fondamental.
Le fait que la fisétine a réduit la proportion de cellules T et NK sénescentes peut aider à améliorer les effets positifs de la fisétine, car les cellules immunitaires saines sont importantes pour nettoyer les cellules sénescentes. De même, la fisétine réduit les marqueurs de l'inflammation et du stress oxydatif. » Étant donné que la fisétine est un produit naturel que l'on trouve dans les aliments et qu'il n'y a eu aucun effet secondaire indésirable, les auteurs de l'étude suggèrent que la fisétine peut bientôt être utilisée dans le
traitement des personnes .
Et
plus récemment , en novembre de cette année, des scientifiques britanniques ont présenté deux autres sénolytiques potentiels: les antibiotiques roxithromycine et azithromycine, qui visent à vieillir les fibroblastes humains.
À la lumière de ce qui précède, il semble tout à fait logique que l'élimination des cellules sénescentes par la sénolitie à un âge avancé améliore la santé et augmente l'espérance de vie. Comme l'ont montré des expériences avec des rongeurs INK-ATTAC modifiés (que nous avons mentionnés au tout début), le nettoyage du corps de certaines des anciennes cellules en administrant le médicament activant l'apoptose AP20187 a augmenté la vie des souris de 17 à 35% par rapport au groupe témoin. Une diminution des marqueurs du vieillissement cellulaire a été enregistrée dans plusieurs tissus à la fois: dans les poumons, le cœur, les reins, les muscles squelettiques, la rate. De plus, la fonction du cœur, des reins et des yeux était normale chez les rongeurs, une bonne activité physique et la tumorigenèse était ralentie.
Cellules souches
À notre avis, il semble tout à fait logique après le traitement avec Senolytics la deuxième étape, qui aide à restaurer les organes et les tissus, d'effectuer une thérapie de remplacement cellulaire avec des cellules souches.
Les cellules souches utilisées en thérapie cellulaire se présentent sous plusieurs formes. L'utilisation la plus prometteuse de la thérapie cellulaire peut être dans le traitement des maladies du tissu osseux liées à l'âge, dans des pathologies qui ne se prêtent pas au traitement médicamenteux (cardiovasculaire et neurodégénératif), ainsi que dans la restauration de la fonction immunitaire. Examinons brièvement ces trois domaines de la thérapie cellulaire.
On pense que les cellules souches mésenchymateuses (CSM) ont le plus grand potentiel de réparation tissulaire dans les maladies cardiovasculaires. Les CSM ont été découverts il y a un demi-siècle par des scientifiques soviétiques, Alexander Friedenstein et ses collègues.
Ils ont leurs propres caractéristiques: la capacité de division symétrique et asymétrique, le potentiel de prolifération élevé et la capacité d'adhésion, la morphologie de type fibroblaste, la formation de colonies en culture et la différenciation facilement induite. C'est leur dernière propriété, découverte il n'y a pas si longtemps - la capacité de se différencier en différents types de cellules - fait des MSC l'outil le plus approprié en thérapie cellulaire.Un autre type de cellules souches moins couramment utilisé est les cellules souches hématopoïétiques (CSH), qui sont impliquées dans la formation du système immunitaire et l'hématopoïèse et se trouvent uniquement dans la moelle osseuse. Bien qu'ils soient constamment divisés dans la moelle osseuse, ils sont relativement peu nombreux et ils sont rarement considérés comme un outil de traitement du vieillissement. Leur domaine d'application typique est la transplantation de moelle osseuse après chirurgie.Dans la moelle osseuse, les CSM indifférenciées créent un microenvironnement pour un autre type de cellules souches de la moelle osseuse - les cellules souches hématopoïétiques, produisant des molécules matricielles: fibronectine, laminine, collagène, etc.Les CSM sécrètent également des cytokines nécessaires à la différenciation des CSH. En thérapie cellulaire, lesCSM sont utilisées dans trois domaines principaux:
- Support hématopoïétique lors d'une transplantation articulaire avec HSC;
- Substitution et restauration de la fonction des tissus non hématopoïétiques endommagés (os, cartilage, muscle squelettique, muscle cardiaque, tissu nerveux, foie, etc.);
- Suppression des conflits immunitaires lors de transplantations allogéniques non liées et de processus auto-immuns sévères.
En raison de leur grande plasticité, les CSM peuvent se différencier en une large gamme de cellules de différents types: en cellules musculaires striées et lisses, en cardiomyocytes, en cellules de tissu osseux et nerveux, de foie, de reins, de pancréas, de cellules du système immunitaire et bien d'autres. En fait, nous parlons du fait que dans notre moelle osseuse il y a tout un hôpital de réserve pour les cellules souches prêt à aider dans une variété de situations d'urgence. Dans les expérimentations animalesil a été retracé comment les MSC marqués introduits dans le corps ont ensuite été détectés dans les cellules du cerveau, du cœur et d'autres organes. Une caractéristique des MSC est leur incorporation prédominante dans les tissus avec des foyers de dommages, ce qui démontre leur potentiel de régénération. Cela est également vrai pour le traitement des maladies cardiaques, dont les cellules, après dommages, n'ont pas la capacité de se régénérer indépendamment.Si nous prenons comme exemple de maladie cardiaque, il y a plusieurs critères pour lesquels les CSM conviennent au traitement des crises cardiaques :- La capacité des cellules à se différencier en cardiomyocytes, contient des structures contractiles;
- La présence entre les cellules de disques d'insertion avec des jonctions lacunaires pour conduire des potentiels d'excitation aux cellules transplantées des cardiomyocytes hôtes;
- ;
- (, , );
- ( ).
, :- ;
- ;
- .
Ainsi, des études cliniques déjà menées ont montré que l'introduction de CSM chez des patients après infarctus du myocarde améliorait la fonction cardiaque (fonction ventriculaire gauche), améliorait la condition physique et réduisait la mortalité [22-24]. Il est connu que les pathologies cardiaques s'accompagnent de la mort des cardiomyocytes. L'introduction des CSM s'accompagne d'une diminution des processus apoptotiques dans le cœur et d'une réduction des cicatrices. De plus, les études ont montré que les CSM jouent un rôle important dans les processus d'antigénèse (la formation de nouveaux vaisseaux sanguins), qui sont extrêmement importants dans la restauration du tissu cardiaque. De plus, la transplantation MSC a stimulé la prolifération et la différenciation des cellules souches endogènes du cœur, qui sont impliquées dans le remplacement des tissus endommagés par de nouveaux, capables de contraction normale. Au cours des 15 dernières années , un certain nombre d'études précliniques (dans des modèles animaux) et cliniques (chez l'homme) ont été menées qui ont montré l'efficacité des CSM dans les maladies cardiaques.Un autre domaine prometteur pour l'utilisation des CSM est le traitement des pathologies neurodégénératives, dont la plupart des traitements médicaux n'existent pas aujourd'hui. Il a été établi que les CSM peuvent traverser la barrière hémato-encéphalique et migrer vers différentes zones du cerveau.Dans des études expérimentales, la participation des CSM à la régénération des structures endommagées du cerveau est décrite. Sous l'influence de facteurs de microenvironnement, les MSC introduits s'intègrent dans la zone de dommages, forment de nombreux contacts avec les neurones, acquièrent un phénotype neuronal (expression de nestine, énolase spécifique, tyrosine hydroxylase, etc.) et l'activité fonctionnelle des neurones dopaminergiques. Les CSM ont également un effet neuroprotecteur, se différenciant en cellules microgliales, qui fournissent un soutien trophique aux tissus endommagés. Les CSM activent les processus de neurogenèse en stimulant les cellules souches neuronales de la zone sous-ventriculaire du cerveau, qui migrent ensuite, prolifèrent, se différencient et remplacent les neurones dopaminergiques morts.Selon les scientifiques, il existe aujourd'hui 3 principaux résultats d'études de thérapie cellulaire avec neurodégénérescence:- La thérapie par cellules souches est probablement le seul traitement possible qui offre un «traitement» pour les maladies neurodégénératives.
- Les améliorations structurelles et fonctionnelles observées chez les animaux nécessitent des recherches supplémentaires. Les résultats cliniques à long terme et la sécurité de la thérapie par cellules souches pour les maladies neurodégénératives nécessitent des recherches supplémentaires (dont certaines sont en cours actuellement).
- Parmi les 4 types de maladies neurodégénératives les plus courantes, il existe relativement plus de preuves pour la thérapie par cellules souches dans la maladie de Parkinson et la sclérose latérale amyotrophique par rapport à la maladie de Huntington et d'Alzheimer.
Au cours des 10 dernières années, un certain nombre d'études précliniques ont été menées sur des modèles animaux montrant les effets bénéfiques de la thérapie cellulaire sur la neuropathologie. Ainsi, l'effet thérapeutique positif de l'administration intraveineuse de CSM humains isolés du tissu adipeux à des souris transgéniques atteintes de la maladie d'Alzheimer a été démontré.
Pour tester la migration des MSC introduits dans le cerveau, les chercheurs les ont étiquetés avec des nanoparticules magnétiques fluorescentes. Les signaux de fluorescence des organes extraits 3 jours après la transplantation cellulaire ont montré que les cellules s'étaient propagées à tous les organes, y compris le cerveau. Après dissection du cerveau en 5 zones distinctes (bulbe olfactif, hippocampe, cervelet, cerveau, mésencéphale et cortex), des signaux de fluorescence des nanoparticules ont été détectés dans toutes les zones du cerveau à l'exception du bulbe olfactif.
L'effet positif s'est manifesté par l'amélioration des capacités cognitives (apprentissage et mémoire), l'accélération de la neurogenèse endogène et l'augmentation de la stabilité synaptique dans le cerveau des rongeurs. Il y
avait également
une diminution du nombre de plaques amyloïdes dans le cerveau, une diminution des niveaux de bêta-amyloïde et du fragment terminal du précurseur amyloïde, et une diminution des processus apoptotiques dans le cerveau.
Dans
une autre étude, des scientifiques ont administré des CSM à partir de tissu adipeux à des souris présentant une sclérose latérale amyotrophique simulée. Le résultat de la thérapie a été un ralentissement du développement des troubles moteurs, une augmentation du nombre de motoneurones lombaires et des facteurs de croissance des neurones.
Une étude des effets de la thérapie cellulaire sur le traitement de la maladie de Parkinson a été réalisée sur des rongeurs et des singes. Chez les rats atteints de la maladie de Parkinson induite par la roténone, la thérapie par cellules souches a provoqué des effets immunomodulateurs, anti-inflammatoires et neurotrophiques. Dans le sérum sanguin des rongeurs, les niveaux du facteur de croissance transformant β, de la protéine chimioattractrice des monocytes et des niveaux de dopamine dans le cerveau ont augmenté.
La thérapie du CSM à partir du tissu adipeux en combinaison avec un adénovirus contenant du NTN et de la tyrosine hydroxylase (TH) (Ad-NTN-TH), des macaques rhésus avec un modèle de la maladie de Parkinson a entraîné des effets neuroprotecteurs, une diminution des tremblements et une mobilité accrue.
Ces résultats sont particulièrement importants, car le tissu adipeux en quantités importantes (jusqu'à 300 ml ou plus) peut être obtenu sous anesthésie locale avec une liposuccion cosmétique relativement indolore, une lipoaspiration de la graisse sous-cutanée ou par excision de dépôts graisseux. Ce tissu sert de source de CSM pour la transplantation et l'ingénierie tissulaire.
En plus des pathologies cardiovasculaires et neurodégénératives décrites ci-dessus, la thérapie cellulaire a un grand potentiel pour restaurer la fonction immunitaire, qui, comme vous le savez, s'aggrave avec l'âge. À ces fins, un autre type de cellules souches de la moelle osseuse est utilisé - les cellules souches hématopoïétiques (CSH).
Le système immunitaire est étroitement lié aux systèmes nerveux et endocrinien, régulant tous les processus corporels, y compris en contribuant énormément au vieillissement. De plus, la détérioration des fonctions immunitaires avec l'âge rend une personne faiblement protégée contre diverses infections, pire nettoie le corps des vieilles cellules et peut conduire au développement de processus auto-immuns et inflammatoires. Tout cela, naturellement, raccourcit l'espérance de vie et accélère le vieillissement.
Il est logique de supposer que le maintien de l'immunité est normal - l'une des principales stratégies de lutte contre le vieillissement. L'un des mécanismes qui peuvent maintenir le système immunitaire en bon état est la greffe de moelle osseuse. Le concept de cette méthode est basé sur le renforcement du système immunitaire vieillissant par des cellules souches hématopoïétiques (HSC) jeunes, saines, autologues (c'est-à-dire propres), qui ont été collectées auprès de la même personne dans leur jeunesse et cryoconservées pendant une longue période. En atteignant la vieillesse, ces propres cellules souches, introduites dans le corps, peuvent rajeunir le système immunitaire et améliorer les fonctions immunitaires. Ce processus est appelé greffe de cellules souches hématopoïétiques autologues (haHSCT).
La transplantation de CSH elle-même a une histoire d'un demi-siècle et a été utilisée avec succès pour restaurer la fonction immunitaire dans le traitement du cancer et des maladies auto-immunes. Environ 40 000 transplantations de CSH sont effectuées chaque année dans le monde, dont le nombre total a atteint 1 million au cours de la période. Des études
ont montré que les CSH transplantées sont incluses dans les fonctions hématopoïétiques et immunitaires du receveur, qui ont été irradiées ou immunisées chimiquement par chimiothérapie. Les CSH transplantées peuplent la moelle osseuse, établissant ainsi un ensemble complet de cellules nécessaires au statut immunitaire et hématologique normal du patient.
En même temps, lorsqu'une greffe de CSH est effectuée, un donneur étranger doit d'abord tuer sa propre moelle osseuse, ce qui est sans aucun doute une procédure nuisible qui peut être évitée si le donneur de moelle osseuse et le receveur sont la même personne.
Que peut-on attendre d'une greffe de cellules souches hématopoïétiques hétérochrones autologues? Sur la base des
données disponibles, il
est supposé que les jeunes cellules souches autologues qui restent cryoconservées pendant une longue période seront effectivement absorbées dans la moelle osseuse de la même personne, tout en conservant la capacité de proliférer et de se différencier. Ceci est mis en évidence par des études qui ont montré qu'avec l'introduction de jeunes CSH chez des personnes âgées, la majorité des cellules transplantées contribuent régulièrement à l'hématopoïèse à long terme.
Du côté du système immunitaire inné, les CSH transplantées avec leur «progéniture cellulaire» saine agiront favorablement en rejoignant les anciennes cellules du système immunitaire inné. Quant à l'immunité acquise, ici les CSH transplantées et les cellules qu'elles produisent peuvent avoir de nombreux effets positifs, par exemple en contribuant à la création de nouvelles cellules qui synthétisent des anticorps. Les effets positifs peuvent être à la fois quantitatifs et qualitatifs, ce qui peut entraîner une résistance accrue aux infections et à d'autres problèmes pathologiques environnementaux et internes du système immunitaire.
En ce qui concerne le pool total de cellules souches, les HSC transplantés peuvent compléter le nombre et améliorer la qualité des anciens HSC, augmenter leur capacité de régénération et augmenter leur auto-renouvellement. La transplantation de CSH peut prévenir ou réduire l'hématopoïèse clonale liée à l'âge et certaines autres anomalies liées à l'âge associées à la fois à la fonction directe des CSH et au travail d'autres organes, comme le foie et le cœur.
Les études animales ont montré la promesse de cette méthode. Ainsi, en 2013, des travaux ont été menés sur la transplantation de vieilles souris (21,5 mois) de cellules de moelle osseuse de jeunes donneurs (1,5 mois) à hauteur de 150 × 10 ^ 6, soit 25% du nombre total de cellules de moelle osseuse de souris. En conséquence, la durée de survie moyenne, à partir de l'âge de 21,5 mois, au début de l'expérience, était respectivement de +3,6 et + 5,0 (± 0,1) mois pour les groupes témoin et expérimental, ce qui correspondait à une augmentation de la vie de 39 ± 4% groupe expérimental sur le contrôle.
Ces dernières années,
des résultats positifs ont été obtenus en utilisant la transplantation HSC dans le traitement des maladies auto-immunes sévères - la sclérose en plaques. Les patients atteints d'une forme agressive de sclérose en plaques, avec une chimiothérapie, ont subi une transplantation HSC pour restaurer la fonction immunitaire. Selon l'étude rétrospective de cohorte d'observation multicentrique de 2017, à laquelle ont participé 281 patients de 25 cliniques de 13 pays, la transplantation HSC a empêché le développement de la sclérose en plaques et a contribué à la survie des patients, ce qui montre l'efficacité de la transplantation HSC pour restaurer la fonction immunitaire.
Bien qu'il soit évident que pour l'utilisation des CSH dans la lutte contre le vieillissement, des recherches supplémentaires sont nécessaires pour démontrer l'efficacité et certifier la sécurité totale de cette méthode.
De manière générale, toutes les données disponibles aujourd'hui montrent les effets plutôt encourageants de la thérapie de remplacement des cellules souches sur l'atténuation et la prévention des pathologies sévères fortement associées à la mortalité (cardiovasculaire et neurodégénérative), et sur la restauration de la fonction du système immunitaire. De plus, les cellules souches ont montré leurs propriétés efficaces dans la lutte contre la fibrose, ce qui renforce encore notre espoir de thérapie cellulaire dans la lutte contre le vieillissement en général et les pathologies liées à l'âge en particulier. Et la combinaison de la thérapie cellulaire avec des sénolitiques ou des sénomorphes (nous en avons également
parlé brièvement), à notre avis, peut montrer un bon résultat supplémentaire en éliminant les cellules sénescentes des tissus et en régénérant les cellules souches.
Mikhail Batin, Timothy Glinin, Alexey Rzheshevsky.