La question du dispositif de vision est un élément sensible de la neurobiologie. D'énormes volumes de littérature et quatre prix Nobel sont consacrés à cette question, mais dans cette situation, on ne peut que constater que l'appareil de vision des mammifères décrit dans les manuels scolaires ne fait pas face à la tâche. Le but de cet essai est de montrer un ensemble de raisons pour lesquelles vous ne devriez pas fermer les yeux sur cela. En fait, un portrait du secret de la vision sera présenté, allant d'une variété de petits détails au tout début du flux d'informations visuelles chez les mammifères, la menace de les ignorer, et se terminant par une pile de problèmes dans la compréhension du traitement du cerveau à la fin du chemin.
Dispositif de système de vision
Aux yeux de tout manuel sur la vision, nous voyons en trois étapes. Première étape: la lumière pénètre dans la rétine et se transforme en excitation nerveuse des photorécepteurs - neurones sensoriels de la rétine. De plus, l'oeil normalise le contraste et la luminosité, concentre l'image.
Deuxième étape: le processus dans la rétine, lorsque la carte des excitations nerveuses des photorécepteurs est transformée en un flux d'informations parallèle, dont chaque élément code son propre aspect d'information visuelle. Les cellules ganglionnaires, dont les axones forment le nerf optique, dans la rétine sont beaucoup plus petites que les photorécepteurs, la première compression d'informations se produit. Une cellule ganglionnaire peut être responsable du codage d'un signal de plusieurs au centre vers des centaines et des milliers de photorécepteurs à la périphérie de la rétine. (Figure 1) Les cellules ganglionnaires sont divisées en deux types principaux, selon la voie à partir du nerf optique, le signal pénètre dans le cortex des hémisphères cérébraux. Un type prédominant quantitativement (80% chez les personnes) donne une acuité visuelle et une perception des couleurs élevées, un contraste d'image stable est important pour eux. Pour des raisons historiques, elles sont appelées cellules PC ou cellules naines, car leur signal passe à travers les couches parvocellulaires (petites cellules) des corps latéraux coudés. Le deuxième type de cellules MC, leur signal passe par les couches magnocellulaires (grandes cellules) des corps latéraux coudés. Ils sont responsables de la perception du mouvement, car ils ont une sensibilité accrue aux images qui clignotent ou bougent.


 Figure 1. Mesurer les propriétés des champs récepteurs. (A) La réponse d'un neurone (une séquence de potentiels d'action ou «adhérences») est contrôlée par l'enregistrement extracellulaire d'un animal anesthésié par l'électrode dans le corps intermédiaire du vilebrequin (LGN). Des stimuli sont fournis à la partie neuronale du champ de vision. (B) Tableau des réponses conditionnelles de différents types de neurones. Chaque colonne montre la réponse d'un type de neurone. Chaque ligne montre les réponses à un type de stimulus. Par exemple, un neurone qui est sélectif dans la direction du mouvement (deuxième colonne) ne réagit que lorsque le stimulus se déplace de gauche à droite dans le champ récepteur. Les neurones qui ont des champs récepteurs standard «centre / environnement» sont tolérants à la taille et à la motilité du stimulus. Les types de neurones non standard présentent des besoins de stimulus beaucoup plus intransigeants.
Figure 1. Mesurer les propriétés des champs récepteurs. (A) La réponse d'un neurone (une séquence de potentiels d'action ou «adhérences») est contrôlée par l'enregistrement extracellulaire d'un animal anesthésié par l'électrode dans le corps intermédiaire du vilebrequin (LGN). Des stimuli sont fournis à la partie neuronale du champ de vision. (B) Tableau des réponses conditionnelles de différents types de neurones. Chaque colonne montre la réponse d'un type de neurone. Chaque ligne montre les réponses à un type de stimulus. Par exemple, un neurone qui est sélectif dans la direction du mouvement (deuxième colonne) ne réagit que lorsque le stimulus se déplace de gauche à droite dans le champ récepteur. Les neurones qui ont des champs récepteurs standard «centre / environnement» sont tolérants à la taille et à la motilité du stimulus. Les types de neurones non standard présentent des besoins de stimulus beaucoup plus intransigeants.Les deux types de ces cellules ont une organisation de type centre / environnement: une stratégie de codage prétendument universelle pour l'information visuelle. (Figure 2) Le meilleur stimulus pour obtenir la réponse la plus énergétique des cellules ganglionnaires est une tache plus ou moins arrondie et petite sur la rétine, et plus elle se détache intensément sur le fond environnant (tache lumineuse ou sombre), plus la réponse cellulaire est énergique.
Troisième étape: le signal est traité dans le cerveau. D'un point de vue généralement accepté, les principaux processus de traitement du cerveau commencent dans le cortex visuel primaire. Un autre recodage important a lieu, les neurones répondent non seulement aux taches sombres et claires à la surface de la rétine, mais deviennent également sélectivement sensibles aux frontières contrastées orientées, aux sections de lignes orientées et à leurs extrémités. Il existe des configurations de stimuli plus complexes, lorsque les neurones répondent précisément à la frontière de contraste quelle que soit leur position, ne serait-ce que dans la zone de responsabilité de la cellule. Ce traitement «complexe» dans le cortex visuel est utilisé comme deuxième niveau d'abstraction dans la perception d'une image statique, où la reconnaissance a atteint un nouveau niveau plus général de perception des frontières quelle que soit leur position. En conséquence: premièrement, la rétine transmet des signaux simples au cortex cérébral; deuxièmement, les neurones du cortex visuel primaire utilisent ces signaux simples pour détecter les bordures et les lignes contrastées; et troisièmement, ces blocs de construction fondamentaux sont utilisés pour définir les limites d'objets entiers et créer une perception visuelle.
Personne n'a probablement supposé que ce point de vue se transformerait en dogme fondamental du granit. La détection des contours est considérée comme la seule façon pour les mammifères de voir comment l'évolution a trouvé la solution parfaite au problème de la perception efficace de l'image. Dans cet essai, ce point de vue sera remis en question et des questions inconfortables seront posées sur la nature de la vision. Ils ont déjà été évoqués plus d'une fois dans l'histoire de l'étude de la vision et ne proposent pas de réponses simples. Alors maintenant, la tâche principale est de se concentrer sur ces questions, en rassemblant les raisons du doute dans la compréhension moderne du dispositif de vision.
La rétine de tous les mammifères envoie des signaux non standard au cerveau
Une étude approfondie de la voie du flux visuel des yeux au cortex cérébral chez les primates confirme péremptoirement que, comme chez d'autres espèces de mammifères, de nombreux canaux parallèles contribuent de manière fonctionnelle au flux visuel des primates [1–4]. (Figure 2) Certains de ces canaux ignorent même le cortex visuel primaire et se rendent immédiatement dans les services de la hiérarchie supérieure [5]. Une grande partie de cela a été mentionnée dans les études classiques de l'anatomie des chats et des singes [6–10], mais a été ignorée par les pionniers de la neurobiologie dans l'étude du cortex visuel. L'utilisation agressive du principe du rasoir Occam a permis de donner un sens aux propriétés des neurones corticaux, car ils construisent leur fonction de reconnaissance des lignes ou des frontières uniquement à partir des apports des cellules ganglionnaires avec l'organisation «centre / environnement» [11]. Les cellules ganglionnaires avec une organisation non standard ont été jetées, ayant un nombre relativement faible de primates dans la rétine. Ce que leur rôle dans la perception visuelle sera décrit ci-dessous, et du point de vue des praticiens de la neurobiologie, il convient de noter qu'avec l'introduction arbitraire d'une électrode dans le nerf optique, la probabilité de rencontrer un axone d'une cellule ganglionnaire non standard est assez faible. Étant donné que les cellules non standard sont rares, la plupart des expérimentateurs ont choisi de suivre le chemin de la moindre résistance, créant des méthodes pour projeter des stimuli visuels sur la rétine qui sont les mieux adaptées pour étudier les cellules du centre / environnement, qui ont transformé les cellules non standard en une `` explosion '' statistique dans les données expérimentales.
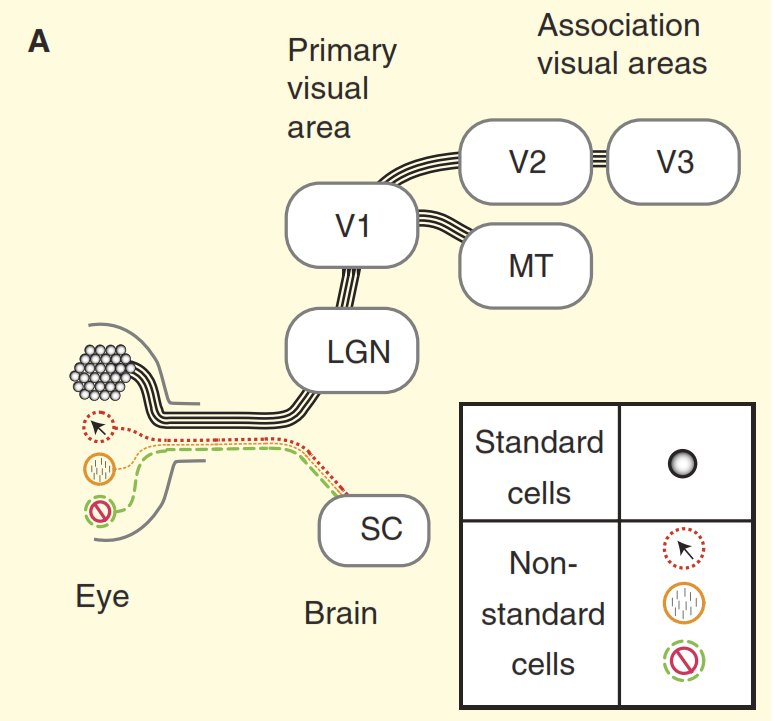
 Figure 2. Perceptions du système visuel.
Figure 2. Perceptions du système visuel.
(A) Le point de vue des manuels sur la conception du système visuel des primates par l'exemple du macaque. La rétine est remplie d'un grand nombre de cellules ganglionnaires standard, dont les axones forment le nerf optique. La rétine contient également un petit nombre de cellules ganglionnaires non standard qui répondent à la lumière par d'autres moyens, mais on suppose traditionnellement qu'elles ne sont projetées que dans les centres autonomes du mésencéphale, à savoir le dicollis supérieur (SC). Les cellules concentriques font saillie dans le noyau relais du thalamus, le corps à manivelle intermédiaire (LGN), qui à son tour transmet des signaux au cortex visuel primaire (V1). Et les cellules standard à travers le corps à manivelle intermédiaire (LGN) transmettent un signal au cortex visuel primaire (V1) puis aux sections supérieures du cortex visuel (V2, V3, MT).
(B) Une vue plus réaliste du système visuel des primates. Certaines des cellules ganglionnaires non standard empoisonnent le signal directement au corps coudé intermédiaire (LGN), puis au cortex visuel primaire. De plus, la diode supérieure n'est pas une direction en cul-de-sac, à partir de là le signal va au corps de manivelle intermédiaire (LGN) et au-delà. Mais ce n'est pas tout, à commencer par le corps à manivelle intermédiaire (LGN), le flux visuel cesse d'être unidirectionnel et sa composante inverse est plus puissante que la directe.Le deuxième problème est illustré à la figure 3. Le graphique supérieur de la figure montre la réponse de la cellule «centre / environnement». Le schéma de réaction de base est très familier aux neurobiologistes de la vision: les cellules ganglionnaires standard centre / environnement montrent une courbe de la ligne de réponse à la fréquence spatiale - la réponse maximale se produit lorsque la bande du réseau coïncide exactement en largeur avec la section centrale du champ récepteur du centre / cellule l'environnement. " Mais considérons maintenant la réponse de l'une des cellules non standard du nerf optique obtenue dans la même expérience (figure 3b). Cette fois, la cellule appartient au type dit de cellules ganglionnaires coniocellulaires, un ensemble composite de types de cellules non standard, qui est généralement généralisé, voire pas du tout, appelé la «voie bleue». Cette cellule a une organisation de type "suppression par contraste" [6,7,12,13], dans cette expérience sa réponse est presque complètement opposée à la réponse d'une cellule standard "centre / environnement". Lorsque l'on tient compte de la différence d'acuité visuelle des singes et des chats, les cellules ganglionnaires de «suppression par contraste» se comportent de manière identique [12,13].
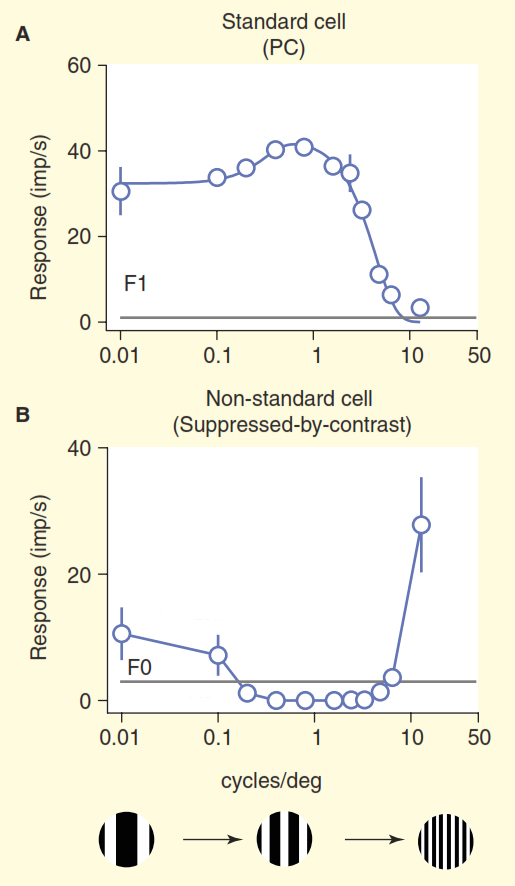 Figure 3. Comparaison des champs récepteurs standard et non standard. Les cellules ont été stimulées par un réseau dérivant avec une fréquence spatiale variable (la fréquence est ici exprimée comme la largeur totale de deux bandes de noir et blanc dans le réseau par degré d'angle de vision). La cellule ganglionnaire «centre / environnement» standard (A) se comporte comme prévu: lorsque la largeur de la bande du réseau est proche de la largeur du centre du champ récepteur, la cellule donne une forte réponse. Une cellule non standard avec «suppression de contraste» (B) est silencieuse au lieu d'être excitée, tant qu'elle est capable de distinguer les rayures noires et blanches.
Figure 3. Comparaison des champs récepteurs standard et non standard. Les cellules ont été stimulées par un réseau dérivant avec une fréquence spatiale variable (la fréquence est ici exprimée comme la largeur totale de deux bandes de noir et blanc dans le réseau par degré d'angle de vision). La cellule ganglionnaire «centre / environnement» standard (A) se comporte comme prévu: lorsque la largeur de la bande du réseau est proche de la largeur du centre du champ récepteur, la cellule donne une forte réponse. Une cellule non standard avec «suppression de contraste» (B) est silencieuse au lieu d'être excitée, tant qu'elle est capable de distinguer les rayures noires et blanches.Nous pouvons seulement supposer que ces cellules reconnaissent un remplissage monotone dans leur zone de responsabilité, par exemple un ciel bleu clair, car lorsque la largeur des barres blanches et noires du réseau diminue en dessous de la résolution de l'œil humain, elles fusionnent en gris uni. Une véritable compréhension du codage des informations visuelles pour ces cellules n'est pas présentée dans le modèle de vision standard.
Tous les non-primates voient bien en utilisant des cellules non standard
Les défenseurs du modèle de vision accepté lorsqu'ils envisagent des primates peuvent se référer à un nombre relativement petit de cellules non standard, mais cela ne s'applique pas à la rétine des lapins, des chats, des rats et des souris [7,8,14–16]. De plus, en nombre absolu (environ 100 000), le nombre de cellules non standard dans la rétine des primates est proche du nombre total de cellules dans la rétine d'un rat ou d'un chat [17]. L'acuité visuelle chez les chats, les lapins, les rats et les souris est plus faible que chez les primates, mais ce n'est pas tout. La vision de toutes ces créatures vous permet de réussir à survivre dans la nature. Quiconque en doute est invité à essayer de se faufiler sur un lapin sur le terrain ou d'attraper une souris sans utiliser de souricière (une tâche simple pour un chat ordinaire).
 Figure 4. Perception visuelle avec peu de détails.
Figure 4. Perception visuelle avec peu de détails.
Les observateurs familiers avec les personnes sur l'image les reconnaissent malgré le faible niveau de détail. Lorsque vous brouillez une image, il reste suffisamment d'informations visuelles utiles pour une personne. De gauche à droite: le prince Charles, Woody Allen, Bill Clinton, Saddam Hussein, Richard Nixon, la princesse Diana.Il est clair, ne serait-ce que pour des raisons médicales, pourquoi les neuroscientifiques se sont concentrés sur la rétine des primates. Mais une telle concentration sélective en essayant de comprendre la vision conduit au fait que les expérimentateurs apportent et transfèrent les résultats de la perception de soi à l'interprétation des résultats de la recherche. L'emballage dense des cellules ganglionnaires des primates est bien adapté pour détecter les fruits comestibles sur un arbre, ou pour lire le dernier numéro du New York Times, mais il n'y a aucune raison particulière d'envisager des tâches telles que le summum bonum (lat.: Le bien le plus élevé) de la vision. Dans l'image évolutive générale, cette acuité visuelle extrêmement élevée peut être considérée comme une adaptation de niche spécifique pour la détection d'objets à contraste élevé à grande distance. La plupart des mammifères de la rétine n'ont pas de fovéa (la fosse centrale de la rétine) - une zone spécialisée avec une acuité visuelle élevée trouvée chez les primates - mais la vision sans un million de cellules ganglionnaires densément emballées reste pleinement fonctionnelle. La preuve est illustrée sur la figure 4, les gens sont facilement capables de reconnaissance sans l'acuité visuelle habituelle [18]. Chez les mammifères non primates, le codage des stimuli visuels a été particulièrement bien étudié chez le lapin [19-23]. Les lapins ont de grands yeux, et le système optique est meilleur que de nombreux types de primates, et ils ont également des cellules ganglionnaires centre / environnement standard dans leur rétine. Cependant, ces cellules standard ne représentent qu'un quart de la population totale des cellules ganglionnaires rétiniennes, représentées par une douzaine de types fonctionnels et anatomiques [14,21]. Il est clair que chacun de ces douze types de cellules est emprisonné par l'évolution sous ses propres stimuli visuels. Mais l’importance de ce fait réside dans le fait que les canaux des cellules ganglionnaires non standard prédominent dans le flux visuel qui coule dans le cerveau du lapin. Cette information n'est pas nouvelle: l'innovation est la preuve que la rétine de tous les mammifères transmet une variété de canaux visuels de codage au cerveau [4, 13, 24, 25] et qu'une telle diversité doit être incluse dans toute vue réaliste du dispositif visuel.
Un exemple bien connu est celui des cellules qui répondent sélectivement à la direction du mouvement du stimulus. Un type d'entre eux envoie directement un signal aux noyaux du tronc cérébral associé au mouvement oculaire [26]. Mais un autre type de ces cellules n'est pas si bien connu, dont le signal va non seulement au mésencéphale, mais aussi à travers les corps latéraux coudés jusqu'au cortex visuel primaire [19]. De telles cellules ne sont pas si rares, mais elles ne sont pas mentionnées dans les manuels scolaires lors de la description de l'appareil de vision. Le signal des cellules ganglionnaires non standard atteint sans ambiguïté le cortex visuel, mais comment l'utilise-t-il?
Le deuxième type de cellule non standard (identifié chez les lapins, les chats et les souris) est le soi-disant détecteur de bord local. Comme les cellules sensibles sélectivement à la direction du mouvement, elles étaient également considérées comme des cellules ganglionnaires rares, mais nous savons maintenant que cela était dû à une erreur lors de l'utilisation des électrodes: elles représentent probablement environ 15% de toutes les cellules ganglionnaires [23]. Les signaux de ces cellules atteignent également le cortex visuel primaire, mais leurs réponses se situent bien au-delà des réponses visuelles standard [8,22,23]. Ces cellules répondent mieux aux petites cibles lentes, comme un prédateur ou un animal prédateur, se déplaçant à une distance lointaine. Cependant, s'il existe de nombreux petits objets, comme sur un champ texturé, les cellules cessent de répondre. En d'autres termes, les cellules réagissent à un petit objet en mouvement, mais uniquement lorsqu'il est seul.
Le détecteur de bord local est apparemment le type le plus nombreux de cellules ganglionnaires rétiniennes chez un lapin, mais il n'était pas inclus dans le modèle de vision standard. Ces cellules peuvent-elles former un système d'analyse de mouvement à des distances éloignées? Comment le cortex visuel traite-t-il les signaux de ces cellules? Comment les autres espèces de mammifères perçoivent le monde avec des cellules ganglionnaires standard et des détecteurs de bord locaux - ou même des cellules avec une autre compression d'informations visuelles qui reste à découvrir?
Le cortex visuel est plus intelligent que les manuels scolaires ne le reconnaissent
Même si nous supposons que l'ensemble du flux visuel n'est codé que par des cellules rétiniennes standard, à ce stade, il est connu que le traitement dans le cortex visuel primaire ne se produit pas exclusivement selon la méthode initialement proposée utilisant des neurones «simples», «complexes», «hyper-complexes», mais également des neurones "avec inhibition terminale". La discussion de ce fait a reçu beaucoup d'espace dans la littérature spécialisée [27-30].
Les problèmes commencent par un autre fait évident que presque tous les neurones du cortex cérébral sont non linéaires, ce qui met en doute l'utilité des schémas hiérarchiques avec des hypothèses linéaires dans l'interprétation de leur fonction [31,32].
Deuxièmement, l'idée des trois principaux types de cellules - «simples», «complexes» et «hyper-complexes» - est une abstraction grossière de la riche variété de types cellulaires du cortex visuel primaire identifiés par des méthodes anatomiques [33,34]. Troisièmement, les neurones du cortex visuel dépendent non seulement du flux visuel entrant, mais aussi de divers signaux contextuels de leurs voisins, de sorte que la réaction aux mêmes stimuli qui font partie de l'image quotidienne et créés artificiellement par les expérimentateurs peut varier [27,35].
Les réponses des neurones du cortex visuel ne sont même pas figées dans le temps: la suppression d'une petite partie de la rétine, qui conduit à l'apparition d'un angle mort, permet aux neurones laissés sans travail de changer de zone de responsabilité et de traiter les informations visuelles des sections de travail de la rétine les plus proches de l'angle mort [36].Du point de vue de l'anatomie, rien de ce qui précède n'est surprenant. Jusqu'à 10% seulement de l'apport d'un neurone individuel provient des canaux du flux visuel [37], le reste provient de neurones voisins ou de neurones situés dans des parties supérieures distantes du cortex cérébral, où les neurones visuels sont encore mal compris et l'interprétation de leurs fonctions est une tâche difficile.Ainsi, il devient évident qu'une vue standard du dispositif de vision est coincée dans un marécage de dogmes. Quelles mesures devraient être prises pour en sortir?Étape 1: revoir les bases
La dernière bonne nouvelle est que les techniques d'imagerie des cellules rétiniennes ont subi une révolution discrète au cours des 5 dernières années, il est donc désormais facile de les visualiser en grand nombre et avec une qualité de résolution sans précédent sous la forme d'une image en trois dimensions. Le problème de la recherche de synapses et de la position relative des cellules est facilement résolu, maintenant elles peuvent être classées non seulement «à l'œil», mais aussi en utilisant des méthodes de classification objectives [15,16]. Le degré de correspondance du typage morphologique au typage physiologique des cellules rétiniennes montre une relation directe (discuté dans [24]). Ainsi, les types structuraux de cellules ganglionnaires rétiniennes déterminent avec précision le nombre de canaux fonctionnels dans le flux visuel.Dans tous les systèmes visuels de mammifères étudiés à ce jour, les données anatomiques indiquent que le nombre de canaux fonctionnels est d'environ douze. Dans la rétine de singe et de chat, les fonctions d'environ la moitié de ces canaux sont bien comprises. Chez un lapin, cette proportion est d'environ un tiers; la rétine de la souris et du rat, malgré leur net avantage pour la recherche génétique, reste largement inexplorée.Ainsi, il peut être utile de revenir, armé de méthodes modernes, sur le chantier inachevé des années 1970 [38]. La tâche consiste à terminer la détermination des fonctions des cellules ganglionnaires, la première étape de la compression des informations visuelles - se débarrasser des taches aveugles au tout début - et à mettre à jour vos objectifs dans le reste du système visuel.Incitatifs fixes
Pourquoi, après plus d'un demi-siècle de recherche, la connaissance de la physiologie de la vision est-elle si loin derrière la connaissance de l'anatomie et que peut-on faire pour améliorer la situation? Mis à part le problème de la sélectivité de la recherche à l'aide d'une électrode, le problème principal reste le choix des méthodes pour trouver le bon stimulus.Comprendre pourquoi les cellules ganglionnaires de la rétine et les neurones du cortex visuel primaire sont utilisés dans le système de vision - quelle est leur adaptation aux caractéristiques de l'environnement visible - est beaucoup plus difficile que ne l'ont suggéré les pionniers des neurosciences. La technique de recherche classique était que les expérimentateurs écoutaient le signal amplifié de l'électrode immergée au hasard dans le nerf optique ou dans le cortex cérébral tout en déplaçant manuellement le stimulus projeté sur la rétine à la recherche de la zone de responsabilité de la cellule à laquelle l'électrode a touché. Méthode rapide et efficace, mais souffrant de subjectivité et de manque de reproductibilité. Les stimuli simples du réseau et l'analyse systémique linéaire sont extrêmement efficaces pour les cellules standard [38,39], mais, comme mentionné précédemment,cette méthode est mal adaptée à l'étude des cellules non standard et des neurones non linéaires du cortex visuel primaire. De nouvelles tentatives pour déterminer des ensembles de stimuli corrects sont intéressantes [40], mais il n'y a pas de consensus jusqu'à présent.L'alternative est basée sur la stratégie de corrélation inverse [41–43], où un stimulus sélectionné au hasard par l'expérimentateur est présenté plusieurs fois, et la réponse cellulaire est utilisée pour calculer la moyenne inverse. Ainsi, l'expérimentateur peut construire une représentation du stimulus moyen conduisant à la réponse cellulaire la plus active. Le grand avantage de cette méthode est qu'elle n'implique aucun réglage spécifique de la cellule sur le stimulus de test. Pour des raisons à la fois théoriques et analytiques, le stimulus du test est généralement choisi comme «aléatoire»: un échiquier vacillant ou une autre forme de bruit visuel. Cette stratégie est conceptuellement élégante, mais se limite largement à l'analyse cellulaire avec une organisation standard de centre / environnement,car les cellules non standard (par définition) sont réglées sur des caractéristiques très aléatoires de l'information visuelle.Une autre alternative utilise une approche plus radicale. La stratégie consiste à rechercher la corrélation inverse de la réponse de la cellule à l'image capturée sur vidéo dans un environnement quotidien et présentée sur l'écran du moniteur [27,44]. L'idée est que le chercheur attend un signal de la cellule lorsqu'un stimulus important lui apparaît. L'efficacité d'une telle méthode a été prouvée expérimentalement, mais la question reste de savoir comment une image bidimensionnelle naturelle doit être considérée, comment cette méthode prendra en compte les effets de la non-linéarité et du contexte, et plus encore comment interpréter les résultats.Nouvelle théorie générale de la vision?
Une comparaison inverse du monde autour des signaux dans le cerveau peut être considérée comme un empirisme poussé à l'extrême. Mais que peuvent offrir les théoriciens des neurosciences contrairement à leurs collègues expérimentateurs? Ils ont l'opportunité de dépasser avec succès le style actuel, d'un point de vue formel, qui n'est qu'une reformulation des résultats expérimentaux. Malgré un quart de siècle d'efforts, la plupart des travaux réalisés n'ont pu passer l'épreuve du temps et n'ont pu être confirmés par de nouveaux faits expérimentaux. Bien que des formulations précises et compactes de résultats expérimentaux soient importantes, elles conduisent rarement à la synthèse de nouvelles connaissances, et le désir de la commodité de l'évaluation mathématique des données peut imposer des restrictions invisibles aux expériences. Un exemple spécifique a été donné précédemment:si la méthode expérimentale se limite à présenter des réseaux de largeur variable sous forme de stimulus, une cellule ganglionnaire avec l'organisation du type de «suppression par contraste» n'apparaît que comme une «explosion» dans les données expérimentales, dont le chercheur ne peut rien dire d'autre.Comment les théoriciens peuvent-ils alors aider? Ils devraient traiter les aspects inconfortables du système nerveux réel. Par exemple, les physiologistes expérimentaux ne savent que trop bien que les systèmes sensoriels ne sont linéaires que lorsque l'expérimentateur les oblige à l'être [27,38,45]. Une large couverture de la théorie de la vision est nécessaire pour faire face à des tâches telles que la compréhension des mérites du codage redondant et clairsemé dans les systèmes visuels, la nécessité de tendre les ponts entre les études de la vision chez les invertébrés et les vertébrés [46,47]. La question est de savoir si la refonte de la première étape de la compression des informations visuelles dans la rétine donnera un résultat [46,48-50]. La variété des canaux fonctionnels du flux visuel, qui avec toute sa diversité nous sert sous la forme d'un tel sentiment familier - la vision, a été précédemment soulignée.Par conséquent, la tâche principale restera de découvrir comment nous «voyons» simplement et comment, en général, pouvons-nous comprendre cela?Les références1. Casagrande VA (1994). A third parallel visual pathway to primate area V1. Trends Neurosci. 17, 305–310.
2. Hendry SHC, and Reid RC (2000). The koniocellular pathway in primate vision. Ann. Rev. Neurosci. 23, 127–153.
3. White AJR, Solomon SG, and Martin PR (2001). Spatial properties of koniocellular cells in the lateral geniculate nucleus of the marmoset Callithrix jacchus. J. Physiol. 533, 519–535.
4. Dacey DM, Peterson BB, Robinson FR, and Gamlin PD (2003). Fireworks in the primate retina: in vitro photodynamics reveals diverse LGN-projecting ganglion cell types. Neuron 37, 15–27.
5. Sincich LC, Park KF, Wohlgemuth MJ, and Horton JC (2004). Bypassing V1: a direct geniculate input to area MT. Nat. Neurosci. 7, 1123–1128.
6. Rodieck RW (1967). Receptive fields in the cat retina: a new type. Science 157, 90–92.
7. Stone J. and Hoffmann K.-P. (1972). Very slow-conducting ganglion cells in the cat's retina: a major, new functional type? Brain Res. 43, 610–616.
8. Cleland BG, Levick WR, Morstyn R., and Wagner HG (1976). Lateral geniculate relay of slowly-conducting retinal afferents to cat visual cortex. J. Physiol. 255, 299–320.
9. DeMonasterio FM (1978). Properties of ganglion cells with atypical receptive-field organization in retina of macaques. J. Neurophysiol. 41, 1435–1449.
10. Yukie M., and Iwai E. (1981). Direct projection from the dorsal lateral geniculate nucleus to the prestriate cortex in macaque monkeys. J. Comp. Neurol. 201, 81–97.
11. Hubel DH, and Wiesel TN (1977). Ferrier lecture. Functional architecture of macaque monkey visual cortex. Proc. R. Soc. Lond. Ser. B Biol. Sci. 198, 1–59.
12. Troy JB, Einstein G., Schuurmans RP, Robson JG, and Enroth-Cugell CH (1989). Responses to sinusoidal gratings of two types of very nonlinear retinal ganglion cells of cat. Visual Neurosci. 3, 213–223.
13. Tailby C., Solomon SG, Dhruv NT, Majaj NJ, Sokol SH, and Lennie P. (2007). A new code for contrast in the primate visual pathway. J. Neurosci. 27, 3904–3909.
14. Rockhill RL, Daly FJ, MacNeil MA, Brown SP, and Masland RH (2002). The Diversity of ganglion cells in a mammalian retina. J. Neurosci. 22, 3831–3843.
15. Badea TC, and Nathans J. (2004). Quantitative analysis of neuronal morphologies in the mouse retina visualized by using a genetically directed reporter. J. Comp. Neurol. 480, 331–351.
16. Kong JH, Fish DR, Rockhill RL, and Masland RH (2005). Diversity of ganglion cells in the mouse retina: Unsupervised morphological classification and its limits. J. Comp. Neurol. 489, 293–310.
17. Wassle H. (2004). Parallel processing in the mammalian retina. Nat. Rev. Neurosci. 5, 747–757.
18. Sinha P. (2002). Recognizing complex patterns. Nat. Neurosci. 5 Suppl, 1093–1097.
19. Levick WR, Oyster CW, and Takahashi E. (1969). Rabbit lateral geniculate nucleus: sharpener of directional information. Science 165, 712–714.
20. DeVries SH, and Baylor DA (1997). Mosaic arrangement of ganglion cell receptive fields in rabbit retina. J. Neurophysiol. 78, 2048–2060.
21. Roska B., and Werblin F. (2001). Vertical interactions across ten parallel, stacked representations in the mammalian retina. Nature 410, 583–587.
22. Zeck GM, Xiao Q., and Masland RH (2005). The spatial filtering properties of local edge detectors and brisk-sustained retinal ganglion cells. Eur. J. Neurosci. 22, 2016–2026.
23. van Wyk M., Taylor WR, and Vaney DI (2006). Local edge detectors: a substrate for fine spatial vision at low temporal frequencies in rabbit retina. J. Neurosci. 26, 13250–13263.
24. Masland RH (2001). Neuronal diversity in the retina. Curr. Opin. Neurobiol. 11, 431–436.
25. Dacey DM, Liao HW, Peterson BB, Robinson FR, Smith VC, Pokorny J., Yau KW, and Gamlin PD (2005). Melanopsinexpressing ganglion cells in primate retina signal colour and irradiance and project to the LGN. Nature 433, 749–754.
26. Simpson JI (1984). The accessory optic system. Ann. Rev. Neurosci. 7, 13–41.
27. Carandini M., Demb JB, Mante V., Tolhurst DJ, Dan Y., Olshausen BA, Gallant JL, and Rust NC (2005). Do we know what the early visual system does? J. Neurosci. 25, 10577–10597.
28. Olshausen BA, and Field DJ (2004). Sparse coding of sensory inputs. Curr. Opin Neurobiol. 14, 481–487.
29. Simoncelli EP, and Olshausen BA (2001). Natural image statistics and neural representation. Ann. Rev. Neurosci. 24, 1193–1216.
30. Olshausen BA, and Field DJ (2005). How close are we to understanding v1? Neural. Comput. 17, 1665–1699.
31. Ferster D., and Miller KD (2000). Neural mechanisms of orientation selectivity in the visual cortex. Ann. Rev. Neurosci. 23, 441–471.
32. Anderson JS, Lampl I., Gillespie DC, and Ferster D. (2001). Membrane potential and conductance changes underlying length tuning of cells in cat primary visual cortex. J. Neurosci. 21, 2104–2112.
33. Lund JS, and Yoshioka T. (1991). Local circuit neurons of macaque monkey striate cortex: III. Neurons of laminae 4B, 4A, and 3B. J. Comp. Neurol. 311, 234–258.
34. Cauli B., Audinat E., Lambolez B., Angulo MC, Ropert N., Tsuzuki K., Hestrin S., and Rossier J. (1997). Molecular and physiological diversity of cortical nonpyramidal cells. J. Neurosci. 17, 3894–3906.
35. Zipser K., Lamme VA, and Schiller PH (1996). Contextual modulation in primary visual cortex. J. Neurosci. 16, 7376-7389.
36. Gilbert CD, Sigman M., and Crist RE (2001). The neural basis of perceptual learning. Neuron 31, 681–697.
37. Douglas RJ, and Martin KA (2004). Neuronal circuits of the neocortex. Ann. Rev. Neurosci. 27, 419–451.
38. Troy JB, and Shou T. (2002). The receptive fields of cat retinal ganglion cells in physiological and pathological states: where we are after half a century of research. Prog. Ret. Eye Res. 21, 263–302.
39. Lennie P., and Movshon JA (2005). Coding of color and form in the geniculostriate visual pathway. J. Opt. Soc. Am. 22, 2013–2033.
40. Victor JD (2005). Analyzing receptive fields, classification images and functional images: challenges with opportunities for synergy. Nat. Neurosci. 8, 1651–1656.
41. Srinivasan MV, Jin ZF, Stange G., and Ibbotson MR (1993). 'Vector white noise': a technique for mapping the motion receptive fields of direction-selective visual neurons. Biol. Cybern. 68, 199–207.
42. Meister M., and Berry MJ (1999). The neural code of the retina. Neuron 22, 435–450.
43. Kara P., Reinagel P., and Reid RC (2000). Low response variability in simultaneously recorded retinal, thalamic, and cortical neurons. Neuron 27, 635–646.
44. Ringach DL, Hawken MJ, and Shapley R. (2002). Receptive field structure of neurons in monkey primary visual cortex revealed by stimulation with natural image sequences. J. Vision 2, 12–24.
45. Schwartz O., and Simoncelli EP (2001). Natural signal statistics and sensory gain control. Nat. Neurosci. 4, 819–825.
46. Horridge A. (2000). Seven experiments on pattern vision of the honeybee, with a model. Vision Res. 40, 2589-2603.
47. Srinivasan MV (2006). Honeybee vision: in good shape for shape recognition. Curr. Biol. 16, R58–60.
48. Marr D. (1982). Vision: A Computational Investigation in the Human Representation and Processing of Visual Information (New York: WH Freeman).
49. Barlow HB (1997). The knowledge used in vision and where it comes from. Phil.Trans. Roy. Soc. Lond. B 352, 1141–1147.
50. Riesenhuber M., and Poggio T. (2000). Models of object recognition. Nat. Neurosci. 3, 1199–1204.