Monin Ilya Alekseevich, ctn
imoninpgd@gmail.com
Modèle Atom avec un grand noyau comparable à la taille de l'Atome dans son ensemble.
À l'heure actuelle, en physique, le modèle d'atome de Rutherford-Bohr est considéré comme universellement reconnu, dans lequel un petit noyau lourd et chargé positivement est entouré de coquilles d'électrons presque sans poids, tandis que la taille des coquilles d'électrons est 1000 fois plus grande que la taille du noyau.
Le modèle de l'atome de Rutherford-Bohr présente de nombreux défauts inhérents qui ont été étouffés pendant 100 ans depuis sa création.
La seule chose qui explique le modèle d'atome de Rutherford-Bohr est l'expérience de la diffusion du flux de particules alpha sur une mince feuille d'or. D'où une conclusion a été tirée sur la taille extrêmement petite du noyau positif dans la composition d'un énorme atome rempli du vide des coquilles d'électrons.
Et comment le modèle de Rutherford explique-t-il l'existence de solides à densité fixe?
Et cela n'explique en rien les propriétés de substances réelles que nous connaissons de la vie quotidienne.
C'est pour cette raison que j'ai dû composer mon propre modèle de la structure de l'atome.
Aucun des modèles existants ne peut tout expliquer à la fois.
Dans mon modèle, je n'explique pas la diffusion des particules alpha dans l'expérience Rutherford.
Eh bien, le modèle de Rutherford n'explique qu'une seule expérience de diffusion de particules alpha sur une feuille d'or, mais ne peut rien expliquer d'autre.
Mais mon modèle explique l'existence de solides, liquides, gaz et toutes les transitions de phase entre eux.
Dans le modèle de Rutherford-Bohr, il est complètement incompréhensible de savoir quelles forces existent les substances solides, dont tous les objets qui nous entourent sont composés, et la transition d'un solide à un état liquide et d'un liquide à un état gazeux de la matière est également incompréhensible.
Il est temps d'essayer de repenser le modèle de structure Atom et de créer un nouveau concept qui pourra expliquer à la fois la résistance des solides et l'élasticité des gaz raréfiés.
Un nouveau modèle Atom est proposé pour examen, dont les principales caractéristiques sont les thèses suivantes:
- Le noyau de l'atome coïncide pratiquement en taille avec la limite extérieure de l'atome;
- Le noyau atomique n'est pas un groupe chaotique de nucléons (neutrons et protons), mais a une structure-architecture très claire, qui est responsable de toutes les propriétés physiques et chimiques d'une substance simple particulière du tableau périodique;
- Les atomes dans les solides entrent en contact directement avec leurs noyaux solides;
- La transition vers différentes phases (solide-liquide-gazeux) est effectuée avec un changement de la position relative des nucléons individuels (ou de leurs éléments) dans la structure du noyau;
- Le concept de "Electronic Atom Shell" est exclu du nouveau modèle d'atome, et toutes les interactions des atomes sont effectuées par contact direct des nucléons des noyaux et par les champs électrostatiques et magnétiques connus attachés à des nucléons spécifiques dans la composition du noyau.
- Il n'y a pas de particule séparée "Electron" dans ce modèle d'atome.
Le noyau de l'atome coïncide pratiquement en taille avec la limite extérieure de l'atome. La coïncidence de la taille du noyau avec les dimensions externes de l'atome permet de donner des explications à de nombreux états de phase jusque-là inexpliqués, à savoir les substances solides, liquides et gazeuses.
Les substances solides du nouveau concept sont expliquées par des atomes-noyaux solides directement en contact les uns avec les autres. De plus, leur résistance à la traction est déterminée par l'attraction d'atomes individuels au niveau des forces magnétiques à courte portée dans le noyau atomique. Eh bien, la résistance à la compression est déterminée exclusivement par la force des noyaux atomiques denses eux-mêmes. La force de compression tend vers l'infini, qui se manifeste dans le fait même de l'existence d'objets géants fortement comprimés par la gravité, tels que les étoiles et les planètes.
Le cas de la pression unilatérale ne crée pas les conditions d'une compression complète et, par conséquent, les atomes commencent à glisser l'un sur l'autre sous l'action de forces de cisaillement dans la direction perpendiculaire à la force de compression active. C'est précisément la possibilité d'un tel changement sur lequel reposent toutes les technologies de formage des métaux (pressage, forgeage, estampage), lorsque dans un espace étroit entre les rouleaux, il est possible de rouler un flan métallique en feuille très mince ou entre la matrice et le poinçon, il est possible d'aplatir le flan en un produit en forme de verre. C'est exactement ainsi que les canettes de bière à parois minces sont fabriquées à partir de pastilles en aluminium-flans par emboutissage.
Le noyau d'un atome a une structure-architecture très claire et unique, qui est responsable de toutes les propriétés physiques et chimiques d'une substance simple particulière du tableau périodique.
Le passage à l'examen de «petits» détails de la structure du noyau nous permet de passer de la caractéristique numérique insignifiante existante du nombre de nucléons et de l'ampleur de la charge selon le tableau périodique à la caractéristique qualitative informative de l'architecture de la structure du noyau, qui devrait porter l'ensemble des propriétés chimiques et physiques d'une substance simple.
La transition vers différents états agrégés (solide-liquide-gazeux) se produit lorsque la position relative des nucléons individuels dans la structure du noyau change ou que les nucléons eux-mêmes changent dans le ragondin.
Dans le modèle de l'atome de Rutherford-Bohr, le noyau était des milliers de fois plus petit que la taille de l'atome, et donc l'effet de son petit noyau sur les transformations de phase externe n'a tout simplement pas été pris en compte. Avec une multiplication par mille de la taille du noyau, son rôle augmente fortement dans l'effet sur toutes les propriétés physiques de la matière, y compris les transitions de phase vers divers états d'agrégation. Au contact direct de grands Nuclei-Atoms multi-nucléon, un nouveau type d'interaction apparaît, basé sur les forces magnétiques et électrostatiques connues depuis longtemps.
Avec un contact étroit des noyaux, élargi aux limites extérieures de l'atome, le phénomène auparavant négligé «interaction électrostatique et magnétique d'ordre à courte portée» commence à apparaître, c'est-à-dire l'interaction de fortes charges magnétiques et électriques de nucléons à des distances proches de la taille du noyau et de la taille des nucléons individuels.
Le modèle précédent considérait l'atome comme étant électriquement neutre, et la séparation de la charge négative de la coquille électronique et du noyau positif n'était pas prise en compte.
Dans le nouveau modèle, l'interaction des Nuclei-Atoms peut être envisagée au niveau de l'effet local de convergence étroite des pôles du même nom du noyau interne espacé Charges-Dipoles. Une telle approche permet de créer un modèle de solide sur les forces d'attraction magnétique, ainsi qu'un modèle d'états de gaz statiques sur les forces de répulsion électrostatique. L'état intermédiaire dans le modèle de phase liquide a des éléments des modèles de phase solide et gazeux, qui sont opposés les uns aux autres dans un espace étroit entre les atomes.
Le gaz existe sur les forces répulsives du même nom Charges électrostatiques dans les dipôles des nucléons individuels, lorsque tous les dipôles électriques de l'atome sont tournés vers l'extérieur par le même nom du pôle électrique. Dans ce cas, tous les atomes de gaz voisins sont hérissés des mêmes pôles de dipôles électriques (au total l'atome reste neutre), ce qui crée leur répulsion mutuelle électrostatique locale. (Fig.1, Fig.2, Fig.3).
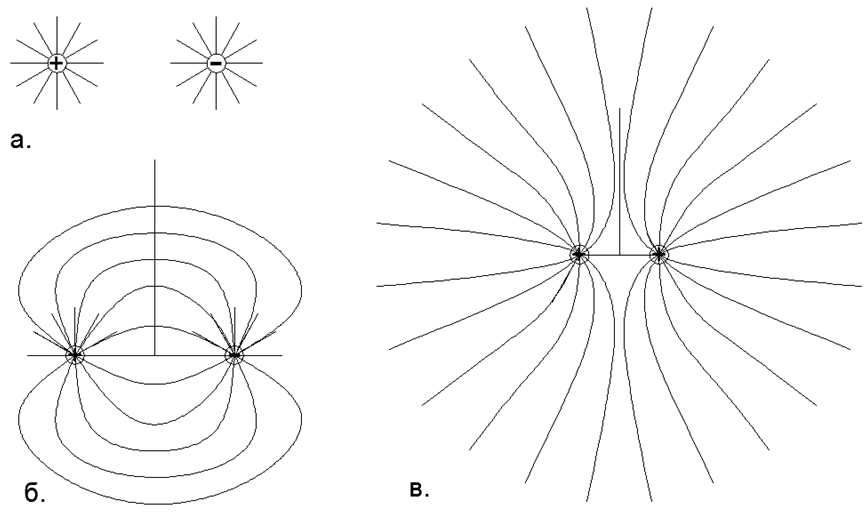 Fig.1. L'interaction des champs de charges ponctuelles selon le principe de superposition: a) Deux charges opposées isolées avec un champ électrique régulier dirigé radialement (sphérique), où les lignes de force sont uniformément réparties et s'étendent radialement à l'infini, c'est-à-dire que dans le modèle abstrait leurs champs n'interagissent pas; b) La forme réelle des lignes de force de deux charges opposées uniques proches, où, selon le principe de superposition, les lignes de force d'une charge positive sont fermées sur une charge négative, et à l'infini la charge totale de ce système est perçue comme nulle et les lignes de force d'un dipôle ne vont pas à l'infini; c) La forme réelle des lignes de force de deux charges homonymes et unidimensionnelles simples étroitement espacées, où selon le principe de superposition, les lignes de force des mêmes charges ne se croisent pas, mais sont déplacées dans des demi-espaces séparés, et à l'infini la charge totale de ce système est perçue comme une charge ponctuelle de double valeur.
Fig.1. L'interaction des champs de charges ponctuelles selon le principe de superposition: a) Deux charges opposées isolées avec un champ électrique régulier dirigé radialement (sphérique), où les lignes de force sont uniformément réparties et s'étendent radialement à l'infini, c'est-à-dire que dans le modèle abstrait leurs champs n'interagissent pas; b) La forme réelle des lignes de force de deux charges opposées uniques proches, où, selon le principe de superposition, les lignes de force d'une charge positive sont fermées sur une charge négative, et à l'infini la charge totale de ce système est perçue comme nulle et les lignes de force d'un dipôle ne vont pas à l'infini; c) La forme réelle des lignes de force de deux charges homonymes et unidimensionnelles simples étroitement espacées, où selon le principe de superposition, les lignes de force des mêmes charges ne se croisent pas, mais sont déplacées dans des demi-espaces séparés, et à l'infini la charge totale de ce système est perçue comme une charge ponctuelle de double valeur. Autrement dit, à partir d'un macroenvironnement éloigné, les atomes neutres semblent uniformément neutres, tandis que dans l'ordre à courte distance avec les atomes voisins, les gaz sont maintenus dans un état stable et équidistant sur les forces de répulsion électrostatique du même nom.
Dans le modèle «Interaction électrostatique de l'ordre à courte portée», les molécules de gaz cessent de se déplacer à des vitesses énormes, restant dans un état de repos électriquement intense, et leur température est déterminée uniquement par la force du champ électrostatique dans l'ordre d'interaction à courte portée. Un changement en douceur de la température du gaz est réalisé par un changement synchrone en douceur de la longueur des épaules des dipôles électriques du nucléon intérieur dans la direction radiale de l'atome. Plus le bras dipôle est court, plus la longueur des pétales de la couronne électrostatique qu'il peut créer est courte.
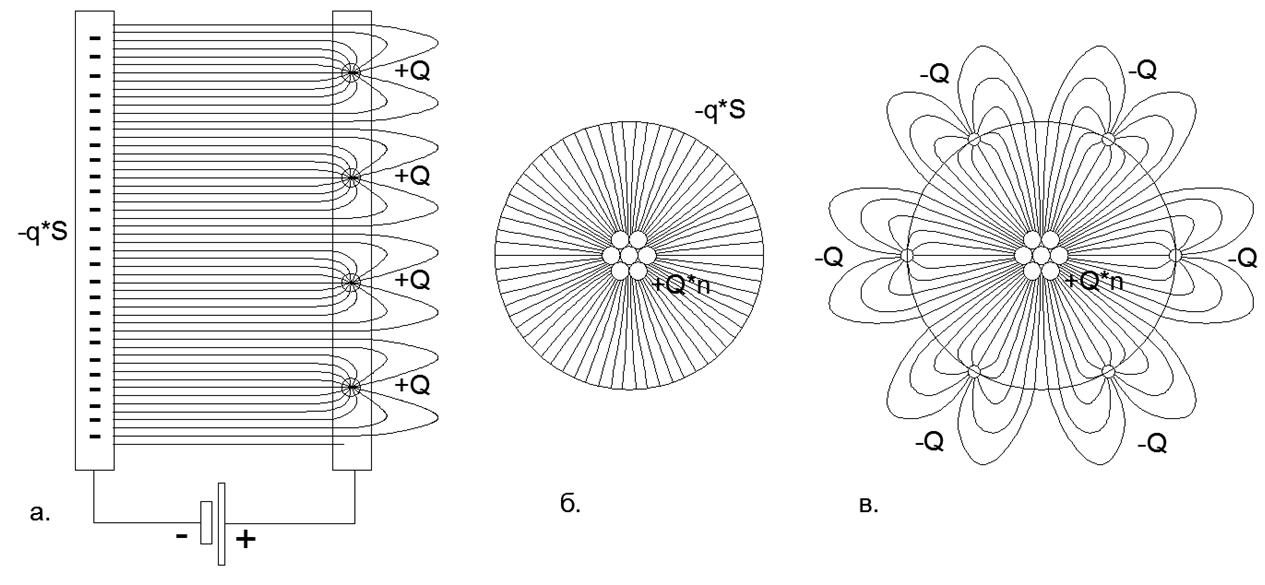 Fig.2 Distribution des lignes de champ électrostatique sur les plaques d'un condensateur à charges réparties et ponctuelles: a) Condensateur plat avec une charge répartie des plaques Moins (le champ ne coupe pas le champ) et charges ponctuelles sur la plaque Plus (le champ se ferme en dehors de l'espace entre les plaques) ; b) Condensateur sphérique avec charge répartie sur la doublure négative et charges ponctuelles sur la doublure positive; c) Condensateur sphérique avec des charges ponctuelles sur la doublure Plus et des charges ponctuelles sur la doublure Moins (la fermeture du champ sur les charges externes crée de longs pétales de lignes de champ qui s'étendent loin dans l'espace au-delà de la doublure sphérique externe solide du condensateur).
Fig.2 Distribution des lignes de champ électrostatique sur les plaques d'un condensateur à charges réparties et ponctuelles: a) Condensateur plat avec une charge répartie des plaques Moins (le champ ne coupe pas le champ) et charges ponctuelles sur la plaque Plus (le champ se ferme en dehors de l'espace entre les plaques) ; b) Condensateur sphérique avec charge répartie sur la doublure négative et charges ponctuelles sur la doublure positive; c) Condensateur sphérique avec des charges ponctuelles sur la doublure Plus et des charges ponctuelles sur la doublure Moins (la fermeture du champ sur les charges externes crée de longs pétales de lignes de champ qui s'étendent loin dans l'espace au-delà de la doublure sphérique externe solide du condensateur).
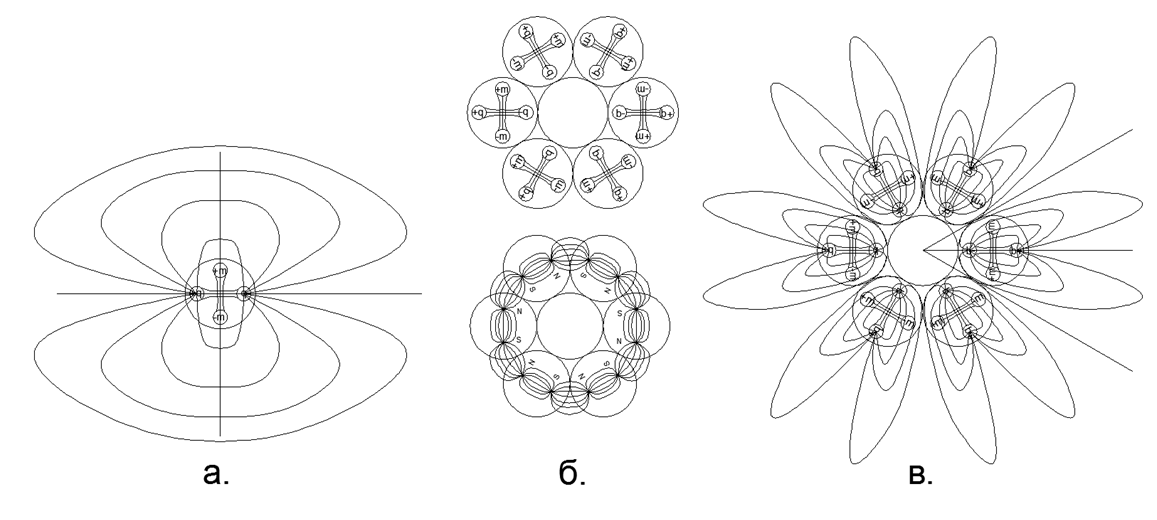 Fig.3. a) Vue du champ électrique du dipôle dans la composition d'un nucléon libre; b) rétention sur les forces magnétiques d'une chaîne de 6 nucléons fermée dans un anneau, tandis que les lignes de force magnétiques sont complètement fermées à l'intérieur de l'anneau et n'entrent pas dans l'espace; c) Le champ électrique des dipôles de l’anneau de nucléons, formant la «couronne» électrostatique (dans ce cas, les pétales des lignes de force de la «couronne» électrique dépassent largement les limites des dimensions de l’atome).
Fig.3. a) Vue du champ électrique du dipôle dans la composition d'un nucléon libre; b) rétention sur les forces magnétiques d'une chaîne de 6 nucléons fermée dans un anneau, tandis que les lignes de force magnétiques sont complètement fermées à l'intérieur de l'anneau et n'entrent pas dans l'espace; c) Le champ électrique des dipôles de l’anneau de nucléons, formant la «couronne» électrostatique (dans ce cas, les pétales des lignes de force de la «couronne» électrique dépassent largement les limites des dimensions de l’atome).L'effet de répulsion électrostatique à courte portée dans les gaz et l'attraction magnétique des noyaux dans la phase liquide (solide) expliquent bien le processus de vaporisation lors d'un chauffage progressif et l'état critique de la vapeur par saturation. Ainsi, l'évaporation (sortie d'une phase solide ou liquide à un état gazeux) se produit lorsque, lorsqu'un atome est chauffé, les dipôles électrostatiques des nucléons se retournent avec les mêmes pôles dans la mesure où à un moment donné la répulsion électrostatique devient supérieure à la force d'attraction magnétique des atomes voisins. La condensation se produit dans l'ordre inverse: le refroidissement des atomes conduit à une diminution de l'intensité de la répulsion électrostatique lorsque les dipôles électriques sont tournés vers une position neutre.
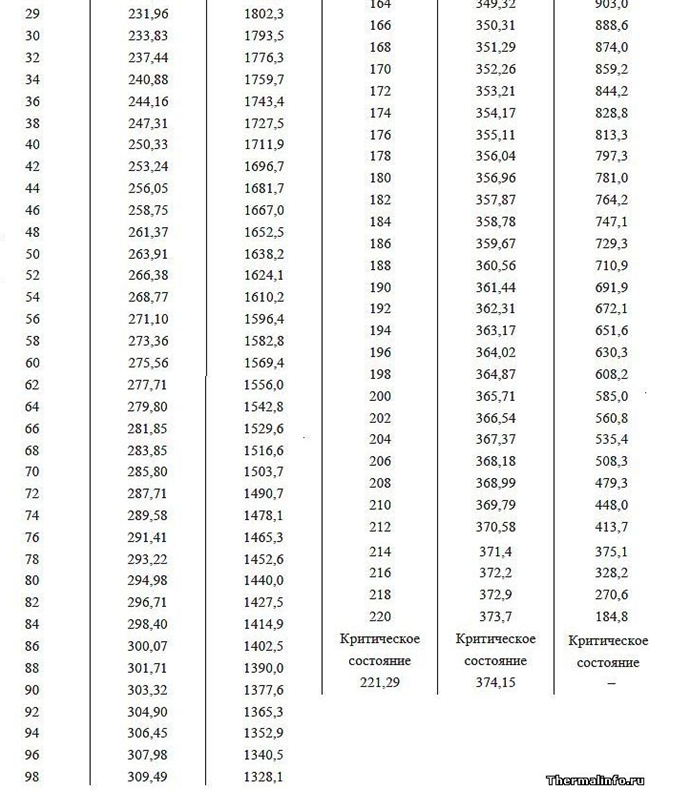
La fonction de travail (énergie de vaporisation) est l'énergie de champ supplémentaire dépensée par un atome lors de l'expansion de la couronne électrostatique dans un espace gazeux vide. L'énergie de sortie (chaleur de vaporisation) avec une pression de gaz croissante devrait diminuer à une température égale du liquide et du gaz au-dessus, ce qui est confirmé par l'exemple de la dépendance de la chaleur de vaporisation à différentes pressions d'air autour (voir les données du tableau pour les pressions inférieures à 1 atm en haute montagne). De plus, avec l'augmentation de la pression et du point d'ébullition de l'eau (données tabulaires du point d'ébullition de l'eau à différentes pressions supérieures à 1 atm.), La fonction de travail diminue, ce qui s'explique par une réduction de la différence des tailles des distances intermoléculaires dans les phases liquide et gazeuse, réduisant ainsi le volume du champ électrique de Corona, qui absorbe en outre l'énergie lorsqu'elle s'ouvre après avoir quitté une eau dense en phase gazeuse raréfiée.
La transition de l'état de vapeur à l'état de glace à des températures négatives doit passer par la phase d'eau liquide. En même temps, la couche la plus mince de la phase liquide de l'eau avec une température supérieure à zéro Celsius se forme à la surface de la glace déjà solidifiée, dans laquelle le flux de chaleur provenant du pliage du champ de condensation des molécules d'eau est distribué. Plus la différence de température de la glace par rapport à 0 est grande, plus la couche d'eau à la surface est mince, car une grande différence de température augmente le taux de transfert de chaleur dans la couche de glace liquide, avec une diminution proportionnelle de l'épaisseur de la couche d'eau pour conduire le flux de chaleur souhaité à partir de la molécule d'eau condensée.
La couche d'eau la plus mince à la surface de la glace lors de l'interaction avec le support d'une charge externe (la semelle de la chaussure ou du traîneau) crée les conditions d'apparition d'une «hydrocline» même à des vitesses relatives presque nulles de la charge par rapport à la glace. La couche d'eau la plus fine avec une épaisseur de plusieurs rangées moléculaires n'a tout simplement pas le temps de se faufiler hors d'un mince espace, tandis que la viscosité de l'eau liquide est très faible, ce qui crée la possibilité de glisser la semelle sur la glace sur une graisse d'eau "hydrocline".
Si l'épaisseur de l'hydrocline est associée à une baisse de température par rapport à 0 ° C, le glissement de la glace devrait diminuer avec l'augmentation du gel. C'est exactement le comportement de la glace qui peut être retracé dans la pratique, lorsque la plus grande glisse sur les routes est perceptible à des températures proches de zéro Celsius. En cas de fortes gelées, lors du déplacement sur la glace, le contact direct est fait de solide-dur, pratiquement sans formation d'hydrocline, comme s'il y avait une prise moléculaire instantanée de glace avec la semelle (pneu) avec le gel du support à la glace.
Selon certains rapports, l'épaisseur du film d'eau sur la surface de la glace, égale à -5 degrés 100 nm, diminue de dix fois à -35 degrés à 10 nm, et à -170 degrés, elle se compose généralement d'une couche de molécules. Ainsi, les habitants de l'Arctique disent que faire glisser des traîneaux sur de la glace à très basse température revient à les faire glisser sur du sable (après tout, il n'y a pas assez de lubrification dans ce cas).
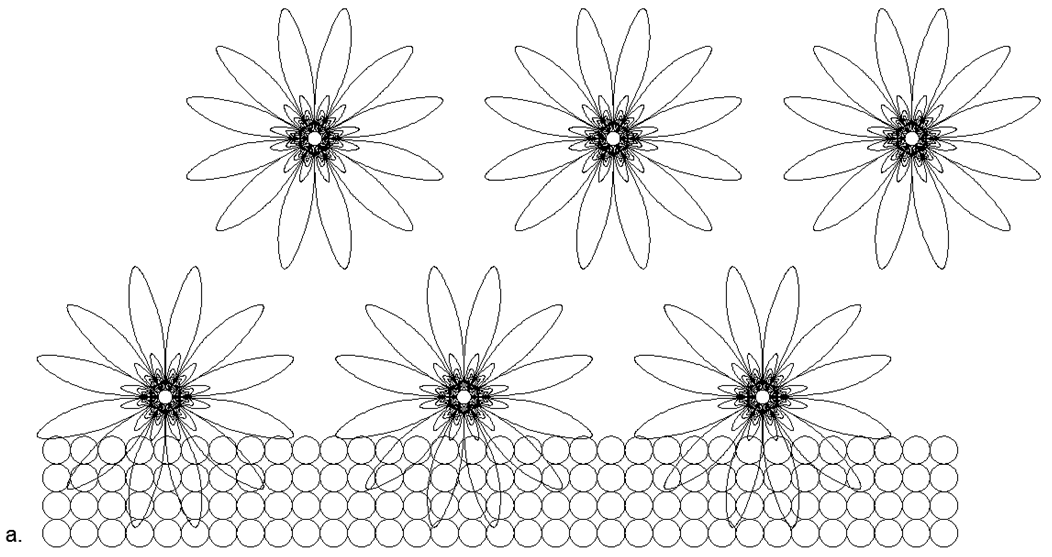
 Fig. 4 Représentation schématique de la zone limite de contact de différentes phases Liquide-Gaz (Eau-Air) dans le cas de la théorie électrostatique du gaz: a) Gaz à une pression de 1 atm. au-dessus de l'eau liquide (la distance entre les centres des molécules est environ 10 fois plus grande qu'en phase liquide); b) Le même gaz au-dessus de l'eau à la même température, mais à une pression de 10 atm., tandis que la distance entre les centres des molécules de gaz est réduite de 10 ^ 1/3 = 2,15 fois. On peut voir clairement la déformation de la couronne électrique monopolaire en contact des atomes de gaz lorsque les molécules se rapprochent. Les lignes de force ne peuvent pas se croiser, et sont donc forcées de se déformer, occupant un volume plus petit, ce qui conduit à une augmentation des forces de répulsion mutuelle (augmentation de la pression du gaz).Tab.1. La chaleur de vaporisation de l'eau, en fonction de la pression et de la température.
Fig. 4 Représentation schématique de la zone limite de contact de différentes phases Liquide-Gaz (Eau-Air) dans le cas de la théorie électrostatique du gaz: a) Gaz à une pression de 1 atm. au-dessus de l'eau liquide (la distance entre les centres des molécules est environ 10 fois plus grande qu'en phase liquide); b) Le même gaz au-dessus de l'eau à la même température, mais à une pression de 10 atm., tandis que la distance entre les centres des molécules de gaz est réduite de 10 ^ 1/3 = 2,15 fois. On peut voir clairement la déformation de la couronne électrique monopolaire en contact des atomes de gaz lorsque les molécules se rapprochent. Les lignes de force ne peuvent pas se croiser, et sont donc forcées de se déformer, occupant un volume plus petit, ce qui conduit à une augmentation des forces de répulsion mutuelle (augmentation de la pression du gaz).Tab.1. La chaleur de vaporisation de l'eau, en fonction de la pression et de la température.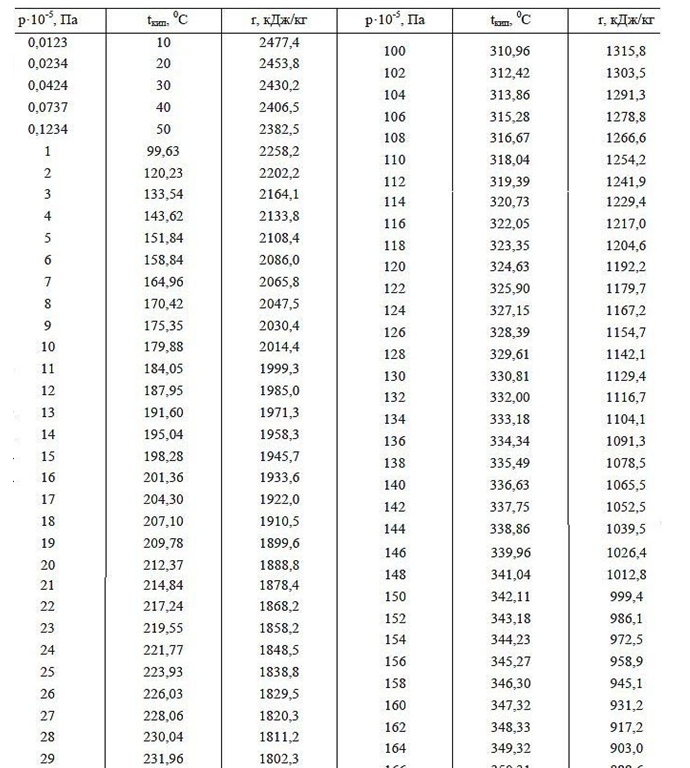
Les équations d'état existantes d'un gaz idéal (la loi Boyle-Marriott) décrivent bien les gaz à basse pression (conditions normales) et à haute température. Mais à haute pression, cette loi idéale ne nous permet pas de décrire les transitions vers le liquide, ni même vers le solide.
La loi de Van der Waltz tente de corriger les incohérences en introduisant des facteurs supplémentaires, en adaptant la courbe théorique à la dépendance obtenue expérimentalement. Dans ce cas, un rejet caché du modèle d'atome de Rutherford-Bohr a lieu, car dans l'équation de van der Wals, l'atome est représenté par une boule solide remplissant tout le volume à ses limites externes.
Dans le même temps, la nature de l'interaction des boules atomiques n'est pas expliquée qualitativement, laissant des explications au niveau des coquilles d'électrons statistiques en apesanteur sur un minuscule nucléole, comme cela devrait être selon le modèle de Rutherford-Bohr.
Dans le cas du modèle proposé, où la répulsion de surfaces de charge similaire se produit, il devient possible de considérer le modèle statique de compréhension, où chaque élément du modèle a une incarnation physique compréhensible et une signification physique.
Ainsi, l'interaction des dipôles est exprimée par la formule la plus simple d'interaction directe par paire pour des charges à quatre points collectées par paires dans des dipôles mécaniquement forts avec un épaulement L et une distance R entre les extrémités proches des dipôles:
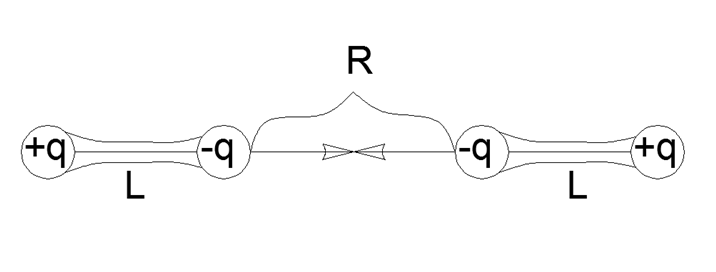
F = K q2 (1 / R2 - 2 / (R + L) 2 + 1 / (R + 2L) 2)
Menant à un dénominateur commun et ouvrant les crochets dans le numérateur, nous obtenons une expression encore plus encombrante:
F = K q2 (2R2L2 + 12RL3 + 4L4) / (R2 (R + L) 2 (R + 2L) 2)
Une caractéristique du modèle de calcul des dipôles est que la fonction de répulsion des dipôles tend vers l'infini loin du centre de l'atome, ou plutôt, à son bord extérieur, où le contact direct des atomes est possible sous l'influence des forces les plus puissantes de l'attraction atomique magnétique. C'est ce contact de deux forces fortement changeantes en valeur et opposées en signe sur la frontière atomique qui nous permet de créer un modèle de répulsion-attraction équilibrée des atomes entre eux.
Lorsque R >> L, la fonction de répulsion électrostatique des dipôles est simplifiée sous la forme:
F = K q2 2L2 / R4
L'attraction magnétique a une propriété de saturation et le graphe de fonction ne va pas à l'infini même avec un contact direct d'atomes, donc l'attraction magnétique trouvera toujours un point d'équilibre avec une répulsion électrostatique sur une pente hyperbolique abrupte de la caractéristique électrostatique.Bien sûr, il est clair qu'en réalité il n'y a pas de forces infiniment grandes, mais il y a une certaine limite de valeurs maximales (par exemple, les forces d'attraction des atomes peuvent être estimées par mesure directe de la résistance à la traction dans un monocristal d'une substance, et la finitude des forces d'interaction électrostatique est déterminée par l'énergie fixe lors de l'annihilation des électrons et du positron). Lorsque deux atomes se rejoignent, les forces répulsives cessent également à un moment donné de croître rapidement et atteignent une certaine valeur finie fixe. Ainsi, deux valeurs non infiniment grandes d'attraction et de répulsion s'équilibrent à un certain point d'équilibre mutuel, qui peuvent être trouvées à l'intersection des graphiques de ces deux fonctions, lors du traçage de graphiques dans un système de coordonnées. (voir graphique 1)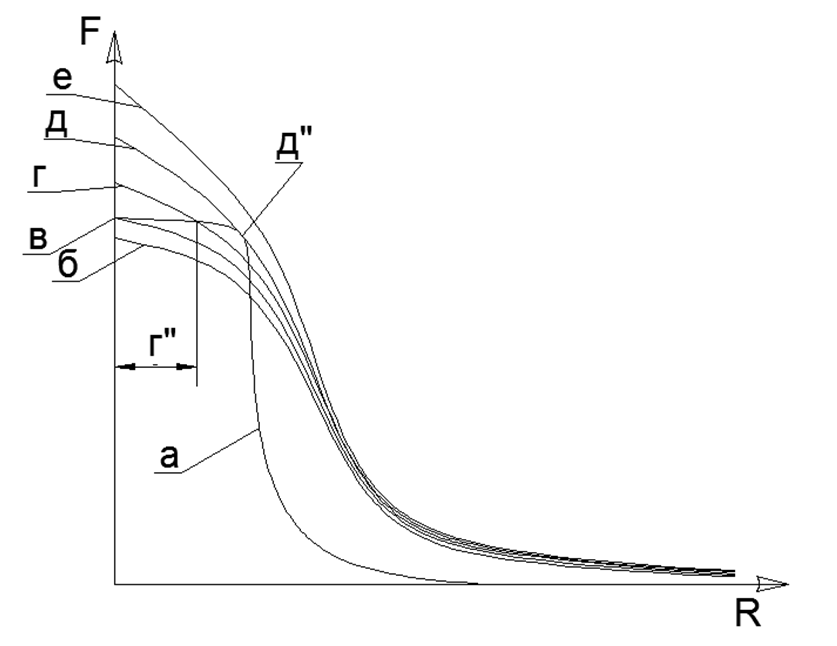 .1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). L'équation de Van der Waltz dresse un tableau très similaire, mais n'explique pas la signification physique des forces d'attraction et de répulsion, tout en déplaçant subtilement la zone de croissance asymptotique infinie de la fonction dans la zone inaccessible du centre de l'atome.L'état liquide d'une substance est le moment où, lors du chauffage, les dipôles électrostatiques ont déjà commencé à se repousser, mais cette répulsion n'est pas encore capable de rompre le lien de l'attraction magnétique des atomes. En conséquence, un petit espace apparaît entre les atomes (g ”dans le graphique du graphique 1), ce qui conduit à une forte augmentation de la mobilité mutuelle des atomes sur la couche de" lubrifiant "électromagnétique.La couche limite solide-gaz est formée au contact de la matière solide couplée magnétiquement avec des atomes de gaz soumis à une contrainte électrostatique. Les atomes de gaz ne peuvent pas pousser d'un solide avec une couronne électrostatique d'atomes non divulguée et sont pressés contre une surface solide. Ainsi, une couche limite d'atomes de gaz se forme, pressée à la surface d'une substance solide. Dans ce cas, la couche de gaz limite est toujours capable de repousser d'autres atomes de gaz d'elle-même, car la couche de gaz limite reste soumise à une contrainte électrostatique au degré nécessaire. Une telle compression de la couche limite de gaz (air) en un métal solide explique l'apparition presque instantanée d'oxydes métalliques à la surface. Un contact supplémentaire de la couche limite de gaz est déjà effectué avec un film protecteur solide d'oxydes sur la surface métallique,protège la couche sous-jacente de métal pur d'une oxydation supplémentaire.Modélisation de prétendues architectures structurelles d'éléments chimiques. À l'avenir, nous considérerons les prétendus modèles de la structure des noyaux d'atomes de diverses substances, où la boule métallique aux propriétés magnétiques fortes sera le nucléon (nucléon, proton). L'interaction magnétique des nucléons répond au critère de la non-centralité de l'interaction de force des nucléons dans le noyau et de la saturation de ces forces lorsque les nucléons se rapprochent, ce qui a longtemps été supposé en physique nucléaire pour de fortes interactions nucléaires.Les aimants modernes en terres rares ont une force magnétique très élevée, ce qui permet de construire des modèles plausibles de structures atomiques, en ne s'appuyant que sur les forces magnétiques de Sharikov-Nuklonov tenant dans le cadre d'un seul noyau avec une architecture unique. Dans ce cas, les forces magnétiques elles-mêmes agissent comme des contrôleurs de critères pour chacun de ces modèles de noyaux, car loin de toutes les combinaisons spatiales de boules peuvent être assemblées sous une forme stable en raison de l'attraction mutuelle et de la répulsion des boules polarisées.Le modèle de chaque atome est assemblé à partir du nombre de nucléons spécifié par le tableau périodique (y compris tous les isotopes stables). Des reconstitutions de modèles sont réalisées à partir de billes magnétiques en néodyme d'un diamètre de 5 mm. Actuellement, ces boules magnétiques sont vendues sous forme de jouets de puzzle appelés Neocub, qui comprennent 216 boules magnétiques de la même taille (morceaux de cube 6x6x6).Sur la base des caractéristiques géométriques obtenues des modèles d'atomes de chaque substance simple, nous allons essayer de trouver les connexions logiques entre la forme du modèle d'atomes et les propriétés de la matière réelle au niveau macro.Au stade initial de modélisation des structures nucléaires, certaines régularités ont été révélées. Les boules magnétiques ont donc tendance à s'aligner en chaînes et les chaînes suffisamment longues s'enclenchent facilement dans les anneaux. Les structures magnétiques des anneaux s'avèrent être très fortes et stables, tandis que le champ magnétique externe de ces anneaux diminue fortement, car presque toutes les lignes magnétiques de leurs flux magnétiques séparent les aimants à billes qui sont fermés par les billes voisines de leur anneau à nucléon magnétique (voir figure 5). Des anneaux de même taille (nombre égal de boules de nucléons) peuvent se connecter facilement les uns aux autres, formant des structures en forme de pilier très stables qui peuvent être étendues presque illimitéement sur la longueur avec de nouveaux anneaux proportionnés (Fig.6).Les chaînes de boules de nucléons peuvent être connectées en parallèle les unes aux autres en deux versions:
.1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). L'équation de Van der Waltz dresse un tableau très similaire, mais n'explique pas la signification physique des forces d'attraction et de répulsion, tout en déplaçant subtilement la zone de croissance asymptotique infinie de la fonction dans la zone inaccessible du centre de l'atome.L'état liquide d'une substance est le moment où, lors du chauffage, les dipôles électrostatiques ont déjà commencé à se repousser, mais cette répulsion n'est pas encore capable de rompre le lien de l'attraction magnétique des atomes. En conséquence, un petit espace apparaît entre les atomes (g ”dans le graphique du graphique 1), ce qui conduit à une forte augmentation de la mobilité mutuelle des atomes sur la couche de" lubrifiant "électromagnétique.La couche limite solide-gaz est formée au contact de la matière solide couplée magnétiquement avec des atomes de gaz soumis à une contrainte électrostatique. Les atomes de gaz ne peuvent pas pousser d'un solide avec une couronne électrostatique d'atomes non divulguée et sont pressés contre une surface solide. Ainsi, une couche limite d'atomes de gaz se forme, pressée à la surface d'une substance solide. Dans ce cas, la couche de gaz limite est toujours capable de repousser d'autres atomes de gaz d'elle-même, car la couche de gaz limite reste soumise à une contrainte électrostatique au degré nécessaire. Une telle compression de la couche limite de gaz (air) en un métal solide explique l'apparition presque instantanée d'oxydes métalliques à la surface. Un contact supplémentaire de la couche limite de gaz est déjà effectué avec un film protecteur solide d'oxydes sur la surface métallique,protège la couche sous-jacente de métal pur d'une oxydation supplémentaire.Modélisation de prétendues architectures structurelles d'éléments chimiques. À l'avenir, nous considérerons les prétendus modèles de la structure des noyaux d'atomes de diverses substances, où la boule métallique aux propriétés magnétiques fortes sera le nucléon (nucléon, proton). L'interaction magnétique des nucléons répond au critère de la non-centralité de l'interaction de force des nucléons dans le noyau et de la saturation de ces forces lorsque les nucléons se rapprochent, ce qui a longtemps été supposé en physique nucléaire pour de fortes interactions nucléaires.Les aimants modernes en terres rares ont une force magnétique très élevée, ce qui permet de construire des modèles plausibles de structures atomiques, en ne s'appuyant que sur les forces magnétiques de Sharikov-Nuklonov tenant dans le cadre d'un seul noyau avec une architecture unique. Dans ce cas, les forces magnétiques elles-mêmes agissent comme des contrôleurs de critères pour chacun de ces modèles de noyaux, car loin de toutes les combinaisons spatiales de boules peuvent être assemblées sous une forme stable en raison de l'attraction mutuelle et de la répulsion des boules polarisées.Le modèle de chaque atome est assemblé à partir du nombre de nucléons spécifié par le tableau périodique (y compris tous les isotopes stables). Des reconstitutions de modèles sont réalisées à partir de billes magnétiques en néodyme d'un diamètre de 5 mm. Actuellement, ces boules magnétiques sont vendues sous forme de jouets de puzzle appelés Neocub, qui comprennent 216 boules magnétiques de la même taille (morceaux de cube 6x6x6).Sur la base des caractéristiques géométriques obtenues des modèles d'atomes de chaque substance simple, nous allons essayer de trouver les connexions logiques entre la forme du modèle d'atomes et les propriétés de la matière réelle au niveau macro.Au stade initial de modélisation des structures nucléaires, certaines régularités ont été révélées. Les boules magnétiques ont donc tendance à s'aligner en chaînes et les chaînes suffisamment longues s'enclenchent facilement dans les anneaux. Les structures magnétiques des anneaux s'avèrent être très fortes et stables, tandis que le champ magnétique externe de ces anneaux diminue fortement, car presque toutes les lignes magnétiques de leurs flux magnétiques séparent les aimants à billes qui sont fermés par les billes voisines de leur anneau à nucléon magnétique (voir figure 5). Des anneaux de même taille (nombre égal de boules de nucléons) peuvent se connecter facilement les uns aux autres, formant des structures en forme de pilier très stables qui peuvent être étendues presque illimitéement sur la longueur avec de nouveaux anneaux proportionnés (Fig.6).Les chaînes de boules de nucléons peuvent être connectées en parallèle les unes aux autres en deux versions:- directions associées des flux magnétiques
- contre-direction du flux magnétique
La direction simultanée des flux magnétiques donne une connexion plus durable et compacte des chaînes de billes (les billes sont situées aux sommets des triangles isocèles). Les flux magnétiques opposés font que les boules sont situées sur le dessus des carrés, ce qui donne un emballage moins dense et moins durable des boules de nucléon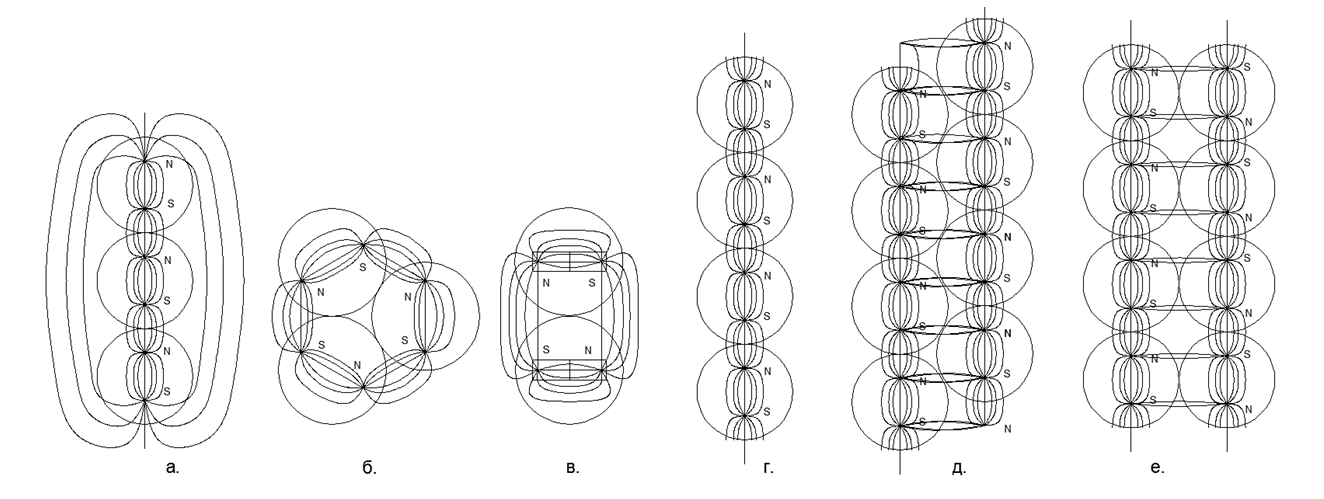 .5. :
.5. :
. 3- ();
. 3- ();
. 2- (), (.);
. - ;
. - , , ;
. - , , . .
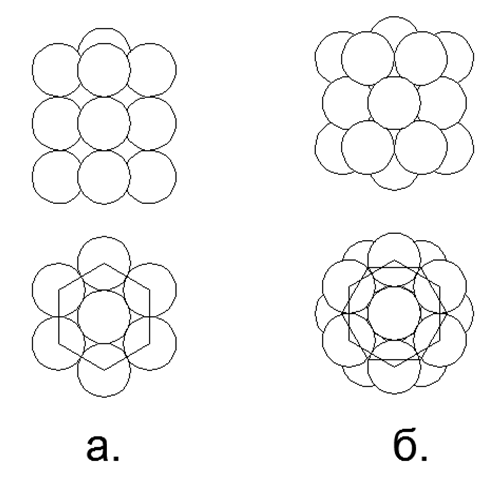 .6. 6- :
.6. 6- :
. ;
. .
- . 6- , .
.
En plus de connecter des anneaux unidimensionnels, il est possible de connecter des anneaux de tailles différentes dans diverses combinaisons, donnant une variété de formes spatiales. C'est cette variété de formes possibles de connexion de structures magnétiques en anneau et de boules magnétiques individuelles qui vous permet de créer de nombreux modèles de l'architecture de noyaux avec un nombre similaire de nucléons, mais liés à différentes substances avec des propriétés chimiques et physiques radicalement différentes.Comme vous le savez, un seul élément chimique peut correspondre à de nombreux isotopes avec un nombre différent de neutrons dans la composition. Ainsi, les structures d'atomes en forme de pilier provenant d'anneaux de six nucléons ou plus ont un espace au centre, ce qui permet de placer des nucléons supplémentaires à l'intérieur de la colonne sans changer l'apparence du noyau atomique. (Fig.6.b).Sur la base de la version proposée de l'attraction magnétique et de la répulsion électrostatique, on peut supposer que les métaux comprennent des structures nucléaires ayant un anneau externe supplémentaire de nucléons couplés magnétiquement au sommet d'une colonne centrale d'anneaux nucléoniques unidimensionnels (Fig.7 - rangée du bas). Cette hypothèse est basée sur le fait que l'anneau magnétique externe n'est pas chargé, augmentant ainsi l'écart entre la colonne interne chargée électriquement à l'approche d'autres atomes du même type. Un tel espace augmente le point d'ébullition et le point de fusion du métal, et crée également une zone plus large pour la zone à l'état liquide.Les substances qui sont des gaz dans des conditions normales, au contraire, doivent avoir un noyau nucléon chargé dans le circuit externe, assurant une répulsion électrostatique à partir du même type d'atomes de gaz, tandis qu'un grand nombre de nucléons peuvent être placés à l'intérieur du cycle chargé, créant une large série isotopique de cet élément. .7. - ( — ) ( - ) . , , . , , .
.7. - ( — ) ( - ) . , , . , , . 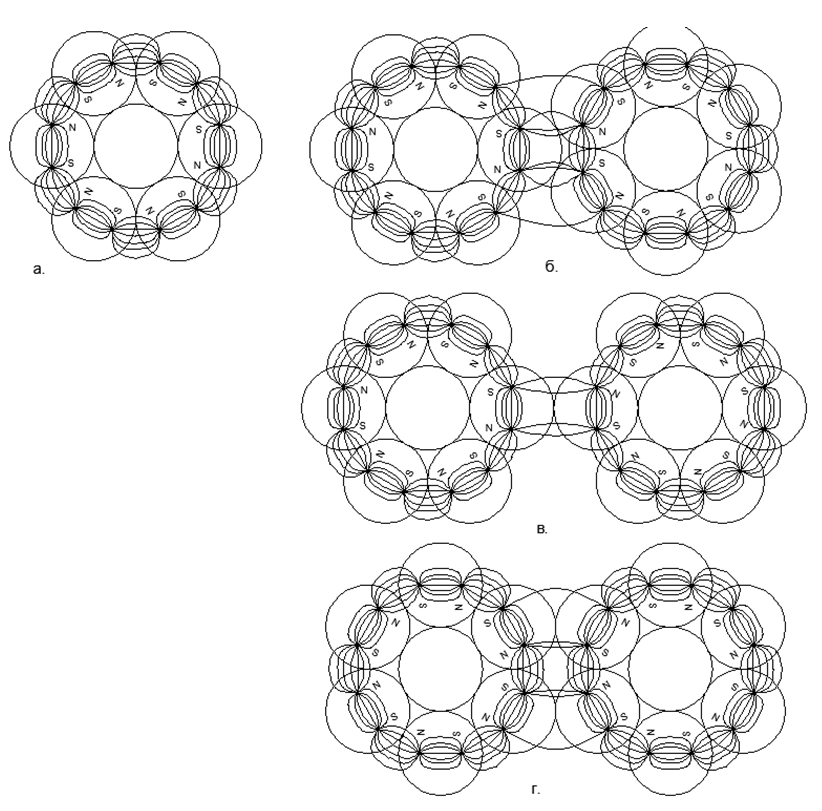 .8. «» :
.8. «» :
. 6- ;
. 6- , , ;
. 6- . , , , (.).
. 6- . , . 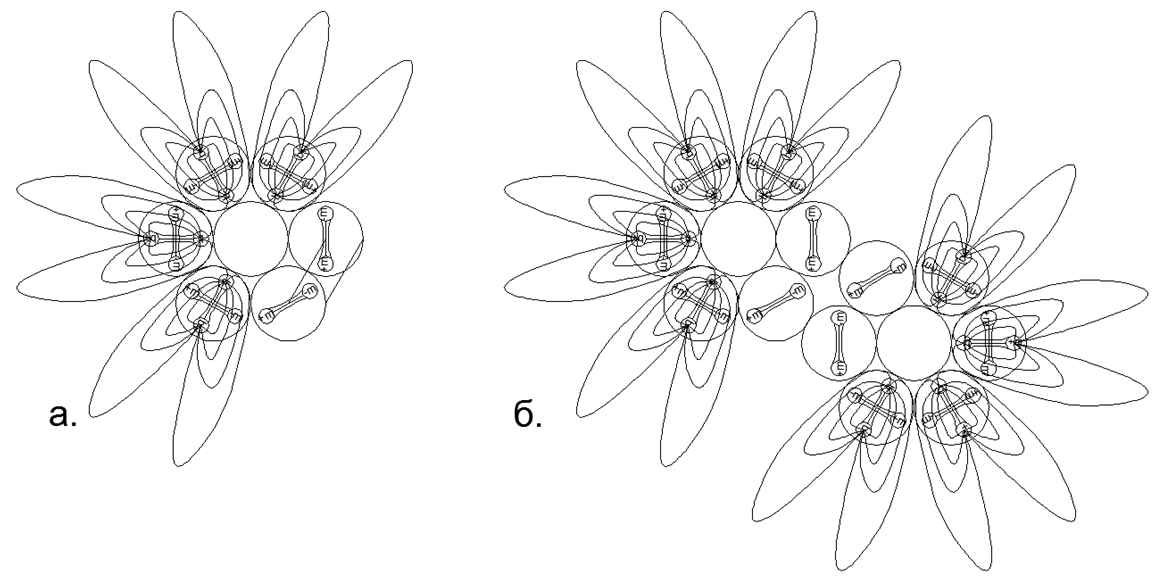 .9. ) , ( N2, 2 ..),; ) , .
.9. ) , ( N2, 2 ..),; ) , . -
Dans ce qui suit, nous examinerons en détail les structures-architecture d'atomes les plus probables des éléments individuels en référence aux particularités de leur composition en nucléons et aux propriétés physiques connues (densité, force, Tplav, TPK, etc.).Ce qui suit est un tableau de 1-2-3 périodes (court) du tableau périodique, où au lieu d'un poids atomique fractionnaire, les poids entiers des isotopes stables individuels trouvés dans la nature sont indiqués (tableau 2).Tab.2. Poids atomiques des isotopes stables des éléments chimiques des périodes 1-2-3rd du tableau périodique.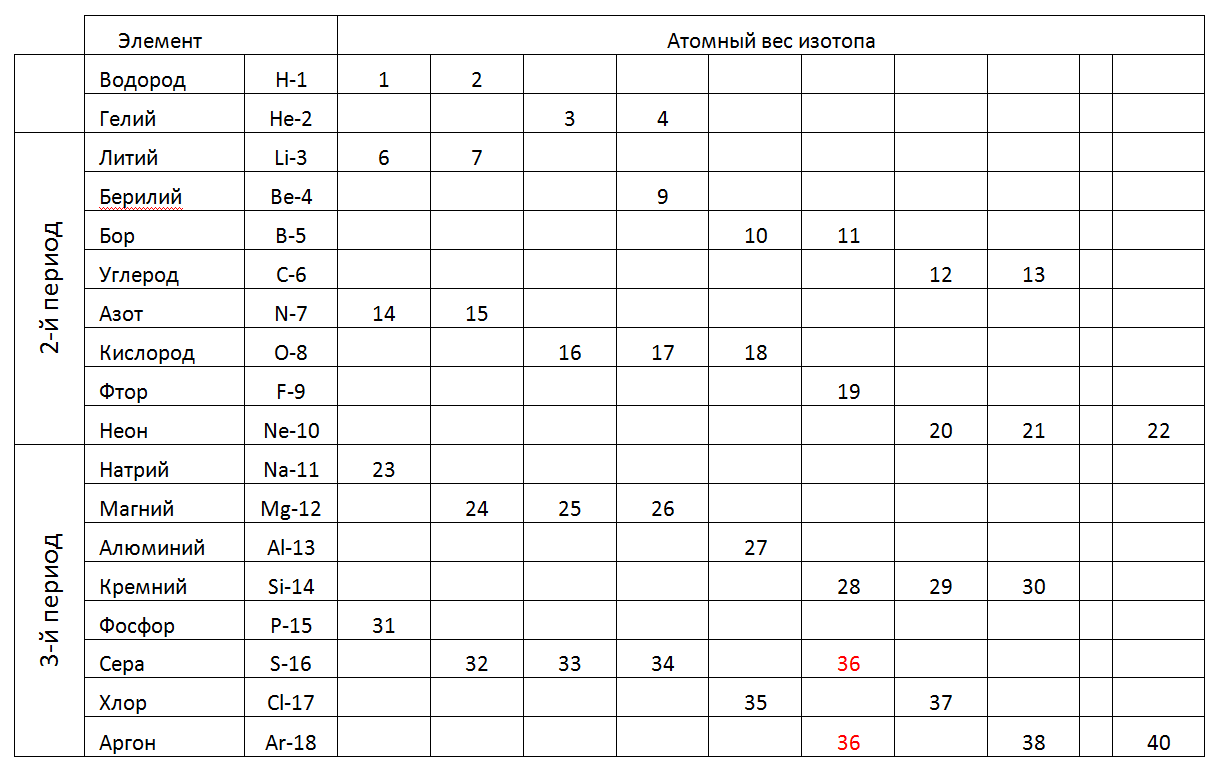 Dans la 1ère période et la 2ème période (la première ligne complète du tableau) le tableau périodique contient des éléments avec un petit nombre de nucléons. Les atomes de petite taille de ces périodes nous permettent d'envisager de tels modèles spatiaux qui correspondent à des formes uniques qui peuvent définir la direction de construction des modèles atomiques pour toutes les périodes ultérieures (voir Fig.7). De plus, l'option de simulation la plus raisonnable peut être considérée comme une augmentation progressive de la longueur du cycle atomique principal chargé, en le complétant par une composition maximale en nucléons de nucléons externes (métal) et intra-cycle (non métalliques) en fonction de leur état chimique, puis recherchez un analogue selon le tableau des correspondances nucléoniques des éléments chimiques .
Dans la 1ère période et la 2ème période (la première ligne complète du tableau) le tableau périodique contient des éléments avec un petit nombre de nucléons. Les atomes de petite taille de ces périodes nous permettent d'envisager de tels modèles spatiaux qui correspondent à des formes uniques qui peuvent définir la direction de construction des modèles atomiques pour toutes les périodes ultérieures (voir Fig.7). De plus, l'option de simulation la plus raisonnable peut être considérée comme une augmentation progressive de la longueur du cycle atomique principal chargé, en le complétant par une composition maximale en nucléons de nucléons externes (métal) et intra-cycle (non métalliques) en fonction de leur état chimique, puis recherchez un analogue selon le tableau des correspondances nucléoniques des éléments chimiques .1.Hydrogène (11H) 1 proton (1p). La substance libre a la forme H2.
La construction d'un atome d'hydrogène ne nécessite aucun effort, car il se compose simplement d'une boule de protons. En raison du flux magnétique ouvert, l'hydrogène monatomique est extrêmement actif, ce qui le fait réagir avec les substances libres les plus proches ou entrer en contact avec d'autres atomes d'hydrogène à l'état d'un anneau fermé stable.
Deutérium (21D) 1 proton + 1 neutron (1p + 1n) - la forme est également sans ambiguïté sous la forme de deux boules collées ensemble.
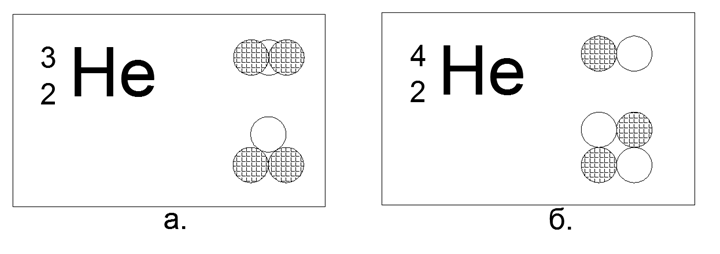
2. Hélium (42He) 2 protons + 2 neutrons (2p + 2n)
Pour l'hélium, il est déjà possible de construire plusieurs options pour les modèles de la structure du noyau:
- Linéaire - quatre nucléons d'affilée,
- Plat (carré) - quatre nucléons dans les coins d'un carré plat,
- Spatial (tétraédrique) - quatre nucléons dans les coins d'un polyèdre volumétrique-tétraèdre.
Dans ce cas, sur 4 billes magnétiques, il est possible de construire uniquement une forme carrée plate du noyau. La forme tétraédrique sur les forces magnétiques ne tient pas, se transformant immédiatement en carré.
À l'avenir, nous nous concentrerons uniquement sur les formes spatiales des atomes, car les variantes linéaires dans des atomes plus massifs ne pourront donner aucune incarnation significative.
Isotope de l'hélium rare (32) 2 protons + 1 neutron (2p + n)
Dans cette configuration, seul un triangle plat est possible.
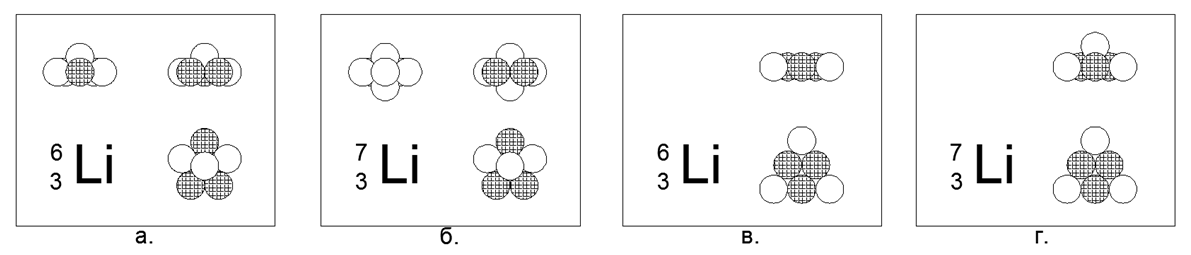
3. Lithium (73Li) -7 nucléons (3p + 4n)
Pour le lithium, il est possible de créer à la fois un modèle plat et tridimensionnel de l'atome.
Le modèle plat est un hexagone avec un nucléon au centre. Le modèle de volume est un pentagone plat avec deux boules aux pôles (les pôles sont les points aux extrémités de l'axe de rotation de la partie axisymétrique principale du modèle de noyau atomique). Les deux modèles ont une symétrie en forme d'étoile prononcée. Lithium métal, très léger (0,534g / cm3), à point de fusion relativement bas (Tm = 454K). Le rare isotope stable Lithium (63Li) -6 nucléons (3p + 3n) peut être modélisé sous les deux formes, donc le choix en faveur de n'importe quel modèle ne peut pas être fait.
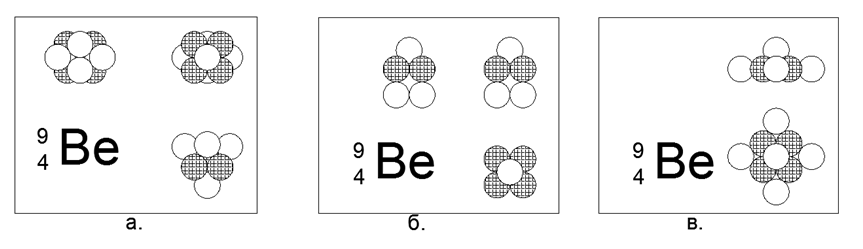
4. Béryllium (94Be) - 9 nucléons (4p + 5n).
Le seul isotope stable à longue durée de vie. Il existe un isotope à vie relativement longue, le béryllium (104Be) - 10 nucléons (4p + 6n) avec une demi-vie de 1,4 milliard d'années. De nombreuses implémentations sont possibles. La forme de sensations la plus stable et la plus compacte ressemble à une forme en forme d'étoile de deux triangles reliés par des avions dans un prisme, où une balle est amarrée aux faces latérales du prisme triangulaire. Le béryllium est un métal léger (1,848 g / cm3), relativement réfractaire (Tm = 1551K). À l'avenir, la forme STAR sera tracée dans la plupart des métaux. Lorsque la 10e boule est ajoutée à la structure résultante, la forme elle-même est modifiée en une autre forme en forme d'étoile, mais asymétrique dans le plan. La nouvelle forme peut être décrite comme une étoile à six pointes avec un centre rempli, au plan latéral duquel un triangle de boules de nucléons s'est amarré. Lorsqu'on regarde le long de l'axe de l '«étoile» sur les deux formes des isotopes du béryllium, une étoile à trois pointes d'un type est clairement visible, ce qui détermine les propriétés externes de base de la matière simple.
5. Bore (115Be) - 11 nucléons (5p + 6n).
Isotopes stables à longue durée de vie 10B et 11B. La configuration spatiale 10B est constituée de deux anneaux pentagonaux connectés en parallèle dans le sens simultané ou opposé du flux magnétique. La configuration spatiale 11B suit la structure de 10B, un seul neutron est ajouté le long de l'axe des anneaux.
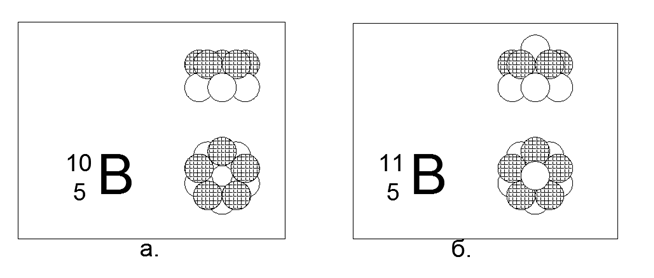
Ainsi, on peut supposer que le non-métal diffère du métal dans sa forme externe principale: le non-métal est un cylindre d'anneaux du même type, le métal est une certaine forme en forme d'étoile (en forme de disque).
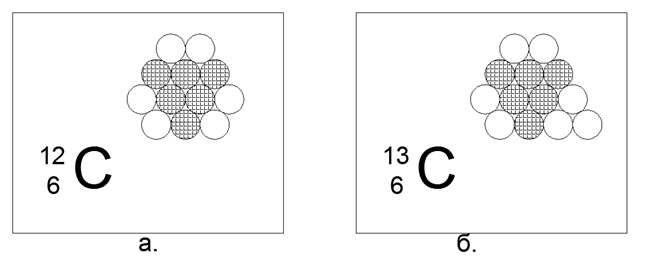
6. Carbone (126) - 12 nucléons (6p + 6n).
Isotopes stables à longue durée de vie 12 (98,93%) et 13 (1,07%), ainsi que radioactifs 14. Un élément extrêmement intéressant qui est très répandu et a une variété infinie de formes structurelles dans la nature (graphite, diamant, charbon, suie, nanostructures de fullerène, etc.) Ce contenu de forme nécessite une structure de 12 billes de certaines propriétés spéciales étonnantes. Une telle structure peut se révéler être un hexagone plat non équilatéral avec trois boules au centre.
Les nucléons chargés sont disposés en triangle, sur les côtés desquels sont attachés trois paires de neutrons. Le résultat est une symétrie à trois faisceaux, où sur les axes de symétrie se trouvent des neutrons externes, prêts pour la connexion magnétique d'autres atomes. Des couches de graphite, ou la surface de nanotubes et des structures en vrac de structures fermées de Fullerenes, sont facilement disposées à partir de ces hexagones.
 Fig. Vue d'une couche de graphène (graphite) composée d'atomes de carbone plan hexagonaux C12.
Fig. Vue d'une couche de graphène (graphite) composée d'atomes de carbone plan hexagonaux C12.Parmi les non-métaux, les substances qui sont des gaz dans des conditions normales sont particulièrement distinguées. Il s'agit des gaz inertes (nobles) monoatomiques, de l'azote et de l'oxygène atmosphériques diatomiques et du fluor halogène diatomique actif.
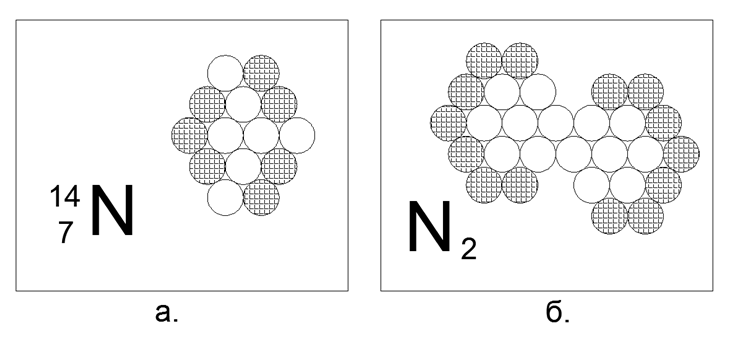
7. Azote (147N) - 14 nucléons (7p + 7n).
Isotopes stables à longue durée de vie 14N et 15N. À l'état libre dans des conditions normales, l'azote est un gaz diatomique, avec une activité extrêmement faible. L'atmosphère de notre planète est composée à 78% d'azote. Posséder la propriété du gaz sous N.u. l'atome nécessite la présence de nucléons chargés sur le périmètre extérieur, sans interruption des neutrons appariés. Mais comme le gaz n'est qu'une molécule diatomique, cela signifie que dans la structure de l'atome, il y a une région magnétiquement active de deux ou trois neutrons d'affilée à la frontière extérieure, par laquelle les atomes d'azote sont liés à la molécule N2. Cette forme de 14 atomes est facilement assemblée sous la forme d'un hexagone non équilatéral, semblable à un losange, où le tracé avec trois neutrons d'affilée sur le périmètre extérieur de l'atome est vraiment naturel. La liaison dans la molécule N2 est si forte que le gaz reste à l'état moléculaire même à 5000 degrés C.
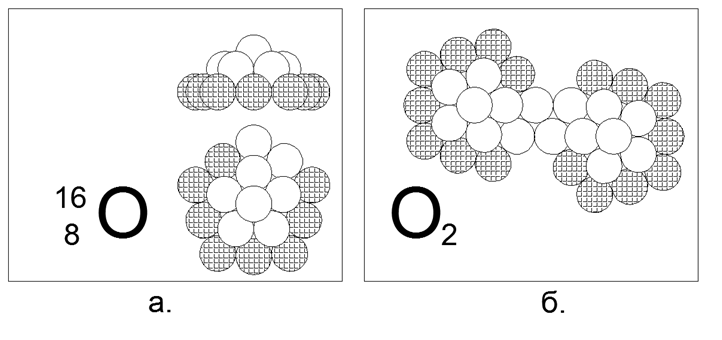
8. Oxygène (168O) - 16 nucléons (8p + 8n).
Isotopes stables à longue durée de vie 17 et 18. La forme supposée de l'isotope 16 le plus courant (99,7%) est un 5-gon de dix nucléons (8 chargés, 2 neutres), avec un espace de contact magnétique-neutre magnétique prononcé dans le cycle extérieur de dix atomes. La doublure intérieure se compose d'un anneau de 5 nucléons avec un seizième nucléon supplémentaire au centre. Les anneaux de 10 et 5 nucléons ne peuvent pas être joints dans le plan et créent donc une forme spatiale en forme de dôme. Les isotopes sont créés en capturant des neutrons supplémentaires au centre sous le "dôme". La présence d'un espace externe de deux nucléons dans l'anneau assure la création d'une molécule diatomique d'O2. La force de liaison à l'intérieur de la molécule d'O2 est beaucoup plus faible que celle de l'azote, et donc l'oxygène est beaucoup plus actif et entre dans la réaction d'oxydation (combustion) à des températures assez basses.
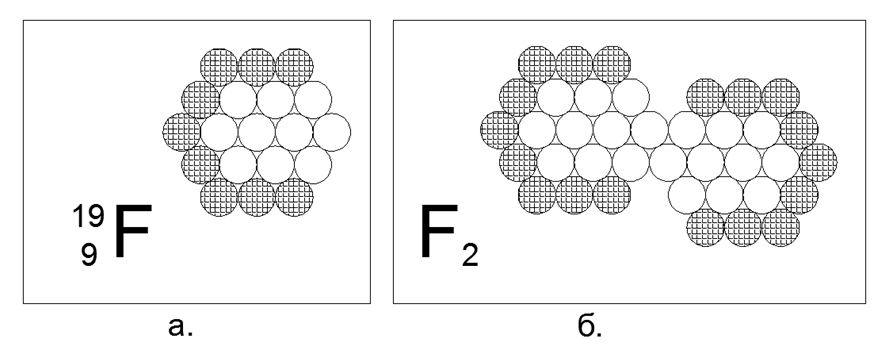
9. Fluor (199F) - 19 nucléons (9p + 10n).
Il n'y a qu'un seul isotope stable, instable en direct de quelques fractions de secondes à des unités d'heures. La forme supposée de la structure: un hexagone plat de 12 et 6 noyaux imbriqués et un 19e nucléon au centre. L'absence de nucléons chargés dans l'anneau extérieur crée une région d'attraction magnétique de trois nucléons neutres, ce qui permet de créer une molécule diatomique F2, après quoi la substance présente des propriétés gazeuses dans des conditions normales. Le gaz cryogénique de fluor-2, c'est-à-dire qu'il ne devient liquide qu'à des températures extrêmement basses (85K ou -188C), ce qui le rend similaire aux propriétés des deux gaz diatomiques précédents.
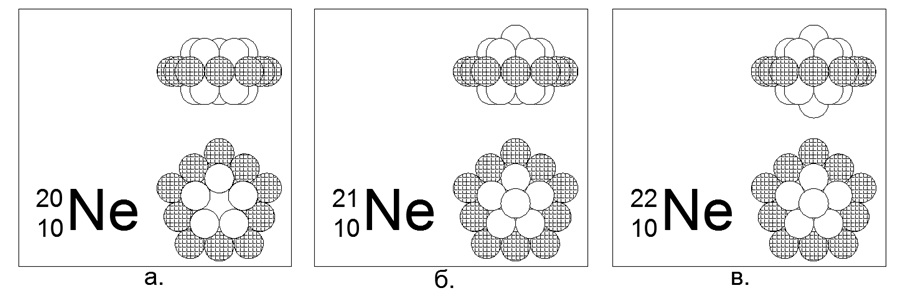
10. Néon (2010He) - 20 nucléons (10p + 10n) contenu dans la nature de 90,47%.
Isotopes stables à longue durée de vie 21He (9,25%) et 22He (0,27%). Structure du noyau estimée: anneau externe chargé de 10 nucléons plus deux anneaux internes de 5 nucléons imbriqués.
Les isotopes 21 et 22 sont créés en ajoutant un nucléon au centre de l'un des 5 anneaux de nucléon le long de l'axe.
Dans le tableau 1, les substances avec un seul isotope stable sont du plus grand intérêt, car leur structure unique ne devrait pas permettre l'absorption des noyaux supplémentaires sans introduire de distorsions dans la forme externe. Ces substances comprennent les métaux béryllium-9 (Fig. 7) et le sodium-23 (Fig. 6), l'aluminium-27, ainsi que le fluor non métallique-19, le phosphore-31.
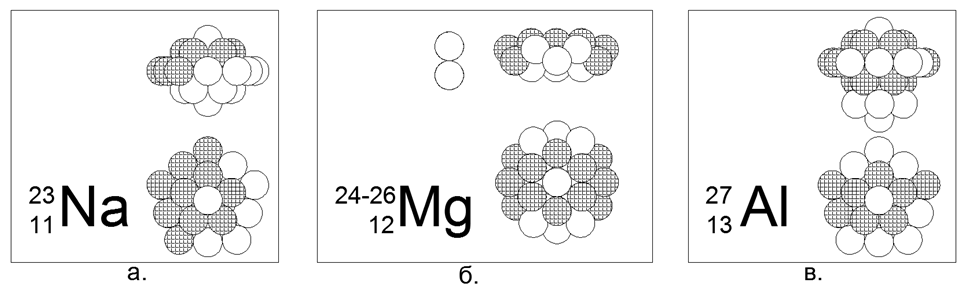
11. Sodium (2311Na) - 23 nucléons (11p + 12n) - C'est le seul isotope stable dans la nature, ce qui nous permet de choisir une configuration nucléonique unique pour lui.
À partir de 23 balles, il n'a été possible de créer qu'une seule version d'une structure dense, magnétiquement stable et symétrique, en forme d'étoile-disque. Un anneau de 10 nucléons est enroulé autour de la partie centrale de deux anneaux de 5 nucléons collés ensemble par des avions. À l'intérieur de la partie centrale entre les deux anneaux de 5 nucléons, un 21e nucléon central est entraîné. Un nucléon de plus (22e et 23e) est connecté aux côtés de la partie centrale le long de l'axe central. En général, le noyau ressemble à un yule sous forme de lentilles convexes. Du fait que les anneaux de 5 nucléons et 10 nucléons ne peuvent pas s'aligner dans un plan, la forme de l'anneau de 10 nucléons prend une forme en zigzag, tandis que les anneaux intérieurs de 5 nucléons sont légèrement séparés, ce qui permet 21- nucléon.
12. Magnésium (12Mg) - 24, 25, 26 nucléons.
Les isotopes ont une prévalence de 78,6% - 10,1% -11,3%, respectivement. Ainsi, il est évident que la forme principale est une structure en forme de disque de deux anneaux de 6 nucléons dans la partie centrale et un anneau de 12 nucléons enroulé autour. Les isotopes sont créés en entraînant un ou deux neutrons dans le tube central du disque, qui dans l'anneau à 6 nucléons correspond exactement à la taille de la boule de nucléons.
13. Aluminium (2713Al) - 27 nucléons (13p + 14n) - C'est le seul isotope stable dans la nature, ce qui vous permet de choisir une configuration de nucléon unique pour lui.
Sur 27 balles, une version axisymétrique de la structure dense magnétiquement stable d'une forme d'étoile-disque avec une multiplicité d'anneaux de 5 nucléons a été créée: un pilier central de trois anneaux de 5 nucléons et un anneau externe de 10 nucléons, et deux nucléons aux extrémités du tube central complètent le tableau. Les isotopes 28 et 29 ont une demi-vie de 2 minutes et 6 minutes, respectivement. Isotope 26 - a T1 / 2 = 717 mille ans., Et se désintègre naturellement en magnésium-26 stable par capture d'électrons (capture bêta). La synthèse continue d'Al-26 se produit dans l'atmosphère lors de la collision de protons cosmiques rapides avec des atomes d'argon.

14. Silicium (14Si) - 28, 29, 30 nucléons.
Les isotopes ont une prévalence de 92,2% - 4,7% -3,1%, respectivement. Le silicium est non métallique. Dans des conditions normales, le silicium existe sous diverses formes, et tous sont solides. Sous forme cristalline, le silicium est un semi-conducteur, ce qui le rend similaire au carbone de la période précédente.
Pour 28 nucléons, il n'y avait pas de formes régulières à partir d'une rangée cylindrique, ce qui a permis de rechercher un modèle d'atome possible dans une série de plaques polyédriques, telles que le carbone et l'azote. Ainsi, 28 nucléons sont obtenus à partir de deux atomes d'azote planaires hexagonaux reliés par des plans.
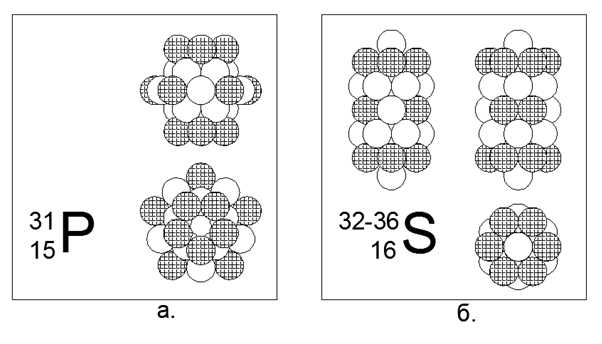
15. Phosphore (3115P) - 31 nucléons.
Le seul isotope stable. Non métallique. Structure estimée: quatre anneaux de 5 nucléons dans le tube central et un anneau extérieur de 10 nucléons au milieu du tube central, ce qui donne 30 nucléons, et 31 nucléons sont entraînés au centre de l'anneau de 10 nucléons, où une cavité apparaît en raison de l'accostage non plan 10 Anneaux à 5 et 5 nucléons. Les charges sont situées sur 5 pièces aux extrémités du tube central et cinq plus uniformément autour de l'anneau externe de 10 nucléons.
16. Soufre (16S) - possède quatre isotopes stables de 32, 33, 34 et 36 nucléons.
Les isotopes ont une prévalence de 95,013% - 0,75% -4,215% -0,017%, respectivement. Le soufre n'est pas métallique. Nous supposons que la forme principale est une structure cylindrique de cinq morceaux de 6 noyaux, dans le tunnel central duquel sont placés des nucléons isotopiques supplémentaires. Pour l'isotope rare du soufre-36, la structure devient obscure, car deux nucléons supplémentaires ne rentrent presque même pas à l'intérieur du tube central. Le soufre-36 remplit non seulement complètement le tube intérieur du cylindre, mais dépasse également des nucléons au-delà des frontières de la partie extérieure cylindrique. Cette configuration donne des propriétés typiquement non métalliques de la substance, c'est-à-dire avec des points de fusion et d'ébullition relativement modérés proches des conditions normales.
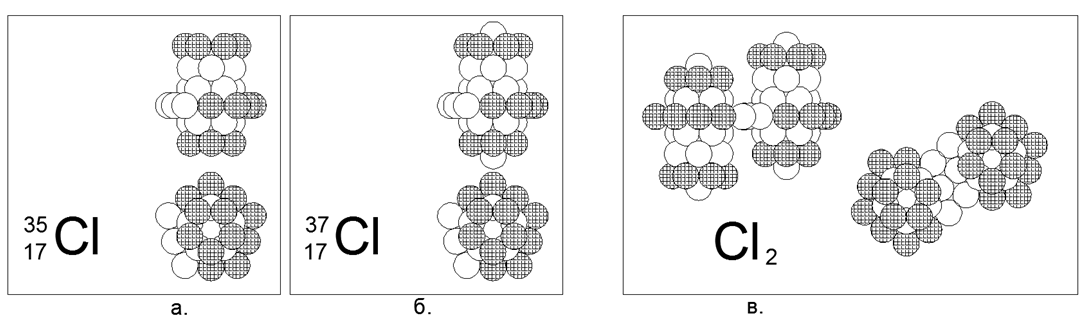
17. Chlore (17Cl) - possède deux isotopes stables de 35 et 37 nucléons.
Les isotopes ont une prévalence de 75% et 25%, respectivement. Le chlore est un gaz non métallique et diatomique dans des conditions normales. Nous supposons que la forme principale du gaz est un large anneau de 10 nucléons incomplètement chargé avec une structure cylindrique imbriquée de trois anneaux de 5 nucléons le long de l'axe où les anneaux d'extrémité du tuyau sont entièrement chargés. Pour l'isotope lourd Chlor-37, un nucléon est en plus attaché aux extrémités du cylindre principal. Le chlore-36 est radioactif avec T1 / 2 = 301 mille ans. Le chlore instable-36 est possible à la fois dans la version avec un nucléon à l'extrémité ouverte du tuyau central et avec un anneau de 10 nucléons entraîné au centre. Avec la proximité des nombres de masse de chlore et de soufre, qu'il existe même des intersections mutuelles du nombre d'isotopes (isobares), la structure du noyau s'avère fondamentalement différente. La différence de structure du noyau se reflète également dans la forte différence de propriétés chimiques et physiques.
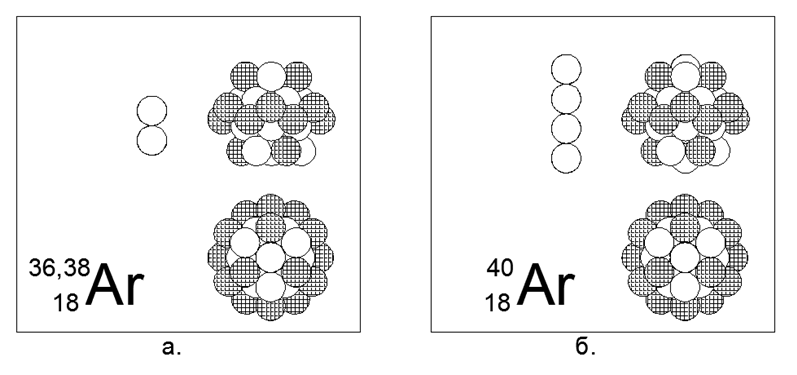
18. Argon (18Ar) - possède trois isotopes stables 36, 38 et 40 nucléons.
Les isotopes sur Terre ont une prévalence de 0,337% - 0,063% -99,6%, respectivement, bien que la distribution dans l'espace soit complètement différente. Sur Terre, tout l'Argon-40 est dérivé du Potassium-40 radioactif en décomposition. L'argon est un gaz inerte. On peut supposer que la forme principale est une structure cylindrique de quatre morceaux de 6 noyaux annulaires, dans le tunnel central, où 2 ou 4 nucléons supplémentaires d'isotopes massifs sont placés, et un anneau de 12 nucléons entièrement chargé est placé au-dessus du tube central. Un anneau extérieur entièrement chargé similaire est une caractéristique des gaz inertes, selon le modèle théorique développé de l'Atom-Nucleus.
L'argon-36 est un isobare du soufre-36 (la deuxième paire du tableau périodique), mais les structures de la forme principale sont sensiblement différentes. On peut supposer que l'un des métaux alcalins suivants, à savoir le potassium ou le calcium, se révélera être proche de l'argon dans la structure du noyau.
Totaux.
L'augmentation progressive de la masse atomique avec une augmentation linéaire du nombre de nucléons chargés selon le tableau périodique a permis de construire une série cohérente de solutions structurelles des Structures-Architectures atomiques d'éléments chimiques qui sont liées à leurs propriétés physiques et chimiques. Les modèles de noyaux-atomes d'éléments comme exigence obligatoire incluent la capacité de construire tous les isotopes stables sans changement radical de la forme de l'atome.
La principale conclusion obtenue à ce stade est l'idée suivante:
Malgré la différence de propriétés chimiques des substances proches du tableau (par exemple: gaz inerte et métal alcalin qui le suit), elles ne différeront structurellement que par l'emplacement des nucléons chargés sur le périmètre extérieur de l'atome ou dans les rangées intérieures. Ainsi, un changement périodique des propriétés est associé à une transition en douceur de la concentration des nucléons chargés de la zone intérieure du noyau vers l'extérieur.