
De quel bureau dans n'importe quel hôpital les enfants et parfois les adultes crient-ils de temps en temps? Quels parents nous trompent effrontément dans l'enfance par rapport à une piqûre de moustique? Je pense que vous avez déjà deviné qu'il s'agit d'un test sanguin. Maintenant, cette procédure est devenue plus rapide et moins douloureuse. Une chose n'a pas changé - son importance. Le diagnostic en médecine joue le rôle le plus important dans les premiers stades de la lutte contre une maladie. Après tout, pour vaincre une maladie, il faut d'abord la découvrir. Après avoir survécu à la procédure de prélèvement sanguin pour analyse, vous êtes parti calmement en attente de ses résultats. En ce moment dans les laboratoires, les personnes utilisant des appareils complexes, encombrants et très chers analysent votre sang, découvrant ce qu'il contient et en quelle quantité. C'est bien d'avoir un tel laboratoire dans votre hôpital local, mais ce n'est pas toujours le cas. Mais que se passerait-il s'il existait un laboratoire de poche, petit et peu coûteux, mais analysant en même temps les échantillons avec la même précision et efficacité qu'un laboratoire ordinaire? Cela ressemble à de la science-fiction, non? L'expression «analyseur de glycémie de poche» en son temps sonnait également futuriste. Aujourd'hui, nous allons découvrir la recherche et la mise en œuvre de la technologie d'analyse quantitative des protéines et des acides aminés à travers un nouveau type d'appareil compact. En quoi consiste ce miracle, comment fonctionne-t-il et quelle est son efficacité? Nous recevrons des réponses à ces questions et à d'autres dans le rapport des scientifiques. Allons-y.
Base d'étude
Nous vivons à l'ère de la technologie numérique, qui est mise en œuvre avec succès dans divers domaines de notre vie. Les études de laboratoire (diagnostic) ne font pas exception. Les scientifiques notent que l'analyse numérique de goutte à goutte est 1000 fois plus précise que la traditionnelle et permet à des millions d'analyses d'être effectuées en parallèle dans une seule goutte d'un échantillon avec un volume mesuré en femtolitres (fl, 1 fl =
10-15 L).
L'utilisation de l'analyse numérique est extrêmement utile pour détecter les acides nucléiques et les protéines, analyser les cellules individuelles et même les exosomes.
Exosomes * - vésicules extracellulaires (diamètre: 30-100 nm), qui sont sécrétées par les cellules dans l'espace intercellulaire. Les exosomes participent au travail de l'immunité, de la sécrétion de protéines, etc.
À l'heure actuelle, les méthodes d'analyse numérique les plus célèbres sont le dELISA (dosage immuno-enzymatique numérique / DIA) et le qPCR (réaction en chaîne par polymérase numérique). Ces techniques vous permettent de travailler avec des cellules individuelles, tout en obtenant des résultats très précis qui ne nécessitent pas de correction. Si récemment, en utilisant ces méthodes, une analyse quantitative réussie des protéines et de l'ARNm dans une cellule en même temps a été réalisée.
Des techniques similaires et une démonstration de leurs talents montrent une fois de plus que la mise en œuvre d'une analyse parallèle dans un environnement extrêmement restreint (échantillon) est tout à fait possible. Cependant, comme toute autre technologie, ces méthodes présentent également des inconvénients. Ils sont assez triviaux - dimensions, prix et complexité de fabrication. Les chercheurs nous rappellent qu'une installation pour un amplificateur numérique (Simoa de Quanterix) coûte environ 100 000 $. Et toutes les cliniques privées ne peuvent pas se permettre un tel montant, je suis déjà silencieux sur celles de l'État.
Bien sûr, cette "bête" Simoa de Quanterix est très puissante, si elle est exagérée. Il utilise des comprimés à microcellules de 200 000 cellules de 40 fl chacune.
 Le simoa de Quanterix
Le simoa de QuanterixDans le même temps, cet appareil peut traiter en parallèle jusqu'à 4 comprimés ELISA de 96 cellules chacun. Ainsi, un appareil est capable de produire les résultats de 66 échantillons en une heure, chacun pouvant être soumis à une analyse 10 plex (c'est-à-dire qu'un échantillon est analysé pour 10 indicateurs à la fois). Les chiffres sont vraiment incroyables. Mais encore une fois, la question se pose du prix et des dimensions d'une telle machine miracle.
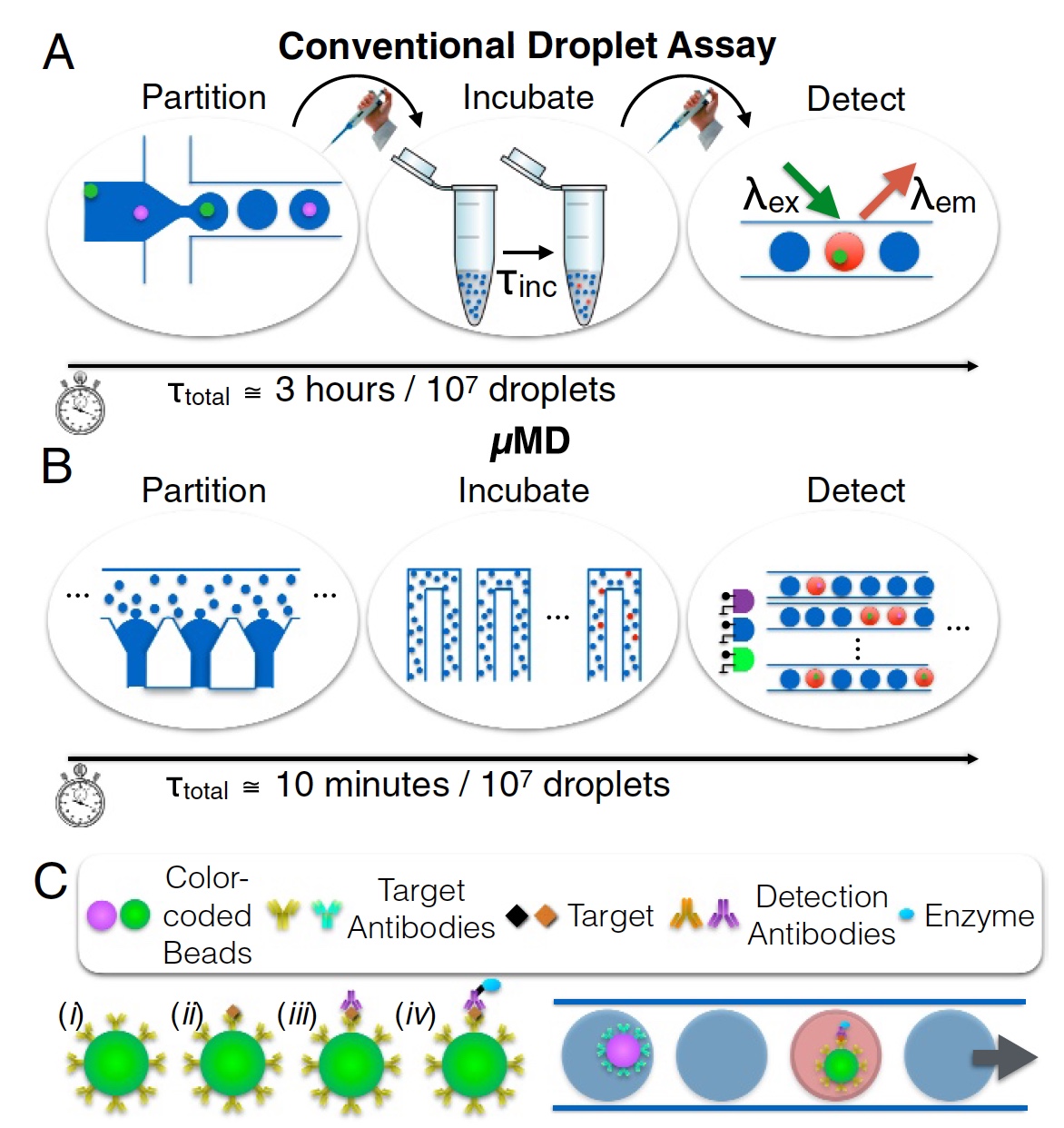 Image n ° 1
Image n ° 1Et ici, les scientifiques proposent de tourner leurs yeux vers les systèmes de gouttelettes microfluidiques. Les systèmes classiques de ce type ne peuvent pas se targuer de performances colossales Simoa de Quanterix, cependant, ils peuvent servir de base à un nouvel appareil. La technique des gouttelettes microfluidiques à flux continu peut théoriquement analyser jusqu'à 1 million de cellules. Cependant, dans la pratique, ces indicateurs n'ont pas encore été atteints pour plusieurs raisons. Premièrement, le débit (moins de 104 gouttes par seconde), lorsque les gouttes sont générées séquentiellement (pas en parallèle) et sont monodisperses. Deuxièmement, la détection de la fluorescence de chaque goutte est effectuée en les faisant passer une à une à travers un spot laser. En d'autres termes, tout est en ligne, un à la fois. Ce processus est illustré sur l'image
1a (séparation, incubation et détermination; 3 heures pour l'analyse de 10
7 gouttes).
Les principaux problèmes de conversion de cette méthode dans un format compact sont la difficulté de paralléliser l'optique pour la détection multicolore de la fluorescence, la complexité de l'intégration du processus de préparation des échantillons et la nécessité de certains outils pour générer des flux de gouttelettes strictement contrôlés. Cependant, les scientifiques ne sont pas habitués à abandonner face aux difficultés, aussi impressionnantes soient-elles.
Micro-drop Megascale Detector (MD, macro détecteur) est la création de nos héros aujourd'hui. Cet appareil peut non seulement être implémenté dans n'importe quel appareil mobile (de poche), mais répond également aux normes d'analyse quantitative des laboratoires ordinaires de grande taille. Le processus est illustré sur l'image
1b (séparation, incubation et détermination; 10 minutes pour l'analyse de 10
7 gouttes).
Pour y parvenir, selon les chercheurs, trois tâches principales ont été mises en œuvre:
- Au lieu de générer 1 goutte chacune, une génération parallèle de gouttelettes microfluidiques a été utilisée, fonctionnant 100 fois plus rapidement. Et les réalisations de collègues scientifiques dans le domaine de la production de gouttes monodispersées ( lien vers cette étude ) ont permis de s'affranchir de la dépendance de la monodispersité des gouttes sur le débit. Cela permet l'utilisation de pompes péristaltiques très peu coûteuses qui peuvent être intégrées dans un appareil mobile (portable).
- La lecture rapide de la fluorescence des gouttelettes à une vitesse de plus de 105 par seconde (rappelez-vous la limite de 104, que j'ai mentionnée ci-dessus) a été obtenue grâce à la visualisation basée sur un téléphone mobile, qui est 100 fois plus rapide que la lecture conventionnelle (lorsque les gouttes sont lues à tour de rôle). Dans ce cas, il n'y a pas besoin d'optiques coûteuses et la mise en œuvre dans les appareils mobiles portables est évidente. La principale caractéristique distinctive de cette innovation est la capacité de surmonter les limites du faible taux de trame des images numériques et de fournir une détection de fluorescence multicolore en modulant plusieurs sources d'excitation de LED ou de diodes laser de différentes couleurs avec des signaux non périodiques uniques. La vidéo peut être décodée pour obtenir des données de fluorescence des gouttelettes, dépassant les limites de fréquence d'images de la caméra. Ainsi, il est possible d'atteindre les mêmes (mentionnés plus haut) de 1 million de gouttes par seconde.
- Et enfin, l'intégration d'une unité de traitement des microgranules (ou microbilles, objets sphériques microscopiques), d'un générateur de gouttelettes, de lignes à retard de signal pour l'incubation des gouttelettes et d'un détecteur de fluorescence. Dans l'ensemble, cela fournit un dispositif peu coûteux, compact et efficace pour l'entrée de sérum non traité (échantillon) et la sortie de données moléculaires (résultat).
Pour démontrer leur invention, les scientifiques ont mis en œuvre un DIGA multiplexé utilisant des microgranules de différentes couleurs obtenus à partir de colorants fluorescents. Chaque couleur est le «code» de couleur de la protéine à laquelle l'anticorps microbille est destiné (
1c ).
Une analyse multiplexe de GM-CSF sérique et d'IL6 dans le sérum a été réalisée en utilisant des granules fluorescents ultraviolets et verts, lorsque les gouttes contenaient un microgranule avec un immunocomplexe rouge fluorescent. Le sérum bovin a été utilisé comme milieu pour l'analyse quantitative, et la limitation de la détermination était de 0,004 pg / ml (picogramme par millilitre, 1 pg = 10
-12 g). Ceci est 1000 fois plus précis que l'ELISA standard et correspond au niveau de précision de l'ELISA numérique.
Il ne faut que 10 minutes pour traiter 10 millions de gouttes. Dans ce cas, le processus lui-même comprend la génération et l'incubation de gouttes, ainsi que la détection de gouttes fluorescentes pour chaque échantillon.
Structure de l'appareil et processus d'analyse
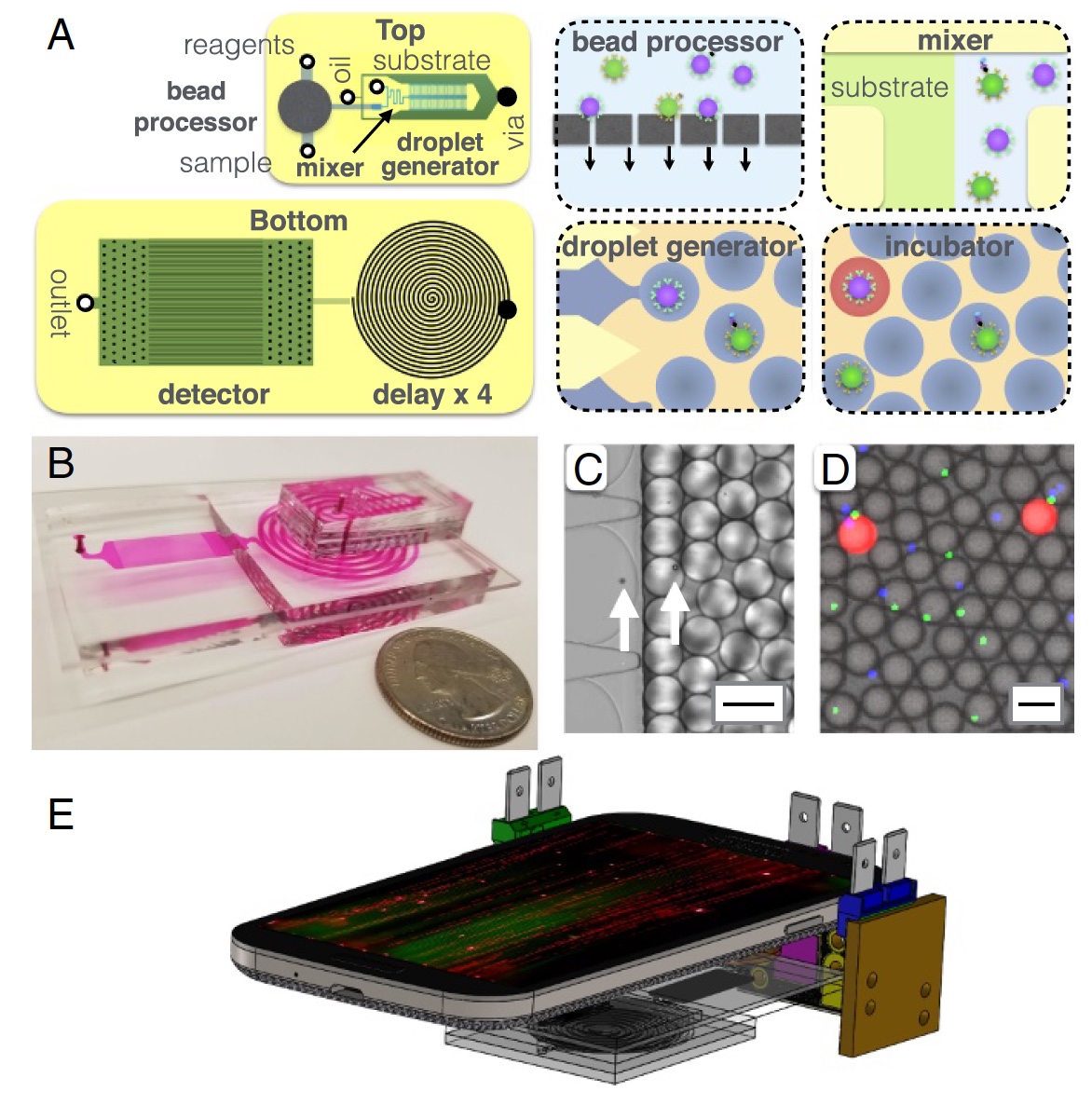 Image # 2: Structure du dispositif MD.
Image # 2: Structure du dispositif MD.Un peu plus sur l'image ci-dessus:
2a - diagramme à puce, vue de dessus et de dessous;
2b est une photo d'une puce MD dans laquelle tous les canaux optofluides sont visibles;
2c est une micrographie du processus d'encapsulation de microbilles dans des gouttelettes d'un diamètre de 40 µm;
2d est une micrographie de fluorescence de gouttes après une ligne à retard;
2e est une représentation schématique d'une plate-forme MD (téléphone mobile, 3 sources lumineuses et la puce MD elle-même).
Les principaux composants de la DM peuvent être appelés un processeur de microgranules, où ce dernier capture les protéines cibles du sérum. Après cela, les granules sont marqués avec des immunocomplexes pour une amplification ultérieure à l'intérieur des gouttelettes. Entre chacun de ces processus, un nettoyage itératif (plusieurs fois) a lieu. Un générateur de gouttelettes est également présent, où les microgranules sont mélangés avec un substrat enzymatique et encapsulés dans des gouttelettes eau-huile.
Vient ensuite un canal microfluidique à travers lequel les gouttelettes passent pendant 3,2 minutes. Ce canal est nécessaire comme retard / décélération du processus, ce qui permet d'amplifier par voie enzymatique le signal fluorescent. La dernière partie est un détecteur (ou scanner) basé sur un téléphone mobile (appareil photo), où la fluorescence des gouttelettes est détectée.
Le processeur de microgranules se compose d'une membrane semi-perméable pour immobiliser les granules. Plusieurs réactifs et tampons de lavage sont délivrés aux granulés immobilisés. Après cela, les granules sont libérés pour une analyse plus approfondie.
La membrane elle-même est en polycarbonate. Une piste gravée de 300 mm
2 avec des pores de 3 µm de diamètre a été gravée sur la membrane.
Dans cette expérience, il y avait deux groupes de microgranules: (d = 5,4 μm, ex / em = 470/490 nm, CFH-5052-2), fonctionnalisés avec un anticorps anti-GM-CSF (MAB2172) et (d = 4,5 μm, ex / em = 370/410 nm, CFP-4041-2) fonctionnalisé avec un anticorps anti-IL6 (MAB206).
Tout d'abord, les microgranules passent par le processus d'incubation avec l'échantillon pendant 1 heure, et seulement après cela, ils sont capturés sur la membrane mentionnée ci-dessus.
A ce stade (au sein de la membrane), les granulés sont lavés avec 1 ml de tampon T20 à un débit de 10 ml / h, incubés avec 0,1 ml d'anticorps de détection 0,7 nM dans du tampon T20 pendant 0,5 heure, lavés à nouveau dans 1 ml de tampon T20 à 10 ml / h, puis ils sont libérés de la membrane en changeant le débit à 6 ml / h.
Après cela, les microbilles libérées sont mélangées avec un substrat ELISA et encapsulées dans des gouttelettes d'un diamètre de 40 μm. Pour assurer un mélange précis des granulés et du substrat et pour minimiser le signal de fond des enzymes générant un signal fluorescent, un canal spécial d'une longueur de 14 mm est utilisé.
Le générateur de gouttelettes est conçu pour que le diamètre des gouttelettes soit indépendant du débit. Cet appareil ne possède que 100 de ces générateurs, qui en sortie donnent un débit de 100 000 gouttes par seconde.
Chaque goutte est encapsulée avec 1 granule ou reste intacte. Dans le même temps, une certaine concentration est atteinte - 10 gouttes de plus que les microgranules (par exemple, 20 gouttes - 10 avec des granules et 10 sans). Cela réduit la probabilité que dans une goutte il y ait deux granules jusqu'à 0,5%.
Après les générateurs de gouttelettes, il y a une ligne à retard semblable à une spirale avec une largeur de canal de 1,8 mm et une hauteur de 1,5 mm. La ligne à retard doit être suffisamment longue, mais vous ne pouvez pas augmenter la taille de l'appareil. Par conséquent, 4 spirales ont été faites une à une, pour passer complètement qui, à un débit de 67 ml / h, les gouttes prendraient 3,2 minutes.
Pour introduire un tel appareil dans une plateforme mobile, il a fallu résoudre certaines tâches liées à la caméra du téléphone. L'utilisation d'une excitation lumineuse à constante de temps habituelle conduit au fait que les gouttelettes se déplaçant dans le champ de vision de la caméra sont visualisées sous forme de rayures. La longueur de cette bande fixe la distance minimale entre les gouttelettes et limite ainsi sérieusement le débit.
Si nous utilisons une excitation lumineuse avec une séquence pseudo-aléatoire (dans le temps), cela nous permettra de «voir» les gouttes individuelles. La vitesse de modulation de la lumière est de 10 fois le temps d'exposition de la caméra. En raison de cette différence, les gouttelettes forment des bandes dont la distance (trois diamètres de gouttelettes) est suffisante pour leur détermination individuelle. Dans ce cas, vous pouvez ignorer 120 canaux d'égouttement parallèles devant la caméra.
Un autre point important dans la détection et le balayage est la fluorescence. Pour réaliser un ELISA multiplex, plusieurs signaux fluorescents différents sont nécessaires, pour cela 3 sources lumineuses ont été utilisées à la fois, chacune ayant la longueur d'onde nécessaire pour exciter un certain colorant fluorescent. Ce triple système se compose de deux lasers à diodes (bleu, vert) et d'une LED (UV).
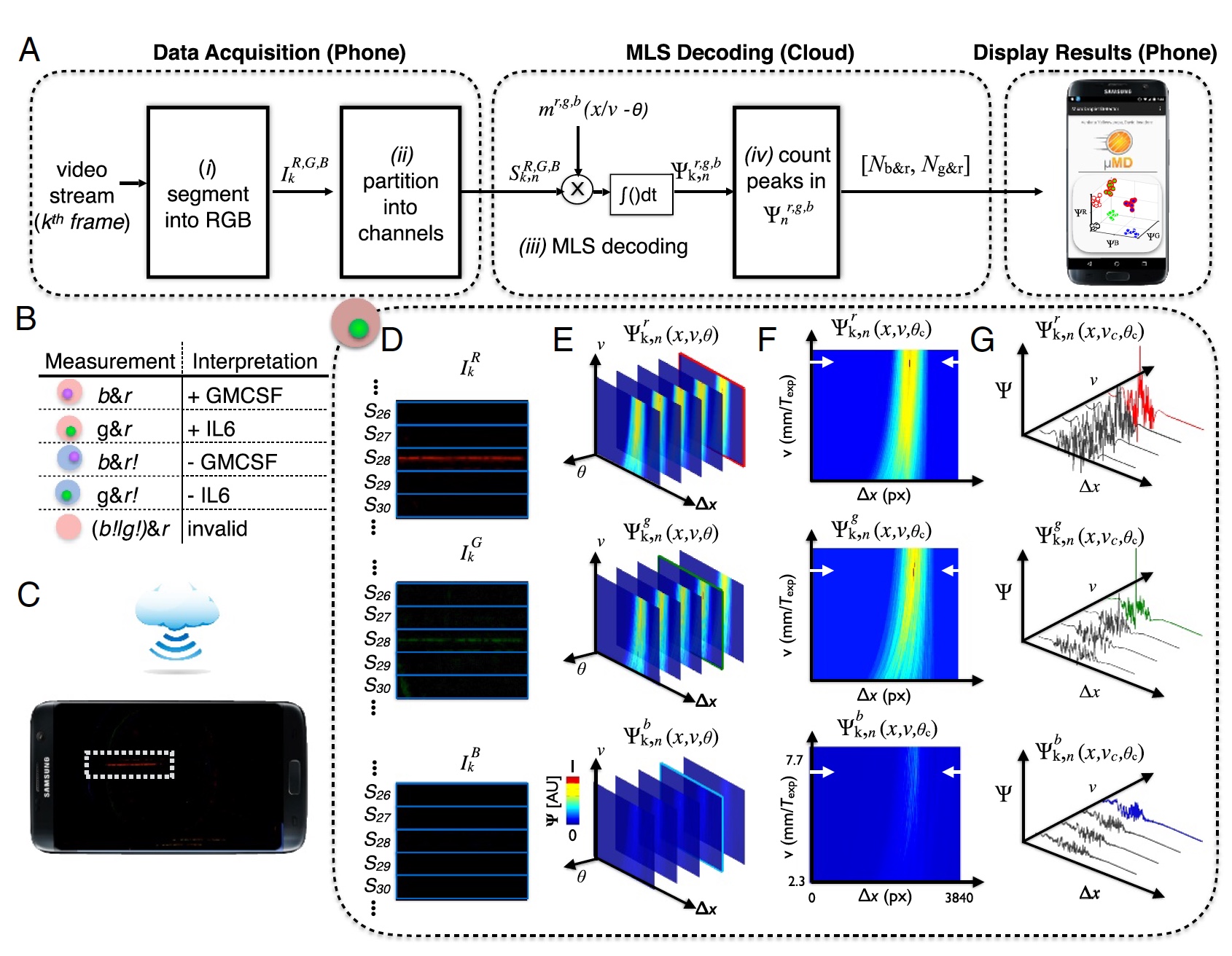 Image n ° 3: processus «échantillon-résultat» (décodage des données de l'appareil photo du téléphone).
Image n ° 3: processus «échantillon-résultat» (décodage des données de l'appareil photo du téléphone).Pour décoder avec précision la vidéo de la caméra du téléphone, il a été nécessaire d'effectuer une détection de corrélation pour les trois motifs de modulation attendus (
m ) qui correspondent à chacune des trois sources de lumière.
Le résultat était un vecteur de corrélation (
3a ), où:
k - trames;
n = 1: 120 canaux dans l'appareil;
R ,
G ,
B - canaux de couleur de l'appareil photo numérique;
r ,
g ,
b - excitation des couleurs.
Le motif de gouttelettes a été créé par une séquence de longueur maximale (MLS) avec | m | = 63 bits. De plus, chaque bit fait 10 pixels dans une image numérique, c'est-à-dire qu'un total de 63 bits fait 630 pixels (1/3 d'une trame de large en 1920).
Un balayage de fluorescence est nécessaire pour déterminer si une goutte contient un microgranule, si c'est le cas, pour déterminer la couleur (UV ou vert - protéine, rouge - molécule cible). Après avoir reçu ces données, elles doivent être extraites. Pour ce faire, l'image vidéo est divisée en composants rouges, verts et bleus conformément aux capteurs de la caméra (
3d ).
Cet appareil utilisait la technologie cloud. Cela a été fait pour réduire la charge sur le fer (c'est-à-dire sur le téléphone lui-même). Au lieu de contrôler la vitesse ou la phase des gouttelettes, le cloud computing a été effectué pour déterminer les gouttelettes avec une phase ou une vitesse inconnue (
3s ). Après avoir déterminé les phases optimales et la vitesse des gouttelettes, on peut déterminer avec précision les pics dans l'espace de corrélation Ψ
r, g, b k, n (x, υ
c , θ
c ) (
3f et
3g ).
Les données collectées sont téléchargées vers une application spéciale (jusqu'à présent uniquement sur le système d'exploitation Android), qui les envoie au cloud pour un traitement à l'aide de MATLAB sur un serveur distant. Après cela, les données déjà traitées sont retournées au smartphone et affichées à l'écran.
Après tous les travaux préparatoires et d'essais, les scientifiques ont décidé de mener un «combat» avec la participation de leur création et du dispositif commercial existant Simoa.
Dans le duel d'essai, trois versions du milieu de travail ont été utilisées: PBS - tampon phosphate de sodium, FBS - sérum bovin fœtal et sérum sanguin humain. L'indicateur le plus important était la limite de détection (LOD), c'est-à-dire la teneur minimale de l'analyte dans l'échantillon.
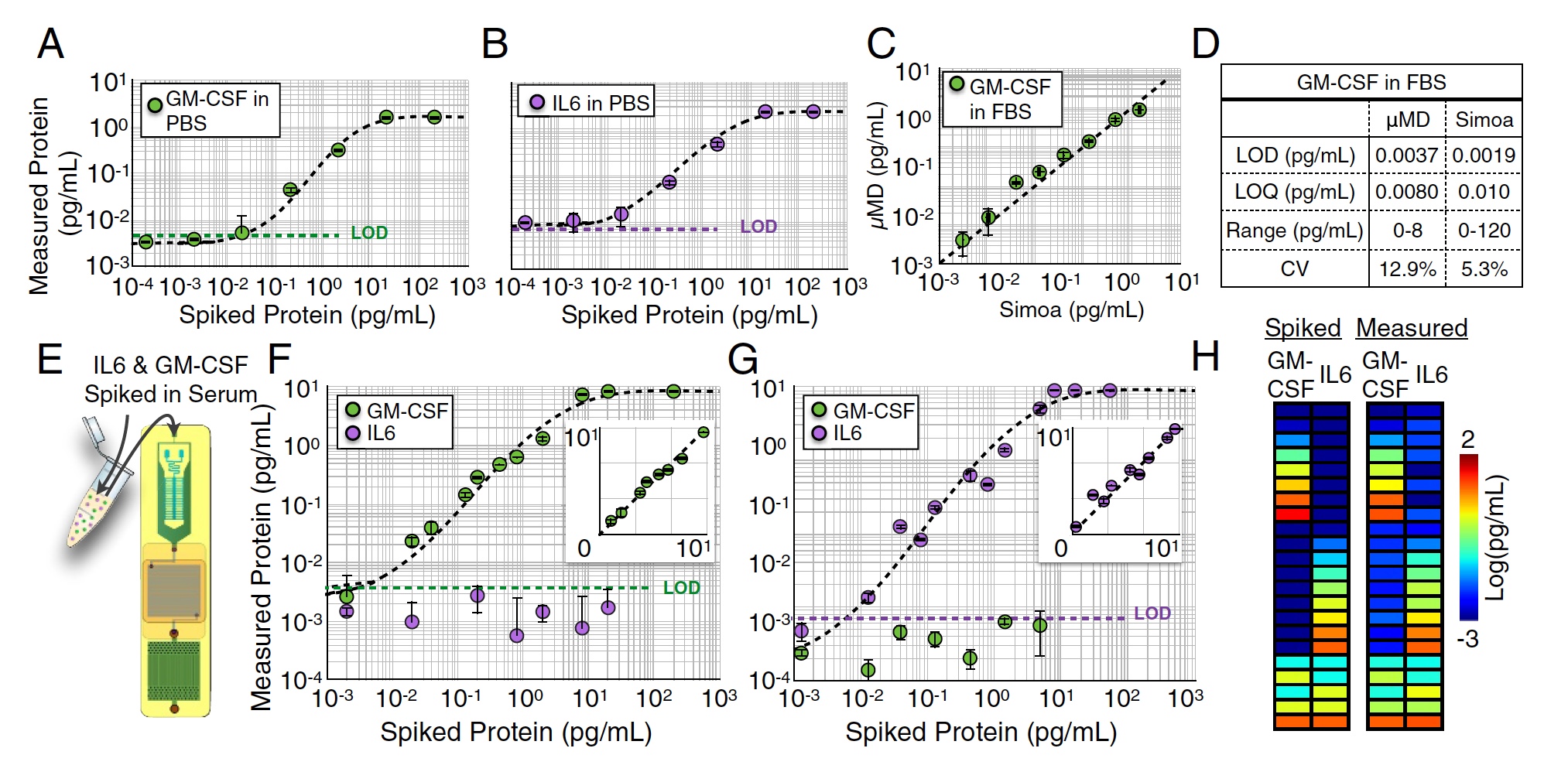
Résultats des tests sur puce MD.
Plusieurs mesures simples du M-CSF (image
A ci-dessus) et de l'IL6 (image
B ) ont été effectuées dans du milieu PBS en mesurant des dilutions en série de 104 à 102 pg / ml. Dans ce test, de très bonnes limites de détection ont été obtenues: LOD = 0,0045 pg / ml pour GM-CSF et LOD = 0,0070 pg / ml pour IL6.
Des mesures similaires ont également été effectuées dans une solution FBS (1: 4). À ce stade, l'échantillon à analyser était divisé en deux entre le dispositif à l'étude et le Simoa commercial "lourd". En conséquence, la création de scientifiques a montré d'excellents résultats, qui n'étaient pratiquement pas inférieurs à ceux de Simoa (R2 = 0,95, image
C ci-dessus).
Mais c'était une analyse un plexe, c'est-à-dire une analyse d'un indicateur. Maintenant, il était nécessaire de vérifier comment la puce MD fera face à l'analyse parallèle de plusieurs protéines, c'est-à-dire à l'analyse duplex de GM-CSF et d'IL6 simultanément. Pour commencer, une certaine quantité de GM-CSF a été ajoutée au FBS, et la concentration d'IL6 était nulle (images
F et
G ). Ensuite, l'inverse a été fait: concentration nulle de GM-CSF et d'IL6.
Dans les deux cas, la limite de détection ne différait pas beaucoup des résultats de l'analyse un-plex réalisée précédemment (p> 0,88 pour GM-CSF et p> 0,90 pour IL6).
Après cela, une certaine quantité de GM-CSF et d'IL6 (image h) a été ajoutée à l'échantillon. La précision de détection était excellente - R2> 0:99 pour GM-CSF et R2> 0:99 pour IL6.
Le test le plus significatif a été l'analyse du sérum humain. Des échantillons de sang ont été prélevés sur 14 sujets. Les chercheurs ont quantifié le GM-CSF et l'IL6 de ces échantillons à l'aide d'une puce MD et Simoa.
 Résultats quantitatifs du sérum humain GM-CSF et IL6 en utilisant MD et Simoa.
Résultats quantitatifs du sérum humain GM-CSF et IL6 en utilisant MD et Simoa.Les résultats de l'analyse utilisant la puce MD se sont avérés très proches des résultats de Simoa (R2 = 0: 96), qui est actuellement l'analyseur le plus précis.
Démonstration de l'appareil.Pour une connaissance plus détaillée des nuances et des détails de l'étude, je vous recommande de consulter le
rapport du groupe de recherche et
les documents supplémentaires qui s'y rapportent.
Épilogue
La vitesse joue un rôle énorme en médecine. Plus le diagnostic est rapide et précis, plus vous pouvez commencer le traitement rapidement. Parfois, ce ne sont même pas des jours, mais des minutes qui ne peuvent pas être perdues. , - . , , .
, MD, , . , , , . 500 . - 5.
, . .
, , .
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir des matériaux plus intéressants? Soutenez-nous en passant une commande ou en le recommandant à vos amis, une
réduction de 30% pour les utilisateurs Habr sur un analogue unique de serveurs d'entrée de gamme que nous avons inventés pour vous: Toute la vérité sur VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbps à partir de 20 $ ou comment diviser le serveur? (les options sont disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbit / s jusqu'à l'été gratuitement lorsque vous payez pour une période de six mois, vous pouvez commander
ici .
Dell R730xd 2 fois moins cher? 2 Intel Dodeca-Core Xeon E5-2650v4 128GB DDR4 6x480GB SSD 1Gbps 100 $249 ! Pour en savoir plus sur la
création d'un bâtiment d'infrastructure. classe utilisant des serveurs Dell R730xd E5-2650 v4 coûtant 9 000 euros pour un sou?