La publication précédente a reçu une évaluation négative avec la formulation «pourquoi publier des choses aussi élémentaires ici». Par conséquent, je préviens immédiatement que ce matériel est destiné principalement aux écoliers qui commencent à étudier la chimie. Et aussi pour ceux qui ne comprenaient pas ce sujet pendant leurs années scolaires. Je publierais un article sur une ressource spécialisée populaire pour les écoliers si elle existait.
Et oui, je connais l'existence d'un modèle atomique dans lequel l'électron est une onde de probabilité située à proximité du noyau. Mais, en règle générale, il est difficile pour un étudiant d'imaginer comment la probabilité peut combiner des atomes en molécules. Par conséquent, je déclare «sur les doigts».
La connexion des atomes en moléculesNotre monde n'existe pas sous forme d'atomes séparés, ils se connectent en quelque sorte les uns aux autres. Lequel?
Prenez deux atomes d'hydrogène. Chacun d'eux contient un proton et un électron, donc la charge totale de chacun de ces atomes est nulle.
Loi pendante
F = k * q1 * q2 / r ^ 2nous dit que les corps neutres ne doivent pas être attirés les uns vers les autres
(q1 = 0, q2 = 0) .
Ainsi, l'hydrogène (et tout autre élément chimique) ne devrait exister que sous forme d'atomes, et ne jamais se combiner en molécules. En fait, les atomes d'hydrogène se combinent toujours par paires. Pourquoi?
Prenons deux morceaux de métal et organisons-les en parallèle à une petite distance l'un de l'autre.

Les deux segments contiennent le même nombre de protons et d'électrons, par conséquent, la charge totale de chacun d'eux est égale à zéro. Donc, ils n'ont aucune raison d'attirer mutuellement.
Nous savons que dans les métaux, une partie des électrons externes quitte leurs atomes et se déplace librement entre les ions (atomes abandonnés) du réseau cristallin du métal. Et ces électrons sont distribués, en moyenne, uniformément.
Imaginez que nous avons réussi à déplacer une partie de ces électrons libres vers le côté gauche du segment inférieur du métal. De plus, dans son côté droit, il y aura un déficit d'électrons.

Nous avons obtenu le soi-disant dipôle: le côté gauche du segment est chargé négativement, le droit est positif. Super. Et que se passera-t-il dans le segment supérieur? Nous savons que les mêmes charges se repoussent, tandis que les opposées s'attirent. Par conséquent, les électrons du segment supérieur, à partir des champs électriques des électrons du segment inférieur, iront du côté droit. Autrement dit, l'image de la distribution des électrons dans ces deux segments de métaux deviendra un miroir:
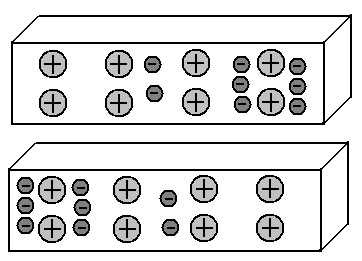
Cet effet des objets chargés sur les objets voisins, conduisant à une redistribution des charges en eux, est appelé induction électrostatique.
Maintenant, la chose la plus intéressante: les noyaux atomiques chargés positivement dans le côté gauche du segment supérieur étaient des électrons opposés collectés dans le côté gauche du segment inférieur. Et les charges opposées sont attirées. Ainsi, les parties gauches des segments commenceront à s'attirer!
La même chose se produira sur le côté droit des segments - uniquement en miroir. Et les extrémités droites des segments seront également attirées les unes vers les autres. Merveilleux, non? La redistribution des charges à l'intérieur d'un des segments des conducteurs a conduit à l'attraction mutuelle de ces deux segments!
Mais que se passe-t-il si nous déplaçons maintenant les électrons libres du segment inférieur vers son extrémité droite? Ensuite, les électrons libres du segment supérieur se déplaceront vers l'extrémité gauche. Autrement dit, en déplaçant les électrons d'avant en arrière dans l'un des segments, nous faisons bouger les électrons du segment voisin, qui n'est en aucun cas connecté avec le premier! Un tel effet du mouvement des électrons dans un conducteur sur le mouvement des électrons dans un conducteur adjacent est appelé induction électrodynamique.
Bien que cela ne s'applique pas à notre sujet, nous notons que nous avons étudié sous une forme quelque peu simplifiée le fonctionnement de l'antenne et du récepteur pendant la transmission radio.
Nous pouvons organiser ces deux pièces de métal différemment - avec les extrémités se faisant face:

Si nous pouvons déplacer les électrons, par exemple, vers le côté droit du segment gauche, les électrons du segment droit, à partir d'eux, se déplaceront également vers le côté droit du segment droit:

Et dans ce cas, ces deux morceaux de métal vont commencer à s'attirer, puisque leurs extrémités proximales ont la charge opposée. Il convient de noter en particulier que dans la deuxième variante de la disposition des segments, la force de leur attraction mutuelle sera plus faible, car seules leurs extrémités opposées sont attirées, tandis que dans la première variante de la disposition des segments, la gauche et la droite sont attirées l'une vers l'autre les fins.
Mais comment est-ce lié à la liaison des atomes? Regardons l'atome d'hydrogène. Il a un électron se déplaçant autour du noyau. Et si le deuxième atome d'hydrogène est à proximité, cet électron fera bouger l'électron du voisin de la même manière qu'il se déplaçait dans nos segments métalliques - tandis que l'électron de l'un des atomes est d'un côté du noyau de son atome, celui voisin sera forcé de se trouver du côté opposé de son atome.
Ici, bien sûr, l'influence n'est pas unilatérale, mais mutuelle - à la fois le premier électron affecte le second et le second affecte le premier. Mais le plus important est que ces deux atomes seront attirés de la même manière que deux morceaux de métal ont été attirés dans la deuxième variante de leur arrangement mutuel (avec des extrémités se faisant face).
L'essence est la même: les électrons sont éloignés les uns des autres, ce qui permet aux charges opposées d'être attirées les unes vers les autres. Imaginez que l'électron de l'un des atomes se trouvait entre les noyaux de deux atomes voisins, tandis que l'électron de l'atome voisin était au point opposé et éloigné de l'orbite:

Nous avons maintenant un électron chargé négativement situé entre deux noyaux atomiques chargés positivement. Les noyaux des deux atomes sont attirés par cet électron. Ainsi, un électron lie actuellement deux atomes.
La distance entre les noyaux d'atomes est supérieure à la distance de chacun des noyaux à l'électron situé entre eux. Et on se souvient que la force d'interaction des charges est inversement proportionnelle au carré de la distance entre elles. Par conséquent, à l'heure actuelle, la force d'attraction des noyaux vers l'électron est supérieure à la répulsion mutuelle des noyaux.
Mais les électrons se déplacent constamment, et donc après un certain temps le premier électron quitte l'espace entre les noyaux, mais le deuxième électron s'y déplace. A ce moment, le rôle du liant passe à l'électron du deuxième atome (moment 3 sur la figure ci-dessous).

Notez qu'aux points de temps indiqués sur les figures 2 et 4, il n'y a pas d'électrons entre les noyaux d'atomes. À ces moments, les noyaux se repoussent. Pour cette raison, la distance entre les atomes varie - elle change constamment pendant la rotation des électrons autour des noyaux, mais sa longueur moyenne, appelée longueur de liaison, est préservée. La longueur de liaison - la distance entre les noyaux d'atomes - est individuelle pour chaque paire de types d'atomes combinés en une molécule.
Les électrons de ces deux atomes dans la molécule d'hydrogène formée tentent d'être aussi éloignés que possible, tout comme ils l'ont fait dans les segments métalliques. Pour cette raison, leur synchronisation se produit - leur emplacement les uns par rapport aux autres à chaque révolution autour des noyaux est approximativement le même.
Cela rappelle quelque peu la performance collective d'une valse, lorsque les paires tournent à la même vitesse de sorte que ni les dames ni les messieurs ne seront jamais côte à côte, mais alterneront toujours:

Cet article est un extrait du livre
"Clear Chemistry" .
Sainte incertitude et Sainte probabilitéLa théorie quantique prétend qu'il est impossible de déterminer simultanément la place exacte d'un électron dans l'espace et son momentum (direction et vitesse de son mouvement). Par conséquent, on pense qu'autour du noyau d'un atome, il existe certains endroits (zones) dans lesquels la probabilité de détecter un électron est élevée. Ces zones sont appelées orbitales électroniques.
Cette théorie n'est pas difficile à expliquer sur un exemple de ménage. Supposons que vous vivez dans un appartement dans lequel il y a une chambre, une cuisine et une salle de bain. Si vous passez 90% du temps dans la chambre, 8% du temps dans la cuisine et 2% du temps dans la salle de bain, alors votre orbite peut être considérée comme la chambre et la cuisine, car la probabilité de vous trouver dans la salle de bain est très faible. Après 100 observations de vous à différents moments, l'observateur est susceptible de vous retrouver dans 90 cas dans la chambre et dans 8 cas en cuisine. Et par ces chiffres, il arrivera à une conclusion sur la superficie de votre habitat.
Maintenant, pourquoi il est impossible de déterminer simultanément la place d'un électron dans l'espace et sa vitesse, et la direction du mouvement. C’est encore plus simple. Le fait est que la vitesse ne peut être mesurée que sur un certain
segment de la distance parcourue. En divisant la longueur de ce segment par le temps pendant lequel il s'est écoulé, nous pouvons connaître la vitesse de déplacement. Mais nous ne pouvons pas considérer un segment d'espace comme l'emplacement du corps. L'emplacement est la coordonnée exacte du corps.
Imaginez une mouche volant dans une pièce sombre. En éclairant la pièce avec un très court éclair de lumière, nous pouvons voir l'endroit où se trouve actuellement la mouche. Mais pour comprendre où et à quelle vitesse il vole, nous devrons allumer la lumière plus longtemps. Ensuite, nous verrons un changement dans la position de la mouche au fil du temps et nous pourrons estimer la vitesse de ce changement. Mais dans ce cas, on ne peut plus indiquer l'
endroit exact où se trouvait la mouche lors de la mesure de sa vitesse, car pendant ce temps elle s'est déplacée d'une certaine distance. C'est tout l'intérêt du principe d'incertitude.
Les électrons se déplaçant autour des noyaux atomiques changent très rapidement la vitesse et la direction du mouvement, il est donc impossible de dire exactement où ils se trouvent à un moment donné et où ils se déplacent.
Et dans le modèle discuté ci-dessus, les électrons se déplacent comme des flèches dans une horloge. Et cela ne peut que provoquer la colère juste des adeptes de la Sainte Incertitude et de la Sainte Probabilité.
Cependant, le fait que nous ne puissions pas dire exactement où se trouve tel ou tel électron, et auquel des atomes il «appartient» ne change en rien le mécanisme électrostatique de la liaison atomique. Il est impossible de lier deux protons autrement qu'en plaçant un électron entre eux. Aucune probabilité ou incertitude ne peut relier des atomes à une molécule. Et il démontre parfaitement l'ion hydrogène moléculaire H2 +. Dans cet ion, il n'y a ni doublet d'électrons, ni compensation des spins d'électrons appariés, ni chevauchement de nuages d'électrons, cependant, cet ion existe et est stable.
De plus, n'oubliez pas qu'il ne s'agit que d'un modèle et que ses capacités «explicatives» sont limitées, tout comme les capacités de tout autre modèle. Par exemple, cela (semble-t-il) n'explique pas pourquoi les atomes d'hydrogène ne peuvent pas se joindre à de longues chaînes comme H3, H4, etc.
Cependant, nous pouvons supposer qu'en raison du fait que les orbitales électroniques dans les molécules d'hydrogène sont déplacées vers le centre de la molécule, elles ne "dépassent" pas de ses extrémités, et donc les molécules d'hydrogène voisines ne sont pas capables de s'accrocher les unes aux autres en utilisant le mécanisme de synchronisation électronique.