Le vieillissement humain est actuellement défini comme une diminution physiologique des fonctions biologiques du corps avec une adaptation constante aux dommages internes et externes. Le système endocrinien joue un rôle important dans l'organisation des interactions cellulaires, du métabolisme, de la croissance et du vieillissement. Plusieurs études, des vers aux mishas, ont montré que la suppression de l'activité de la voie de l'hormone de croissance / facteur de croissance analogue à l'insuline 1 / insuline (GH / IGF-1 / insuline) peut être utile pour prolonger la durée de vie d'une personne, tandis que les résultats chez l'homme sont contradictoires. Dans cette revue, nous discutons du rôle potentiel du système IGF-1 dans la modulation de la longévité, en faisant l'hypothèse que l'adaptation endocrinienne et métabolique observée chez les centenaires et les mammifères avec restriction calorique peut être une stratégie physiologique pour augmenter l'espérance de vie en raison du ralentissement de la croissance cellulaire / métabolisme, meilleure utilisation des réserves physiologiques, passage du métabolisme cellulaire de la prolifération cellulaire aux actions régénératrices et diminution de l'accumulation des cellules vieillissantes.
Entrée.Le vieillissement est défini comme une diminution physiologique des fonctions biologiques de l'organisme avec une diminution progressive ou une perte d'adaptation aux dommages internes et externes. Chez l'homme, le phénotype du vieillissement est extrêmement hétérogène et peut être décrit comme une mosaïque complexe résultant de l'interaction de plusieurs événements aléatoires et environnementaux, des changements génétiques et épigénétiques accumulés tout au long de la vie. Malgré son énorme complexité, la base moléculaire du vieillissement est limitée par les quelques mécanismes biologiques hautement conservateurs évolutifs responsables du maintien et de la restauration du corps (1).
Au cours des trois dernières décennies, l'un des sujets les plus discutés en gérontologie a été le rôle du système hormone de croissance (GH) / facteur de croissance analogue à l'insuline-1 (IGF-1) / insuline dans la régulation de la longévité. Les données accumulées indiquent que cette voie joue un rôle important dans la pathogenèse d'un certain nombre de maladies liées à l'âge, notamment le cancer, la démence, les maladies cardiovasculaires et métaboliques (2 à 4).
Dans les modèles animaux, il a été démontré que l'inhibition du système GH / IGF-1 / insuline augmente considérablement la durée de vie. Cependant, chez l'homme, les données sont contradictoires (5, 6).
Cette revue décrit les avancées récentes dans l'étude du système IGF-1 et la modulation de la longévité, et émet l'hypothèse que l'adaptation endocrinienne et métabolique observée chez les centenaires et les mammifères pendant la restriction calorique peut être une stratégie physiologique pour augmenter l'espérance de vie en raison d'un ralentissement croissance / métabolisme cellulaire, meilleur contrôle de la transmission du signal et des capacités de réserve physiologique, et accumulation réduite des cellules vieillissantes.
Système IGF-1 et durabilité dans les modèles animaux
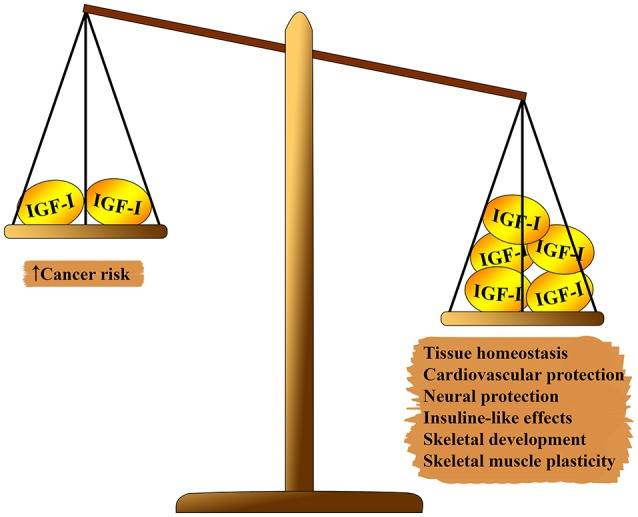 Fig. 1 Effet pléiotrope de l'IGF-1 sur le corps. D'un côté de l'échelle, qui l'emporte sur: l'homéostasie tissulaire, les effets cardioprotecteurs et neuroprotecteurs, les effets de type insulinique, la participation à la formation du squelette et la régénération musculaire. Sur le deuxième côté de la balance: le risque de cancérogenèse.
Fig. 1 Effet pléiotrope de l'IGF-1 sur le corps. D'un côté de l'échelle, qui l'emporte sur: l'homéostasie tissulaire, les effets cardioprotecteurs et neuroprotecteurs, les effets de type insulinique, la participation à la formation du squelette et la régénération musculaire. Sur le deuxième côté de la balance: le risque de cancérogenèse.Le système IGF-1 a plusieurs effets pléiotropes sur le vieillissement biologique (voir figure 1). L'IGF-1 joue un rôle important dans le développement du fœtus, sa croissance pendant l'enfance et l'adolescence et l'homéostasie des tissus adultes. En outre, l'IGF-1 a, apparemment, un effet athéroprotecteur, un effet neuronal protecteur et semblable à l'insuline (à des concentrations élevées), et régule le métabolisme osseux et la régénération musculaire. Néanmoins, l'IGF-1 est un facteur de risque majeur dans le développement de plusieurs types de tumeurs en raison de sa forte activité proliférative, principalement en raison de la modulation du cycle cellulaire, de l'apoptose et de la survie cellulaire (7 - 9). La plupart de ces effets sont médiés par l'interaction avec le substrat du récepteur de l'insuline (IRS) -1 et-2 et la modulation de la voie cible PI3K / AKT / mammifère de la rapamycine (mTOR) (voir Fig.2)
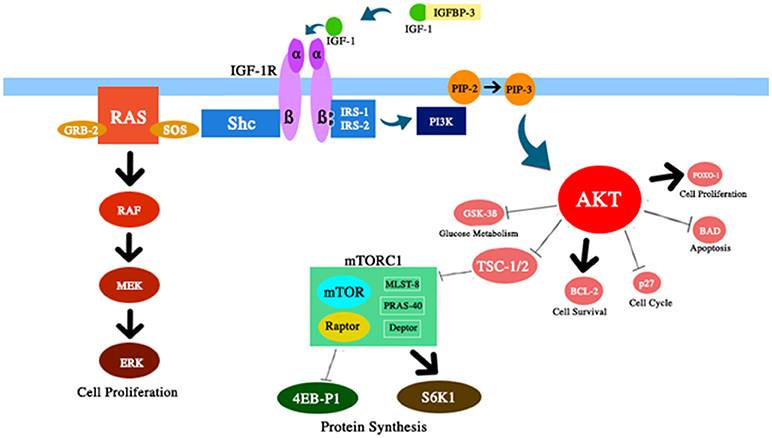 Figure 2 Représentation schématique de plusieurs composants du chemin IGF-1 / PI3K / AKT / mTOR discuté dans cette revue. L'IGF-1 améliore l'activité de l'AKT avec des effets correspondants sur la survie et la prolifération cellulaire, le métabolisme du glucose et la synthèse des protéines.
Figure 2 Représentation schématique de plusieurs composants du chemin IGF-1 / PI3K / AKT / mTOR discuté dans cette revue. L'IGF-1 améliore l'activité de l'AKT avec des effets correspondants sur la survie et la prolifération cellulaire, le métabolisme du glucose et la synthèse des protéines.
Plusieurs études précliniques ont rapporté que des mutations dans les gènes qui contrôlent la voie de signalisation GH / IGF-1 / insuline peuvent augmenter considérablement la durée de vie des modèles animaux invertébrés et vertébrés (5, 6).
Modèles d'invertébrés.Chez les invertébrés, la cascade de type insuline / IGF est régulée par plusieurs peptides capables d'interagir avec un récepteur commun de type insuline / IGF-1.
Dans le nématode Caenorhabditis elegans, la voie analogue à l'insuline / IGF se compose de plusieurs protéines codées par les gènes daf-2, age-1 (codant pour la sous-unité catalytique PI3K), akt-1, akt-2, pdk-1, sgk-1 (serine-thréonine kinases ), daf-16, skn-1 et daf-18 (PTEN, phosphatase impliquée dans l'inhibition de la voie de signalisation AKT). Il a été démontré qu'une activité réduite des gènes daf-2, age-1, akt-1, akt-2, pdk-1, sgk-1 supprime cette voie, et les animaux présentant ces mutations vieilliraient plus lentement et auraient une durée de vie prolongée jusqu'à 300%. En revanche, la stimulation de la voie analogue à l'insuline / IGF diminue la durée de vie des nématodes (10, 11).
Chez la mouche des fruits Drosophila melanogaster, la signalisation de type insuline / IGF consiste en dINR (protéine de type récepteur d'insuline / IGF-1), substrat de récepteur d'insuline CHICO, PI3K Dp110 / p60 et cible PK3 PI3K. Il a été signalé que les mouches présentant une mutation dans ces gènes augmentaient considérablement l'espérance de vie (12, 13).
Étonnamment, les mêmes mécanismes moléculaires dans différents tissus n'affectent pas le vieillissement de la même manière. Plusieurs études sur les nématodes et les mouches des fruits ont montré qu'une diminution de la signalisation de type insuline / IGF dans les tissus nerveux et adipeux joue un rôle majeur dans la régulation de la longévité (14, 15). Bien qu'il ait été démontré dans les modèles d'invertébrés que cette cascade est importante pour moduler la durée de vie, les effets de la signalisation de type insuline / IGF sur la durée de vie sont beaucoup plus complexes chez les vertébrés car ils ont des molécules d'insuline et d'IGF fonctionnellement spécifiques, des protéines de liaison IGF (IGFBPs ), IGFBP, protéases GH, plusieurs récepteurs et plusieurs mécanismes de transmission du signal intracellulaire avec différentes expressions tissulaires spécifiques (16).
Modèles de vertébrésPlusieurs souris GH / IGF-1 mutantes ont été conçues avec différentes cibles. Les modèles les plus récents sont décrits ci-dessous.
Souris Snell et Ames.Les souris Snell et Ames sont deux souches de souris avec des mutations dans les gènes PIT-1 et PROP-1, respectivement (17, 18). Étant donné que les protéines PIT-1 et PROP-1 sont nécessaires à la différenciation des cellules hypophysaires qui produisent la GH, la prolactine et l'hormone stimulant la thyroïde, les deux types de souris mutantes homozygotes manquent des trois hormones (18). Ces modèles ont montré une augmentation significative de l'espérance de vie (42 à 70% de plus que chez les souris de type sauvage), une sensibilité accrue à l'insuline et une fréquence tumorale plus faible (19, 20). Lorsque les souris Ames étaient limitées en calories, leur durée de vie augmentait encore plus (21). Bien que ces animaux manquent de trois hormones, il a été démontré que l'augmentation de la longévité dépend principalement de la carence en GH (22).
Souris allumée / alluméeLes souris allumées / allumées présentent une carence en GH et une mutation du gène qui code pour le récepteur de l'hormone de libération de la GH (GHRHR). Ces animaux étaient des nains, avaient une augmentation du tissu adipeux, des taux de tumeurs plus faibles et une espérance de vie augmentée de 23 à 25% (19).
Souris GH-Releasing Hormone-Knockout (GHRH-KO).Les souris knockout hormone de libération de GH (GHRH-KO) vivent 43% (chez les femelles) et 51% (chez les mâles) plus longtemps que les animaux de type sauvage et ont de nombreuses caractéristiques phénotypiques des souris Ames, telles que l'hypersensibilité à l'insuline, une diminution des triglycérides et des taux de cholestérol plasmatiques, une augmentation du tissu adipeux, des taux plasmatiques élevés de leptine et d'adiponectine (23).
Souris à récepteur GH-Knockout (GHR-KO)Les souris désactivées du récepteur de GH (GHR-KO) ont des niveaux de GH sériques élevés et des niveaux d'IGF-1 très bas. Il a également été signalé que cette souche de souris vivait de 38 à 55% plus longtemps que le type sauvage (24) et montrait une réduction du stress oxydatif, ainsi qu'une apparition plus faible et retardée de tumeurs mortelles (25). Des résultats similaires ont été observés chez des souris df / KO, ont croisé deux brins de misha, les nains GHR-KO et Ames, qui manquaient de récepteurs GH et GH et ont continué d'augmenter l'espérance de vie (26). Contrairement aux frères et sœurs Ames sauvages et aux souris naines, la restriction calorique n'a pas augmenté la durée de vie des souris GHR-KO, ce qui suggère que l'axe GH / IGF-1 et la restriction calorique peuvent avoir des mécanismes similaires ou se chevauchant partiellement pour prolonger la durée de vie (27) .
Antagonisme des récepteurs GH (GHA)Tous les modèles animaux avec suppression du système GH / IGF-1 ne montrent pas une augmentation de l'espérance de vie. La souche GHA de souris en est un exemple. Le GHA, généré en remplaçant un acide aminé, est capable de se lier au récepteur de GH avec la même affinité que le GH, mais ne provoque pas de signalisation intracellulaire. L'espérance de vie des souris GHA n'a pas augmenté de manière significative (28).
IGF-1R +/– SourisAlors que la plupart des souris avec un récepteur IGF-1 inactif (IGF-1R - / -) meurent à la naissance, les animaux hétérozygotes pour l'allèle mutant du récepteur IGF-1 (IGF-1R ±) ont montré de très faibles niveaux d'IGF-1 sérique , environ 10% plus petite et 33% plus longue espérance de vie chez les femmes et 16% chez les hommes. Cependant, dans cette étude, les témoins de type sauvage ont survécu à 19 mois, ce qui a compromis l'interprétation des résultats (29). Des études plus récentes évaluant l'espérance de vie dans une autre lignée IGF-1R ± ont montré une légère augmentation de l'espérance de vie de 5 à 10%, mais uniquement chez les femmes (30, 31). De plus, la principale souche de fond semble affecter le degré d'extension de la vie dans plusieurs modèles de souris (32).
Un IGF1-R spécifique au cerveau +/-Une souris mutante IGF1-R +/− spécifique au cerveau vivait 9% plus longtemps que le type sauvage, ce qui souligne le rôle correspondant du système nerveux dans la modulation de la longévité (33).
Souris perturbées par IGF-1 spécifiques du foie (LI-IGF-1 - / -).Les souris dont la production d'IGF-1 est altérée (LI-IGF-1 - / -) ont des niveaux sériques très faibles d'IGF-1 et des niveaux sériques élevés de GH en raison de l'inactivation du gène IGF-1. Les souris LI-IGF-1 - / - avaient une obésité nettement réduite et, par conséquent, le poids était 25% plus bas que chez les souris de type sauvage. Seules les souris LI-IGF-1 - / - femelles ont montré une augmentation de l'espérance de vie de 16% par rapport aux souris témoins (34).
Pappa - / - souris.Les souris Pappa - / - ont un knock-out du gène de la protéine plasmatique associée à la grossesse A, PAPP-A, PAPPA, une protéase spécifique pour les protéines de liaison à l'IGF. La durée de vie moyenne de cette souche de souris était 38% plus longue par rapport aux témoins de type sauvage. Les souris Pappa - / - étaient des naines, mais leurs taux sériques de glucose, d'insuline, d'IGF-1 et de GH ne différaient pas de ceux des témoins de type sauvage, ce qui suggère que le PAPPA agit principalement au niveau autocrinien ou paracrine. En plus d'augmenter l'espérance de vie, les souris Pappa - / - ont montré une incidence plus faible de tumeurs, ainsi que des lésions dégénératives liées à l'âge (35, 36).
IRS Disrupted (IRS1 - / -) mouse.IRS-1 et -2 sont des médiateurs importants pour l'insuline ainsi que pour la signalisation IGF-1. Les souris IRS1 - / - étaient résistantes à l'insuline, avec un défaut dans la transmission des signaux d'insuline principalement dans le tissu musculaire, environ 30% plus court que le type sauvage, et seules les femelles avaient une espérance de vie 18% plus longue que les animaux de type sauvage (37 ) )
Les souris IRS2 - / - étaient également résistantes à l'insuline, mais contrairement aux souris IRS1 - / -, elles présentaient des défauts de signalisation de l'insuline dans plus de tissus, y compris le foie, le tissu adipeux et le muscle squelettique. Ces souris ont développé un diabète et leur durée de vie était beaucoup plus courte que celle des souris de type sauvage et des souris IRS2 ±. Les souris IRS2 +/- avaient une sensibilité à l'insuline améliorée et une espérance de vie accrue (+ 18%) par rapport aux souris de type sauvage. De plus, les souris IRS2 ± et IRS2 - / - spécifiques au cerveau ont été signalées comme étant résistantes à l'insuline et ont vécu 18 et 14% plus longtemps que les témoins de type sauvage, respectivement (38).
Souris modifiées KLOTHO.La protéine KLOTHO inhibe la signalisation de l'insuline et de l'IGF-1, peut-être en perturbant l'interaction récepteur / ligand. Les souris surexprimées KLOTHO étaient de taille normale, et une résistance à l'insuline s'est développée chez les mâles, et l'espérance de vie chez les mâles et les femelles a été significativement augmentée (+18 et + 30%, respectivement) (39, 40).
P66shc Disrupted Mouse (P66shc - / -).P66shc est une protéine qui assure la médiation de la signalisation IGF-1 après le récepteur en activant la voie MAPK. Les souris P66shc - / - avaient un phénotype normal, mais vivaient 28% plus longtemps que les témoins de type sauvage (41). Cependant, ces données n'ont pas été confirmées dans une étude récente (42).
Le rôle de la signalisation GH / IGF-1 / insuline dans le vieillissement et la longévité a été étudié en profondeur dans tous ces modèles animaux. Bien que les invertébrés, l'effet de la suppression de la voie IGF-1 / insuline sur l'espérance de vie était évident et significatif, dans les modèles murins cet effet était affaibli et non reproductible dans certains cas, comme dans les lignées IGF-1R ± et P66shc - / - des souris. Cependant, la plupart de ces modèles ont montré des caractéristiques communes chez les souris à longue durée de vie, telles que des niveaux réduits d'IGF-1 circulant et d'insuline et une sensibilité accrue à l'insuline, qui sont susceptibles de réduire l'incidence du cancer, d'améliorer la résistance au stress et de prolonger la vie. . Les changements génétiques qui peuvent perturber le système IGF-1 peuvent garder les animaux en bonne santé pendant de plus longues périodes et peuvent retarder ou atténuer certaines maladies liées à l'âge. Dans ce processus, les tissus nerveux et graisseux jouent un rôle important.
De plus, des données supplémentaires sont nécessaires pour déterminer le meilleur moment dans le temps pendant la durée de vie pour intervenir dans la suppression du système IGF-1 afin d'obtenir un effet positif sur la durée de vie. Chez les souris igf f / f C57B l / 6, une carence en IGF-1 circulant, à partir de 5 mois ou plus tôt, a augmenté l'espérance de vie de 15% uniquement chez les femelles avec une diminution du nombre d'organes présentant une pathologie en fin de vie par rapport au groupe témoin . De plus, une déficience tardive en IGF-1 (15 mois) a réduit le risque de cancer, mais n'a pas eu d'effet positif sur l'espérance de vie (43). Ces données soulignent l'importance de la carence en IGF-1 à un âge précoce pour augmenter l'espérance de vie. D'un autre côté, Mao et al. (44) ont récemment rapporté que l'administration tardive d'anticorps monoclonaux dirigés contre le récepteur IGF-1 à des souris CB6F1 âgées de 18 mois a prolongé l'espérance de vie des femmes de 9% et amélioré certains aspects de la santé.
Système IGF-1 chez les personnes à vie longue
Les centenaires du centenaire sont considérés comme le meilleur modèle humain pour étudier les déterminants biologiques de la longévité, qui ont atteint les valeurs les plus extrêmes de l'espérance de vie humaine (45).
Plusieurs études ont comparé les niveaux d'insuline circulante et d'IGF-1 dans les foies longs avec ceux des témoins plus jeunes (46).
Le remodelage métabolique lié à l'âge est un processus physiologique qui se produit dans l'ensemble de la population. Le vieillissement est souvent associé à une diminution de la tolérance au glucose, qui est associée à une résistance accrue à l'insuline (47), mais les personnes à vie longue ont une exception. Il a été constaté (48) que la résistance à l'insuline augmente avec l'âge et diminue chez les personnes de plus de 90 ans vivant dans le sud de l'Italie. En effet, les sujets à longue durée de vie ont montré une sensibilité à l'insuline plus élevée et une meilleure fonction des cellules bêta que les sujets plus jeunes. Cette différence ne dépendait pas non plus des principaux facteurs anthropométriques et métaboliques. Chez les patients de 100 ans, la concentration plasmatique de glucose pendant 2 heures était inférieure à celle des personnes âgées (âge moyen 78 ans). Chez les foies longs, la consommation de glucose médiée par l'insuline était plus élevée que chez les témoins âgés lors de la prise de glucose euglycémique, ce qui a maintenu la tolérance au glucose préservée et l'action de l'insuline dans ce groupe à longue durée de vie (49, 50). Des résultats similaires confirmant la meilleure sensibilité à l'insuline ont été observés dans d'autres populations de foies longs (51, 52).
De plus, les foies longs ont montré l'effet préservé de l'insuline non seulement sur le métabolisme du glucose, mais aussi sur le tissu adipeux. En fait, la perfusion d'insuline est généralement associée à une inhibition de la lipolyse et, par conséquent, à une diminution significative de la concentration d'acides gras libres et de triglycérides dans le plasma. Chez les foies longs, l'activité inhibitrice de l'insuline pendant la lipolyse était plus élevée que chez les participants témoins (âge moyen 78 ans) (50). Il convient de noter que chez les foies longs, par rapport aux témoins adultes, un ton sympathique plus faible est également observé, ce qui peut être associé à une meilleure action de l'insuline et, par conséquent, à un faible niveau d'insuline à jeun dans le plasma (53, 54).
Les données sur le système IGF-1 concernant l'espérance de vie sont toujours contradictoires chez les sujets à longue durée de vie (46). Paolisso et al. (55) ont décrit une augmentation du rapport plasmatique IGF-1 / IGFBP-3 dans les foies longs en bonne santé par rapport aux personnes âgées. Ils ont suggéré que ce rapport accru indique une biodisponibilité plus élevée d'IGF-1, ce qui contribue à une amélioration de l'action de l'insuline dans les foies longs. Bonafè et al. (56) ont rapporté que les sujets avec au moins l'allèle A du gène du récepteur IGF-1 (G / A, codon 1013) avaient de faibles taux plasmatiques d'IGF-1 libre et étaient plus répandus chez les personnes à longue durée de vie. Arai et al. (57) ont décrit des niveaux relativement faibles d'IGF-1 sérique dans la population japonaise de foies longs. Dans cette population, les taux les plus bas d'IGF-1 et d'IGFBP-3 étaient associés à une mortalité accrue (58).Ces résultats contradictoires reflètent probablement la complexité du système IGF et les différences ethniques dans la population enregistrée. De plus, les centenaires étaient souvent comparés à un groupe témoin de sujets plus jeunes. Ainsi, dans la plupart de ces études, il a été impossible de conclure si les différences entre l'IGF-1 dans les deux groupes étaient associées à une espérance de vie différente ou reflétaient une diminution physiologiquement dépendante de l'IGF-1. En effet, il existe plusieurs limites à l'étude des foies longs: (1) faible prévalence (1 centenaire pour 5 à 10 000 habitants), (2) faiblesse due à l'âge extrême (près de 95% des foies longs ont au moins 1 critère d'asthénie), (3 ) l'absence d'un groupe témoin du même âge (45, 59). En raison de ces limites, ce modèle humain n'est pas adapté à l'étude des variables liées à l'âge,qui peuvent être impliqués dans la modulation de l'espérance de vie.Les descendants de centenaires sont un autre modèle intéressant pour déterminer les facteurs pertinents associés à la longévité humaine et au vieillissement en bonne santé. Un ensemble cohérent d'observations dans différents pays suggère que les descendants de foies longs sont en meilleure santé que les représentants des mêmes groupes démographiques (51, 60, 61) et biologiquement (épigénétiquement) plus jeunes que leur âge chronologique (62). En général, ces études montrent que les parents de centenaires sont plus susceptibles de vivre plus longtemps et d'avoir une bonne santé (60, 63). En outre, l'étude de la progéniture des foies longs présente l'avantage de disposer d'un groupe témoin démographiquement approprié composé d'une descendance d'âge comparable, dans laquelle les deux parents sont nés dans la même cohorte de centenaires, mais sont décédés avant l'âge seuil.après quoi les gens sont classés comme «centenaires». Cette stratégie est essentielle pour prévenir les effets de cohorte. Ainsi, le modèle de progéniture des foies longs peut surmonter certaines des limites que l'on trouve dans l'étude des foies longs (rareté, faiblesse et manque de contrôle approprié) (60).Dans plusieurs études, le système IGF-1 / insuline a été caractérisé chez les descendants de foies longs et dans le groupe témoin correspondant.Nous avons évalué la bioactivité circulante de l'IGF-1, mesurée à l'aide d'un test d'activation de récepteur de kinase innovant (KIRA) effectué sur des foies longs, des descendants de longs foies et des descendants témoins comparables. La progéniture des foies longs et des foies longs avait une activité biologique circulante relativement plus faible d'IGF-1 par rapport au groupe témoin. Fait intéressant, l'activité biologique de l'IGF-1 chez les descendants de foies longs était inversement liée à la sensibilité à l'insuline (51).Suh et al. (64) ont évalué les taux sériques d'IGF-1 chez les descendants de centenaires juifs ashkénazes et chez des témoins comparables à l'âge. Chez les enfants de sexe féminin à longue durée de vie, l'IGF-1 sérique était 35% plus élevé que chez les participants témoins. Cette différence peut représenter une réponse compensatoire à une diminution de la signalisation du récepteur IGF-1. De plus, la présence juive de centenaires ashkénazes a décrit la présence excessive de mutations hétérozygotes dans le gène du récepteur IGF-1 ainsi que des niveaux d'IGF-1 sériques relativement élevés et une diminution de l'activité des récepteurs IGF-1 par rapport au groupe témoin sans longévité familiale.Pour étudier la longévité, d'autres auteurs ont examiné des frères et sœurs de quatre-vingt-dix ans et leurs descendants. Dans l'étude de Leyden sur la longévité, 421 familles ont été sélectionnées, comprenant au moins deux journalistes, frères et sœurs, leurs descendants et partenaires de descendants comme témoins. Dans ces populations, le glucose sérique, l'insuline et les triglycérides étaient le meilleur biomarqueur pour un vieillissement en bonne santé (les faibles niveaux de glucose et d'insuline étaient considérés comme sains) (65). Les centenaires de neuf ans dans le rapport IGF-1 / IGFBP-3 le plus bas de la circulation sanguine étaient associés à une meilleure survie (66). Les descendants de neuf ans ont montré une meilleure sensibilité à l'insuline par rapport à leurs partenaires, tandis que des niveaux similaires de sérum à jeun IGF-1 et IGFBP-3 ont été observés dans les deux groupes à jeun (67). Intéressantque la sécrétion totale de GH sur 24 heures était de 28% inférieure chez la progéniture par rapport au témoin (68).Une autre approche adoptée pour étudier la longévité chez l'homme consiste à sélectionner des composants familiaux pour une longévité exceptionnelle et un vieillissement en bonne santé sur la base de critères stricts, tels que la Long Life Family Study, une mesure de la durée de vie familiale. Ces familles, sélectionnées pour leur espérance de vie exceptionnelle, ont été comparées à un groupe témoin sans antécédents familiaux de longévité (69). Dans cette population, les niveaux de circulation d'IGF-1 se sont révélés être un biomarqueur fiable lié à l'âge (70).À l'appui du rôle potentiel du système GH / IGF-1 / insuline dans la longévité humaine, il existe de nombreuses études génétiques. En effet, il a été constaté que plusieurs loci génétiques sont associés à des niveaux circulants d'IGF-1 et d'IGFBP-3 et sont potentiellement capables d'affecter le vieillissement (71). Une analyse à l'échelle du génome des associations menée auprès de personnes de quatre-vingt-dix ans et de populations de patients âgés de moins de 60 ans a montré un lien clair entre la variation génétique des gènes impliqués dans la voie insuline / IGF-1 et la durée de vie humaine (72). Dans une étude prospective sur des personnes âgées, des femmes ayant un profil génétique, indiquant une diminution de l'activité de signalisation insuline / IGF-1, ont montré une durée de vie plus longue (73).Dans quatre cohortes indépendantes d'individus à longue durée de vie, une augmentation linéaire de la prévalence de l'homozygotie exogène du récepteur GH 3 (G3R) avec l'âge a récemment été décrite. La présence du génotype d3 / d3 a augmenté l'espérance de vie d'environ 10 ans (74).IGF-1
L'une des observations les plus convaincantes dans la biologie du vieillissement est la capacité de limiter les calories pour prévenir ou retarder certaines maladies liées à l'âge et augmenter l'espérance de vie des mammifères (75 - 78). Les mécanismes biologiques de ce phénomène ne sont pas entièrement clairs, mais la suggestion a été faite concernant l'implication potentielle de changements correspondants dans le métabolisme énergétique, le système endocrinien et les dommages oxydatifs.
La restriction calorique provoque de nombreux changements hormonaux. Chez les rongeurs, la restriction calorique sans famine a supprimé les niveaux circulants d'IGF-1 et d'insuline proportionnellement au niveau de restriction, augmenté la sensibilité à l'insuline et la résistance au stress et à la toxicité, et réduit le risque de cancer (79, 80). Fait intéressant, la plupart de ces caractéristiques observées chez les souris de type sauvage pendant la restriction calorique ressemblent à celles rapportées chez les souris qui vivent longtemps en raison d'une altération génétique de la signalisation de GH / IGF-1 / insuline, comme décrit précédemment.
Des essais cliniques randomisés chez l'homme ont montré que la restriction calorique ne réduit pas l'IGF-1 sérique à moins que l'apport en protéines soit réduit (81, 82). Cependant, une méta-analyse récente évaluant l'effet de la restriction nutritionnelle sur les biomarqueurs reconnus du vieillissement en bonne santé a montré une diminution des taux d'IGF-1 humain dans le sang (83).
D'autres changements hormonaux, tels qu'une diminution des niveaux d'insuline, des hormones thyroïdiennes et des niveaux de leptine, ainsi qu'une augmentation de l'adiponectine et de la sensibilité à l'insuline, ont été observés pendant la restriction alimentaire (85, 86).
Cette adaptation hormonale peut jouer un rôle important dans la prolongation de la vie grâce à plusieurs mécanismes:
1) Diminution du taux métabolique, de la prolifération cellulaire et du stress oxydatif. En fait, l'IGF-1 est un puissant facteur de croissance et l'hormone thyroïdienne est un puissant stimulant du métabolisme de base et du métabolisme oxydatif. De plus, les schémas de transcription suggèrent que la restriction calorique chronique modérée chez les adultes ralentit le processus de vieillissement, faisant passer le métabolisme cellulaire de la croissance à l'entretien et à la récupération (84).
2) Réduire l'accumulation de cellules vieillissantes. Le vieillissement cellulaire s'est révélé être un médiateur clé du vieillissement (87). Au fil du temps, l'homéostasie des protéines diminue et les dommages s'accumulent. Fait intéressant, certaines maladies liées à l'âge peuvent être retardées en affaiblissant l'accumulation de cellules vieillissantes (88, 89). En règle générale, la voie mTOR est activée par plusieurs signaux, y compris les nutriments, l'IGF-1 et l'insuline (figure 2). La déréglementation de cette voie, qui a été signalée après une restriction calorique, a augmenté la durée de vie de certains organismes. Cet effet est apparemment secondaire à une augmentation de l'autophagie, un processus de digestion cytoprotecteur. En fait, l'autophagie est un processus de traitement cellulaire qui peut éliminer les composants cellulaires anciens ou endommagés, empêchant l'accumulation de cellules vieillissantes (90, 91).
3) Lutter contre l'inflammation. L'intervention alimentaire chez les animaux et les humains peut ralentir le processus de vieillissement, affaiblissant le statut inflammatoire d'un degré faible (83, 92). Les mécanismes sous-jacents à l'activité anti-inflammatoire de la restriction nutritionnelle ne sont pas clairement définis. On pense que cet effet est dû à une diminution de la masse grasse et des adipokines pro-inflammatoires, ainsi qu'à une amélioration de l'intégrité de la barrière intestinale observée lors d'une intervention alimentaire (93, 94).
Il est intéressant de noter que le profil biochimique endocrinien observé chez les sujets lors d'une restriction calorique est comparable à celui des centenaires, ce qui confirme le rôle potentiel du système endocrinien dans la modulation de l'espérance de vie. En plus d'augmenter la sensibilité à l'insuline et d'abaisser les taux plasmatiques / sériques d'IGF-1, plusieurs études ont montré une augmentation des taux d'adiponectine circulante et une diminution des taux de leptine circulante et d'hormones thyroïdiennes chez les personnes à longue durée de vie par rapport aux sujets plus jeunes.
Le tissu adipeux est un organe endocrinien qui produit plusieurs cytokines impliquées dans des processus pertinents, tels que le métabolisme énergétique, l'homéostasie lipidique et glucose et la modulation de la réponse inflammatoire. Le tissu adipeux viscéral joue un rôle majeur dans le développement des maladies métaboliques (95). Le vieillissement est associé à une augmentation de la masse grasse et à une redistribution du tissu adipeux, caractérisée par une perte de graisse sous-cutanée périphérique et une accumulation de graisse viscérale. Chez les personnes âgées, des changements dans la sécrétion, la synthèse et la fonction des adipokines ont été décrits, probablement en raison d'un déséquilibre dans la fonction, la prolifération, la taille et le nombre de cellules graisseuses (86). L'adiponectine est une cytokine sensibilisante à l'insuline, anti-inflammatoire et anti-athérogène. L'adiponectine circule dans le sang sous plusieurs formes: trimère, hexamère, multimère de haut poids moléculaire (HMW) et adiponectine globulaire (forme clivée protéolytiquement). On pense que le multimère HMW est une forme plus active d'adiponectine pour la protection contre la résistance à l'insuline et le diabète (96). L'adiponectine circulante est indépendamment et négativement associée à certains aspects du syndrome métabolique, y compris la résistance à l'insuline, le poids corporel, la pression artérielle et les lipides sériques. La leptine est principalement produite dans le tissu sous-cutané et dans une moindre mesure dans le tissu adipeux blanc viscéral. Cette cytokine régule l'apport alimentaire, la dépense énergétique et l'athérogenèse. La leptine favorise la perte de poids en réduisant l'appétit et en stimulant le métabolisme et possède des propriétés pro-inflammatoires (97).
Plusieurs études ont rapporté que les foies longs ont des taux plasmatiques d'adiponectine plus élevés et des concentrations de leptine plus faibles que les témoins plus jeunes (53, 98 - 102). Toutes les formes d'adiponectine étaient significativement augmentées dans les foies longs, mais le HMW multimère était significativement plus élevé (99). Dans les foies longs, des concentrations élevées d'adiponectine se sont révélées indépendantes de l'IMC, de la fonction rénale ou cardiovasculaire et ont été associées à un phénotype métabolique favorable (taux plus élevés de HDL-C, taux d'hémoglobine glyqué inférieur, insuline, HOMA-IR et triglycérides) (98, 99). Des niveaux élevés d'adiponectine ont également été trouvés chez la progéniture de sujets à vie longue (plus de 95 ans) (103).
Une diminution du niveau d'hormones thyroïdiennes est apparemment caractéristique des foies longs. Mariotti et al. (104) ont rapporté que les centenaires en bonne santé avaient des taux sériques de TSH et FT3 inférieurs et des taux sériques de rT3 supérieurs à ceux observés dans d'autres groupes témoins. Dans une autre population italienne de foies longs, les valeurs totales de T4 étaient inférieures à la normale dans 60% des cas examinés (105). Baranovskaya et al. ont rapporté que les taux sériques de T3 chez les centenaires étaient inférieurs à ceux des jeunes femmes âgées et jeunes (52). Nous avons récemment caractérisé le profil de la fonction thyroïdienne dans une cohorte italienne de 672 patients (âgés de 52 à 113 ans). Une diminution liée à l'âge du niveau FT3 et des ratios FT3 / FT4 a été notée, tandis que FT4 et TSH augmentent avec l'âge (106). Dans les familles de centenaires chinois, une diminution de la fonction thyroïdienne (forte TSH et faible concentration en FT3) semble liée à l'âge, et ce phénotype est héréditaire (107).
Corsonello et al. (108) ont constaté que des parents concomitants (progéniture ou nièces / neveux) avaient des taux de maladies concomitantes, FT3, FT4 et TSH inférieurs à ceux des témoins de même âge qui n'étaient pas des parents de foies longs. Dans une autre population italienne, un taux de FT4 plasmatique inférieur a été observé chez les descendants de foies longs par rapport à un groupe témoin du même âge (60).
En général, les foies longs sont minces (109) et adhèrent à de saines habitudes alimentaires (110). Semblable aux sujets pendant la restriction calorique, les foies longs ont observé une croissance / métabolisme cellulaire plus lente, un meilleur contrôle de la transmission du signal et une autophagie accrue. Grâce à l'analyse de la méthylation de l'ADN dans tout le génome chez les centenaires et leurs descendants, nous avons identifié des gènes et des voies modulées épigénétiquement potentiellement impliqués dans le vieillissement et la longévité. Nos résultats indiquent que ces populations étaient caractérisées par une meilleure conservation du statut de méthylation de l'ADN, une croissance / métabolisme cellulaire plus lente et un meilleur contrôle de la transmission du signal par le biais de mécanismes épigénétiques (111). Les foies longs ont conservé leur fonction bioénergétique en raison de l'hypertrophie mitochondriale, qui peut compenser les défauts fonctionnels (112). De plus, les foies longs en bonne santé ont des niveaux élevés d'autophagie, comme en témoignent des niveaux de béclin-1 sériques supérieurs par rapport aux jeunes patients atteints d'infarctus du myocarde et aux témoins sains (113). Une augmentation de l'activité autophagique a également été observée chez des sujets appartenant à des familles à longévité exceptionnelle (114).
Le phénomène correspondant se pose en relation avec le statut inflammatoire, qui s'affaiblit chez les sujets après restriction calorique (115, 116) et est élevé chez les foies longs (117 - 119). Avec le vieillissement, il existe un état de pathologie inflammatoire légère et chronique (inflammation liée à l'âge) et une prévalence accrue d'un certain nombre de maladies, telles que les maladies cardiovasculaires, l'athérosclérose, les tumeurs, les troubles cognitifs, l'arthrose et le diabète (120, 121). Par conséquent, l'affaiblissement de l'état inflammatoire chronique après une restriction calorique est un effet bénéfique. Les centenaires du centenaire montrent des signes d'inflammation, mais en même temps, semble-t-il, ont épargné ses effets nocifs. Ce paradoxe évident peut s'expliquer par le fait que les foies longs ont un équilibre complexe et particulier entre les facteurs pro-inflammatoires et anti-inflammatoires, ce qui conduit à un développement de l'inflammation plus lent, plus limité et équilibré par rapport aux personnes âgées, qui se caractérisent par une réponse inefficace pour contrer l'inflammation chronique (120 , 121).
Ces données suggèrent les mécanismes généraux pour augmenter la longévité et retarder les maladies liées à l'âge trouvées dans les foies longs et les mammifères pendant un régime hypocalorique.
Opinion des auteurs.Les modèles précliniques ont fourni un aperçu plus approfondi du processus de vieillissement en utilisant des données cohérentes qui prennent en compte le rôle du système GH / IGF-1 / insuline dans la modulation de l'espérance de vie. Bien qu'il soit bien connu qu'une augmentation de la sensibilité à l'insuline et de faibles niveaux d'insuline sont associés à une meilleure survie, il existe des preuves montrant qu'un affaiblissement de l'axe GH / IGF-1 peut avoir un effet bénéfique sur l'augmentation de l'espérance de vie chez l'homme. Cependant, on ignore encore quels sont les niveaux optimaux d'IGF-1 tout au long de la vie pour vivre plus longtemps et être en meilleure santé. De plus, la sensibilité du récepteur IGF-1 et l'activation de la voie post-récepteur n'ont pas été évaluées dans la plupart des études impliquant des sujets à longue durée de vie. Par conséquent, il n'est pas possible de déterminer l'état réel de l'activation de la signalisation du récepteur IGF-1 par une simple dose de niveaux d'IGF-1 circulant. Il est donc difficile d'identifier des stratégies pharmacologiques ou environnementales qui ciblent ce système pour augmenter la longévité et favoriser un vieillissement sain. Une compréhension globale de ces aspects reste le principal problème pour identifier les interventions visant à ralentir le vieillissement humain et à utiliser en médecine de réadaptation. Les futures études devraient évaluer l'état fonctionnel de la signalisation des récepteurs IGF-1, y compris par le biais du profilage transcriptionnel et de l'analyse des réseaux fonctionnels concernant les gènes régulés IGF-1 chez les sujets à longue durée de vie.
ConclusionsDes similitudes frappantes ont été décrites en ce qui concerne le profil endocrinien entre les foies longs et les sujets après un régime hypocalorique. L'adaptation endocrinienne et métabolique observée dans les deux modèles peut être une stratégie physiologique pour augmenter l'espérance de vie en raison du ralentissement de la croissance / métabolisme cellulaire, de la perte plus lente de la réserve physiologique naturelle, de la transition du métabolisme cellulaire de la prolifération cellulaire à l'activité régénérative et de la réduction de l'accumulation de cellules vieillissantes. Apparemment, ces mécanismes, au moins partiellement, sont médiés par la modulation du système GH / IGF-1 / insuline.
Les références- Franceschi C, Valensin S, Bonafè M, Paolisso G, Yashin AI, Monti D, et al .. Le réseau et les théories de remodelage du vieillissement: contexte historique et nouvelles perspectives. Exp Gerontol. (2000) 35: 879–96. 10.1016 / S0531-5565 (00) 00172-8.
- Bartke A, Darcy J. GH et le vieillissement: pièges et nouvelles perspectives. Best Pract Res Clin Endocrinol Metab. (2017) 31: 113–25. 10.1016 / j.beem.2017.02.005
- Vitale G, Salvioli S, Franceschi C. Le stress oxydatif et le vieillissement du système endocrinien. Nat Rev Endocrinol. (2013) 9: 228–40. 10.1038 / nrendo.2013.29
- Vitale G, Cesari M, Mari D. Vieillissement du système endocrinien et son impact potentiel sur la sarcopénie. Eur J Intern Med. (2016) 35: 10-15. 10.1016 / j.ejim.2016.07.017
- Reddy SSK, Chaiban JT. L'endocrinologie du vieillissement: une clé de la longévité «Great Expectations». Endocr Pract. (2017) 23: 1107–16. 10.4158 / EP171793.RA
- Junnila RK, List EO, Berryman DE, Murrey JW, Kopchick JJ. L'axe GH / IGF-1 dans le vieillissement et la longévité. Nat Rev Endocrinol. (2013) 9: 366–76. 10.1038 / nrendo.2013.67
- Yakar S, Adamo ML. Physiologie du facteur de croissance analogue à l'insuline 1: leçons tirées de modèles murins. Endocrinol Metab Clin North Am. (2012) 41: 231-247. 10.1016 / j.ecl.2012.04.008 [Article gratuit PMC] [PubMed] [CrossRef] [Google Scholar]
- Higashi Y, Sukhanov S, Anwar A, Shai SY, Delafontaine P. IGF-1, stress oxydatif et athéroprotection. Tendances Endocrinol Metab. (2010) 21: 245-54. 10.1016 / j.tem.2009.12.005 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, et al .. Isoformes des récepteurs de l'insuline en physiologie et maladie: une vue mise à jour. Endocr rév. (2017) 38: 379-431. 10.1210 / er.2017-00073 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang RAC ... elegans mutant qui vit deux fois plus longtemps que le type sauvage. Nature (1993) 366: 461-4. 10.1038 / 366461a0 [PubMed] [CrossRef] [Google Scholar]
- Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, un gène semblable au récepteur de l'insuline qui régule la longévité et la diapause chez Caenorhabditis elegans. Science (1997) 277: 942-6. 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [Google Scholar]
- Tatar M, Kopelman A, Epstein D, Tu MP, Yin CM, Garofalo RS, et al .. Un homologue mutant du récepteur de l'insuline de la drosophile qui prolonge la durée de vie et altère la fonction neuroendocrine. Science (2001) 292: 107-10. 10.1126 / science.1057987 [PubMed] [CrossRef] [Google Scholar]
- Clancy DJ, Gems D, Harshman LG, Oldham S, Stocker H, Hafen E, et al .. Prolongation de la durée de vie par perte de CHICO, une protéine du substrat du récepteur de l'insuline de la drosophile. Science (2001) 292: 104-6. 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Scholar]
- Libina N, Berman JR, Kenyon C. Activités tissulaires spécifiques de C. elegans DAF-16 dans la régulation de la durée de vie. Cell (2003) 115: 489-502. 10.1016 / S0092-8674 (03) 00889-4 [PubMed] [CrossRef] [Google Scholar]
- Broughton S, Partridge L. Signalisation de type insuline / IGF, système nerveux central et vieillissement. Biochem J. (2009) 418: 1-12. 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Scholar]
- Reindl KM, Sheridan MA. Régulation périphérique du système de facteur de croissance analogue à l'hormone de croissance chez les poissons et autres vertébrés. Comp Biochem Physiol A Mol Integr Physiol. (2012) 163: 231–45. 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [Google Scholar]
- Snell GD. Nain, un nouveau caractère récessif mendélien de la souris domestique. Proc Natl Acad Sci USA. (1929) 15: 733-4. 10.1073 / pnas.15.9.733 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Rôle de l'axe GH / IGF-1 dans la durée de vie et la durée de vie: leçons des modèles animaux. Hormon de croissance IGF Res. (2008) 18: 455–71. 10.1016 / j.ghir.2008.05.005 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Extension de la durée de vie et retard du vieillissement immunitaire et du collagène chez les souris mutantes présentant des défauts de production d'hormone de croissance. Proc Natl Acad Sci USA. (2001) 98: 6736–41. 10.1073 / pnas.111158898 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Brown-Borg HM, Borg KE, Meliska CJ, Bartke A. Souris naines et le processus de vieillissement. Nature (1996) 384: 33. 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Scholar]
- Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Prolonger la durée de vie des souris à longue durée de vie. Nature (2001) 414: 412. 10.1038 / 35106646 [PubMed] [CrossRef] [Google Scholar]
- Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. Le traitement par l'hormone de croissance précoce raccourcit la longévité et diminue la résistance au stress cellulaire chez les souris mutantes à longue durée de vie. FASEB J. (2010) 24: 5073–9. 10.1096 / fj.10-163253 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA, et al .. La perturbation hormonale libérant l'hormone de croissance prolonge la durée de vie et régule la réponse à la restriction calorique chez la souris. Elife (2013) 2: e01098. 10.7554 / eLife.01098 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Évaluation des paramètres de croissance et de la durée de vie des souris perturbées par le gène GHR / BP. Endocrinology (2000) 141: 2608-13. 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Scholar]
- Ikeno Y, Hubbard GB, Lee S, Cortez LA, Lew CM, Webb CR, et al .. Incidence réduite et occurrence retardée de maladies néoplasiques fatales chez les souris knock-out de récepteur d'hormone de croissance / protéine de liaison. J Gerontol A Biol Sci Med Sci. (2009) 64: 522–9. 10.1093 / gerona / glp017 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Gesing A, Wiesenborn D, Do A, Menon V, Schneider A, Victoria B, et al .. Une souris à longue durée de vie dépourvue d'hormone de croissance et de récepteur d'hormone de croissance: un nouveau modèle animal pour les études sur le vieillissement. J Gerontol A Biol Sci Med Sci. (2017) 72: 1054–61. 10.1093 / gerona / glw193 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Bonkowski MS, Rocha JS, Masternak MM, Al Regaiey KA, Bartke A. Une perturbation ciblée du récepteur de l'hormone de croissance interfère avec les actions bénéfiques de la restriction calorique. Proc Natl Acad Sci USA. (2006) 103: 7901-5. 10.1073 / pnas.0600161103 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Coschigano KT, Holland AN, Riders ME, List EO, Flyvbjerg A, Kopchick JJ. La suppression, mais pas l'antagonisme, du récepteur de l'hormone de croissance de la souris entraîne une réduction sévère du poids corporel, de l'insuline et des niveaux de facteur de croissance de type insuline I et une durée de vie accrue. Endocrinology (2003) 144: 3799-810. 10.1210 / fr.2003-0374 [PubMed] [CrossRef] [Google Scholar]
- Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, et al .. Le récepteur IGF-1 régule la durée de vie et la résistance au stress oxydatif chez la souris. Nature (2003) 421: 182–7. 10.1038 / nature01298 [PubMed] [CrossRef] [Google Scholar]
- Bokov AF, Garg N, Ikeno Y, Thakur S, Musi N, DeFronzo RA, et al .. La signalisation IGF-1R réduite chez les souris Igf1r +/- altère-t-elle le vieillissement? Plos ONE (2011) 6: e26891. 10.1371 / journal.pone.0026891 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. L'effet de longévité de la mutation IGF-1R +/− dépend de l'activation du récepteur génétique spécifique. Aging Cell (2014) 13: 19-28. 10.1111 / acel.12145 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Mulvey L, Sinclair A, Selman C. Modulation de la durée de vie chez la souris et les effets confondants du patrimoine génétique. J Genet Genomics (2014) 41: 497-503. 10.1016 / j.jgg.2014.06.002 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Kappeler L, De Magalhaes Filho C, Dupont J, Leneuve P, Cervera P, Périn L, et al .. Les récepteurs IGF-1 du cerveau contrôlent la croissance et la durée de vie des mammifères grâce à un mécanisme neuroendocrinien. PLOS Biol. (2008) 6: e254. 10.1371 / journal.pbio.0060254tt [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Svensson J, Sjögren K, Fäldt J, Andersson N, Isaksson O, Jansson JO, et al. L'IGF-1 dérivé du foie régule la durée de vie moyenne des souris. PLoS ONE (2011) 6: e22640 10.1371 / journal.pone.0022640 [Article PMC gratuit] [PubMed] [CrossRef] [Google Scholar]
- Conover CA, Bale LK. La perte de protéine plasmatique A associée à la grossesse prolonge la durée de vie chez la souris. Aging Cell (2007) 6: 727–9. 10.1111 / j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. Sci. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015