
Quel est le plus sur la planète? Qu'est-ce qui est au sommet de nos besoins avec l'air et la nourriture? Selon une plaisanterie barbu, qu'est-ce qui fait qu'une personne est apparentée à un concombre? La réponse est simple: l'eau. Ce composé chimique joue un rôle central dans de nombreux macro et micro-processus: du changement climatique à la structure chimique des organismes vivants. Le H
2 O possède un certain nombre de propriétés chimiques et physiques qui sont d'une manière ou d'une autre utilisées par les scientifiques dans divers domaines. La modification de certains paramètres entraîne l'apparition de nouvelles propriétés ou une modification des anciennes. Dès notre jeune âge, beaucoup d'entre nous savent que l'eau dans des conditions normales bout à 100 ° C et gèle à des températures inférieures à 0 ° C. Et puis les scientifiques ont décidé de changer cela.
Aujourd'hui, nous vous rencontrerons une étude dans laquelle les scientifiques ont pu créer de l'eau qui ne gèle pas même à -263 ° C. Quelles manipulations ont été effectuées pour y parvenir, quelles nouvelles propriétés et caractéristiques l'eau liquide «éternellement» a-t-elle commencé à posséder et quelle est l'utilité de cette recherche? Nous chercherons des réponses dans le rapport du groupe de recherche. Allons-y.
Base d'étude
La base de ce travail est le processus de prévention de la cristallisation de l'eau à basse température. Pour cela, il faut changer la géométrie de l'eau, dans laquelle le soi-disant «confinement», c'est-à-dire la rétention, peut aider. Ce mécanisme aide à empêcher la cristallisation à basse température des molécules dans une structure hexagonale, résultant en de l'eau amorphe. Les scientifiques ont appelé cette rétention physique de l'eau au niveau de la nanoconfiguration nanométrique. C'est plus facile à dire qu'à faire, mais les scientifiques ne seraient pas des scientifiques s'ils n'avaient pas la ténacité et une paire d'as dans leur manche. Les as étaient des lipides artificiels avec des modifications cyclopropyliques dans les chaînes hydrophobes, qui présentent un comportement unique des cristaux liquides à basse température. Ces lipides peuvent maintenir l'état amorphe de l'eau jusqu'à -263 ° C.
En tant que modèle d'eau fermée dans un environnement cellulaire, les scientifiques ont choisi le confinement à l'intérieur d'interfaces douces, telles que celles formées lors de l'auto-organisation des surfactants en milieu aqueux. Un tel modèle peut aider à comprendre les mécanismes de survie cellulaire à basse température.
Les chercheurs attirent notre attention sur le fait que les effets dimensionnels se manifestent dans différentes phases formées par les
monoacylglycérols hydratés
* à différentes températures et niveaux d'
hydratation * .
Les monoacylglycérols * sont une classe de glycérides qui se composent d'une molécule de glycérol liée à un acide gras via une liaison ester (ester).
Hydratation * - ajout à des molécules d'eau ou à des ions.
Les monoacylglycérols ont un polymorphisme, c'est-à-dire une structure cristalline différente selon les conditions: lamellaire (L
α ), inverse bicontinue cubique (Q
II ), inverse hexagonale (H
II ), inverse micellaire (L
2 ).
Le problème est que cette variété d'options est perdue lorsque des températures inférieures à la température ambiante sont atteintes, lorsque la classe générale de lipides cristallise en une phase lamellaire (L
c ), dans laquelle les queues lipidiques sont emballées dans un réseau cristallin à longue portée. Si la température descend en dessous de zéro, alors la coexistence de la phase lamellaire L
c et de la glace se retrouve à tous les niveaux d'hydratation.
Il s'avère que vous ne pouvez pas utiliser de tels lipides? Pas vraiment. Les lipides peuvent être modifiés afin que leurs propriétés positives puissent être appliquées, en évitant les restrictions indésirables. Dans des études précédentes, les scientifiques ont réussi à remplacer la double liaison cis au milieu de la chaîne lipidique monooléine par un groupe cyclopropyle. À la suite de cette manipulation, un nouveau lipide sera obtenu - la monodihydrosterculine (MDS), dont le comportement de phase montre l'absence de la phase hexagonale inverse et la stabilité de la phase Q
II D à des températures allant jusqu'à 4 ° C.
Sur la base des développements et théories ci-dessus, les scientifiques ont présenté leur propre étude, qui décrit un nouveau type de mésophases formant des lipides avec des propriétés non standard à basse température. La propriété la plus frappante est la capacité de retenir l'eau vitreuse à des températures allant jusqu'à 10 K et à des vitesses de refroidissement très faibles.
Polymorphisme lipidique
Pour commencer, les scientifiques expliquent certaines nuances concernant le polymorphisme lipidique. Dans la nature, il existe actuellement un nombre très limité de lipides pouvant former des phases Q
II .
Les chaînes lipidiques fournissent les éléments fondamentaux de toutes les mésophases. Leur structure moléculaire, une certaine longueur, courbure, position et degré d'insaturation affectent la
mésophase finale
* .
Mésophase * - l'état d'une substance entre un liquide et un solide.
Si nous remplaçons la double liaison cis des monoacylglycérols par un fragment cis-cyclopropyle, la courbure de la chaîne et la longueur des lipides seront réduites à l'original, mais le compactage fractionné et la tension latérale des queues seront considérablement modifiés. Et pour changer la rigidité de la queue lipidique, il est nécessaire de changer le nombre et la position des groupes cyclopropyles, ainsi que la longueur et la courbure des chaînes hydrophobes.
Au cours de l'étude, les scientifiques ont synthétisé trois lipides (les structures sont représentées en
1a ): la monodihydrostéruline (MDS), le lipide de cyclopropane monolactobacilline (MLB) - un analogue du monovaccin (MV) et le DCPML - monolinoléine (ML).
 Image n ° 1
Image n ° 1Les graphiques ci-dessus montrent les résultats de la diffusion des rayons X aux petits angles (MPR): diagramme de phase de la composition et de la température de l'échantillon MLB (
1b ), diagramme de phase de la composition et de la température de l'échantillon DCPML (
1c ).
À en juger par les observations, le MLB hydraté a une séquence de transition, comme dans les monoacylglycérols classiques (
1b ), dans laquelle L
α , Q
II G et Q
II D sont observés avec un niveau d'hydratation croissant. Contrairement au MDS, la phase H
II est présente dans le MLB à haute température.
Il a été possible de découvrir que la phase H
II et la phase cubique Q
II D restent stables au-dessus de l'eau. Cette observation a permis de déterminer le degré d'hydratation limite pour les deux phases en analysant les paramètres du réseau à chaque niveau d'hydratation.
Dans le cas du lipide DCPML, les scientifiques ont remarqué un phénomène inhabituel - la formation d'une phase cubique Q
II G à 22 ° C avec une teneur en eau de seulement 5% (
1s ).
Des études antérieures ont montré que la formation de H
II avec des monoacylglycérols hydratés purs n'est possible qu'à des températures élevées (supérieures à la température ambiante). Les phases H
II stables à température ambiante et physiologique (≈ 36,6 ° C) nécessitent l'utilisation de molécules hydrophobes ou la présence d'un éther plutôt que d'une liaison ester.
La formation de la phase H
II à température ambiante suggère un changement dans le diagramme de phase DCPML vers des températures et une hydratation plus basses, ce qui a été confirmé dans cette étude.
Un échantillon de DCPML avec 12,5% d'eau a d'abord été refroidi progressivement à -20 ° C, puis à nouveau chauffé à 22 ° C. À la fin de chaque étape de refroidissement et de chauffage, le système était équilibré et des données MPP ont également été collectées (
2a ).
 Image n ° 2
Image n ° 2La transition de phase de L
α à Q
II G se produit dans la plage de température −15 ... −10 ° C pendant les procédures de chauffage et de refroidissement. Il a également été révélé la formation d'une nouvelle phase cubique lipidique stable à basse température. Lorsqu'il est chauffé, le rayon du canal d'eau de la phase Q
II G diminue - de 8,4 Å à -10 ° C à 7,8 Å à 22 ° C.
En conséquence, les scientifiques ont reçu une phase cubique Q
II G absolument stable à des températures inférieures à zéro. Cette observation contredit les faits généralement acceptés selon lesquels les lipides (par exemple, la monooléine) forment des phases cubiques, qui cristallisent en une phase cristalline lamellaire et de la glace à des températures inférieures à 0 ° C.
Propriétés et comportement de l'eau
La nature cristalline du DCPML à basse température indique les caractéristiques non standard de l'eau contenue dans les nanocanaux. La taille des zones d'eau (plaques ou canaux) peut être manipulée en modifiant le rapport eau / lipides. Les transitions de fusion ont été étudiées en utilisant des mesures de calorimétrie différentielle à balayage (DSC) des mésophases à différents niveaux d'hydratation (
2b ).
Les échantillons DCPML ont subi un traitement thermique cyclique (chauffage - refroidissement - chauffage) de -70 ° C à 60 ° C avec une vitesse de balayage de 5 ° C par minute. Ce que nous voyons dans le graphique
2b a été obtenu lors du deuxième processus de chauffage. À une concentration en eau de 20 et 25% dans l'échantillon, un pic de fonte des glaces est visible à 0 ° C, ce qui est typique de l'eau pure (sans ajout de lipides). Si l'hydratation augmente, ce pic commence à diminuer (15% d'eau), puis disparaît complètement (5% et 10% d'eau). La conclusion est assez évidente - le confinement dans les phases L
α et Q
II G à un faible niveau d'hydratation empêche la cristallisation de l'eau à la vitesse de refroidissement considérée.
De plus, dans le graphique
2b , de petits pics peuvent être observés à des températures élevées, qui correspondent à des transitions entre différentes géométries et correspondent aux résultats de MPP (
1c ). Les différences de température de transition de plusieurs degrés peuvent s'expliquer par des vitesses de chauffage différentes et, par conséquent, des temps d'équilibrage différents. Bien sûr, il ne faut pas oublier l'erreur (1,5%), qui dépend de la composition des différents échantillons.
Les scientifiques notent que la formation de glace est présente dans le ML à des températures allant jusqu'à -60 ° C, tandis que l'état amorphe est préservé dans le DCPML. Cela suggère que le confinement seul ne peut pas empêcher la cristallisation, mais fonctionne en conjonction avec le comportement des cristaux liquides des lipides pour y parvenir.
Ensuite, les échantillons ont été refroidis à -263 ° C à une vitesse de 0,1 ° C par minute, équilibrés puis chauffés à la même vitesse. Dans les images
2c et
2d, nous voyons les résultats des mesures FWS pendant le chauffage, qui montrent l'absence d'une transition de premier ordre dans DCPML avec une faible teneur en eau. Les scientifiques ont choisi un échantillon avec une teneur en eau de 7,5% afin d'assurer une géométrie uniforme dans toute la plage de température en dessous de zéro.
Les profils FWS des graphiques
2c et
2d ne montrent aucun saut dans la région de 0 ° C, bien qu'une augmentation de la mobilité soit observée à une température d'environ -50 ° C. Les scientifiques notent que la mésophase obtenue à partir de ML commercial au lieu de DCPML avec la même topologie et la même teneur en eau montre une fusion à une température d'environ -10 ° C (pics dans les encarts en
2s et
2d ). Le DCPML à 15% d'eau dans l'échantillon montre également un saut, ce qui correspond à la fonte de la glace à une température d'environ -10 ° C. Cependant, à en juger par les données DSC, l'intensité de transition dans ce cas est beaucoup plus faible, c'est-à-dire qu'une partie seulement de l'eau est impliquée dans la formation de glace. Et l'absence de saut pour la transition lipide-lipide confirme l'absence de la phase cristalline L
c dans DCPML.
Des expériences utilisant la diffraction des rayons X à grand angle (WAXS) à basses températures ont montré la structure hexagonale de la glace dans les échantillons avec une hydratation de 20% et 25 (
2e ), ainsi que l'absence de cristallisation dans la région WAXS pour les autres échantillons. Les données d'observation confirment à nouveau la nature cristalline liquide de la phase lamellaire (L
α ) et l'absence de glace cristalline à faible hydratation.
Enfin, les scientifiques ont également utilisé la spectroscopie RMN pour étudier la mobilité de l'eau et le comportement des phases (
2f ). Pour un échantillon contenant 7,5% d'eau, la limite de détection a été atteinte à 0 ° C, ce qui indique un coefficient de diffusion inférieur à 10
-11 m
2 / s. Et pour un échantillon avec 10% de diffusion a été observée à -11 ° C.
Ainsi, la dépendance quasi-linéaire à la température de la diffusion confirme l'état liquide de l'eau dans la plage de températures considérée, et des informations supplémentaires obtenues à partir des analyses FWS et DSC confirment la transition de l'eau du liquide au vitreux à basse température.
 Image n ° 3
Image n ° 3Les scientifiques ont combiné toutes les données collectées et ont pu composer un diagramme de phase de l'eau contenue dans les mésophases DCPML (
3a ).
Il convient de noter que les processus et les caractéristiques observés sont étroitement liés aux caractéristiques qui distinguent le DCPML de tous les autres monoacylglycérols connus, à savoir le décalage général des transitions de phase vers des températures et une hydratation plus basses, ainsi que l'absence de L
c même à des températures extrêmement basses.
L'image
3b montre les résultats des mesures MPR de la géométrie lipidique, superposées au sommet du diagramme de phase de l'eau (
3a ). Pendant l'hydratation, la transition inverse L
α → Q
II G → L
α est observée dans la plage de température de -10 ° C à 0 ° C. Il est intéressant de noter que la présence d'eau liquide à des températures inférieures à zéro est associée à la stabilité de la phase cubique Q
II G. Et avec une diminution de l'hydratation pendant le refroidissement, la combinaison du trouble lipidique et de la restriction de phase géométrique L
α empêche la formation de glace à n'importe quelle température.
Si le degré d'hydratation augmente, la formation de glace hexagonale sera observée. Les observations ont montré qu'avec une hydratation de 20% et un refroidissement de l'échantillon à -30 ° C, la phase Q
II G est stable pendant plusieurs heures, sans qu'aucune glace ne soit détectée. La transition vers la phase L
α se produit après une incubation de l'échantillon pendant 1 heure à une température de -40 ° C, et ici la formation de glace est déjà observée. Lorsqu'elle est chauffée à partir de -40 ° C, la phase L
α reste stable jusqu'à 0 ° C. Entre -40 ... -20 ° C, le paramètre de réseau α montre la diminution attendue (de 39,2 Å à 38,4 Å), typique des mésophases. Mais déjà dans la gamme de -20 ... -10 ° C, la situation est inverse: une augmentation de 38,4 Å à 39,2 Å, qui est généralement associée à une hydratation accrue de la bicouche lipidique.
En plus de toutes les observations, mesures et diverses techniques de balayage, les scientifiques ont également utilisé la modélisation de la dynamique moléculaire pour confirmer les résultats de l'étude.
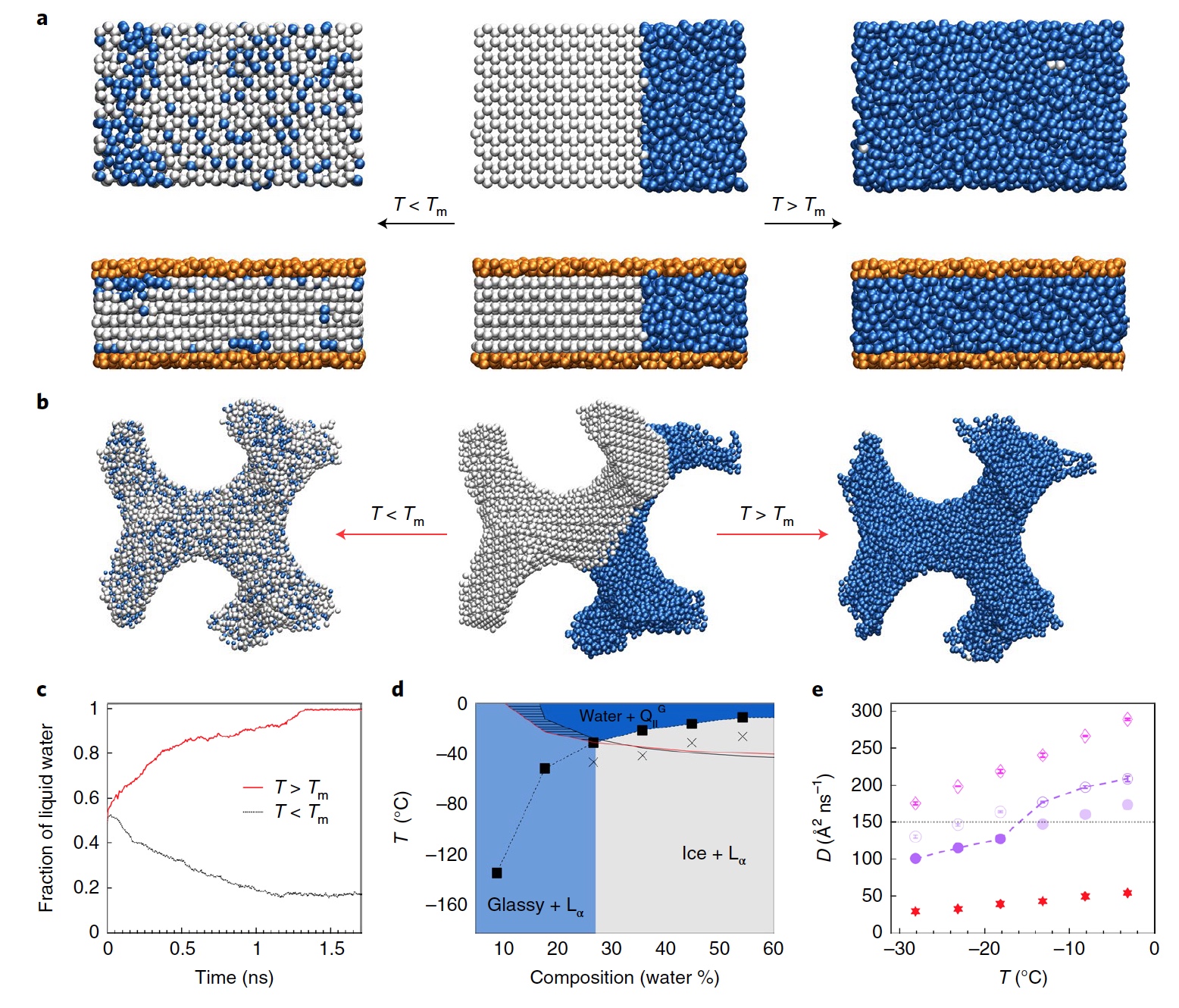 Image n ° 4
Image n ° 4Les chercheurs sont bien conscients que les résultats d'une telle simulation dépendent fortement de tout un ensemble de variables: l'interaction entre l'eau et les molécules lipidiques, la transition lipide-lipide, le seuil de transition vers l'état vitreux, etc. Cependant, ils soutiennent que les résultats de leur modélisation sont pleinement cohérents avec les observations.
La figure
4a montre un modèle de dynamique moléculaire pour la température de fusion de la mésophase de la plaque à 54,3% d'hydratation. Au centre, nous voyons la configuration de départ, qui est partiellement remplie de glace (sphères blanches) et d'eau liquide (sphères bleues). La configuration finale sous le point de fusion est indiquée à gauche. Et à droite - au-dessus du point de fusion. La rangée supérieure est un système sans lipides, celle du bas avec des lipides (sphères orange). Les images
4b sont une présentation de l'eau enfermée dans une phase cubique Q
II G avec une hydratation de 54,3%, pour la configuration initiale (au centre) et finale en dessous (à gauche) et au-dessus (à droite) de la température de fusion. À son tour, le graphique
4c montre l'évolution temporelle de l'eau au-dessus (ligne rouge) et en dessous (ligne noire) du point de fusion.
Les chercheurs notent qu'avec une faible hydratation, le système suit un comportement «standard», c'est-à-dire qu'il passe de la structure cubique à la structure lamellaire (
4d ). Lors du refroidissement, la phase Q
II G passe à L
α , montrant une diminution soudaine de la mobilité de l'eau (
4e ). Moins de mobilité signifie que le système a besoin de plus de temps pour s'équilibrer. Dans ce mode, le processus de refroidissement traverse la ligne de fusion après que la diffusion soit déjà difficile, c'est-à-dire avant la cristallisation de l'eau, à la suite de quoi on observe de l'eau vitreuse.
Pour une connaissance plus détaillée des nuances de l'étude, je vous recommande fortement de consulter le
rapport des scientifiques .
Épilogue
Les scientifiques ont l'habitude d'élargir les frontières de notre vision du monde, en comprenant divers processus et phénomènes. Certaines études sont le point de départ de technologies futures et de nouvelles découvertes, et certaines ne sont que de la curiosité. Aujourd'hui appartient à la première catégorie. Comprendre le comportement des deux éléments les plus importants de la vie (l'eau et les lipides) à des températures extrêmement basses peut aider à développer de nouvelles méthodes de diagnostic et d'analyse des biomatériaux difficiles voire impossibles à analyser à température ambiante en raison de leur instabilité. Les scientifiques parlent également de la perspective de changements dans les cellules vivantes, c'est-à-dire de leur modification du fonctionnement normal à des températures très basses. En d'autres termes, si nous considérons les hypopsychroplanes (−50 ° C et en dessous) et les psychroplanes (−50 à 0 ° C) comme des options possibles pour la colonisation, alors cette étude n'est qu'un petit pas sur la voie.
Merci de votre attention, restez curieux et bonne semaine de travail, les gars!
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir des matériaux plus intéressants? Soutenez-nous en passant une commande ou en le recommandant à vos amis, une
réduction de 30% pour les utilisateurs Habr sur un analogue unique de serveurs d'entrée de gamme que nous avons inventés pour vous: Toute la vérité sur VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbps à partir de 20 $ ou comment diviser le serveur? (les options sont disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbit / s jusqu'à l'été gratuitement lorsque vous payez pour une période de six mois, vous pouvez commander
ici .
Dell R730xd 2 fois moins cher? Nous avons seulement
2 x Intel Dodeca-Core Xeon E5-2650v4 128 Go DDR4 6x480 Go SSD 1 Gbps 100 TV à partir de 249 $ aux Pays-Bas et aux États-Unis! Pour en savoir plus sur la
création d'un bâtiment d'infrastructure. classe utilisant des serveurs Dell R730xd E5-2650 v4 coûtant 9 000 euros pour un sou?