Dédié à tous désespérés et désespérés ... desserrer un écrou rouillé!Le printemps est définitivement arrivé dans les rues de nos villes. Il est devenu plus chaud et les gens joyeux ont commencé à donner la préférence à leurs vrais amis de fer, oubliant au moins temporairement les tablettes et les smartphones. Les cyclistes, les motocyclistes et de nombreux autres amateurs de véhicules saisonniers se sont lancés et ont soudainement constaté que quelque chose était rouillé, quelque chose ne pouvait pas être dévissé, etc. etc. J'avoue, je suis de ceux qui ont découvert :) Et pour que le travail de lutte contre la corrosion ne soit pas vain, j'ai décidé de remplir le matériel accumulé dans un article habr.
Les informations seront certainement utiles à absolument tous ceux qui ont eu au moins une fois à traiter des pièces rouillées, non seulement les amateurs de voitures et les femmes au foyer, mais aussi les restaurateurs d'équipement, ceux qui vont peindre des poteaux rouillés dans le pays / souffrent de taches rouillées sur l'évier et veulent juste aller au fond du processus rouille et trouver des méthodes pour lutter efficacement contre ce fléau. Aujourd'hui, nous parlons de comment réveiller «l'acier endormi».
Eh bien, traditionnellement - n'oubliez pas de mettre en signet,% USERNAME%, c'est pratique! :)
Contexte chimique
Nous vivons dans un monde de fer et de ses alliages. Et là où il y a du fer, il y aura certainement ses oxydes sous forme de rouille. Tout élément en fer rouille à l'air libre, la seule question est de savoir à quelle vitesse. Lorsqu'ils sont exposés à l'eau, à l'oxygène, aux gaz agressifs contenus dans l'air, les métaux ferreux se transforment facilement en formes chimiquement résistantes de leurs composés. Ce processus naturel de transition des métaux en oxydes, hydroxydes et sels commence avec la surface, de sorte que la surface non protégée des métaux ferreux est toujours recouverte d'un film de produits de corrosion. L'épaisseur de ces films dépend des conditions de formation et varie de fractions de micromètre à plusieurs millimètres. Le processus de corrosion se développe avec le temps, même dans des conditions de stockage favorables, car de nombreux sels sont hygroscopiques et les formations d'oxyde et d'hydroxyde en vrac absorbent et retiennent l'eau de l'air, ce qui contribue au développement du processus de corrosion.
En fait, la rouille des métaux est simplement l'oxydation du fer par l'oxygène atmosphérique, dans laquelle l'eau agit comme un «catalyseur». Tout cela est décrit par trois réactions principales:
O
2 + 4e
- + 2H
2 O → 4OH
-Fe → Fe
2+ + 2
-4Fe
2+ + O
2 → 4Fe
3+ + 2O
2-Le fer, étant un métal assez actif, dégage des électrons et s'oxyde; l'eau accepte ces électrons et alcalinise le milieu réactionnel avec des ions OH
- . Les ions ferreux en combinaison avec OH
- précipitent dans un précipité insoluble d'hydroxyde de fer (II), qui commence progressivement à former diverses combinaisons d'oxydes / hydroxydes en présence du même oxygène, y compris en raison des processus de déshydratation progressive.
Fe
2+ + 2H
2 O ⇌ Fe (OH)
2 + 2H
+Fe
3+ + 3H
2 O ⇌ Fe (OH)
3 + 3H
+Fe (OH)
2 ⇌ FeO + H
2 O
Fe (OH)
3 ⇌ FeO (OH) + H
2 O
2FeO (OH) ⇌ Fe
2 O
3 + H
2 O
La composition de la rouille, respectivement, change lentement au fil du temps, en fonction des conditions de l'atmosphère environnante (excès / manque d'oxygène et d'eau)
Mécanisme antirouille en une seule image Comme déjà mentionné, la composition de la rouille formée peut varier en fonction du type d'acier, de la présence d'électrolytes, de l'agressivité de l'impact et de sa durée. En général, on pense qu'il existe 16 oxydes de fer ayant une structure cristalline, une composition chimique et un état de valence différents du fer, qui peuvent théoriquement être trouvés dans la rouille. Dans notre région, la plupart de la rouille formée à température ambiante peut contenir de la
goethite (α-FeO (OH)), de l'
acaganite (β-FeO (OH)), des
lépidocrocytes (γ-FeO (OH)) et de la
magnétite (Fe
3 O
4 ; Fe (II), Fe (III)
2 O
4 ). Je recommande de se souvenir de ces noms, ils sont toujours utiles. La plupart des chercheurs conviennent que la principale composante cristalline de la rouille est le γ-FeO (OH), qui, lorsqu'il est chauffé, se transforme en γ-Fe
2 O
3 . Si une pièce ou un produit rouille depuis longtemps dans une atmosphère humide, de petites quantités de Fe
3 O
4 (souvent de composition non stœchiométrique) peuvent être détectées dans la rouille. Les échantillons rouillés dans l'eau distillée sont de la rouille provenant de α-FeO (OH), γ-FeO (OH) et Fe
3 O
4 cristallins. Si le métal subit de la rouille dans la chambre de brouillard
salin , le principal composant cristallin de la rouille est le γ-FeO (OH) avec une structure lamellaire et poreuse.
Je voudrais également rappeler que les sels, en particulier les ions chlorures, agissent comme une sorte de catalyseur électrochimique qui accélère la corrosion (nos routes d'hiver et les fonds de véhicules ne vous laisseront pas mentir) et contribuent à la formation de γ-FeO (OH). Il existe des études dans lesquelles les auteurs comparent la rouille prélevée pour l'analyse en divers endroits (côtiers, continentaux, etc.). La rouille formée dans les zones côtières était principalement sous la forme de gros flocons; dans les zones à forte humidité et chlorures dans les sols, la rouille en forme de feuille s'est formée, et la rouille poudreuse et à grains fins était le lot des territoires du centre et du nord. Des échantillons de rouille en couches contenaient du γ-Fe
2 O
3 · H
2 O sur la surface de contact avec l'air et du Fe
3 O
4 sur la surface de contact avec le métal, α-FeOOH et δ-FeOOH ont été trouvés dans les couches intermédiaires et dans les flocons.
Pourquoi est-ce que je dis tout cela, et ensuite que j'ai besoin de connaître l'ennemi en personne. Plus le type de rouille est déterminé avec précision - plus il est efficace de le dissoudre.
Il est bien connu qu'en fonction des conditions environnementales, une rouille multicolore peut se former: rouille rouge (l'oxyde hydraté Fe
2 O
3 · H
2 O se forme à des niveaux élevés d'oxygène et de vapeur d'eau, le plus souvent il s'agit d'une corrosion atmosphérique uniforme dans des environnements très agressifs.), rouille jaune (la soi-disant rouille solvatée, FeO soluble (OH) · H
2 O se forme dans des conditions d'humidité élevée, le plus souvent si le métal était dans une flaque d'eau / eau stagnante), rouille brune (oxyde sec Fe
2 O
3 , qui est formé à haute teneur en oxygène Oui, et à faible humidité, le plus souvent c'est de la rouille localisée, qui se manifeste sous forme de taches hétérogènes ou uniquement dans certaines zones (contamination et défauts sur la surface métallique) et de rouille noire (oxyde de Fe
3 O
4 qui se forme dans un environnement à faible teneur en oxygène et faible humidité est un type de rouille stable, semblable à la couche de revêtement qui se produit lorsque le métal est oxydé).
Si des ions de divers acides inorganiques entrent en jeu (carbonates, sulfates, chlorures déjà mentionnés, ainsi que bromures, fluorures, iodures, nitrates et sélénates), ce que l'on appelle
rouille verteLa rouille verte est le nom commun de divers composés verts cristallins contenant des cations de fer et les anions mentionnés ci-dessus. Cette beauté (?) Se forme sur des surfaces en fer / fonte / acier exposées à de l'eau contenant des ions chlorure, sulfate, carbonate ou bicarbonate dans des conditions aérobies / anaérobies alternées. Par exemple, dans les navires, les ponts, etc. Une vue générale de la structure cristalline de la rouille verte est montrée dans l'image. En principe, nous pouvons supposer que la structure des «nuances de rouille» habituelles est à bien des égards semblable à celle du vert, mais sans anions acides.
Bien que la rouille soit généralement un aspect négatif, il existe des exemples où elle sert également la personne. Un exemple est le bleuissement des troncs d'armes (y compris le traitement avec le soi-disant «vernis à rouille») et les lames de couteaux maison.
Barils de pistolet après traitement antirouilleVoici à quoi ils ressemblent juste après le traitement:
Et donc - après le polissage:
Un mince film d'oxyde de «rouille noire» (décrit ci-dessus) est formé sur le métal, protégeant le métal d'une oxydation supplémentaire. Ce processus est également appelé oxydation:
Oxydation - la création d'un film d'oxyde à la surface d'un produit ou d'une pièce à la suite d'une réaction redox. L'oxydation est principalement utilisée pour obtenir des revêtements protecteurs et décoratifs, ainsi que pour la formation de couches diélectriques.
À titre d'exemple, nous pouvons citer la colonne de fer (alias
colonne Kutubova ) à Delhi - un cylindre de sept mètres de haut et pesant six tonnes et demie, qui fait partie de l'ensemble architectural Qutb Minar, situé à environ 20 kilomètres au sud de Old Delhi. La colonne est devenue célèbre grâce au fait que pendant 1600 ans d'existence, elle a pratiquement évité la corrosion.
Ce à quoi ils ne s'attendaient pas à propos de cette colonne, de «fait de fer de météorite» à «cadeau de Shiva». Mais, traditionnellement, la réponse était simple: «des températures élevées et de l'air sec»
sauveront le père de la démocratie russe. Un mince film d'oxyde protège le métal de la rouille s'il n'est exposé qu'à de l'eau douce ou de l'air sec.
Rouille filetée telle quelle
Si nous introduisons brièvement le mécanisme de la rouille du fil, il s'avère qu'il ne diffère pratiquement pas de la rouille du métal en surface. Initialement, l'eau pénètre dans les canaux inter-filetés (entre l'écrou et le boulon), qui, en combinaison avec l'oxygène de l'air et les électrons de fer, déclenchent les processus décrits par les formules ci-dessus. À la suite de ce processus, des oxydes et hydroxydes de fer commencent à se former, qui, selon les conditions, subissent des cycles d'hydratation / déshydratation et forment une structure poreuse monolithique. On peut dire que la rouille à l'intérieur d'un fil diffère de la rouille d'un métal ouvert en ce sens qu'un manque d'oxygène peut être observé à l'intérieur du fil et que quelque chose de similaire à la rouille noire se formera (Fe
3 O
4 ).
Le phénomène le plus proche de l '«aigrissement» est probablement la rouille du béton armé. Les mêmes conditions manquent d'oxygène. Dans de telles conditions, le volume des oxydes libres formés à la suite de l'oxydation est beaucoup plus grand que le volume du métal ayant réagi. Les oxydes remplissent complètement tous les pores et fuites (fils ou saillies près du renfort), agissant comme une sorte d'agent de soutènement ou de scellant.
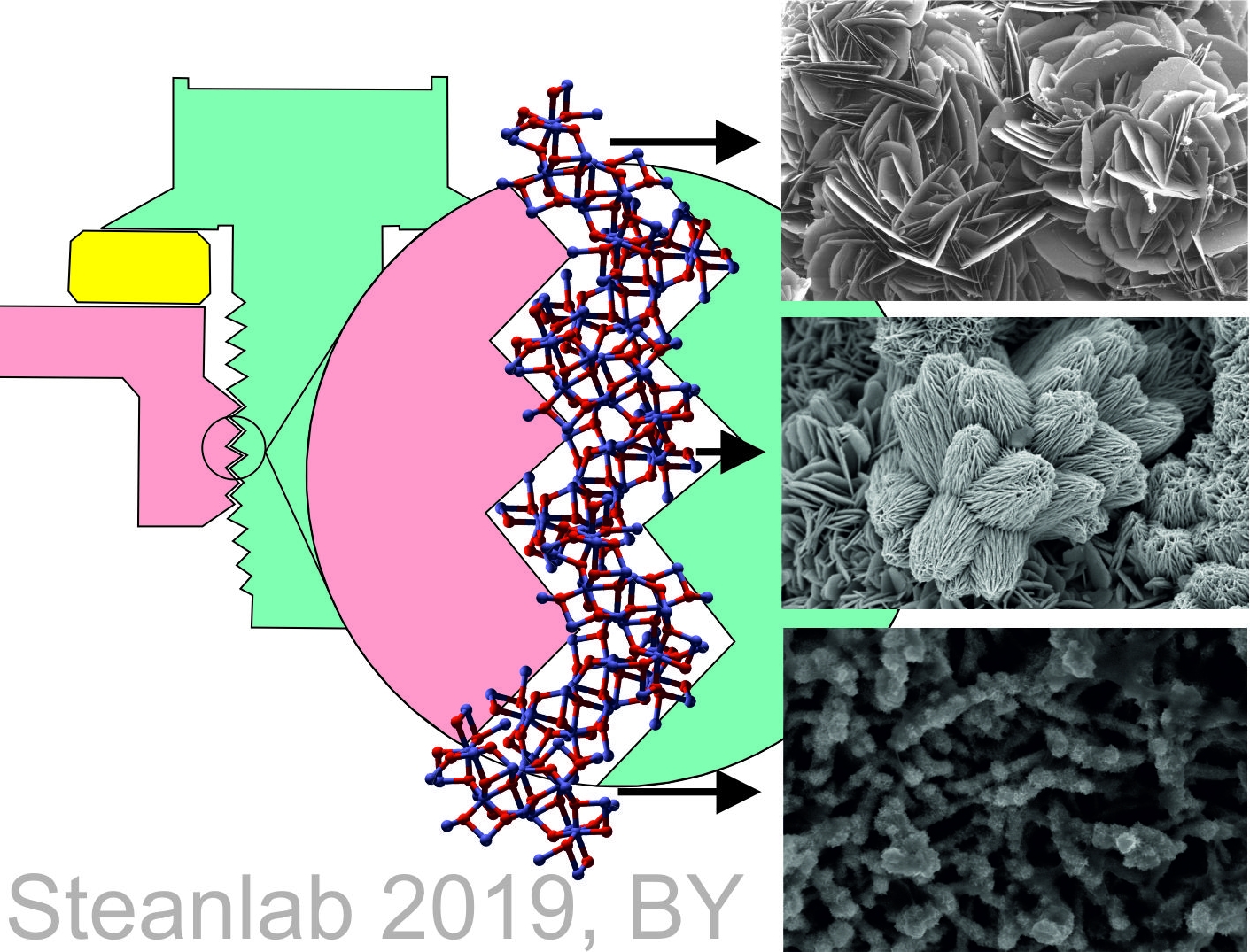
À la suite du processus décrit, lentement mais inexorablement vrai, la rouille presse tout ce qui est en contact avec elle et détruit le béton, bloque le fil, etc. Il existe même une chose telle que «l'emballage de la rouille» ou «la rouille de l'emballage», qui en traduction dans le grand et puissant signifie «la rouille de l'emballage». On l'observe dans les cas où le volume des oxydes formés avec sa pression de calage évince les parties métalliques adjacentes aux endroits de corrosion. L'exemple le plus célèbre des effets de la rouille en lots peut être l'
effondrement du pont sur la rivière Myanus aux États-Unis en 1983 avec de nombreuses victimes.
Une enquête spéciale a révélé que la corrosion résultant de l'eau de pluie pénétrant dans les structures métalliques du pont en raison d'une technologie de drainage défectueuse s'est progressivement répandue dans les montures en fer. Les éléments de fixation se sont progressivement rouillés et ont poussé un coin de la dalle de la route du support en millimètres. Lorsque la distance est devenue suffisante pour la destruction, une voiture qui passait a servi de déclencheur. Depuis lors, un nouveau terme est apparu dans la construction de ponts et est activement utilisé lorsque des signes d'accumulation de rouille entre les plaques d'acier et les joints de ponts sont observés lors de l'inspection du pont.
Béton écrasé, mais ne peut pas manipuler le boulon J'espère que la mécanique du processus est à peu près claire. Il est nécessaire pour évaluer les méthodes existantes de lutte contre la rouille filetée (presque "en lots").
Méthodes de destruction de la rouille à l'intérieur d'un fil
De la manière la plus simple, pour dévisser le boulon, vous devez faire deux choses
- Détruire (= disperser) la masse poreuse monolithique d'oxydes et d'hydroxydes avec formation de zones de densité réduite, de «défauts» et de cavités
- Réduisez la friction entre les fragments d'oxydes monolithiques et laissez-les glisser facilement les uns par rapport aux autres tout en tournant l'écrou
Vous pouvez le faire par différentes méthodes:
Méthode de destruction 1 - MécaniqueEn fait, grand-père. Car pendant longtemps, en l'absence d'autres possibilités, il est d'usage de frapper sur un fil rouillé dans l'espoir de détruire par vibration des plaques monolithiques et des chaînes d'oxydes formés. Dès que le boulon est retiré, les oxydes (et ils sont suffisamment fragiles) continueront à se frotter en poussière. Le procédé n'est pas particulièrement efficace et nécessite en outre un spécialiste qui "sent un marteau", afin de ne pas tordre ou riveter par inadvertance un boulon hermétiquement.
Une bonne option est d'utiliser des clés à chocs électriques ou pneumatiques (+ il y a aussi des tournevis, a ajouté
redbeardster dans les commentaires), comme celui de l'image:
Bien que dans ce cas, ainsi qu'avec un marteau ordinaire, l'essentiel est de ne pas en faire trop et de ne pas casser le boulon. Il est préférable d'installer une tête correctement sélectionnée du côté de l'écrou et de soutenir en même temps le boulon avec une clé supplémentaire.
Dans le cas où il n'est pas nécessaire de sauvegarder les fixations (par exemple, dans le cas des voitures anciennes), vous pouvez simplement couper l'écrou avec une meuleuse d'angle (meuleuse) et percer le boulon. Mais les coûts de main-d'œuvre pour une telle procédure sont tels que je conseillerais d'utiliser cette méthode au dernier tour, après avoir testé toutes les possibilités décrites dans l'article.
Addition: Je me souvenais du
moulin , mais des
clés (ce sont des coupe-noix et des coupe-noix) - non. Merci au lecteur
p_fox qui m'a rappelé une telle chose.
destruction_method 2 - ThermiqueCette méthode est basée sur la compréhension que tous les corps se dilatent lorsqu'ils sont chauffés et lorsqu'ils sont refroidis, ils se contractent. Le chauffage de l'écrou (ou de l'objet dans lequel le boulon est vissé) entraînera la formation de micro-fractures dans le monolithe d'oxyde situé le long du filetage. L'alternance des cycles de chauffage / refroidissement est très susceptible d'entraîner l'écrasement des flocons de rouille et la formation de "vide". Et dès que des trous sont formés à l'intérieur de la couche, le boulon se retournera très probablement. En plus de l'écrasement mécanique des couches d'oxyde dû à l'expansion du métal, la déshydratation des composants de la rouille eux-mêmes a lieu. Par exemple, le recuit à 350 ° C transforme la rouille principalement en maghémite (γ-Fe
2 O
3 ), la magnétite se forme à 550 ° C et à 750 ° C la rouille se transforme en un mélange de magnétite, de wustite (FeO) et de fer métallique (Fe) .
Auparavant, cette méthode n'était disponible que pour les propriétaires de brûleurs à l'acétylène ou au propane, mais avec l'avènement d'aliexpress aujourd'hui, presque tout le monde peut acheter un brûleur compact pour un cylindre «dichlorvos» et des boulons et écrous rouillés calcinés pour leur propre plaisir.

L'élimination thermique active de la rouille est également utilisée dans la restauration des produits en fer. Certes, ce n'est pas seulement un recuit, mais la réduction à haute température des oxydes en fer élémentaire. Cela se fait soit en chauffant les produits rouillés dans un milieu de monoxyde de carbone (aka CO, aka monoxyde de carbone) sous une couche de charbon de bois avec un accès limité à l'air et une température de 800 ° C. L'hydrogène peut également être utilisé comme agent réducteur, surtout s'il y a accès à des fours tubulaires dont la température est contrôlée sur toute la longueur du four. L'ammoniac est introduit dans la partie réactionnelle du four, qui se décompose sur le catalyseur à 400-600 ° C en azote et hydrogène. L'hydrogène réduit les oxydes en «fer éponge», ce qui nécessite en outre un traitement supplémentaire avec des agents protecteurs, tels que la paraffine fondue.
Addition: dans cette section, je
présenterai la fonction de nettoyage de la rouille au laser mentionnée par le lecteur
Alexus819 , qui est parfaitement applicable aux surfaces lisses (voir la vidéo cliquable).
destruction_method 3 - ChimiqueLa méthode chimique pour la destruction de la rouille filetée est basée sur le fait que les composants chimiques entrant dans les pores et les capillaires de la couche d'oxyde peuvent interagir avec elle, soit en convertissant la rouille en un composé soluble ou en la réduisant en fer métallique. Les deux soulagent la pression de l'agent de soutènement à l'intérieur du filetage et permettent à l'écrou de tourner en raison de la formation de pores supplémentaires ou de zones de densité réduite. En général, les mécanismes d'influence de la méthode chimique peuvent être divisés en trois directions:
protonation ,
complexation et
réduction . Pas étonnant que j'aie cité les noms des «minéraux» les plus communs formant la rouille au début de cet article. Je l'ai fait pour qu'un lecteur curieux puisse prendre un réactif approprié, caché dans une table sous le spoiler.
La plus grande collection de solvants antirouille avec mécanismes (cliquable) Et maintenant, un petit détail sur chacun des mécanismes avec des exemples.
ProtonationDu fait de la protonation, les réactifs capables de devenir donneurs de protons (H
+ ) réagissent avec la rouille. Le plus souvent, des acides minéraux inorganiques sont utilisés à cet effet.
Le mécanisme de protonation du Fe (III) sous l'influence des acides Traditionnellement, des solutions d'acides minéraux sont utilisées pour nettoyer la surface du fer des produits de corrosion. La plus active est une solution contenant 35% d'acide orthophosphorique et 5-10% d'acide chlorhydrique. Les solutions d'acides - sulfurique, chlorhydrique - vous permettent d'éliminer rapidement les produits de corrosion, mais provoquent toujours un décapage des métaux. Pour éviter cela, des inhibiteurs de corrosion sont introduits dans des solutions acides.
Ainsi, dans 1 M ( juste au cas où une solution d'une concentration de 1 M contient 1 mole d'une substance par litre de solution ), il est conseillé d'ajouter du thiosemicarbazide, de la thiourée, de l'urotropine, de la triphénylphosphine, du benzotriazole (de bons résultats sont obtenus lorsque le fer est traité avec une solution sulfurique de 1 M). acide contenant 0,1-0,5% de thiourée ou 0,5-1,0% de benzotriazole); dans une solution d'acide chlorhydrique 1 M - urotropine et triphénylphosphine.Remarque: La triphénylphosphine est un composé organique de formule P (C 6 H 5 ) 3 , ou simplement Ph 3 P. C'est un dérivé de la phosphine. Il a l'apparence de cristaux blancs. Relativement stable lorsqu'il est stocké dans l'air.La triphénylphosphine est également intéressante car son dérivé, l'oxyde de triphénylphosphine, est largement utilisé en microélectronique et, par son odeur, les chiens du Labrador aux États-Unis apprennent à trouver divers dispositifs de mémoire électronique. Sous le spoiler extrait de Science et vie n ° 10/2018Ça sent l'électronique- , , , , , -. 17 ( 2018 ), . — , , , SD, microSD, SIM- , , . , , , — . 50 .
. — ? , , , . , . , « » . , , .
« » , , - , . , , .
Depuis que nous avons commencé à parler des inhibiteurs, en plus de ceux mentionnés ci-dessus (et disponibles dans les tableaux ASTM ci-dessous), nous pouvons également mentionner diverses amines présentes dans les «solvants antirouille» de marque. La monoéthylamine, la diéthylamine, la triéthylamine, etc. sont activement utilisées. (qui est à portée de main).ComplexationComplexation - le processus de la soi-disant composés de coordination. Ce sont des molécules ou des ions neutres résultant de l'addition de molécules neutres ou d'autres ions appelés ligands à un ion ou un atome appelé agent complexant. Le plus souvent, les ligands agissent comme des molécules organiques en vrac.Le mécanisme général de dissolution de la rouille par complexation La plupart des acides organiques utilisés pour dissoudre la rouille fonctionnent précisément selon le mécanisme de formation complexe avec les ions Fe (III). La meilleure efficacité est démontrée par l'acide formique, citrique et oxalique (ainsi que leurs sels), l'acide éthylènediaminetétraacétique (EDTA) et son sel Trilon-B, qui est activement utilisé dans toutes sortes de détartrants de type Calgon. Lors de l'utilisation de solutions d'acides organiques, des inhibiteurs de corrosion (la même urotropine) peuvent être ajoutés à leur composition, car les acides, bien que lentement, mais provoquent parfois un décapage des métaux. Je voudrais noter que les acides organiques fonctionnent mieux en présence de petites quantités d'acides minéraux (régulateur de pH) et lorsqu'ils sont chauffés (voir la photo sous le becquet).Comparaison de l'efficacité de dissolution des oxydes de fer avec les acides citrique et oxalique Récupération avec chance). Son essence réside dans les processus de transfert d'électrons et l'adsorption connexe d'un donneur d'électrons, la polarisation cathodique de l'électrode, le transfert d'électrons de complexes de surface instables vers la surface Fe (III) et bien plus encore. Le plus important, à mon avis, est qu'un grand nombre de composés sont utilisés comme agents réducteurs - dithionite de sodium (bisulfite), acide thioglycolique (il est également mercaptoacétique, largement utilisé pour la permanente et la teinture des cheveux) acide, thiocyanate, hydrazine, acide ascorbique, hydroquinone, sulfure d'hydrogène fructose, saccharose. Et même des choses aussi étonnantes que les acides sulfoniques du sol:, , , Fe (III) Fe (II) ( Fe
0Dans des conditions appropriées, une dissolution réductrice peut également être effectuée photochimiquement.Les agents réducteurs les plus populaires sont le peroxyde d'hydrogène, une solution aqueuse à 3 à 5% de NaOH et le sulfite de sodium Na 2 SO 3 , le bisulfite de sodium déjà mentionné ci-dessus, l'acide ascorbique. Souvent, la poudre de zinc dans une solution à 15% de NaOH (qui, soit dit en passant, lorsqu'elle est appliquée sur des surfaces lisses rouillées, est en outre épaissie avec de l'alcool polyvinylique) est utilisée comme solvant réducteur pour la rouille. Comparaison de l'efficacité de diverses méthodes pour dissoudre la rouilleSouvent, pour dissoudre la rouille, non pas des réactifs individuels sont utilisés, mais leurs combinaisons, où chaque substance met en œuvre son propre mécanisme pour dissoudre les oxydes de fer. Un exemple est le même zinc + NaOH dans lequel du Trilon B est ajouté pour accélérer le processus, régulant ainsi la capacité de nettoyage du mélange. Sous le spoiler se trouve une image avec laquelle vous pouvez comparer le taux de dissolution de la rouille à l'aide de divers mécanismes.Comparaison de l'efficacité de dissolution des oxydes en utilisant différents mécanismes (protonation, complexation, réduction) Ci-dessous, un diagramme qui montre que les méthodes de dissolution de la rouille utilisant des combinaisons de divers «destructeurs de couche d'oxyde» (hétérogènes) sont les plus efficaces., , ASTM . , , , .
, ASTM:
Et, pour les amateurs d'un
tour rapide d' électrolyse - des composés pour le nettoyage électrochimique. Le processus est vraiment sérieusement accéléré par rapport au traitement chimique.
Note d'un chimiste colloïdal : il faut comprendre que dans le cas d'un fil (par opposition à de la rouille en surface), afin de détruire tous les oxydes le long du fil, les composés ci-dessus doivent les atteindre (la réaction ne se produit qu'au point de contact direct entre le réactif et l'oxyde). Et pour ce faire, c'est assez difficile, car tous les chemins de pénétration sont fortement obstrués par de la rouille qui n'a pas encore eu le temps de réagir. Par conséquent, en plus de l'efficacité de dissolution, l'effet mouillant du réactif (la capacité de pénétrer dans les pores, les microfissures et les capillaires) doit être pris en compte. La section suivante est consacrée à ces questions.
Réduction du frottement ou «débris lubrifiants ...»
Comme je l'ai écrit plus haut, après destruction chimique, thermique ou mécanique des couches d'oxyde de rouille, il est nécessaire de réduire les frottements entre elles. Il est logique que cela puisse être fait avec de la graisse. La plupart des remèdes «populaires», tels que diverses huiles, kérosène, essence, acétone, ne modifient pas l'état de rouille à l'intérieur du boulon «acide», mais ils peuvent s'aider eux-mêmes à tourner l'écrou avec les fragments de la couche d'oxyde après le traitement initial pour détruire le cadre poreux.
Important! Le versement d'hydrocarbures sur le fil «acidifié» n'a de sens que si le chemin le long du fil n'est pas complètement obstrué par des oxydes, auquel cas le solvant pénètre / adsorbe en eux et ne fait alors qu'agir comme lubrifiant. C'est-à-dire il est nécessaire d'humidifier avec toutes sortes de kérosène soit les boulons peu rouillés, soit lorsque le boulon a déjà été touché et que des pores se sont formés dans les oxydes. Par conséquent, compte tenu de ce qui précède (par exemple, le point de
destruction thermique ), il serait logique d'appliquer du «kérosène» sur le fil rouillé, puis, en tapant simultanément sur la tête du boulon avec un marteau ou un autre instrument à percussion, essayez de déplacer l'écrou de son emplacement. Pour les conduites d'eau en fonte et en acier avec un fil, les experts recommandent de chauffer les endroits rouillés, d'appliquer de la paraffine de la bougie, de les chauffer à nouveau jusqu'à ce que l'hydrocarbure fondu trempe et glisse le long des fils et essaie ensuite de se détendre.
Une note sur le WD-40. Beaucoup ont probablement entendu parler de cette chose, le «triomphe de la pétrochimie américaine». Contrairement à certains amis qui ne peuvent imaginer une voiture sans bulle WD-40 dans la boîte à gants, je ne ressens pas beaucoup de respect pour ce mélange d'hydrocarbures. Pour ceux qui ne sont pas au courant, il s'agit d'une solution qui a été développée dans les années 60 du siècle dernier pour protéger le corps des missiles américains contre la rouille et la corrosion. Eh bien, comme d'habitude, les Américains ordinaires ont apprécié les avantages de ce liquide incompréhensible. "WD-40" est l'abréviation du terme "déplacement d'eau, 40ème formule", c'est-à-dire pour la 40e fois, ils ont fait quelque chose. La composition WD-40 n'a jamais été brevetée, afin de préserver les secrets commerciaux. Par conséquent, on ne sait toujours pas vraiment ce qui se trouve dans le développement d'origine. Chaque année, cela devient de plus en plus difficile à découvrir (car selon les histoires de personnes bien informées,> 90% des WD-40 sur notre marché sont des contrefaçons), et ce n'est pas nécessaire, car il y a 10 ans, les journalistes du magazine Wired ont
apporté ce «kérosène» au gaz chromatographe + spectromètre de masse et a constaté que la composition contient: huile minérale, décane, nonane, undécane, tridécane, tétradécane, cyclohexane, diméthylnaphtalène et dioxyde de carbone pour créer la pression nécessaire dans le cylindre. La fiche signalétique (fiche de données de sécurité pour le marché américain) donne les informations suivantes: 50% - hydrocarbures aliphatiques, <25% - huile minérale, 12-18% hydrocarbures aliphatiques à basse pression de vapeur pour réduire la viscosité de la solution (diluant facilement volatil), 2-3% dioxyde de carbone, <10% d'ingrédients inertes.
La solution mentionnée ci-dessus est souvent louée pour son incroyable perméabilité (ou perméabilité, je ne me souviens pas exactement comment les fans de WD le disent). Si vous regardez du point de vue de la chimie des colloïdes, il s'avère que ces personnes signifient très probablement le phénomène de
mouillage . En bref, cela dépend des forces d'interaction intermoléculaire et consiste en ce qui suit: si les forces d'interaction entre les molécules d'un liquide et un solide sont plus grandes qu'entre les molécules d'un liquide, alors le liquide se répand sur la surface du solide, c'est-à-dire il mouille et vice versa, si les forces d'interaction entre les molécules liquides sont supérieures à celles entre les molécules liquide et solide, alors le liquide s'accumule en goutte et ne mouille pas la surface du liquide. Ceci est directement lié à une chose telle que
la tension superficielle .
Tatko napaminae : pour que le fils n'oublie pas de parler de «tormozuha rouge», c'est aussi du liquide de frein BSK (comme «huile de ricin butyl-alcool» dans un rapport 1: 1).
Les freins soviétiques inhibent la corrosion mieux que quiconque dans le monde Pendant que quelqu'un utilisait le WD-40 dans la boîte à gants, si je démontais un moteur et que soudainement il y avait une attache fortement rouillée, ce qui se passait était le suivant. Tatko regarda silencieusement cette affaire, puis se rendit silencieusement au garage et apporta une seringue avec un liquide rouge d'odeur âcre. Le liquide a été appliqué, vieilli 30 minutes et ... Et en effet, dans la plupart des cas, cela a fonctionné et l'écrou pouvait être dévissé. En toute honnêteté, je note que toutes les fixations pour lesquelles BSK a été utilisé étaient dans des moteurs, où il y avait toujours une certaine quantité de lubrifiant. Pour être honnête, il est très probable que mon père ait encore ce liquide de frein dans le garage, qui est stocké spécifiquement en cas de fixations rouillées. Il est difficile de trouver une telle option en vente maintenant, car les fabricants ont abandonné le butanol au profit de divers polyglycols et de leurs esters, qui pénètrent bien plus les capillaires des fils. Cela est peut-être dû au fait que les polyglycols sont moins chers, et peut-être parce qu'ils sont plus sûrs.
Addition: @ Alexey Shukaev précise que la transition du butanol aux polyglycols est associée à une différence de point d'ébullition. "Le passage au gaz => compressibilité => l'hydraulique cesse de fonctionner" - j'ai donc dû refuser ...
Dans ma mémoire, il y avait des exemples de cas où des gens, fatigués de trouver de l’argent pour l’alcool d’usine, buvaient du liquide de frein rouge. Le butanol, après tout, issu de la même série d'alcools que l'éthanol, même s'il a la toxicité la plus élevée parmi les alcools simples (DL
50 : 2290-4360 mg / kg). La plupart des huiles de fusel dans la production d'alcool par distillation sont le butanol. C'est lui qui donne la gueule de bois furieuse et incomparable. Mais c'est quand "digéré". Et l'huile de ricin, elle est connue pour son effet laxatif thérapeutique. En général, multifonctionnel en URSS a produit un produit ...
Remarque : dans le monde moderne, fatigué de la recherche infructueuse d'un mélange d'huile de ricin avec du butanol, son analogue (de la même couleur) est utilisé: l'
huile de transmission (rouge) d'une transmission automatique (ATF) et l'acétone dans un rapport 1: 1. Couleur similaire, efficacité aussi.
Lorsque vous contactez l'alcool, n'oubliez pas... que le légendaire physicien soviétique Lev Davidovich Landau à propos de l'alcool a déclaré ce qui suit: "Un verre de champagne du Nouvel An traditionnellement bu pendant un mois entier me prive d'activité créative." Et ses amis, par exemple, le remarquable physicien suisse Wolfgang
Pauli (lauréat du prix Nobel, soit dit en passant) a ajouté: «Je sais pourquoi Landau ne boit pas. Il est toujours ivre. Il est intoxiqué par la vie elle-même, il n'a pas besoin d'alcool. » C'est à ça que les gars doivent être.
Et qu'est-ce qui découle de tout cela?
Et de tout cela, il s'ensuit que si un liquide (un solvant) a une tension superficielle inférieure à l'eau, il vaudra mieux humidifier la rouille et pénétrer dans les pores et les capillaires plus rapidement qu'une solution aqueuse de tout acide. Il sera préférable de pénétrer, mais il ne pourra pas détruire ou affaiblir les liaisons entre les couches d'oxyde. Les observations suivantes émergent:
1) WD-40, et toutes sortes de "clés liquides" (clé à liquide Eng) - sont des hydrocarbures ordinaires et des composants proches, ayant une faible tension superficielle et capables de bien mouiller les oxydes poreux et de pénétrer dans leurs capillaires.
En règle générale, ces produits pétroliers sont parfaitement absorbés par les filetages et assurent la lubrification. Lubrification uniquement, car tous les composants eux-mêmes sont inertes et n'ont aucun effet notable sur la rouille. Du mot en général. Par conséquent, il est préférable de les utiliser après / en conjonction avec les méthodes de destruction des couches d'oxyde décrites dans l'article. Ce qui est triste, c'est que même les RUST REMOVER reconnus par RUST ne corrodent pas la rouille et ne pénètrent pas parfaitement.
2) Tous les PB-Blaster, Rust buster et Rust dissolver déclarés comme solvants pour la rouille se dissolvent vraiment chimiquement. En règle générale, ils contiennent également un composant qui réduit la tension superficielle et donne un léger effet lubrifiant. Mais cet effet est profondément secondaire. Sous le spoiler, quelques exemples célèbres:
Solvants de rouille à l'intérieurLe premier que nous avons un produit de Henkel -
Dissolvant de rouille pour gelée navale LoctiteComposition:
Acide phosphorique - 10,0-30,0% (= solvant de rouille protonant + agent de phosphatation des métaux)
Isopropanol - 1,0-5,0% (= «lubrifiant», c'est-à-dire composant qui assure le mouillage et la pénétration)
Acide sulfurique - 0,1-1% (= solvant de rouille protonant)
Eau -> 50%
Polysaccharides -? (= épaississant pour créer la bonne consistance)
Ensuite, un certain
gel dissolvant de rouille PermatexComposition:
Eau - 40,0-70,0%
Acide phosphorique - 10,0-30,0% (= solvant de rouille protonant + agent de phosphatation des métaux)
Isopropanol - 1,0-5,0% (= «lubrifiant», c'est-à-dire composant qui assure le mouillage et la pénétration)
Monoéthanolamine (MEA) -? (= inhibiteur de corrosion)
Rhodamine -? (= colorant)
Comme vous pouvez le voir, tous les mêmes acides inorganiques et alcools vigoureux sont utilisés pour leur donner la mobilité nécessaire et réduire la tension superficielle. + Dans certains cas, des inhibiteurs de corrosion. C'est-à-dire théoriquement, tout le monde peut expérimentalement fabriquer son propre solvant antirouille en mélangeant son acide inorganique préféré (= disponible) avec de l'alcool (disponible).
Important : toutes les méthodes chimiques pour la destruction et la transformation de la rouille décrites dans l'article peuvent être utilisées non seulement pour dissoudre les filetages "acides" sur les boulons, mais aussi pour le traitement anti-corrosion du métal (fer / acier / fonte) de toute forme, ainsi que pour éliminer les taches rouillées sur la plomberie etc.
Eh bien, pour une collation, je voudrais offrir un tel fait. Récemment, en lien avec la volonté des fabricants de composés chimiques de se conformer aux concepts de
la chimie verte , en recherche constante de nouveaux composants plus respectueux de l'environnement et biodégradables. Toutes sortes de solvants et de convertisseurs de rouille ne sont pas restés de côté. La dernière tendance est l'utilisation de composés organiques de nature phénolique, les tanins, comme composant transformant (au lieu de l'acide phosphorique et du phosphate de fer habituels, par exemple). L'action tannique de ces substances transforme les oxydes de fer rougeâtre en un tannate stable noir bleuâtre. Ici, vous avez un endroit où vous pouvez attacher un
kaki astringent avec ses tanins :). Et en général, théoriquement, c'est une bonne option de rouiller le bas de votre voiture préférée, au lieu d'acides inorganiques toxiques, de la traiter avec une forte infusion de thé vert ...
À ce sujet, l'histoire de la rouille est terminée, et toutes les mises à jour et notes intermédiaires à partir desquelles les articles habra sont bien formés peuvent maintenant être vues dans mon canal de télégramme
lab66 . Abonnez-vous pour ne pas vous attendre au prochain article, mais pour être immédiatement au courant de toutes les recherches :)

Littérature utiliséeNikitin M.K. Chimie en restauration. - L.: Chimie, 1990 .-- 304 p.
ASTM G1 - 03 (2017) e1 Pratique standard pour la préparation, le nettoyage et l'évaluation des échantillons d'essai de corrosion
www.armorvci.com/corrosion/types-of-rustT. Kisato, agent de conversion de la rouille pour la prévention de la corrosion. Brevet japonais 2014, JP 2014 169486 A 20140918.
M. Usman, JM Byrne, A. Chaudhary, S. Orsetti, K. Hanna, C. Ruby, A. Kappler, SB Haderlein, Magnétite et rouille verte: synthèse, propriétés et applications environnementales des minéraux de fer à valence mixte, Chem . Rev. 118 (2018) 3251-3304.
RM Cornell, U. Schwertmann, The Iron Oxides: Structure, Properties, Reactions, Occurrence and Uses, 2e éd., Wiley-VCH, 2006.
YS Choi, JG Kim, Comportement à la corrosion aqueuse de l'acier résistant aux intempéries et de l'acier au carbone dans des environnements de chlorure d'acide, Corrosion 56 (2000) 1202-1210.
Hansen, HCB Chimie environnementale des LDH de fer (II) -Iron (III) (rouilles vertes). Dans les doubles hydroxydes en couches: présent et futur; Nova Science Publishers: Huntington, NY, 2001; pp 469−493.
Réguer, S., Dillmann, P., Mirambet, F .: Dans: Dillmann, P., Béranger, G., Piccardo, P., Matthiessen, H. (éd.) Corrosion des objets patrimoniaux métalliques, p. 170. Woodland Publishing Ltd., Cambridge (2007)
web.archive.org/web/20140119014037/http : //www.wired.com/science/discoveries/magazine/17-05/st_whatsinside
Lange's Handbook of Chemistry (1967) 10e éd. pp 1661–1665