Avant de commencer la présentation du matériel, je voudrais dire quelques mots sur moi: un membre des communautés contre le déni du VIH par le VIH («dissidence du VIH / SIDA»): en 2016-2018, «Les dissidents du VIH / SIDA et leurs enfants», à partir de 2018 - «Déni du VIH / SIDA et médecine alternative».
Mon opinion - et pas seulement la mienne - est que la plupart des cas de refus de traitement du VIH sont causés par un malentendu banal qu'il s'agit d'une infection chronique contrôlée, ainsi que par la stigmatisation des personnes vivant avec le VIH - l'utilisation du cliché commun que le VIH - une maladie des couches inférieures de la société ou vice versa, "l'élite culturelle". Ce n'est pas le cas depuis longtemps - en Russie, environ 1% de la population vit avec le VIH et la situation ne prévoit pas de s'améliorer.
Il y a environ un an, plusieurs articles sur cette ressource m'ont encouragé à rédiger cinq notes sur l'histoire de la lutte contre les virus. Le but de ces articles était de décrire les principes de fonctionnement de divers types de médicaments anti-VIH (les consultants étaient un microbiologiste et un spécialiste des maladies infectieuses). J'espère que vous apprécierez l'organisation de ces notes.
À propos des virus
Donc, quelques mots sur les virus en général: ils occupent une position intermédiaire entre le monde vivant et le monde non vivant; ils sont incapables de se reproduire indépendamment, pour cela, les cellules de l'organisme hôte sont nécessaires.
Le virus est organisé tout simplement: il porte un code génétique, le code est fermé dans une capside, la capside est parfois entourée d'une coquille. Le code peut être présenté de différentes manières. Le porteur de code est l'ADN ou l'ARN, c'est-à-dire acide nucléique (NK). Les chaînes de code peuvent être un ou deux: NK double brin et simple brin. La chaîne peut être fermée en anneau ou linéaire. En 1971, David Baltimore, selon ces signes, a divisé les virus en 7 classes. Cette classification est toujours en usage aujourd'hui et sera importante pour expliquer le fonctionnement de certains médicaments.
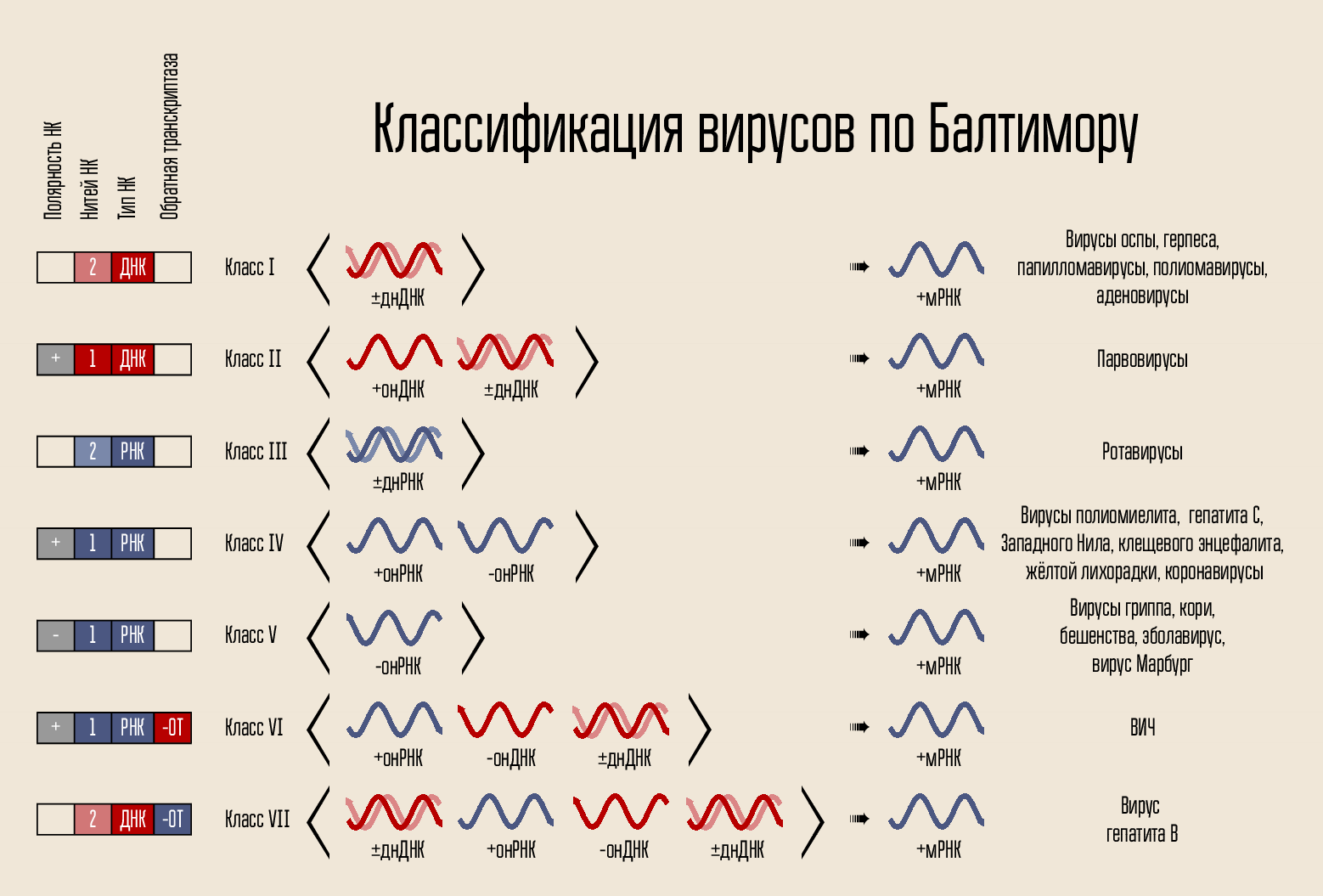
Le code lui-même pour la construction d'un nouveau virus ne peut pas pénétrer la cellule elle-même; il a besoin d'un mécanisme de pénétration. Par conséquent, il existe une coquille protéique - une capside, qui protège le NK du virus et aide à pénétrer dans la cellule. Dans certains cas, les virus peuvent avoir des membranes lipidiques supplémentaires.
La pénétration du virus dans la cellule

Pour entrer dans une cellule, le virus doit se connecter à sa membrane. Pour ce faire, il existe des protéines à la surface du virus qui se lient aux protéines réceptrices de la cellule hôte - à des endroits sur la surface de la paroi cellulaire auxquels le virus peut se fixer. Et ils doivent strictement s'adapter au virus, sinon il ne pourra même pas s'accrocher à la cellule.
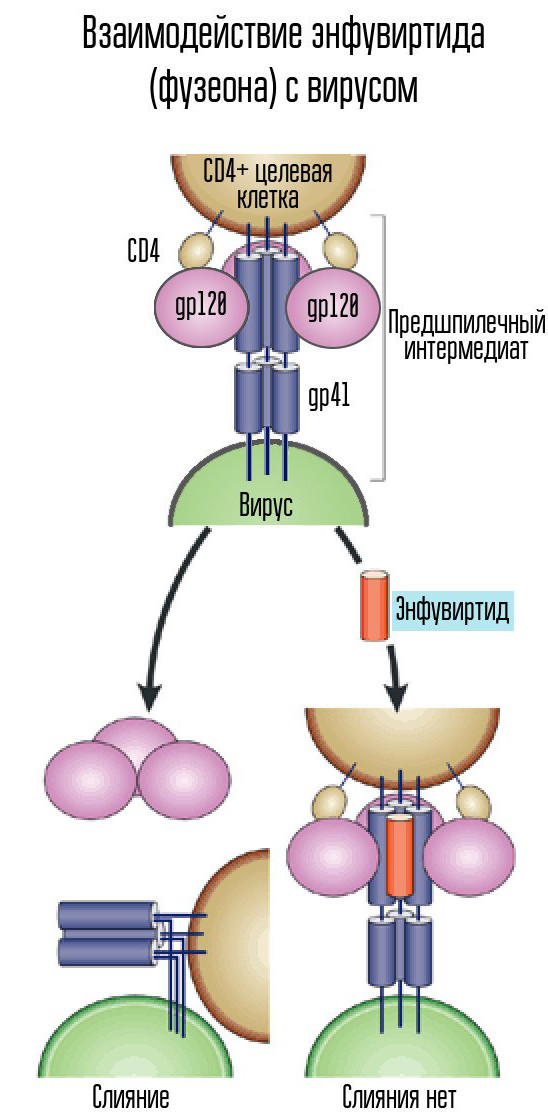
Pour cela, le VIH utilise le récepteur CD4 (les cellules avec un tel récepteur sont les cellules immunitaires du corps, y compris les lymphocytes T, les monocytes, les macrophages, etc.). Le CD4 seul ne suffit pas - vous avez besoin d'un autre corécepteur, CCR5 ou CXCR4. Le VIH utilise la protéine gaine gp120 pour se joindre. Après cela, la forme d'une autre protéine d'enveloppe virale, gp41, change. Il se plie sur le côté, formant une épingle à cheveux et permettant à la capside du virus de fusionner avec la cellule.
L'enfuvirtide (Fuzeon), un inhibiteur de la protéine gp41, est l'un des agents utilisés pour combattre le virus. L'enfuvirtide se combine avec cette protéine pour empêcher la formation d'épingle à cheveux. Ainsi, la capside du virus ne peut pas fusionner avec la cellule et l'infection ne se produit pas. Ce médicament est le seul inhibiteur de fusion développé et approuvé.
Les rétrovirus, dont le VIH appartient, sont une cible extrêmement gênante pour les médicaments en raison de leur variabilité. Les cellules humaines sont beaucoup moins volatiles. Environ 1% de la population du nord de l'Europe est connue pour être immunisée contre le VIH: ils sont porteurs de la mutation CCR5-∂32, ce qui rend la forme du récepteur CCR5 impropre à la combinaison avec le VIH.
Malheureusement, changer la forme de ce récepteur pour toujours, y compris pour les nouvelles cellules qui continuent d'apparaître dans le corps humain, est une tâche extrêmement difficile (bien qu'il y ait eu des tentatives), mais le développement d'un inhibiteur des récepteurs est un médicament qui s'attacherait au récepteur cellulaire et empêcherait ainsi le VIH de se joindre pour lui - très probablement.
Plusieurs inhibiteurs des récepteurs CCR5 et CXCR4 étaient en cours de développement, mais le seul approuvé à ce jour est le maraviroc, un inhibiteur de CCR5.
Transcription inverse
Que se passe-t-il après la fusion du virus avec la cellule dans le cas du VIH?
Le VIH est le virus de classe VI de Baltimore; il stocke son génome dans l'ARN. Il y a de l'ADN dans le cœur de la cellule, le VIH doit donc transformer un acide nucléique en un autre. Une telle transcription (NK → NK) est réalisée par les enzymes correspondantes appelées polymérases. Pour l'ADN dépendante de l'ARN (c'est-à-dire la lecture des informations de l'ARN) (c'est-à-dire à la sortie de laquelle l'ADN apparaît), il existe un nom spécial - transcriptase inverse. La transcriptase inverse prend le désoxynucléoside souhaité (pour plus de simplicité, il s'agit en fait de désoxynucléoside triphosphates) et construit un ADN complémentaire de l'ARN viral correspondant.
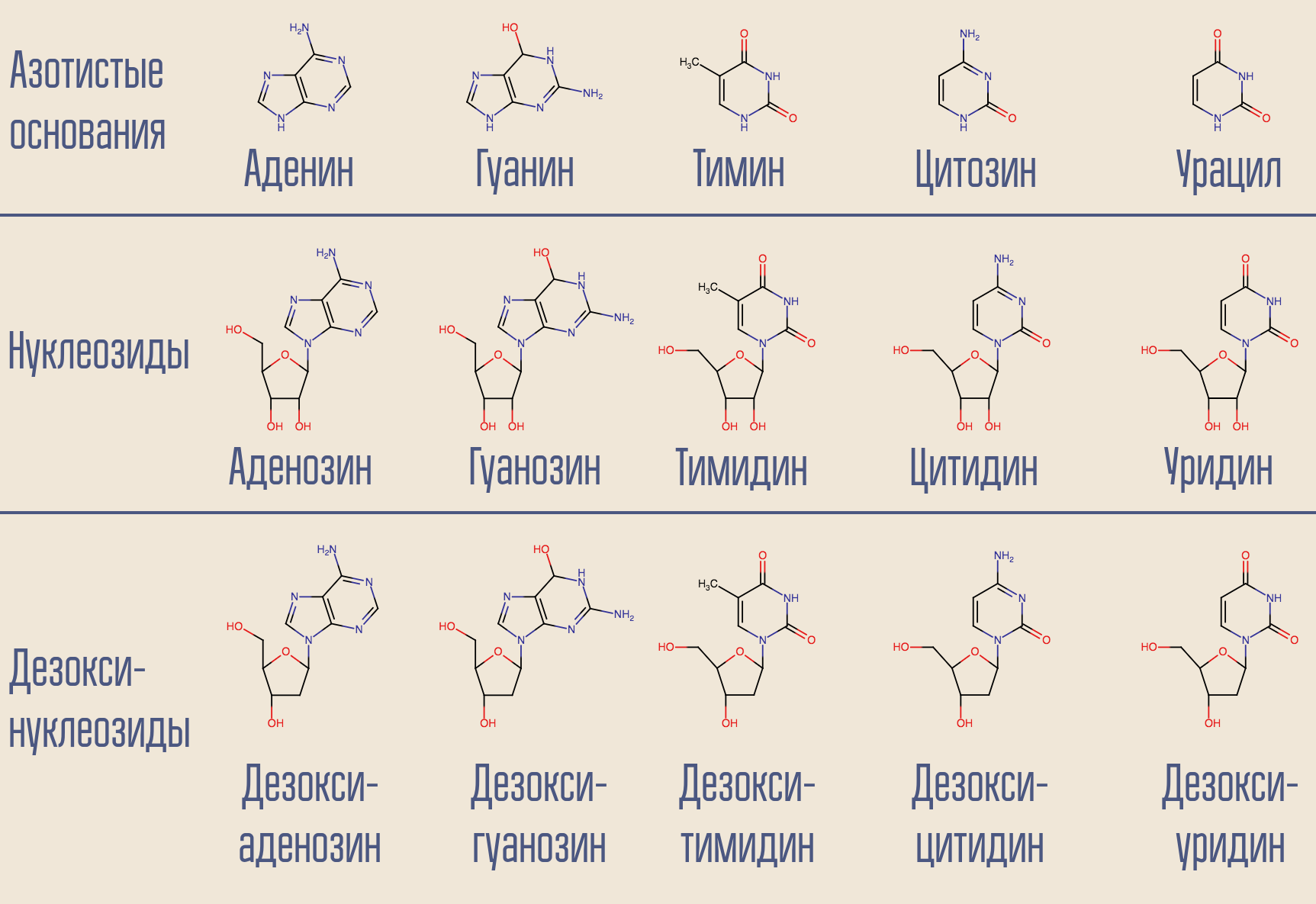
Est-il possible d'interrompre ce processus? Oui, pour cela, il vous suffit de supprimer une transcriptase inverse quelque chose qui ressemble à un désoxynucléoside mais qui n'en est pas un. C'est ainsi qu'a agi le tout premier médicament anti-VIH, la zidovudine (azidothymidine, AZT). Elle est similaire à la désoxythymidine, mais ne l'est pas.
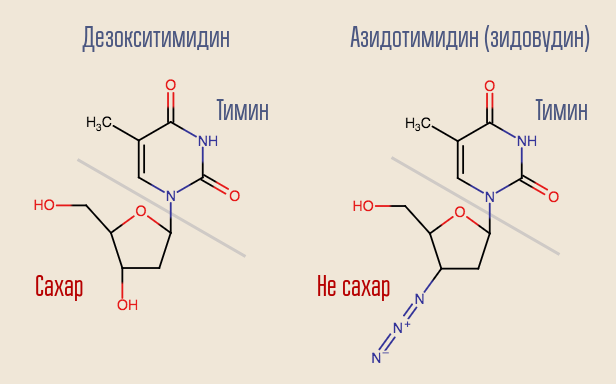
L'azidothymidine a été développée dans le cadre d'une recherche de substances pouvant combattre les tumeurs. On supposait qu'il serait intégré à la construction de l'ADN humain ordinaire, l'interrompant. Ainsi, le médicament affecterait le plus fortement les cellules qui se divisent le plus rapidement - les cellules tumorales. Il y avait certaines raisons de le penser - un autre médicament de ce groupe, précédemment synthétisé, la 6-mercaptopurine, était efficace dans le traitement de la leucémie.
Malheureusement, dans les tests sur les animaux, le médicament s'est avéré inefficace et a été oublié pendant un certain temps, jusqu'à ce qu'en 1984 le virologue Marty St.Clair, qui travaillait dans les laboratoires de la Burroughs Wellcome Foundation, entreprenne des études pour vérifier toutes les substances disponibles pour les options de traitement. ils ont une nouvelle maladie - l'infection par le VIH.
La transcriptase inverse a «reconnu» la zidovudine sous le nom de désoxythymidine et a essayé de l'incorporer à l'ADN. La synthèse d'ADN à ce site a été interrompue car le médicament n'était similaire qu'à la désoxythymidine. La zidovudine a complètement supprimé la reproduction du virus et les essais sur l'homme ont commencé presque immédiatement.
Les volontaires infectés par le VIH ont été divisés en deux groupes, dont l'un a reçu un placebo et l'autre a reçu de l'AZT. La différence entre les deux groupes était si frappante que d'autres tests ont été considérés comme inhumains - le médicament a montré une efficacité étonnante.
Le succès de la zidovudine a incité à étudier d'autres inhibiteurs nucléosidiques de la transcriptase inverse (INTI), et de nombreux autres médicaments sont apparus en peu de temps. Le plus intéressant des premiers médicaments est la lamivudine, un analogue d'un autre désoxynucléoside, la désoxycytidine. L'inconvénient de la lamivudine est qu'avec la monothérapie avec ce médicament, la résistance se développe très rapidement, en un mois environ. Cela est dû à la mutation ponctuelle du VIH, M184V. Malgré cela, il était souhaitable de laisser la lamivudine dans le schéma. Le fait est qu'un virus avec cette mutation est hypersensible à la zidovudine, et la mutation elle-même réduit le taux de réplication du virus.
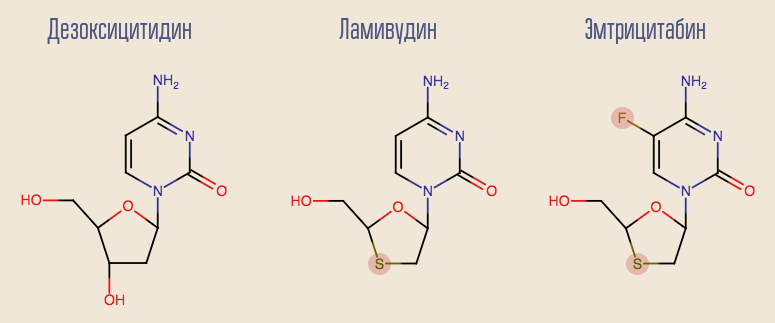
Actuellement, la lamivudine commence progressivement à se retirer dans le passé, laissant la place à son analogue plus moderne, l'emtricitabine. La lamivudine et l'analogue de la désoxyadénosine, l'adéfovir, donnent de bons résultats dans le traitement de l'hépatite B. Malheureusement, l'adéfovir s'est révélé inefficace dans le traitement du VIH. Cependant, après une légère modification de sa molécule, une version mise à jour de celui-ci est apparue - le ténofovir. Le ténofovir et l'emtricitabine font partie de nombreuses lignes thérapeutiques modernes.
La combinaison de deux INTI pourrait prolonger considérablement la vie des personnes vivant avec le VIH, cependant, il était clair que pour supprimer complètement le virus, il était nécessaire d'inclure au moins un médicament d'un type d'action différent, car tôt ou tard le virus développait une résistance à toute combinaison d'INTI. L'une des premières substances d'un type d'action différent était un autre type d'inhibiteur de la transcriptase inverse - non nucléosidique (INNTI). Bien que la transcriptase inverse (RT) veuille fonctionner avec quelque chose comme le nucléoside (nucléoside triphosphate), vous pouvez essayer de fabriquer une substance qui se liera à la RT et changera de forme afin qu'elle ne puisse plus remplir ses fonctions.
En 1996 et 1998, deux de ces substances, la névirapine et l'éfavirenz, respectivement, ont été approuvées. Chacun d'entre eux supprime efficacement le travail de l'OT, et en combinaison avec deux INTI, il crée un schéma complet de thérapie antirétrovirale hautement active (HAART) - suffisante pour qu'une personne vivant avec le VIH puisse vivre pleinement, dont la durée ne diffère pas beaucoup de celle d'une personne sans VIH .
En 2006, la première association médicamenteuse à usage unique par jour a été approuvée: Atripla. Atripla se compose de deux INTI, l'emtricitabine et le ténofovir (sous forme de ténofovir disoproxil - un promédicament, une forme posologique chimiquement modifiée qui se transforme en médicament directement dans le corps), et un INNTI, l'efavirenza. Atripla est devenu une nouvelle étape qualitative vers l'amélioration de la qualité de vie des patients. À ce jour, les médicaments génériques d'Atripla sont l'un des médicaments les plus couramment utilisés dans le monde (dans les pays en développement).
Cependant, aujourd'hui, les INNTI quittent progressivement le marché - les vieux médicaments provoquent divers effets secondaires. Ainsi, par exemple, les deux premiers mois après le début de la prise d'éfavirenz peuvent provoquer des étourdissements et d'autres effets similaires chez certains patients (pas tous!). Bien sûr, c'est bien mieux qu'une mort imminente; Cette condition ne dure pas si longtemps, et ils ont déjà appris à y faire face - cependant, la tendance actuelle est la transition vers de tels médicaments, le patient n'en ressent aucun effet secondaire.
Intégration
Si la transcriptase inverse a fait son travail, est-il possible d'arrêter l'incorporation d'ADN viral dans l'ADN cellulaire? Une enzyme spéciale appelée intégrase est impliquée dans ce processus.
Le processus d'intégration de l'ADN viral se déroule en plusieurs étapes. Initialement, l'intégrase se lie à l'ADN viral, retirant le dinucléotide GT de l'extrémité 3 'de chaque brin. Ensuite, l'ensemble du complexe est transporté vers le noyau, où l'intégrase catalyse le stade du transfert de chaîne. Cette étape est une réaction de transestérification (échange de radicaux): les nucléotides d'ADN de la cellule se connectent non pas entre eux, mais avec les nucléotides de l'ADN viral. L'intégrase attaque les liaisons internucléotidiques situées à une distance de cinq nucléotides. Ainsi, après intégration, il reste: le traitement des extrémités 5 'des chaînes d'ADN viral, l'achèvement de 5 nucléotides manquants et la ligature (la connexion de deux brins NK avec une enzyme ligase), qui sont réalisées avec la participation de protéines cellulaires [1].
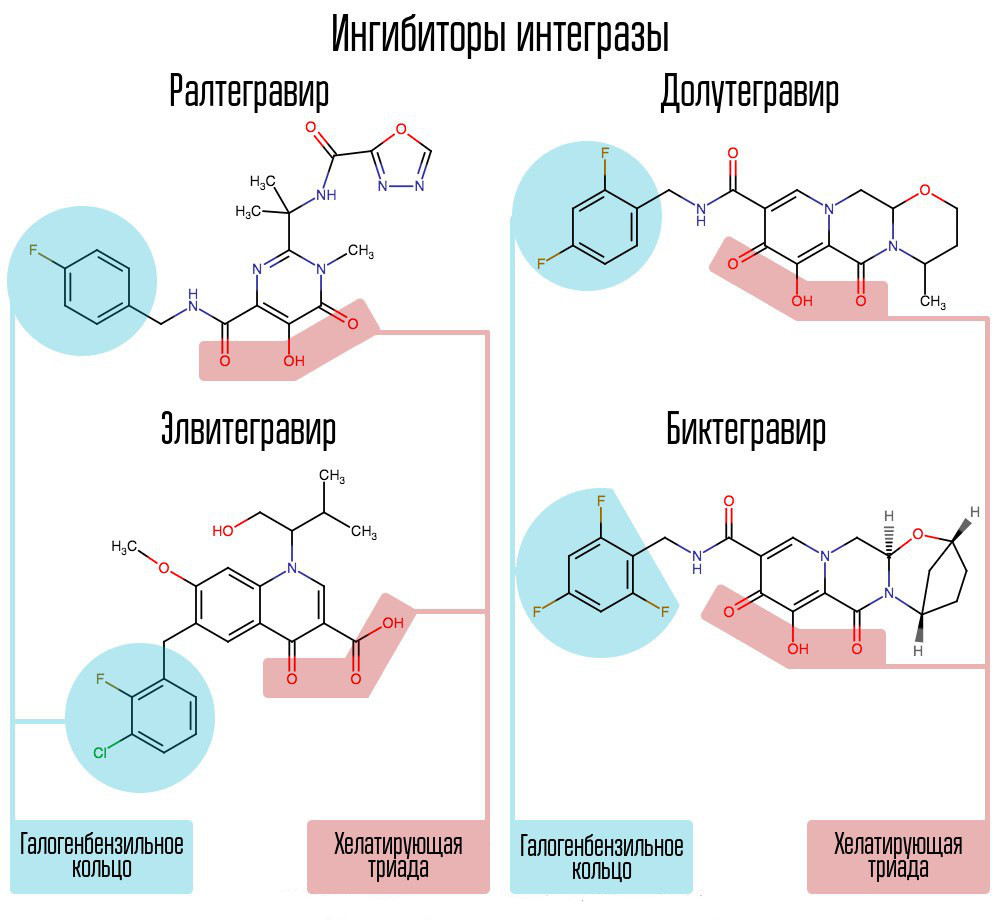
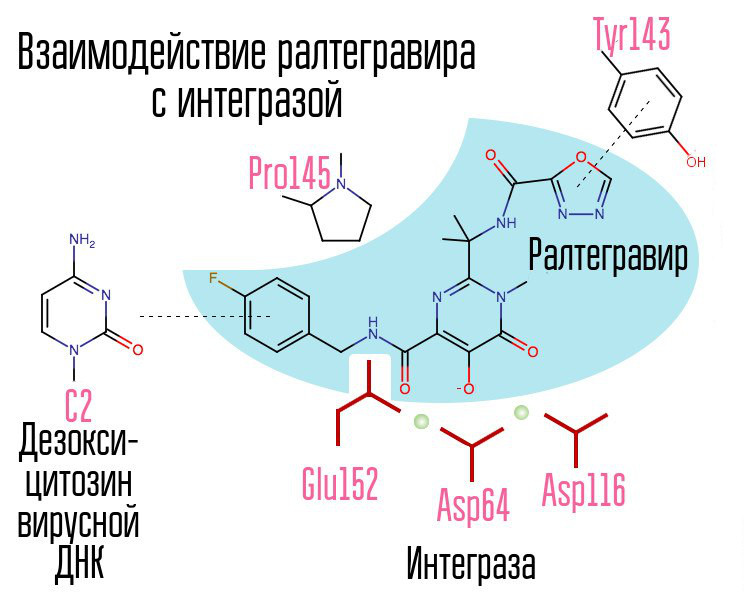
Le criblage d'environ 250 000 substances dans des bibliothèques de composés chimiques a révélé des substances qui inhiberaient l'intégrase du VIH. Tous se sont avérés être des composés d'acide 2,4-dioxobutanoïque. Ils ont coordonné les ions métalliques dans le centre actif de l'intégrase - dans cette partie, qui était responsable du transfert de chaîne. De nouvelles tentatives pour développer des inhibiteurs de l'intégrase du VIH-1 ont conduit à l'émergence d'un dérivé de la N-pyrimidinone, une substance MK-0518, appelée raltégravir. [2]
Le raltégravir et les inhibiteurs de l'intégrase ultérieurs sont communs à la triade chélatante (ions métalliques de coordination) et au cycle halogène-benzyle interagissant avec l'avant-dernière désoxycytosine à l'extrémité 3 'de l'ADN viral lié à l'enzyme.
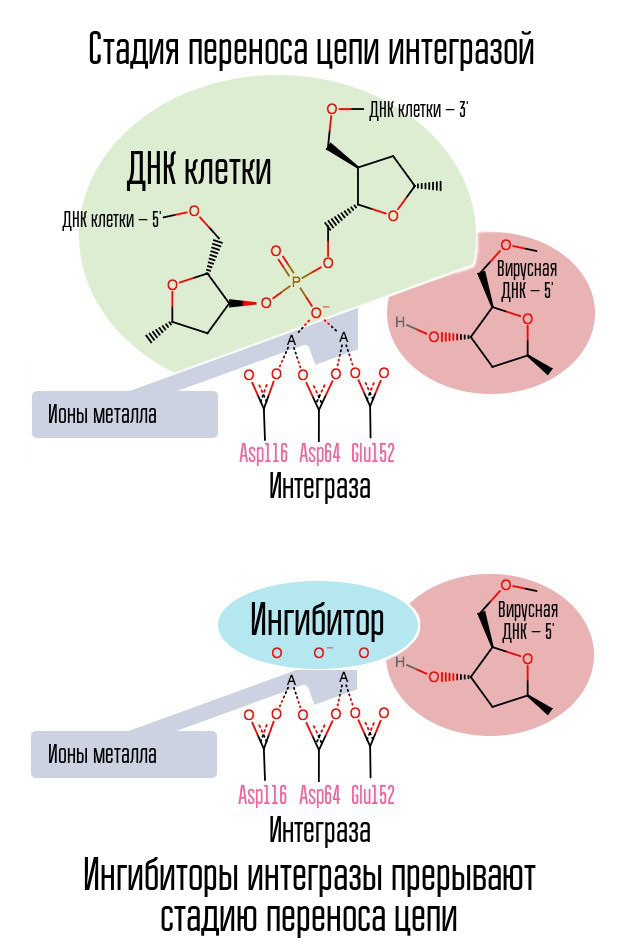
Le processus d'intégration du virus dans la cellule est la dernière étape dans laquelle la prophylaxie post-exposition est efficace. Après cela, les cellules qui portent l'ADN du VIH dans leur noyau apparaissent dans le corps humain. La fenêtre la plus efficace pour la prophylaxie post-exposition est d'environ 6 à 10 heures.
Le cycle halogénbenzyle de la molécule d'inhibiteur d'intégrase interagit avec l'ADN viral et le groupe d'atomes d'oxygène interagit avec deux atomes métalliques. L'intégrase virale utilise ces atomes métalliques pour introduire de l'ADN viral dans la cellule. Par conséquent, le processus d'intégration est bloqué.
Les IA modernes, comme le dolutégravir, ont pu vaincre les «maladies infantiles» du raltégravir associées à la formation rapide de résistances.
Protéolyse
Une fois que le génome viral a franchi le stade de transcription, les ARN viraux créés sont envoyés pour quitter la cellule. Dans le processus de création du virion, une autre enzyme virale appelée protéase est impliquée. La protéase coupe de longues polyprotéines en protéines fonctionnelles individuelles, entraînant la formation d'enzymes virales et de protéines structurelles du virus.
La protéase est active non seulement contre les protéines du VIH, mais également contre les protéines des cellules hôtes, ce qui peut expliquer l'effet cytotoxique du VIH (mort cellulaire).
Si la protéase est bloquée, le virion ne pourra pas passer par la phase de maturation et restera totalement non fonctionnel. La protéase VIH-1 est une protéase aspartique rétrovirale typique avec la séquence d'acides aminés caractéristique Asp25 Thr26 Gly27 (acide aspartique - thréonine - glycine) dans le centre actif. Le premier inhibiteur de protéase, le saquinavir, a été approuvé par la FDA le 6 décembre 1995. C'est donc après la création du saquinavir que le traitement antirétroviral hautement actif est devenu disponible pour la première fois.
Un autre représentant typique de ce groupe de médicaments est le lopinavir (utilisé conjointement avec le ritonavir - kaletra - l'un des médicaments anti-VIH les plus courants en Russie). Le ritonavir est également un inhibiteur de protéase, mais il est utilisé comme rappel - grâce à son action, la concentration du médicament principal augmente.
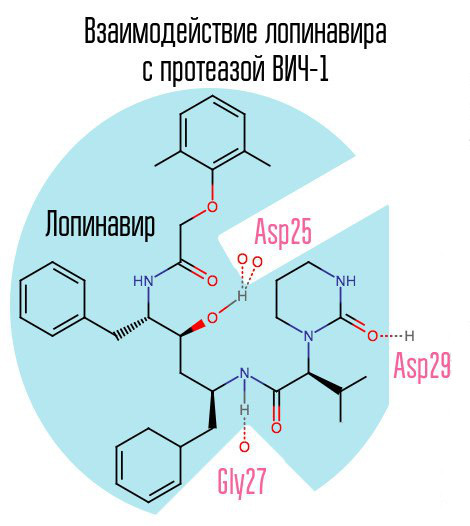
Étant donné que le saquinavir et les inhibiteurs de protéase (IP) ultérieurs visent spécifiquement le centre actif de l'enzyme, avec le développement d'une résistance à un IP, il y a une forte probabilité qu'une résistance à d'autres IP se produise. La solution à ce problème peut être la création de tels inhibiteurs dirigés vers d'autres zones de protéase.
Le médicament darunavir (prezista), qui est apparu en 2006, a atténué dans une certaine mesure le problème aigu des souches de VIH résistantes au VIH-1, car il a formé un lien auparavant inutilisé avec l'acide aspartique en position 30.
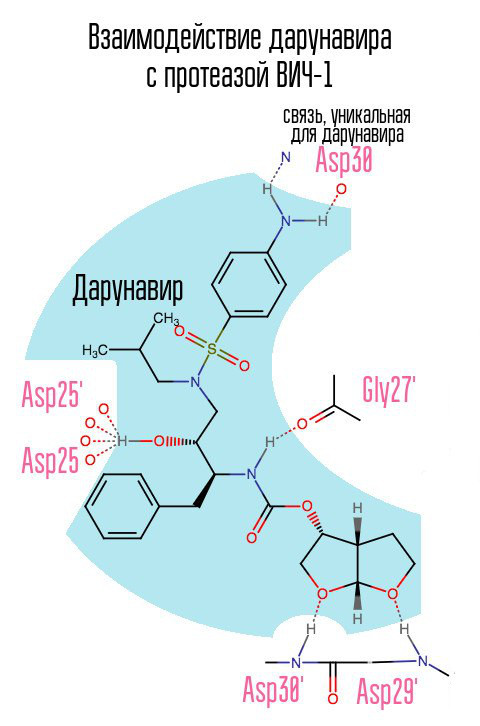
Sans protéase, le virus ne peut pas subir le processus de maturation. Les inhibiteurs se lient au centre actif de la protéase et l'empêchent de fonctionner.
Les inhibiteurs de protéase sont très efficaces à une charge virale élevée: étant donné qu'à ce moment de nombreux nouveaux virions naissent dans le corps, les IP ne leur permettent pas de mûrir, réduisant ainsi efficacement la charge virale en peu de temps. Cependant, à l'heure actuelle, les IP ne sont pas utilisés en thérapie de première ligne, laissant la place aux inhibiteurs de l'intégrase (II).
La raison en était les effets secondaires: le fait est que, par exemple, le même kaletra a conduit à une inhibition non spécifique de la protéolyse des protéines des aliments, du fait que ces protéines pénètrent dans l'intestin grêle et provoquent des diarrhées. Suivre un régime spécifique ou utiliser de nouveaux IP, tels que la prezista, peut réduire cet effet à presque zéro, mais un autre effet associé à une augmentation du taux de sucre empêche souvent l'utilisation d'inhibiteurs de protéase indéfiniment.
Schémas thérapeutiques modernes
À ce jour, les plus modernes sont considérés comme des schémas comprenant un inhibiteur de l'intégrase et un ou deux INTI (dolutégravir + abacavir + lamivudine; le dolutégravir + lamivudine est un schéma populaire à deux composants, cependant, ne convient pas à tout le monde). Ces régimes permettent à une personne de vivre une vie pleine qui ne diffère pas en durée de la vie d'une personne sans VIH.
Malgré tous les succès, une guérison complète du VIH n'est toujours pas possible (la transplantation de cellules souches de la moelle osseuse d'un donneur avec une mutation CCR5-∂32 permet d'obtenir un tel résultat, mais, apparemment, uniquement en cas de réaction du greffon contre l'hôte, dans un grand nombre de cas entraînant la mort du bénéficiaire).
Conclusion
Les méthodes développées contre le VIH ont aidé à lutter contre d'autres maladies infectieuses: comme mentionné ci-dessus, la lamivudine et le ténofovir sont efficaces contre le virus de l'hépatite B (Baltimore classe VII - la polymérase de l'hépatite B peut transférer de l'ARN à l'ADN, donc certains INTI sont efficaces pour la combattre) . Les connaissances acquises ont aidé à développer des médicaments à action directe contre l'hépatite C, qui peuvent aujourd'hui guérir complètement cette maladie (l'hépatite C n'a pas de phase latente, par conséquent, lors de la suppression de la charge virale, de nouveaux virions n'ont nulle part d'où venir - la maladie est complètement guérie).
[1] Korolev S. P., Agapkina Yu. Yu., Gottikh M. B. Problèmes et perspectives d'utilisation clinique des inhibiteurs d'intégration du VIH-1
[2] Shahgildyan V.I. Inhibiteurs de l'intégrase du VIH - la base d'une thérapie antirétrovirale efficace et sûre