
Que retenons-nous de l'expression "science-fiction"? Bien sûr, des robots, des voitures volantes, l'étude de coins de l'Univers jusque-là inexplorés, des extraterrestres et toute une série de complots. Parmi eux, une place particulière a toujours été occupée par le thème de la colonisation d'une autre planète, soit par la confiance dans l'inévitabilité de la mort de la sienne, soit par le désir de changer radicalement la situation. Le premier concurrent pour le titre de Earth 2.0 a toujours été Mars, froid et sans vie. Pour le moment, il n'est pas encore possible de faire vos valises et de prendre l'avion pour Mars en vacances pendant deux semaines, mais c'est absolument réaliste et faisable, la question n'est que de savoir dans combien de temps. Le moins le plus visible de Mars (à l'exception de l'absence d'un Internet normal) est l'absence d'une atmosphère acceptable pour la vie. Pour voler vers la destination, sortez de l'avion et respirez profondément, ressentant toute la fraîcheur de l'air local - il ne s'agit pas de Mars. Mais ce ne sera pas toujours le cas.
Aujourd'hui, nous vous rencontrerons une étude qui décrit une nouvelle méthode pour générer de l'oxygène par une réaction chimique inhabituelle. Comment les scientifiques ont-ils produit de l'oxygène moléculaire à partir du CO
2 , quelle est l'efficacité de cette méthode et où peut-elle être utilisée en dehors des voyages interplanétaires? Nous chercherons des réponses à ces questions dans le rapport des scientifiques. Allons-y.
Base d'étude
Une personne n'a besoin que de trois choses pour la vie: de la nourriture, de l'eau et de l'air, dans lesquels il y aura suffisamment d'oxygène. Ce sont nos principaux besoins (oui, Internet n'est pas sur cette liste). Mais l'oxygène ne se trouve tout simplement pas sur la route, surtout en dehors de notre planète bien-aimée. Par conséquent, si nous voulons aller quelque part, nous devons l'emporter avec nous et utiliser divers appareils pour purifier l'air et le réutiliser. Toute cette joie prend beaucoup de place, et tôt ou tard l'oxygène sera épuisé. Et reconstituer les réserves dans l'espace ou sur Mars sera, pour le moins, problématique.
Cependant, relativement récemment, les scientifiques ont découvert une quantité assez importante d'oxygène dans la comète 67P / CG6, ce qui les a incités à poser une question très évidente - d'où venait-elle? L'oxygène dans les corps tels que les comètes est le résultat d'une réaction abiotique qui se produit dans des conditions extrêmes, au cours desquelles de H
2 O, CO
2 , CO, etc. O
2 (oxygène) est libéré. Les scientifiques affirment que de telles réactions peuvent expliquer la présence d'oxygène dans les comètes, la haute atmosphère de Mars et dans l'atmosphère primitive de la Terre. Une personne peut utiliser une telle réaction chimique pour produire de l'O
2 à partir de CO
2 , ce qui rendra Mars apte à la vie.
Si elle est très exagérée et brève, alors la réaction mentionnée ci-dessus est la décomposition du CO
2 en composants: C + O
2 . En d'autres termes, la dissociation.
La dissociation du CO
2 peut avoir lieu dans plusieurs scénarios en fonction de l'énergie disponible pour la réaction. La dissociation partielle CO
2 → CO + O (5,43 ou 7,56 eV) nécessite le moins d'énergie. Il existe également une dissociation complète de CO
2 → C + O + O, nécessitant 16,46 eV. Et, la dissociation la plus curieuse et exotique est lorsque le CO
2 se décompose en C et O
2 . Les calculs montrent qu'une réaction similaire se produit à la surface de l'énergie potentielle de l'état fondamental, formant d'abord un composé cyclique intermédiaire de CO
2 [c-CO
2 (
1 A
1 )], qui se transforme ensuite en COO intermédiaire colinéaire (
1 Σ
+ ) sur le chemin de la dissociation en C + O
2 .
Une telle réaction est possible si la molécule est "courbée" pour que les deux atomes O se rapprochent le plus possible. Cela nécessite 6 eV d'énergie interne. Et, vous devez admettre que peu importe la force des hommes à plier les tiges métalliques, il sera beaucoup plus difficile de plier une molécule.
Les transitions dans des états électroniquement excités et anioniques de CO
2 peuvent aider à plier la molécule. Les scientifiques rappellent que des expériences récentes de leurs collègues ont montré que l'utilisation de la photoexcitation VUV (ultraviolet sous vide) et de la fixation électronique permet la dissociation du CO
2 en C (
3 P) + O
2 (X
3 Σ
g -). Cependant, personne n'a auparavant étudié ce processus exotique à un niveau suffisamment détaillé. Et tout cela parce que, à la suite de ces expériences, aucun produit O
2 ionisé n'a été trouvé. Mais, comme nous le savons, ne pas trouver quelque chose ne signifie pas que ce n'est pas du tout.
Par conséquent, dans l'étude que nous examinons aujourd'hui, les scientifiques ont appliqué des méthodes de diffusion de faisceaux d'ions ainsi qu'une modélisation mathématique pour démontrer une nouvelle façon d'activer la réduction directe du CO
2 en O
2 avec la détection de produits O
2 ionisés. Ce processus contient une voie de réaction intramoléculaire inconnue qui se produit lors de collisions actives d'ions et de la surface du CO
2 . Le plus surprenant est le manque de dépendance de cette réaction à la nature et à la température de la surface.
Résultats de recherche
Tout d'abord, les scientifiques démontrent la formation d'O
2 dans les collisions hyperthermiques CO
2 + / Au en traçant la distribution d'énergie cinétique de trois produits ioniques moléculaires dispersés (CO
2 + , O
2 + et O
2 - ) pour différentes énergies incidentes de CO
2 + (E
0 ) . À E
0 <80 eV, un signal très faible de CO
2 + diffusé a été détecté (
1a , graphique à gauche).
 Image n ° 1
Image n ° 1L'énergie de pointe du CO
2 + sortant
est proportionnelle à E
0 , c'est-à-dire qu'il y a un rebond balistique ou pulsé depuis la surface, ce qui exclut la pulvérisation physique. Les scientifiques pensent qu'observer un signal «dynamique» de CO
2 + est crucial car il est la preuve que du CO
2 survit à une collision de surface. De plus, il est possible de déterminer la séquence des collisions des atomes constitutifs. En plus du CO
2 + , des signaux d'ions O
2 diffusés ont également été observés (
1b ,
1c / graphique au centre et à droite). Dans ce cas, les énergies des O
2 + et O
2 - libérés représentent une grande partie de l'énergie des particules incidentes (57%) et augmentent uniformément parallèlement à E
0 dans une plage plus large que le CO
2 + diffusé. Le signal maximal d'ions O
2 a été observé à E
0 ~ 100 eV.
Les chercheurs appellent la découverte de produits ioniques O
2 surprenante, car ni l'atomisation de l'O
2 de surface ni l'abstraction de l'atome O ne peuvent expliquer la formation de ces ions. Et tout cela parce que ces deux mécanismes produiraient de l'O
2 à des énergies de sortie beaucoup plus faibles que ce qui a été observé. Il est logique de supposer que la dissociation même du CO
2 est impliquée ici.
La dissociation partielle et complète du CO
2 est en bon accord avec les autres produits ioniques détectés (CO
+ , CO
- , O
+ , O
- et C
+ ). Et l'énergie du CO
+ , CO
- et O
- sortant change en parallèle avec l'énergie des particules incidentes, ce qui est cohérent avec la formation dynamique lors d'une collision de surface.
Mais les pics O
+ et C
+ montrent une dépendance extrêmement faible à E
0 , ce qui indique une origine différente, c'est-à-dire la pulvérisation. Les produits C
+ dispersés qui se manifestent à E
0 > 80 eV confirment la dissociation complète.
Ensuite, les scientifiques ont utilisé la cinématique pour décrire le mécanisme de diffusion.
La théorie binaire des collisions (BPS) nous permet de calculer le facteur cinématique, défini comme la fraction de l'énergie des particules incidentes, détenue par le produit diffusé émergeant de la surface. Dans le modèle le plus simple, le CO
2 + est diffusé sous forme de molécule entière, c'est-à-dire comme une sphère solide avec une masse atomique de 44 Da. Dans ce cas, le BPS prédit un coefficient cinématique de 0,6349, qui est plutôt faiblement corrélé avec les données (
2a ).
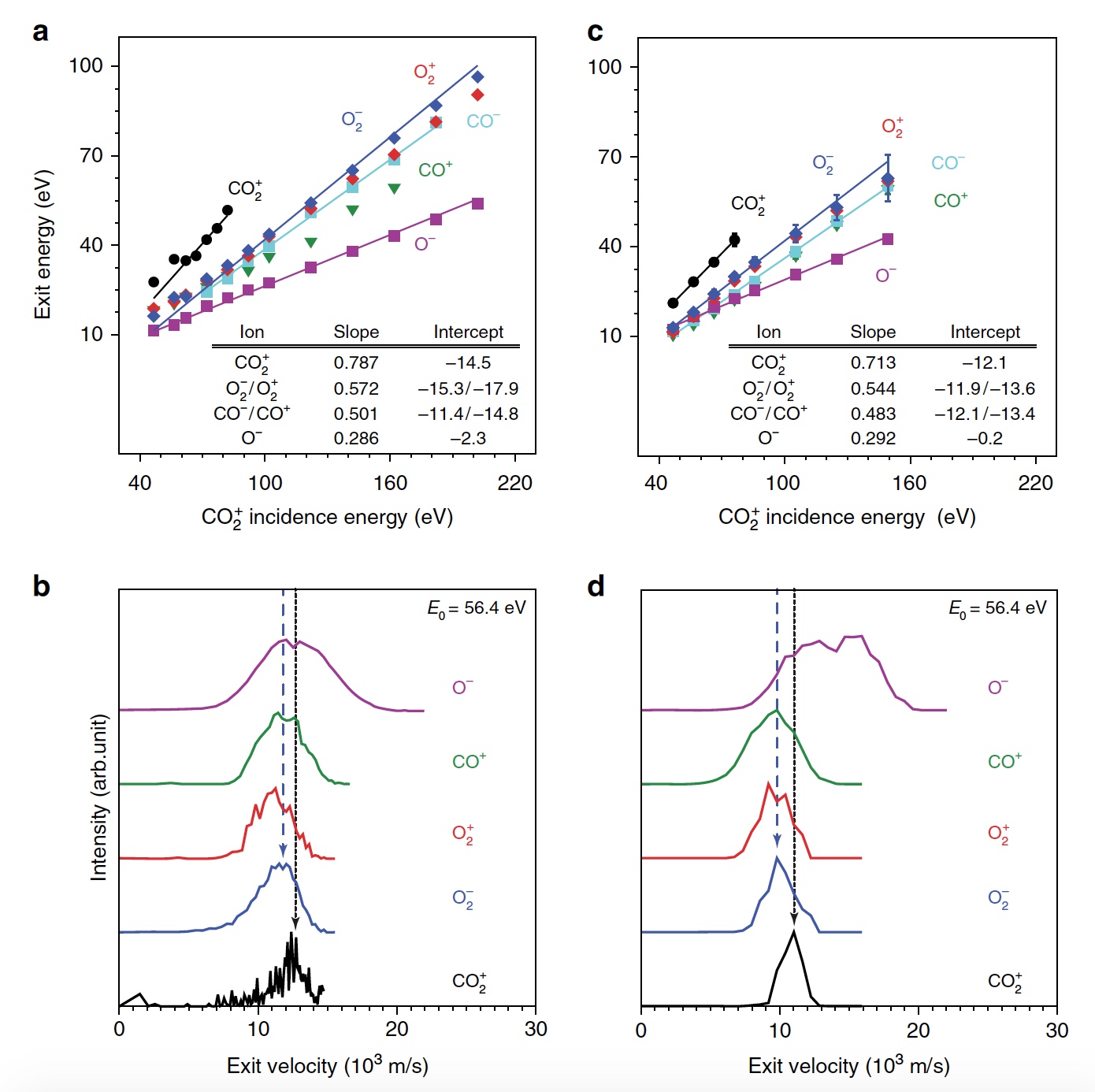 Image n ° 2
Image n ° 2Après cela, les scientifiques ont appliqué un modèle dans lequel l'atome O entre d'abord en collision avec l'atome Au de surface, puis la deuxième collision du fragment CO se produit sans dissociation rapide de la molécule de CO
2 . L'application du BPS à ce modèle de collisions successives donne un coefficient cinématique de 0,7870, ce qui est en excellent accord avec les données sur l'énergie du CO
2 + sortant (ligne noire à
2a ). Le graphique
2a montre également les énergies d'autres produits ioniques diffusés sortants.
La principale source potentielle de ces produits peut être appelée dissociation partielle ou complète du CO
2 et pulvérisation en surface de fragments de CO
2 adsorbés. Malgré le fait qu'une certaine pulvérisation soit effectivement observée à des valeurs élevées de E
0 (> 140 eV), une analyse cinématique des données sur l'énergie des particules sortantes fournit des preuves convaincantes de la présence d'une dissociation précisément pulsée de la molécule de CO
2 .
Ensuite, les scientifiques ont effectué une analyse de la vitesse des particules diffusées observées.
La figure
2b montre une comparaison des pics de distribution des ions à E
0 = 56,4 eV. Comme nous pouvons le voir, les taux de sortie de CO
+ , O
2 + , O
2 - dispersés et la partie plus lente de la distribution O
- se chevauchent, ce qui indique une origine commune. Cependant, la distribution de O
est sensiblement plus large, s'étendant à des vitesses de sortie plus élevées, ce qui peut indiquer une autre origine. Les produits ioniques O
2 sortent à des taux inférieurs à CO
2 + en raison de l'inélasticité due à la rupture des liaisons chimiques et à l'ionisation de surface non résonante.
Selon les scientifiques, l'analyse cinématique ci-dessus a fourni des preuves concluantes que certaines molécules de CO
2 se dispersent intactes après une collision séquentielle en deux étapes de fragments O et CO. Cependant, des questions demeurent concernant divers aspects du mécanisme de formation d'O
2 .
Après les expériences, un certain nombre de questions demeurent. Premièrement, il n'est pas clair si l'O
2 est produit par le mécanisme électronique adiabatique ou non adiabatique. Deuxièmement, les trajectoires de collision qui sous-tendent la distribution de vitesse à la sortie des fragments ioniques sont inconnues. Troisièmement, on ne sait pas combien d'O
2 neutre
se forme .
Dans ce cas, la modélisation peut clarifier la situation, à savoir la méthode classique de dynamique moléculaire (méthode MD).
Pour simuler la trajectoire de diffusion du CO
2 sur Au (111), la géométrie de diffusion observée dans l'expérience a été appliquée. On suppose que le CO
2 est libéré à la surface de l'énergie potentielle d'un électron singulet en cas de neutralisation des ions CO
2 + entrants avant une collision violente.
La neutralisation rapide se produit par l'effet tunnel résonnant des électrons de la surface métallique vers le cation moléculaire, car le niveau moléculaire de CO
2 (-13,8 eV) se trouve dans la zone Au occupée (de -5,3 à -15,3 eV). Dans la simulation, les transferts d'électrons de / vers la surface ont également été pris en compte pour prendre en compte l'ionisation des produits de collision neutres.
L'image
2c montre les valeurs énergétiques calculées des particules sortantes.
Il a été constaté qu'un petit nombre de CO
2 maintient l'intégrité à E
0 > 80 eV, ce qui est cohérent avec l'absence de signal à ces énergies lors d'expériences pratiques. Les données obtenues par modélisation sont en excellent accord avec les données expérimentales, ce qui est facile à voir en comparant les graphiques
2a (expérience) et
2c (simulation).
En plus de cet accord entre expériences et modélisation, il se manifeste également par une comparaison du taux d'ions de sortie à E
0 = 56,4 eV (
2d ). Le modèle et l'expérience montrent une expansion de la distribution des vitesses CO
+ et O
- . Il a également été confirmé que les distributions de O
2 + et O
2 - sont similaires au cation partant plus lentement que l'anion. De plus, dans les deux cas, il a été constaté que le CO
2 + émerge à un taux plus élevé que les produits O
2 ionisés.
Par conséquent, l'utilisation de cette technique de modélisation peut fournir des données assez précises concernant le mécanisme de réaction de la conversion directe du CO
2 en O
2 .
Au cours de la phase principale de la simulation, 20 000 trajectoires de collision CO
2 -Au-Au ont été recréées à différentes énergies des particules sortantes. En conséquence, plusieurs variantes de produits de dissociation ont été obtenues, y compris O
2 (
3a ).
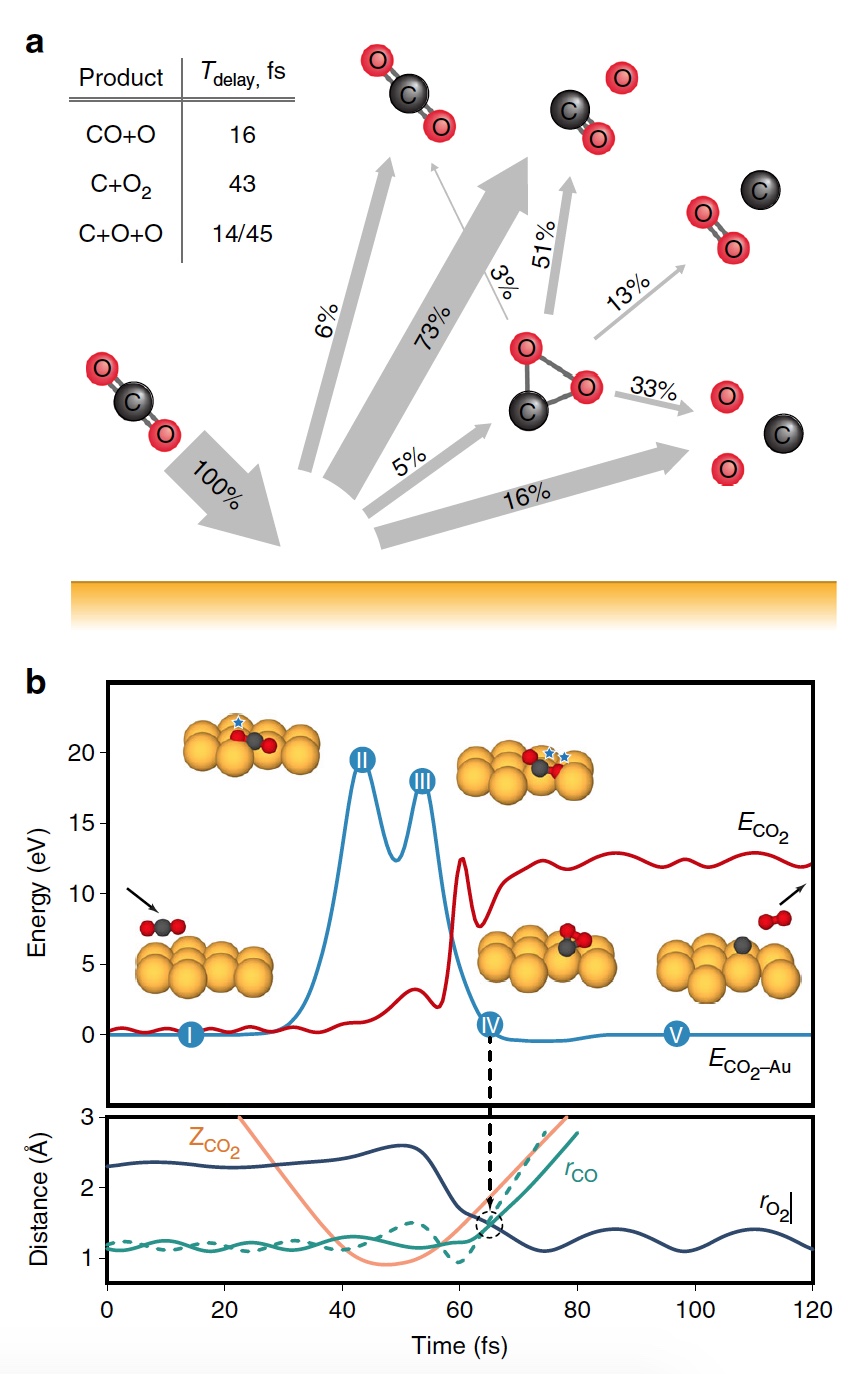 Image n ° 3
Image n ° 3La figure
3b montre une trajectoire représentative qui se traduit par la formation d'O
2 . À la suite du transfert d'énergie pulsé pendant une collision, un réarrangement intramoléculaire important se produit à l'intérieur du CO
2 rebondissant. La distance O - O diminue et la distance C - O augmente, atteignant un pic lorsque le CO
2 acquiert une configuration triangulaire avec des longueurs de liaison presque égales. Un tel produit de CO
2 intermédiaire fortement courbé a une quantité importante d'énergie interne et se dissocie rapidement, ce qui entraîne la formation d'un atome de C libre et d'une molécule d'O
2 vibrante.
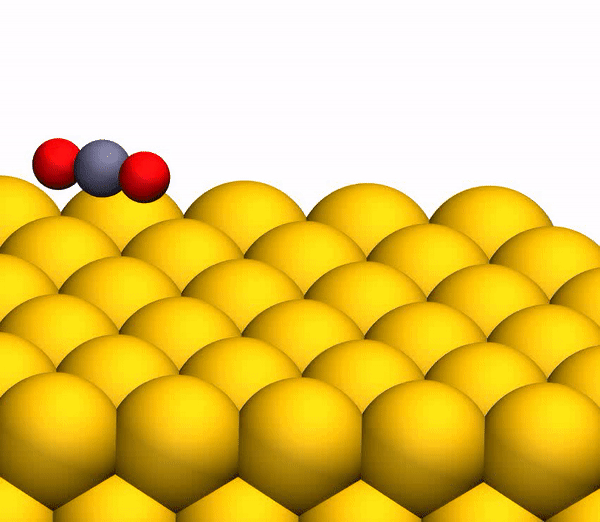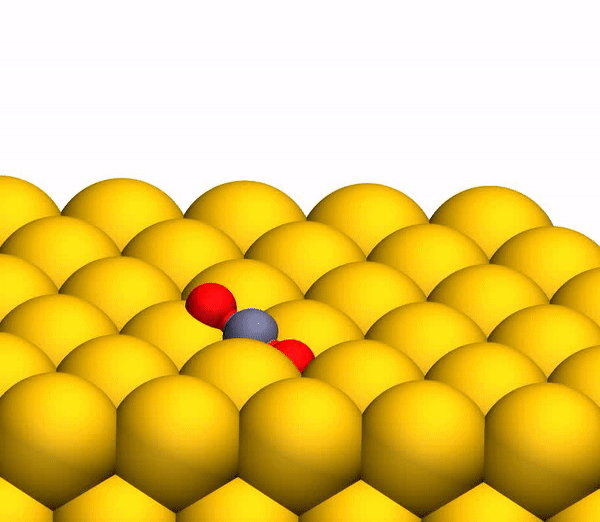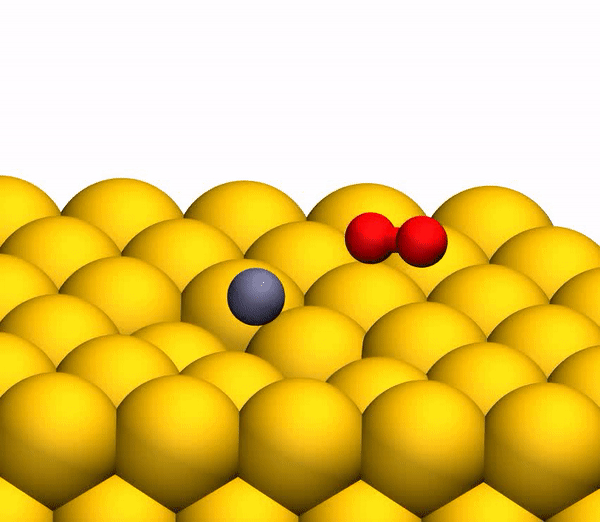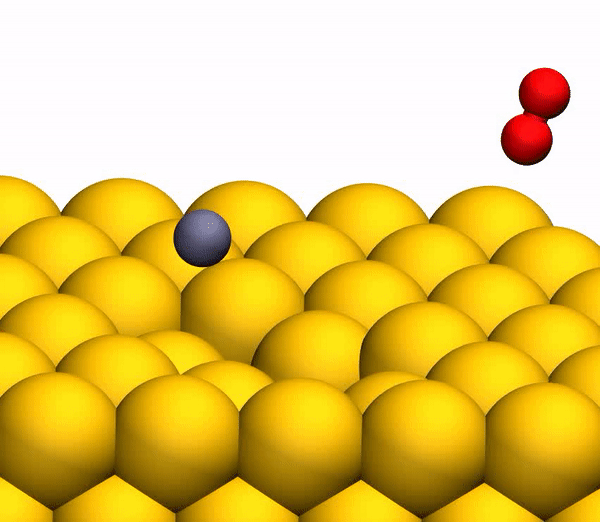 Processus de séparation du CO 2 en un atome de C libre et une molécule d'O 2 vibrante.
Processus de séparation du CO 2 en un atome de C libre et une molécule d'O 2 vibrante.Il convient de noter que le mécanisme de séparation décrit ci-dessus est pleinement cohérent avec les conclusions du modèle cinématique utilisé précédemment.
Les calculs ont montré qu'environ 5% de toutes les trajectoires conduisent à un état intermédiaire fortement courbé de CO
2 , qui est l'une des étapes de l'extraction de l'O
2 . Cette condition est fragmentée principalement par dissociation partielle (51%), après quoi la dissociation complète suit à nouveau, mais avec un résultat plus élevé (33%).
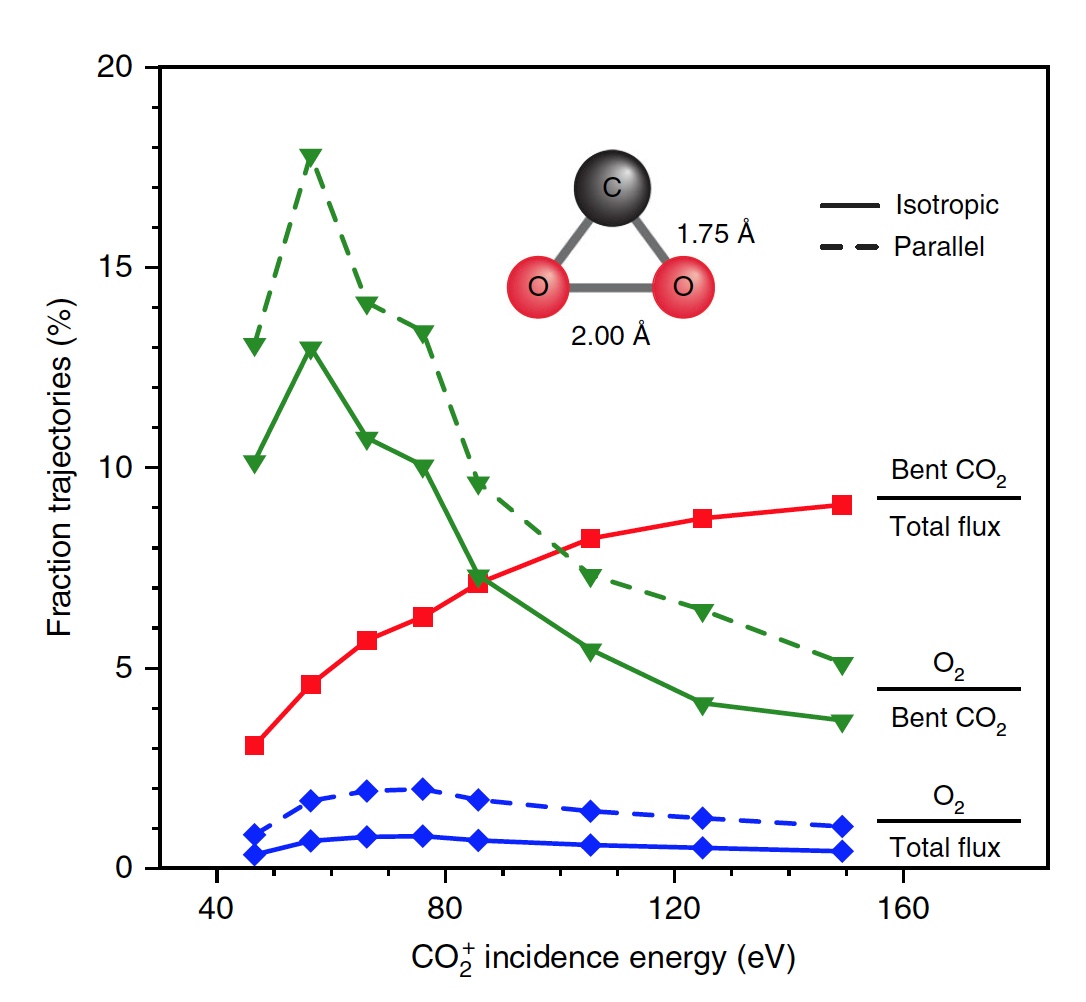 Image n ° 4
Image n ° 4Les scientifiques notent que de toutes les molécules incurvées de CO
2 , seulement 13% produisent de l'oxygène. Autrement dit, le résultat global de la dissociation de CO
2 → C + O
2 est de 0,6% à E
0 = 56,4 eV. Si vous augmentez l'énergie des particules incidentes, vous pouvez obtenir O
2 jusqu'à 0,8 ± 0,2% à E
0 ~ 70 ± 15 eV (ligne bleue dans l'image n ° 4).
De plus, la fraction des trajectoires de formation d'O
2 augmente de manière significative lorsqu'un état intermédiaire fortement courbé de CO
2 (ligne verte) est atteint, atteignant un maximum de 13% à E
0 ~ 55 ± 10 eV. Le rendement total inférieur en O
2 neutre est dû au fait que seule une petite fraction des molécules linéaires de CO
2 atteint un état fortement courbé (ligne rouge). Si vous modifiez spécifiquement l'orientation des molécules de CO
2 entrantes (axe parallèle à la surface), vous pouvez ainsi obtenir 2% d'O
2 en plus (ligne verte en pointillés).
Pour une connaissance plus détaillée des nuances de l'étude, je vous recommande de consulter le
rapport des scientifiques .
Épilogue
Ce travail a démontré que grâce à des réactions chimiques non standard, il est possible d'obtenir de l'oxygène à partir du dioxyde de carbone. Personne ne prétendra qu'une telle technique nécessite de nouveaux raffinements et améliorations. Cependant, le fait que ce travail ouvre vraiment de nouvelles possibilités pour les voyages interplanétaires, la colonisation de Mars, et non seulement ne peut être nié. Il y a aussi un problème d'oxygène et de dioxyde de carbone sur notre planète d'origine. Au contraire, avec ce dernier, son volume a considérablement augmenté depuis l'industrialisation. Et considérant que le CO
2 est l'un des principaux responsables du réchauffement climatique, réduire sa quantité et en tirer de l'oxygène semble être une idée très tentante. Comme nous ne pouvons toujours pas nous passer d’usines, d’usines, de voitures à moteur à combustion interne et d’autres choses, les nouvelles méthodes de nettoyage de notre atmosphère ne sont pas seulement nécessaires, mais extrêmement nécessaires. Voyager vers des planètes lointaines est certainement cool, mais avant que le déplacement massif vers Mars soit encore très, très loin, il vaut donc la peine de penser davantage à la Terre sur laquelle nous vivons qu'à Mars, dont nous rêvons.
Merci de votre attention, restez curieux et bonne semaine de travail, les gars! :)
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir des matériaux plus intéressants? Soutenez-nous en passant une commande ou en le recommandant à vos amis, une
réduction de 30% pour les utilisateurs Habr sur un analogue unique de serveurs d'entrée de gamme que nous avons inventés pour vous: Toute la vérité sur VPS (KVM) E5-2650 v4 (6 cœurs) 10 Go DDR4 240 Go SSD 1 Gbps à partir de 20 $ ou comment diviser le serveur? (les options sont disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
Dell R730xd 2 fois moins cher? Nous avons seulement
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV à partir de 199 $ aux Pays-Bas! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - à partir de 99 $! Pour en savoir plus sur la
création d'un bâtiment d'infrastructure. classe utilisant des serveurs Dell R730xd E5-2650 v4 coûtant 9 000 euros pour un sou?