
Les succès de l'oncologie clinique moderne sont indéniables. Opérations de plus en plus complexes, nouveaux médicaments, méthodes efficaces de soulagement de la douleur et d'élimination des symptômes douloureux. Dans notre blog, nous
avons suffisamment
parlé de la façon dont il est possible aujourd'hui d'étendre et de faciliter la vie des patients, même dans les derniers stades de la maladie.
Mais, néanmoins, des milliers de patients cancéreux du monde entier apprennent quotidiennement qu'une tumeur qui a cédé hier à certains traitements est en train de repousser ou de métastaser. Les médecins se retrouvent régulièrement au point mort: tous les médicaments et méthodes de traitement prescrits ont été essayés, et il n'y a plus de médicaments efficaces pour ce patient.
Cependant, même un moyen de sortir de cette impasse peut être trouvé. Avec le développement de la génétique et de la biologie moléculaire, les oncologues ont trouvé une nouvelle façon d'étudier la tumeur afin d'y trouver des vulnérabilités.
Pour ce faire, utilisez des tests de génétique moléculaire - déterminant les caractéristiques de l'ADN des cellules cancéreuses. La méthode est techniquement compliquée, coûteuse, elle nécessite des connaissances spécifiques d'un médecin.
L'étude dure 3 semaines, coûte de 250 à 670 tr En conséquence, le médecin reçoit un rapport de 30 pages d'informations complexes, qu'il devrait toujours être en mesure d'utiliser. Mais pour les patients qui ont déjà cessé d'espérer, cela donne une durée de vie supplémentaire.
Chez
Medicine 24/7, nous recourons régulièrement à la recherche en génétique moléculaire pour traiter une personne quand "tout le monde l'a essayé - rien d'autre à faire". Et les patients, qui ne semblaient plus rien pouvoir aider, continuent de vivre. Certains sont de deux mois au lieu de deux semaines, et d'autres sont des années au lieu de quelques mois.
Aujourd'hui, nous voulons parler de la façon dont les tests de génétique moléculaire sont effectués, dans quels cas ils peuvent aider le patient et quelles connaissances le médecin donne.
Nous sommes tous des mutants, c'est la norme. Mais certaines mutations mènent au cancerLes cellules «décentes» vivent sans déranger les autres. Ils utilisent une quantité strictement allouée de ressources, remplissent adéquatement leurs fonctions biologiques et, en temps voulu, ils meurent, laissant la place aux générations suivantes (ce processus est appelé apoptose). Tous les 7 à 10 ans, le corps humain est complètement mis à jour.
Pour ce faire, toutes les cellules somatiques (celles qui composent le corps), à l'exception des globules rouges, se divisent continuellement.
Avant de se diviser, la cellule est stockée avec une «copie» de l'information génétique héréditaire qui est en son cœur. Les brins d'ADN «repliés» en chromosomes à l'intérieur du noyau sont répliqués, c'est-à-dire doubler. Et après cela, la cellule se divise, distribuant tranquillement à chacune des cellules filles un ensemble identique de chromosomes. D'une cellule, deux sont absolument identiques et, avec leur bagage génétique, chacun obtient une «connaissance» de la façon dont il doit vivre, de la fonction à remplir et du nombre de fois dans la vie à partager.
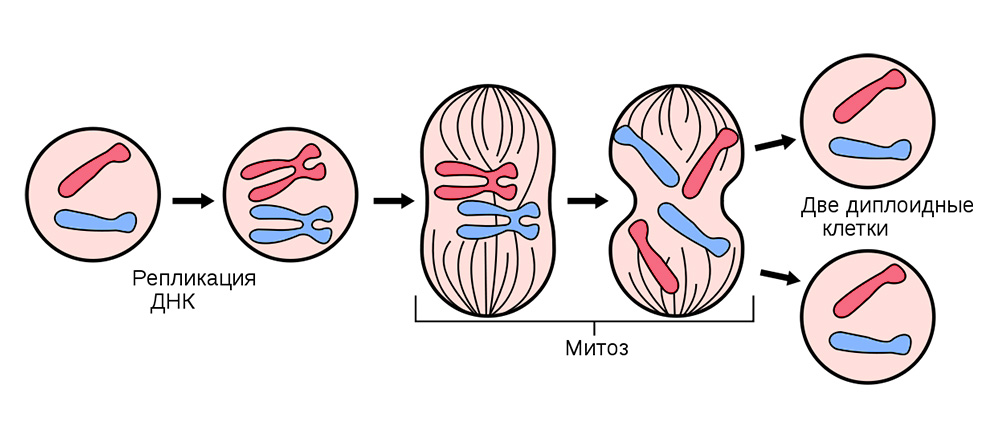 La division cellulaire somatique se produit dans tous les organes et tissus.
La division cellulaire somatique se produit dans tous les organes et tissus.Parfois en cours d'échecs de division - des mutations se produisent. Soit le brin d'ADN se brisera, il sera copié avec une erreur, soit les sections des chromosomes se mélangeront. Des centaines de facteurs peuvent affecter cela: du stress et de la fumée de tabac à l'exposition aux radiations.
Les mutations peuvent être divisées en 4 types.1. Remplacement d'une paire de bases (polymorphisme mononucléotidique, SNP): un nucléotide - la "lettre" du code génétique - change en un autre. La structure de la protéine codée par cette séquence nucléotidique est également perturbée.
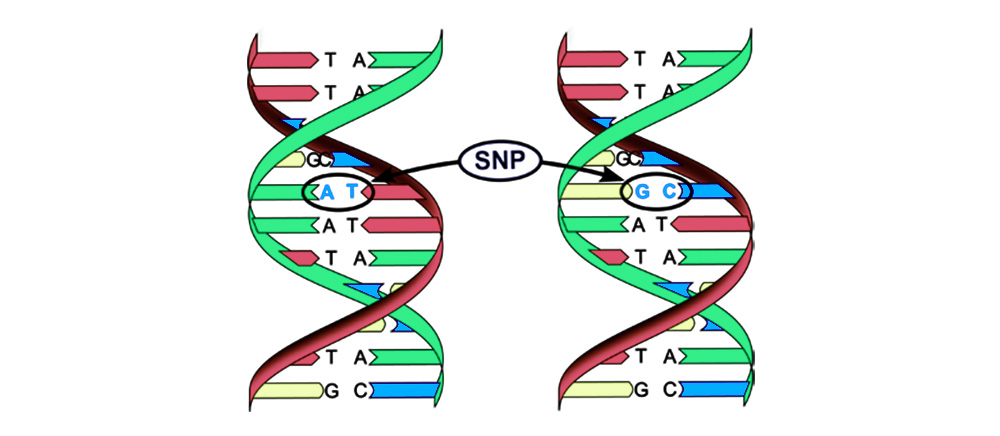 2. Aberrations chromosomiques.Délétion
2. Aberrations chromosomiques.Délétion - perte d'un site chromosomique. Ils se produisent en raison de la terminaison de la partie terminale ou de la rupture de l'ADN à deux endroits à la fois. C'est tout - ce gène n'est plus exprimé sur le chromosome.
Des "morceaux" d'ADN arrachés peuvent être insérés dans le chromosome adjacent - une
insertion (ou une inversion, si l'insertion se produit dans l'ordre inverse) en
résultera . Parfois, entre les chromosomes, il y a un "échange mutuel" de sections d'ADN -
translocation . Le résultat en est un: des gènes «supplémentaires» sont
exprimés .
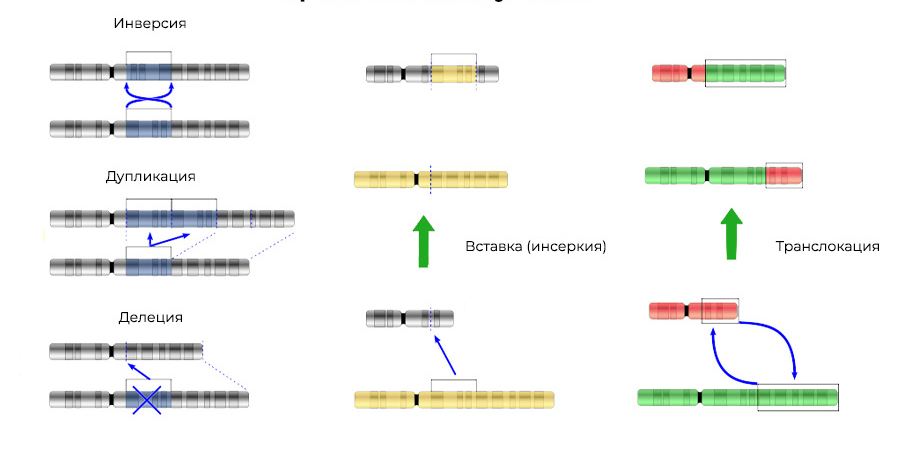 Les mutations changent non seulement la structure d'un site d'ADN, mais aussi l'ordre de ces sites3. Fusion de gènes
Les mutations changent non seulement la structure d'un site d'ADN, mais aussi l'ordre de ces sites3. Fusion de gènes - un gène est «assemblé» à partir de parties d'autres gènes et exprimé (déclenché) dans son ensemble. La protéine dans l'expression d'un tel gène chimère s'avère également inhabituelle, hybride, avec des propriétés nocives.
 Deux gènes «collés ensemble» pendant la translocation et ont formé un gène chimérique (cause la leucémie)
Deux gènes «collés ensemble» pendant la translocation et ont formé un gène chimérique (cause la leucémie)Nous avons la chance que l'ADN soit plein de sections pas trop importantes qui ne codent rien. De nombreuses mutations se produisent dans ces zones - et s'avèrent insignifiantes, n'ont aucun effet sur le travail ultérieur des cellules. Et une telle cellule, avec une légère différence par rapport au «standard», continue de vivre et de partager normalement.
En 70 ans, 100 billions de divisions cellulaires se produisent dans le corps humain. Cela représente 1,4 billion de divisions par an - il y a suffisamment de cas pour accumuler une «masse critique» d'erreurs dans l'ADN au fil du temps, ou pour qu'un autre échec puisse encore pénétrer dans la section ADN encodant quelque chose d'important. Cela entraînera une mutation non inoffensive, à cause de laquelle la cellule deviendra maligne (maligne).
Une cellule maligne se distingue d'un trouble normal du cycle cellulaire.Le cycle cellulaire (la vie cellulaire de division en division / mort) est strictement régulé par le
travail de protéines spéciales: kinases, cyclines, facteurs de croissance et facteurs de transcription - il y en a des dizaines dans chaque cellule vivante, et chacune a sa propre fonction spéciale mais importante.
Ils transmettent des signaux entre les cellules d'un organisme multicellulaire, s'activent mutuellement, démarrent le processus de division et contrôlent son exactitude, maintiennent l'activation correcte des gènes, remplissent leurs fonctions par la cellule, «vérifient» l'intégrité du génome, «commandent» à la cellule de commencer l'apoptose s'il est temps de mourir, et t .p.
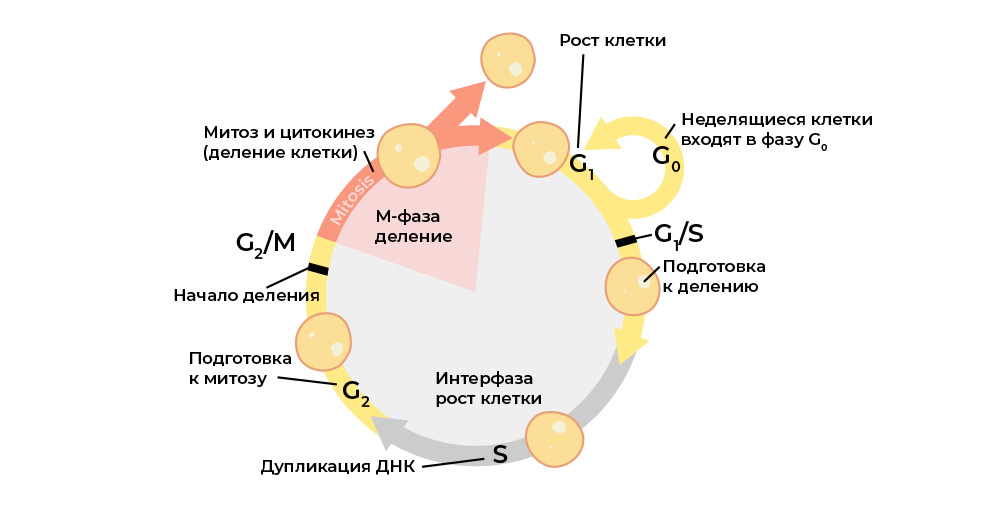 Chaque étape du cycle cellulaire est contrôlée par des protéines régulatrices.
Chaque étape du cycle cellulaire est contrôlée par des protéines régulatrices.Et chacune de ces protéines est codée dans une
partie spécifique de l'ADN - le gène. Si un tel gène subit une mutation nuisible, il «reproduira» incorrectement la protéine régulatrice correspondante. Et le «mauvais» régulateur de protéines perturbera le cycle cellulaire, et avec lui le comportement de la cellule entière.
Par exemple, le gène du régulateur protéique de la prolifération (croissance de la masse cellulaire) "se décompose" - et les "mutants" commencent à se diviser plus qu'ils ne le devraient, les cellules saines "écrasent".
Ces gènes importants, dont les changements peuvent conduire à la cancérogenèse (l'apparition d'un cancer), constituent deux grands groupes.Les protooncogènes sont des gènes «normaux» qui peuvent devenir des
oncogènes en raison de l'amélioration ou du changement de leurs fonctions. Les gènes dont l'expression peut conduire à une tumeur maligne de la cellule et au développement de néoplasmes sont appelés
oncogènes . Si une mutation nocive se produit dans le proto-oncogène, elle devient un
oncogène et peut provoquer une tumeur.
Parmi ceux qui sont les mieux
étudiés et sont largement entendus:
- EGFR, ALK, BRAF - cancer du poumon non à petites cellules;
- BRAF - mélanome;
- HER2 - cancer du sein (cancer du sein);
- KRAS - cancer colorectal.
De plus, des mutations de ces gènes se retrouvent dans plusieurs types de tumeurs. Par exemple, une expression accrue de HER2 se retrouve non seulement dans le cancer du sein, mais aussi dans le cancer du poumon et de l'estomac.
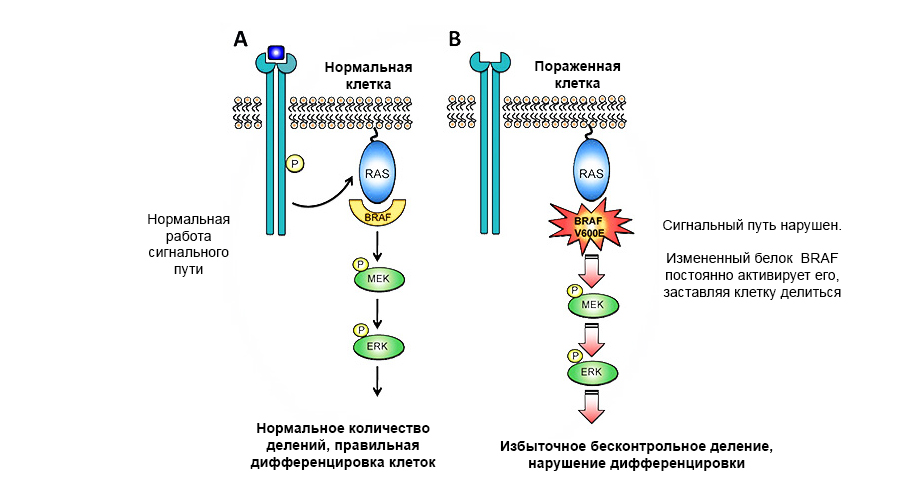 Une mutation du proto-oncogène de la protéine BRAF entraîne une croissance tumorale incontrôlée.
Une mutation du proto-oncogène de la protéine BRAF entraîne une croissance tumorale incontrôlée.Les gènes suppresseurs de tumeurs (anti-oncogènes) - au contraire, peuvent
supprimer la croissance des cellules tumorales ou participer à la réparation (réparation) de l'ADN endommagé. Mais l'inactivation des gènes suppresseurs à la suite de mutations augmente considérablement la probabilité d'une tumeur maligne.
Par exemple:
- mutations BRCA1, BRCA2 - cancer des glandes mammaires, ovaires;
- mutations p53 - jusqu'à 50% de divers types de tumeurs cancéreuses, y compris sarcomes;
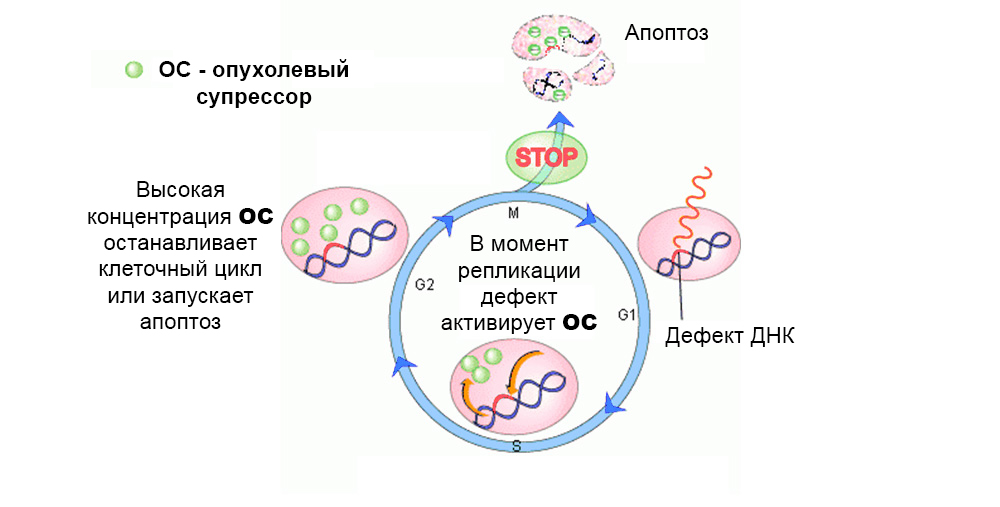 Normalement, les mécanismes de protection agissent contre le développement de cellules mutées. Un défaut dans le gène suppresseur de tumeur les «éteint»
Normalement, les mécanismes de protection agissent contre le développement de cellules mutées. Un défaut dans le gène suppresseur de tumeur les «éteint»Au total, l'effet de plusieurs dizaines de proto-oncogènes et suppresseurs de tumeurs sur la cancérogenèse a été étudié.
Pourquoi y a-t-il tant de difficultés et comment prolongent-elles la vie des patientsChaque mutation trouvée dans un gène proto-oncogène ou suppresseur est la cause des «superpuissances» de la cellule cancéreuse, telles que la négligence de l'apoptose et la capacité de se cacher de l'immunité. Mais en même temps - c'est son point faible potentiel.
Sachant quelle est la raison des particularités du mécanisme de fonctionnement de la tumeur, on peut trouver une substance qui «coince» ce mécanisme et interrompt les réactions pathologiques dans la cellule. Autrement dit, des mutations spécifiques dans la tumeur - indiquent la cible à laquelle les médecins «frappent» avec le médicament. Ce principe a permis le développement d'
une thérapie ciblée .
La thérapie ciblée - le nom de toute une branche de la pharmacothérapie efficace contre le cancer - est née du mot anglais target. Les médicaments ciblés agissent «ciblés» sur les cellules cancéreuses - car seuls ils ont des mutations dans les gènes correspondants. Les cellules saines n'ont pas de telles mutations - et les médicaments n'agissent pas sur elles.
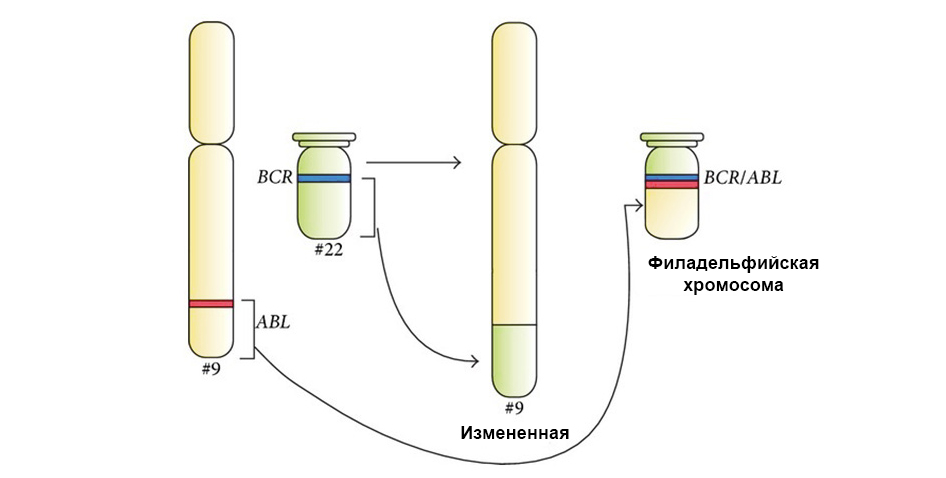
La figure ci-dessous montre le mécanisme d'action du médicament ciblé Imatinib sur les cellules tumorales avec la mutation chromosomique de Philadelphie: le gène de fusion BCR-ABL. Cette mutation conduit au fait que le mécanisme de l'apoptose cesse de fonctionner dans la cellule - les erreurs dans le génome s'accumulent, la cellule dégénère en cancereuse.
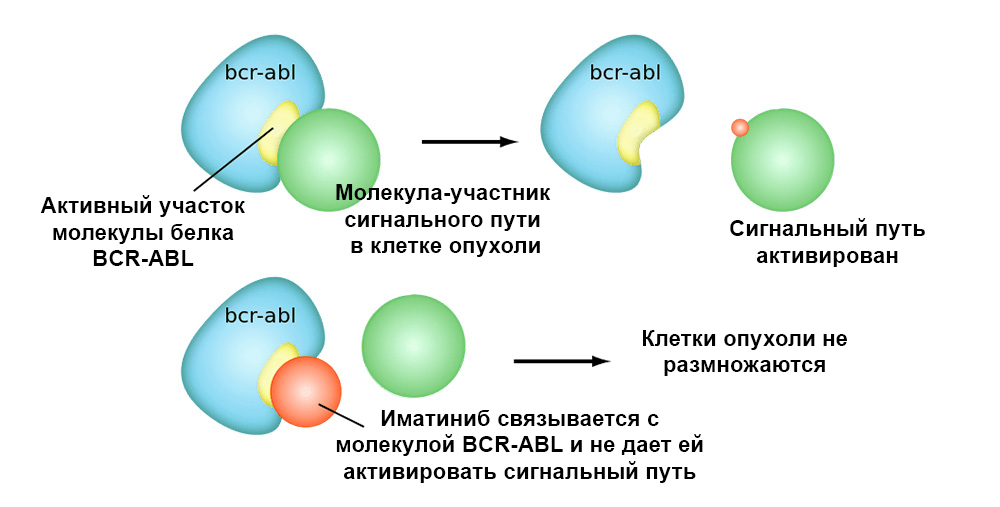 L'imatinib se lie au site actif de la molécule de protéine BCR-ABL et bloque sa capacité à interagir avec d'autres molécules dans les voies du signal.Les médicaments ciblés présentent donc 2 avantages importants par rapport à la chimiothérapie classique.Une plus grande efficacité.
L'imatinib se lie au site actif de la molécule de protéine BCR-ABL et bloque sa capacité à interagir avec d'autres molécules dans les voies du signal.Les médicaments ciblés présentent donc 2 avantages importants par rapport à la chimiothérapie classique.Une plus grande efficacité. L'action ciblée sur les cellules tumorales permet d'obtenir une meilleure «réponse» de la tumeur au traitement. Par exemple, par rapport au traitement classique, l'ajout du médicament ciblé Trastuzumab avec la chimiothérapie du cancer du sein avec surexpression de HER2 a
significativement augmenté la fréquence des «réponses» - 81% contre 73%, et la fréquence de la rémission morphologique complète (disparition de la tumeur) - 43% contre 23%
Moins d'effets secondaires. Chimiothérapie classique à effet cytotoxique. Essentiellement, des substances toxiques pour tuer ou au moins ralentir la croissance des cellules cancéreuses. Surtout, ils agissent sur les cellules qui se divisent rapidement. C'est pourquoi, par exemple, les cheveux en tombent: c'est aussi un type de cellules qui se divisent activement, et elles «tombent sous la distribution». En raison de cette action peu ciblée, les médicaments chimiothérapeutiques entraînent de graves effets secondaires: le tractus gastro-intestinal et d'autres organes en souffrent également.
Dans la pratique
de la médecine 24h / 24 et 7j / 7, nous prescrivons le plus souvent des médicaments ciblés dans le cadre d'un traitement global: nous combinons chimiothérapie, cible et immunothérapie.
La difficulté est que chaque tumeur est unique dans son ensemble de mutations «cibles»Tout comme chaque personne a un code ADN unique, les tumeurs sont uniques. Après tout, ils sont «nés» des propres cellules du corps. Il n'y a pas de tumeurs ayant les mêmes propriétés moléculaires génétiques. Par conséquent, la création d'une «pilule» universelle contre le cancer est fondamentalement impossible. Le cancer est une maladie trop individuelle.
Mais le traitement pour lui devrait être approprié - sélectionné individuellement pour un patient particulier - en fonction du fait que nous déterminons les mutations dans ses cellules tumorales.
Dans un passé récent, les tumeurs malignes ne pouvaient être classées que par histologie, c'est-à-dire selon l'organe dans lequel elles étaient originaires et à quoi ressemblaient les cellules cancéreuses au microscope.
Pour utiliser efficacement une thérapie ciblée, cela ne suffit pas. Le médecin doit savoir quelles sont les mutations dans les cellules tumorales d'un patient particulier, s'il existe des «cibles» de biomarqueurs pour tel ou tel médicament. La médecine personnalisée telle qu'elle est.
Pour cela, nous utilisons des études de génétique moléculaire. Pour trouver les "cibles" pour lesquelles vous devez frapper avec des médicaments ciblés et immuno-thérapeutiques - vous devez déterminer à partir de quels gènes l'ADN de la tumeur est assemblé et quels gènes sont "cassés". En conséquence:
- nous apprenons la sensibilité de la tumeur aux médicaments;
- savoir si la tumeur résiste à certains médicaments;
- découvrir les caractéristiques génétiques qui donnent une hypersensibilité aux médicaments;
- nous choisirons un nouveau traitement si la tumeur ne répond plus au traitement standard;
détecter une tumeur / métastase à un stade très précoce - par des fragments de son ADN dans le sang; - nous pouvons prédire une évolution favorable ou agressive de la maladie.
L'échantillon est le plus souvent le tissu tumoral, soit prélevé pendant l'opération pour enlever la lésion primaire, soit une biopsie - un morceau microscopique de la tumeur est prélevé avec une longue aiguille fine spéciale.
Vous pouvez rechercher l'ADN des cellules tumorales dans le sang - puis vous avez besoin d'une soi-disant biopsie liquide, deux tubes à essai avec du sang de 8,5 ml chacun.
Lors d'une biopsie, nous rencontrons souvent le fait que de nombreux patients ont peur de toucher complètement la tumeur - ils ont peur que cela provoque sa croissance. À ce jour, aucune étude ne montre une telle relation. Bien sûr, une biopsie doit être effectuée correctement. Lorsque nous prenons une biopsie, les médecins marquent le plus souvent le lieu d'entrée de l'aiguille: soit ils font un petit tatouage (il y a un tel instrument ), soit ils mettent un bracket (chirurgical). Si une opération est nécessaire plus tard, ils excisent tout le cours où l'aiguille était - de la peau à la tumeur - afin que nous réduisions encore plus le risque de propagation des cellules cancéreuses au-delà de la tumeur.Ensuite, les échantillons sont envoyés au laboratoire d'études de génétique moléculaire.Là, l'ADN tumoral est isolé de l'échantillon et séquencé. C'est-à-dire qu'ils «lisent» la séquence de «lettres» -nucléotides. Et puis ils le comparent avec un panel de diagnostic sélectionné dans la base de données des bibliothèques - des génomes déjà décryptés de milliers d'autres personnes. Le panel est sélectionné pour chaque patient en tenant compte de l'historique et des données cliniques. Tout cela, bien sûr, se fait par des séquenceurs automatiques et un ordinateur.
Et si il y a 20 ans la «lecture» du génome prenait des mois, elle nécessitait un décryptage lent et complexe, aujourd'hui dans le laboratoire avec lequel nous travaillons, une analyse se fait en quelques jours ouvrables.
De plus, plusieurs méthodes sont utilisées à la fois: le
séquençage d'une nouvelle génération (NGS), le séquençage Sanger et la méthode d'hybridation par fluorescence (FISH) . Ensemble, ils vous permettent de lire l'intégralité de la séquence d'ADN d'une tumeur, de découvrir les mutations du conducteur - c'est-à-dire celles qui ont lancé le processus malin et peuvent maintenant être ciblées par une thérapie ciblée - et même de visualiser le caryotype entier (ensemble de chromosomes).
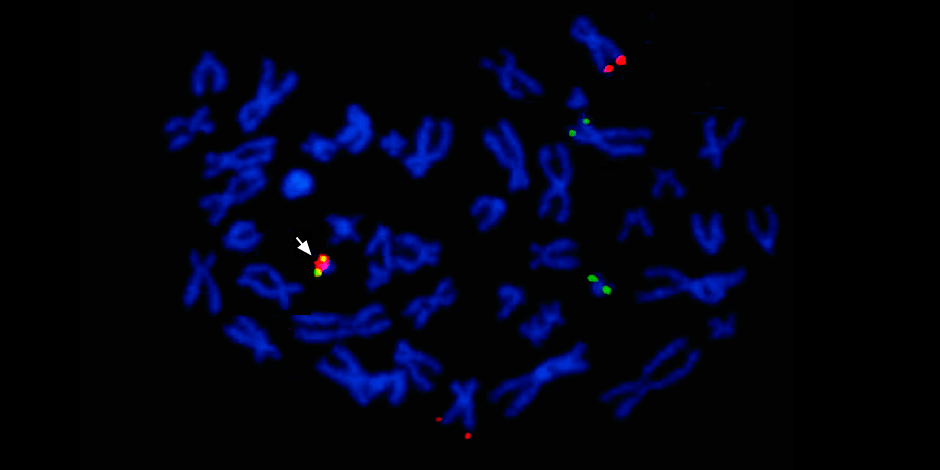 Sous la flèche à gauche - la fusion du signal rouge et vert - la preuve de la fusion du matériel génétique des chromosomes 9 et 22 avec la formation du chromosome chimérique de Philadelphie.
Sous la flèche à gauche - la fusion du signal rouge et vert - la preuve de la fusion du matériel génétique des chromosomes 9 et 22 avec la formation du chromosome chimérique de Philadelphie.De plus, une étude génétique moléculaire complète détermine nécessairement
l'instabilité des microsatellites (MSI, instabilité des microsatellites) - une violation du mécanisme de réparation de l'ADN, qui conduit à l'accumulation rapide de mutations dans les cellules. Ce facteur vous permet de faire des prévisions sur l'évolution future de la maladie.
Après avoir obtenu le profil génétique moléculaire de la tumeur, son analyse commenceDes programmes spéciaux traitent les résultats et font des recommandations automatiquement. Mais ensuite, ces recommandations sont nécessairement supervisées manuellement par une équipe d'experts. L'analyse implique la génétique, la bioinformatique, les oncologues, les immunologistes et les chimiothérapeutes. À ce stade, des améliorations et des ajouts se produisent nécessairement.
Selon la demande, une telle étude peut prendre
de 5 à 15 jours ouvrables : un patient a juste besoin de déterminer le type de tumeur et de clarifier la thérapie recommandée - il suffit de vérifier la présence d'un ensemble de base de 20 mutations d'ADN selon les recommandations des associations mondiales du cancer. Et un autre, avec un diagnostic rare ou une résistance au traitement standard - il faut faire un "passeport moléculaire" de la tumeur, et pour cela - séquencer 400 gènes.
En conséquence, dans la première partie du rapport, toutes les mutations trouvées dans la tumeur du patient et les médicaments ciblés qui seront les plus efficaces dans ce cas sont
enregistrés .
Une thérapie ciblée est approuvée pour ce type de tumeur avec des mutations détectées, et une thérapie ciblée est approuvée pour le traitement d'autres types de cancer avec les mêmes mutations. Dans la pratique, nous avons eu des cas où des médicaments de deuxième ordre, hors AMM, ont été prescrits et ont bien agi.
De plus, le personnel du laboratoire fait un excellent travail de surveillance de la recherche scientifique, ce qui peut être important dans le cas de ce patient.
La deuxième partie du rapport contient une revue des études existantes à l'époque avec des données détaillées sur la fréquence d'apparition de cette mutation, sur l'effet de différents médicaments et sur la possibilité d'utiliser l'un ou l'autre type de thérapie ciblée pour les mutations identifiées. Cela aide à faire au moins un pronostic approximatif pour le patient.
La troisième partie du rapport contient des études cliniques pertinentes auxquelles le patient peut participer afin de recevoir un traitement expérimental. Il s'agit de la dernière méthode d'urgence, mais connaître tous les détails à son sujet est utile pour la tranquillité d'esprit du patient.
En conséquence, à partir de ce rapport, le médecin reçoit le profil génétique moléculaire le plus complet de la tumeur maligne. Il a des informations sur ce que nous traitons exactement, quelle ventilation spécifique dans une cellule. Il existe une compréhension «la plus récente» des médicaments actuellement approuvés ou disponibles pour une utilisation dans les essais cliniques.
 Le rapport est assez lourd - 30 pages de lecture à couper le souffle
Le rapport est assez lourd - 30 pages de lecture à couper le souffleQui en a besoin?
Ceux qui ont développé une résistance tumorale ou une intolérance à tous les médicaments du protocole de traitement standard.
La situation où "tout le monde a essayé - cela n'a pas aidé"., , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.