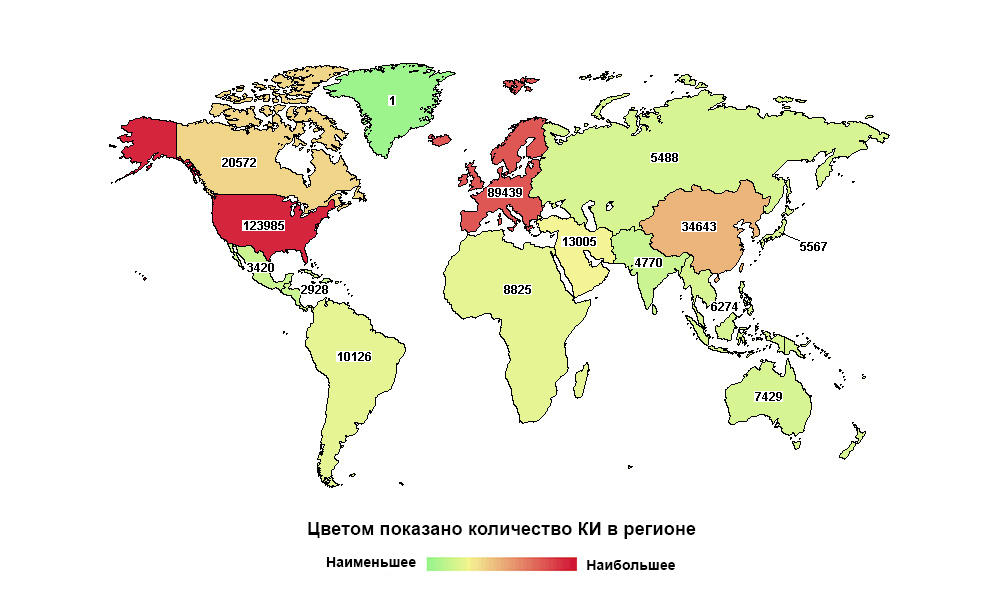
 La Russie est loin d'être la première au monde, mais la première en nombre d'études dans sa macrorégion
La Russie est loin d'être la première au monde, mais la première en nombre d'études dans sa macrorégionAujourd'hui, tout médicament, avant d'arriver chez le patient, passe par une longue série d'essais cliniques. Il est nécessaire de prouver qu'il est capable de résoudre un problème de santé spécifique, et de le faire plus efficacement et, de préférence, plus sûr que ses prédécesseurs.
La sélection est serrée - 98% de tous les médicaments étudiés n'atteignent pas les patients. Chez 2% des «chanceux», la recherche scientifique sur une nouvelle substance avant d'entrer sur le marché prend plus de 12 ans et plus de 1,5 milliard de dollars.
À la clinique
Medicine 24/7 , nous participons directement aux essais cliniques. Pour la deuxième année consécutive, nous menons des essais cliniques sur des médicaments antitumoraux étrangers. Avec notre aide, de nouveaux médicaments accèdent plus rapidement à la Russie et plus de 100 personnes par an - une autre chance de traitement, gratuitement.
Pour les cliniques privées, la pratique est inhabituelle: un minimum d'avantages commerciaux, trop de difficultés d'organisation du processus et des exigences strictes pour un établissement médical. Habituellement, seuls les grands centres fédéraux parviennent à s'y conformer.
Mais pour de nombreux patients en Russie, un essai clinique du médicament est la seule chance d'obtenir un traitement gratuit pour une maladie mortelle. Mais parmi les patients cancéreux russes, 30% ne savent tout simplement pas ce qu'est un essai clinique et seuls quelques-uns y ont participé.
Par conséquent, nous voulons que le plus de gens possible apprennent et vérifient: peut-être qu'ils ont une chance d'obtenir un médicament qui peut leur sauver la vie.
Dans cet article, nous expliquerons pourquoi nous avons besoin et comment les essais cliniques sont organisés, qui et comment y arriver.
Histoires tristes. Pourquoi les essais cliniques sont-ils nécessaires et pourquoi sont-ils mauvais sans eux
Recherche / essai clinique (ci-après - IC) - une étude scientifique impliquant des personnes en tant que sujets, qui est réalisée afin d'évaluer l'efficacité et la sécurité d'un nouveau médicament ou d'élargir les indications pour l'utilisation du déjà connu. En plus des médicaments, les IC peuvent également étudier l'efficacité et l'innocuité de nouvelles méthodes de traitement et de diagnostic.
La médecine évolue et devient une science exacte, qui ne peut se passer de statistiques.
Auparavant, le médecin de famille connaissait par cœur les histoires de tous ses patients, le médecin pouvait vivre toute sa vie dans une même ville, trouver et se souvenir d'une approche personnelle pour traiter tout le monde. De plus, le choix des potions était restreint: herbes médicinales, sangsues, mercure et arsenic. La responsabilité lors du postulat de "toute la volonté de Dieu" sur les médecins était moindre.
 Arsenic de la fin du XVIII puissance "restaurée" et arthrite "guérie" ...
Arsenic de la fin du XVIII puissance "restaurée" et arthrite "guérie" ... ... et le mercure, par exemple, était un laxatif et "de la syphilis".
... et le mercure, par exemple, était un laxatif et "de la syphilis".Lorsque la médecine s'est répandue, les médecins ont dû développer des tactiques de traitement vraiment incomparables. Certains médicaments étaient censés aider la plupart des patients dans des conditions données.
Idéalement, un médecin ne devrait utiliser que les méthodes de prévention, de diagnostic et de traitement qui ont une probabilité extrêmement faible d’obtenir des «résultats aléatoires», car leur utilité et leur efficacité ont été prouvées par de nombreuses expériences correctement menées.
Il s'agit de la
médecine fondée sur des preuves - la seule approche adéquate à un problème aussi grave que la santé humaine aujourd'hui.
Et c'est
la recherche clinique qui est à la
base de la médecine factuelle.
Jusqu'au milieu du 20e (!) Siècle, il n'existait aucune réglementation de la recherche sur les nouveaux médicaments. Pour rétablir l'ordre, comme cela arrive souvent, il a fallu quelques tragédies.
En 1937, 105 enfants et un adulte sont morts, prenant "l'élixir" du sulfonamide antiseptique et ... du diéthylène glycol toxique. Oui, celui qui est utilisé aujourd'hui dans l'antigel. Ensuite, la société pharmaceutique
ME Massengill l'a utilisé sans le savoir comme solvant, excipient. Aucune étude de sécurité du «cocktail» résultant pour l'homme n'a été menée. Lorsqu'ils ont soudain réalisé et saisi la drogue en vente, il y avait déjà plus d'une centaine de victimes. En 1938, le Congrès américain a adopté une loi sur la recherche obligatoire des médicaments avant leur mise en vente. Le contrôle a été confié à la FDA (
English Food and Drug Administration), la Food and Drug AdministrationUn scandale encore plus fort s'est produit avec la
thalidomide à la fin des années 50 et au début des années 60. "Les somnifères apaisants et somnifères, qui aident parfaitement à la toxicose des femmes enceintes" se sont rapidement vendus. Ses études n'ont été menées que sur des rats. Il s'est avéré que ce n'était pas suffisant. Chez l'homme, la thalidomide a provoqué des défauts dans le développement du fœtus. En Europe, en Australie et au Japon, environ 10 000 enfants sont nés avec des malformations (malformations) des membres. Le médicament a été interdit dans la plupart des pays en 1961.
 Les mamans de ces enfants ont bu des somnifères, non testés chez l'homme
Les mamans de ces enfants ont bu des somnifères, non testés chez l'hommeDepuis lors, les médicaments ont été soigneusement étudiés avant l'enregistrement. Ceci est régi par les
règles internationales harmonisées tripartites de bonnes pratiques cliniques (ICH Harmonized Tripartite Guideline for Good Clinical Practice, abrégé en ICH GCP). De 1996 à 1997, ils opèrent aux États-Unis, au Japon et dans l'UE, et depuis 2003, ils ont été introduits en Russie.Comment se déroule l'étude et pourquoi pendant si longtemps?
L'ensemble du processus de création du médicament peut être divisé en 3 grandes phases.
1. Recherche d'idées et d'études précliniques - in vitro et chez l'animal.
2. Si cela ne s'arrête pas là, les études cliniques commencent, avec des personnes: d'abord prudentes, puis plus massives.
3. Le médicament est ensuite enregistré auprès des autorités réglementaires pour devenir un nom familier dans les répertoires médicaux.
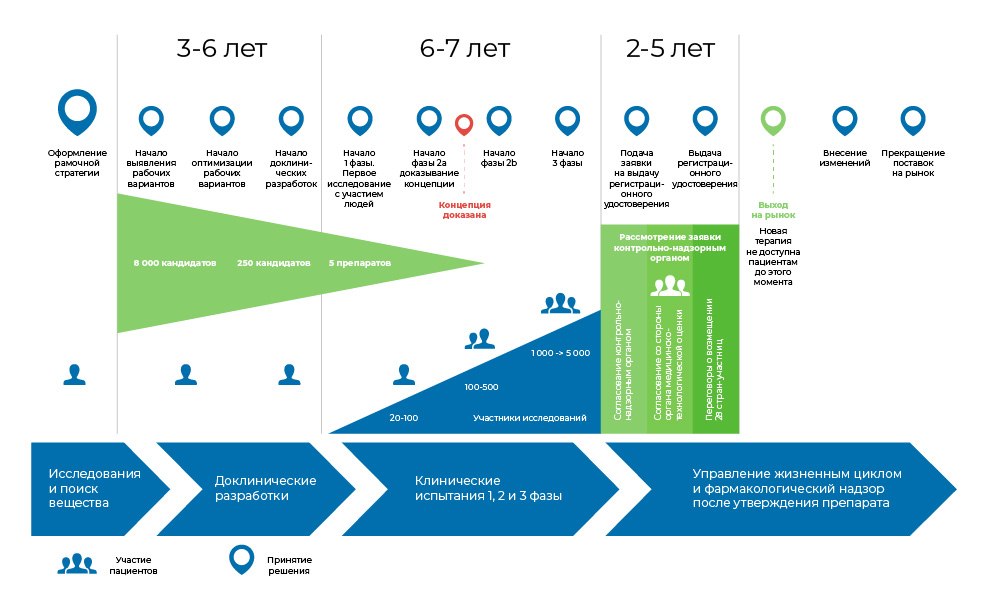 Le processus de développement d'un médicament. Du moment où la molécule est créée jusqu'au début de la vente du médicament, cela prend de 8 à 20 ans.Est-ce que quelqu'un a besoin de ça?
Le processus de développement d'un médicament. Du moment où la molécule est créée jusqu'au début de la vente du médicament, cela prend de 8 à 20 ans.Est-ce que quelqu'un a besoin de ça? L'oncologie est l'un des domaines les plus flagrants de la médecine en termes de besoins non satisfaits en médicaments. Selon l'Organisation mondiale de la santé, en 2018, le cancer a
tué 9,6 millions de personnes. Les tumeurs sont souvent retrouvées aux stades ultérieurs, alors qu'il ne reste que le traitement palliatif.
Dans le même temps, des découvertes dans le domaine de la biologie moléculaire et de la génétique ont permis de comprendre les mécanismes qui contribuent au développement et à la progression du cancer, et la compréhension du travail de l'immunité antitumorale s'est améliorée.
Et aujourd'hui, le développement de médicaments antitumoraux est l'un des domaines de la médecine les plus intensifs et les plus scientifiques.
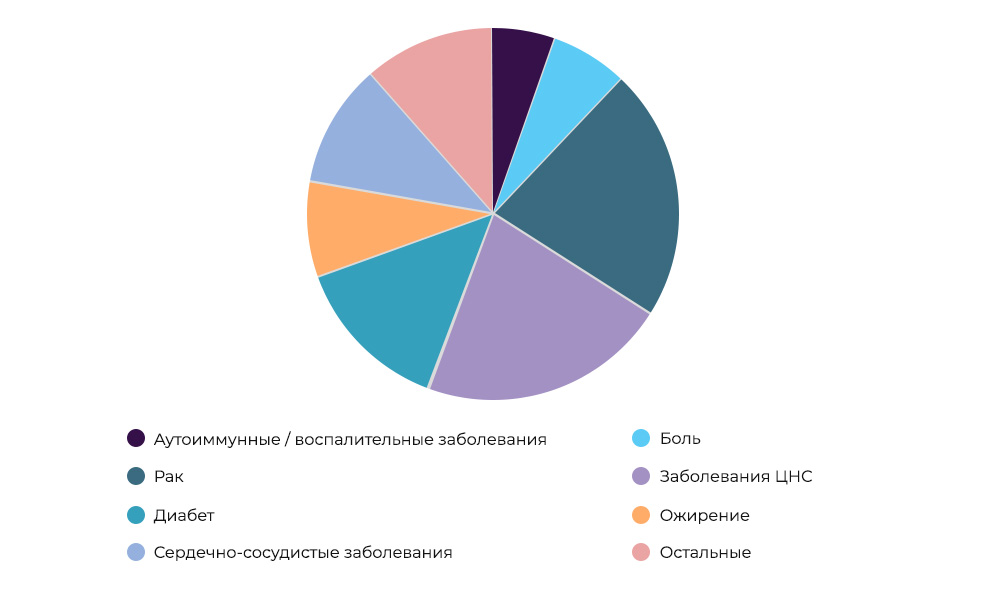 Recherche sur les médicaments anticancéreux - 23% de tous les IC dans le mondeQui paie pour la recherche.
Recherche sur les médicaments anticancéreux - 23% de tous les IC dans le mondeQui paie pour la recherche. Parfois, l'organisateur et le sponsor peuvent être un organisme de recherche. Mais le plus souvent, les scientifiques sont engagés dans la recherche scientifique au détriment des sociétés pharmaceutiques. Ceux-ci s'attendent à entrer sur le marché avec un médicament réussi, à réaliser des bénéfices et à récupérer les coûts de l'IC et du développement. C’est comme acheter un nouveau film en location dans un film: le distributeur ne sait pas s’il va “tourner” ou non. La production de nouveaux médicaments est une entreprise très risquée.
Auparavant, de nombreuses sociétés pharmaceutiques effectuaient leurs propres recherches, en utilisant le personnel de scientifiques. Désormais, une institution médicale qui a passé son accréditation et satisfait à certaines exigences peut devenir une plateforme et un interprète pour l'expérience.
C'est exactement le cas de notre
«Médecine 24/7» . L'entreprise pharmaceutique est prête à payer, mais les finances sont allouées à la fin de l'étude, sur le fait des coûts encourus. La clinique ne gagne pas de superprofits. Et les médecins chercheurs ne gagnent généralement rien en plus de leur salaire habituel. C'est plutôt la position du chef de la clinique: une personne considère qu'il est juste de faire avancer les médicaments du pays et en profite pour y participer.
D'abord une idée surgit. En fait, sur quoi enquêter? En oncologie, on trouve d'abord des «cibles» - un point faible de la maladie. Si vous perturbez ou «éteignez» simplement les molécules cibles, la tumeur «souffre». De nombreux médicaments anticancéreux modernes,
ciblés ou
immunothérapeutiques, reposent sur ce principe.
 Le mécanisme des médicaments ciblés dans le cancer colorectal. Les cellules cancéreuses arrêtent de se diviser, ou développent des vaisseaux sanguins supplémentaires vers la tumeur, ou le médicament protège les cellules voisines de devenir malignes
Le mécanisme des médicaments ciblés dans le cancer colorectal. Les cellules cancéreuses arrêtent de se diviser, ou développent des vaisseaux sanguins supplémentaires vers la tumeur, ou le médicament protège les cellules voisines de devenir malignesPour trouver de telles substances, puis choisir les candidats les plus appropriés, il faut beaucoup de ressources et de temps pour des
études in vitro et in silicio - c'est-à-dire in vitro ou par simulation informatique.
La substance sélectionnée est stockée dans la bonne quantité - produite selon des règles spéciales (en Russie, elle est GOST R 52249-2009), sans impuretés et sans violation de la technologie. Et avec ces tubes à essai, les scientifiques vont tester le médicament sur des animaux.
La souris est le moteur du progrès. Après avoir testé des idées in vitro, un scientifique avec un approvisionnement de son médicament potentiel se rend au vivarium - vous devez vérifier comment le prototype se comporte dans le corps d'un mammifère (in vivo).
Même en 1025, Avicenne a écrit dans le "Canon of Medical Science" que les médicaments doivent être vérifiés. En outre, il est souhaitable - sur un patient potentiel, une personne. Après tout, le résultat obtenu sur les lions et les chevaux ne garantit pas que le médicament affectera les gens de la même manière.
Et toujours en médecine, sans expériences sur les animaux - ne peut pas faire. Les lions et les chevaux, cependant, ont été laissés seuls. Les études précliniques dans le monde se déroulent principalement chez la souris, le cobaye et le lapin.
 Les souris de laboratoire ont même érigé un monument à Novossibirsk Academgorodok
Les souris de laboratoire ont même érigé un monument à Novossibirsk AcademgorodokÀ ce stade, vérifiez à quel point le médicament est nocif / sûr:
- cela provoque-t-il des allergies
- at-il des effets toxiques sur les tissus et les organes,
- comment cela affecte la capacité des animaux à se reproduire et le développement normal du fœtus, etc.
De plus, ils observent le comportement du candidat médicament à l'intérieur du corps de l'animal (pharmacocinétique):
- taux d'absorption et augmentation de la concentration sanguine,
- quelles sont la dose maximale et minimale
- à quelle vitesse il est excrété du corps, etc.
Toutes ces données sont nécessaires pour décider
s'il est possible d'utiliser la substance d'essai pour l'homme. Et si oui, combien est nécessaire.
Mal inévitable. Bureaucratie Le
Département d'État surveille les progrès corrects de CI
. réglementation de la circulation des médicaments du Ministère de la santé et du Service fédéral de surveillance des soins de santé (Roszdravnadzor).Si le scientifique est arrivé au moment où il est nécessaire de procéder à des essais cliniques chez l'homme - il est temps de préparer une demande de conduite d'IC. Pour ce faire, il a besoin de plusieurs
documents .
- Dossier du médicament à l'étude. Tout ce qui a déjà été découvert sur le médicament: données sur la pharmacocinétique, l'efficacité, la toxicité, etc.
- Protocole d'étude Il détaille le plan des recherches futures et les méthodes d'évaluation des résultats;
- Brochure du chercheur. Une petite feuille de triche pour expliquer clairement l'essence de l'étude aux volontaires et aux patients et obtenir leur consentement éclairé.
Comité d'éthique. La prochaine étape de la quête consiste à obtenir l'évaluation et la conclusion du comité d'éthique.
Le comité d'éthique est un groupe indépendant de médecins, scientifiques, personnel médical et non-spécialistes (membres du public). Ils étudient le protocole d'étude et le consentement éclairé pour s'assurer qu'un accord a été conclu entre le patient, les chercheurs, la société pharmaceutique et l'autorité de régulation nationale, que les droits de personne n'ont pas été violés, personne n'a été soumis à la contrainte et personne n'a violé le libre arbitre.
Après les effets secondaires graves d'un médicament en 2006, le comité d'éthique est devenu encore plus strict. Par conséquent, parfois, l'étude peut «geler» à ce stade pendant un an ou plus.
Après vérification de tous les documents et approbation du comité d'éthique, le médicament potentiel passe au stade des
essais cliniques - chez l'homme.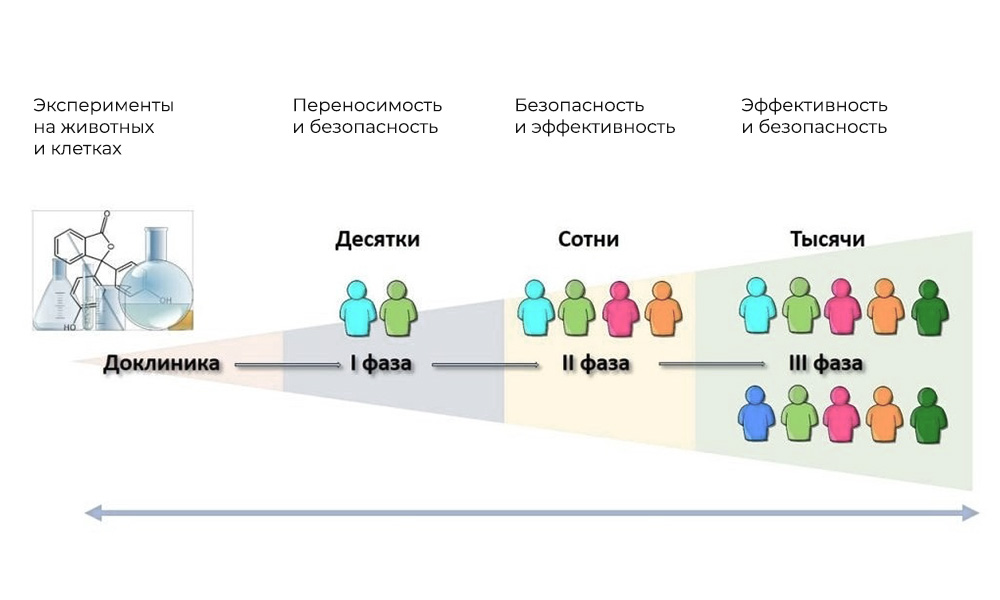 Les principales phases des essais cliniques sont chez l'homme.
Les principales phases des essais cliniques sont chez l'homme.Phase I. Tester le mécanisme d'action
Participants: 20 à 100 personnes.
Durée: de plusieurs mois à 1 an.
Objectif: étudier la tolérance, la pharmacodynamique et la pharmacocinétique.
Il est vérifié si la substance agit sur l'homme de la même manière que sur les animaux, si elle est sûre.
Dans la première phase d'une étude clinique, théoriquement, des volontaires sains devraient participer, mais les tests oncologiques de substances puissantes dans un corps sain ne peuvent pas être qualifiés d'éthiques. Par conséquent, les personnes atteintes de la maladie correspondante sont impliquées, contre lesquelles le futur médicament peut être efficace.
Les participants reçoivent progressivement une injection de toutes les doses plus importantes du médicament, en commençant par le minimum jusqu'au maximum autorisé. Après chaque administration, l'état du patient est surveillé.
La pharmacocinétique est évaluée : taux d'absorption et excrétion (excrétion de substance inchangée), distribution sur les tissus et les organes.
La pharmacodynamique est également évaluée: effet du médicament sur les cellules tumorales, sur d'autres organes et organes, effets secondaires. L'application et le niveau de dosage préférés sont en cours de clarification.
En plus des études avec des doses croissantes, en phase I je vérifie:
- l'effet de la nourriture sur le médicament;
- interaction avec d'autres médicaments;
- l'effet d'autres maladies qui peuvent affecter la dose souhaitée du médicament (par exemple, chez un patient souffrant d'insuffisance rénale).
Selon la
FDA , 70% des médicaments réussissent la première phase de l'IC.
Phase II Vérification de l'action pour un objectif donné: un type spécifique de maladie
Participants: 100 à 500 patients.
Durée: de plusieurs mois à 2 ans.
Objectif: tester l'efficacité de certaines indications
Il est nécessaire d'étudier l'efficacité du nouveau médicament par rapport au placebo ou au traitement existant. De plus, un plus grand nombre de participants peuvent détecter des effets secondaires plus rares qui ne sont pas détectés dans la phase I.
Pour participer à cette phase d'IC, les patients sont sélectionnés selon un nombre de critères beaucoup plus important que lors de la première phase. Par exemple, non seulement «cancer du sein», mais «cancer du sein, stade T2N1M0, sous-type HER2 positif».
En règle générale, les études à ce stade sont menées en
double aveugle, randomisées, contrôlées par placebo.Double aveuglement: ni le médecin ni le patient ne savent qui reçoit la substance active et qui reçoit un placebo ou le traitement optimal existant.
La randomisation implique que les patients sont divisés en groupes au hasard - à l'aide d'un générateur de nombres aléatoires. Ni le médecin ni le participant à l'IC ne peuvent influencer ce processus.
Le contrôle placebo signifie que les participants d'un groupe recevront un placebo dans les mêmes conditions que les participants d'un autre groupe qui reçoivent la substance active.
 Tout le monde - la même apparence, le goût et l'odeur du médicament.
Tout le monde - la même apparence, le goût et l'odeur du médicament.Toute cette «théologie du complot» est nécessaire pour exclure la distorsion intentionnelle ou inconsciente des données expérimentales par les participants ou les chercheurs.
Ainsi, dans la première phase, où il n'y a pas d'exigences aussi strictes, il y a des résultats étonnants. Il s'agit d'une statistique «sale»: en phase II, elle est débarrassée de tout excès et les résultats deviennent plausibles.
Selon la FDA, seulement 33% des médicaments qui atteignent la phase II subissent avec succès l'IC et passent à la phase suivante.
Phase III Études complémentaires
Nombre de participants: 300 - 3 000 ou plus.
Durée: d'un an à plusieurs années.
Objectif: confirmation de l'efficacité et de la sécurité de la substance d'essai dans de grands échantillons.
Il s'agit de la partie la plus importante, la plus complexe et la plus coûteuse du processus de développement d'un médicament. Le but de ces études est de confirmer l'efficacité et l'innocuité de la substance d'essai lorsqu'elle est utilisée par un grand nombre de patients.
Sur la base des résultats de cette phase, les fabricants de médicaments reçoivent l'autorisation de le mettre sur le marché.
Dans la phase III, des milliers de patients de différents pays peuvent participer. Tout doit être planifié dans les moindres détails, de sorte que dans tous les lieux de l'étude, sa conception et ses conditions significatives soient exactement les mêmes.
La conception de l'étude est si étroite que non seulement un patient mourant, mais aussi un patient avec un pronostic de rémission stable peuvent y entrer. Le médicament doit être si sûr qu'il peut être administré à une personne pratiquement en bonne santé - et la qualité de vie ne diminue pas.
Avant le début de la phase III, il y a beaucoup de consultations et de discussions entre chercheurs et experts tiers: il est très important de réfléchir à la conception des expériences afin de ne pas manquer l'essentiel et d'obtenir toutes les données nécessaires.
Au cours de la phase III, l'efficacité et l'innocuité du nouveau médicament et la relation dose-réponse sont finalement confirmées.
. , . , :
12-18 .
FDA, 25-30% , .
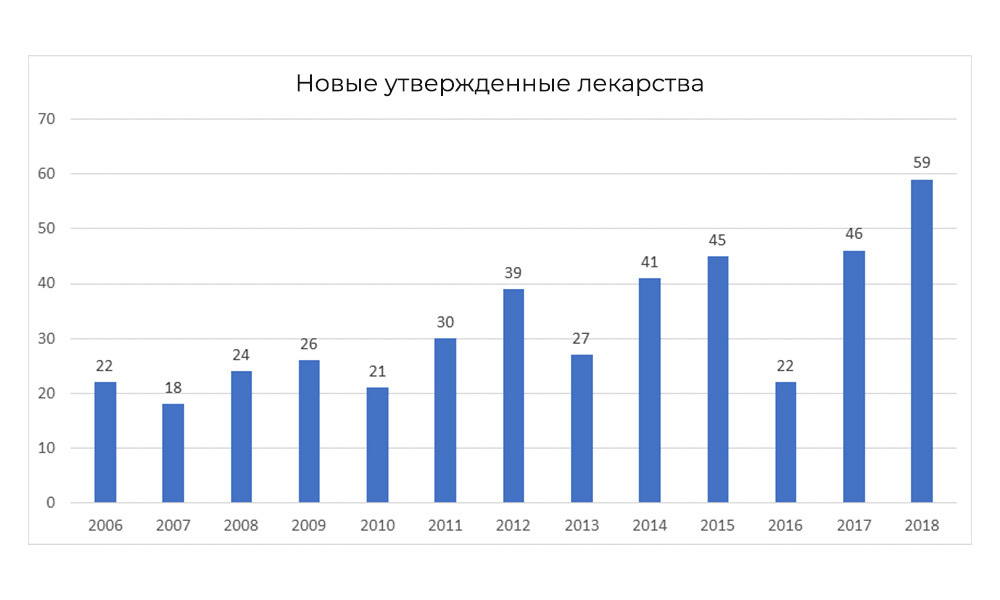 , 2018 FDA
, 2018 FDA:
( , ). , : , .
3 , , . , , , 3 , , .
, 12 – 12 , . , 6 12. , , , , .
2-3 .
« 24/7» III.
. , « ». , . , – , , .
, III – – , «» .
, . .
-,
GCP, Good Clinical Practice.-, . , - : - . . .
-, . , , , , , , – . – : , .
 –
–, , , , .
1 200 , . : , , , , . « » – - .
2 3 , .
2 :
. , , , , .. —
. .
– , , .
, . «», : , , / , – .
. , – . , .
18 .
, – , , 3-4 . : 10 , – .
, , .
– – . , . , , .
, , , , – – . .
, .
Mais si le sujet est proche de vous, jetez un œil aux listes d'essais cliniques sur RosOncoWeb , CTAgency et sur le site Internet du Ministère de la Santé . Et assurez-vous de contacter les oncologues de "Medicine 24/7" - vous devez tenter votre chance.