Le but principal de l'utilisation de médicaments qui ralentissent le processus de vieillissement est d'allonger une vie saine et active. Cette dernière, à son tour, vise à améliorer le bien-être économique de la population vieillissant rapidement de la planète. Pour que toute intervention pharmacologique soit universellement approuvée, les médicaments doivent être efficaces chez tout adulte et avoir un bon profil de sécurité. Dans cet article, nous avons montré qu'avec l'aide de médicaments déjà connus de la science, nous avons pu augmenter considérablement l'espérance de vie de C. elegans. L'augmentation de la durée de vie des vers a été obtenue en modifiant l'activité de plusieurs voies de signalisation évolutives conservatrices associées au vieillissement. En raison de l'influence sur différentes voies de signalisation ayant un effet synergique commun, nous espérons pouvoir ralentir le processus de vieillissement, doubler la durée de vie et également plus que doubler la durée d'une période de vie saine, sans changements compensatoires dans le développement physique et l'activité.
À notre connaissance, l'espérance de vie des nématodes de C. elegans atteinte chez les adultes avec des médicaments était la plus élevée de notre travail. Nous avons utilisé des médicaments initialement destinés au traitement de diverses maladies des adultes. Le développement d'une méthode basée sur l'utilisation de médicaments déjà approuvés agissant simultanément sur plusieurs voies de signalisation associées au vieillissement est considéré comme très prometteur. Elle peut conduire à prévenir le développement de maladies liées à l'âge et l'asthénie physique de la population âgée du monde, qui vieillit rapidement.
Présentation
L'une des étapes les plus importantes de la science du vieillissement a été la découverte de voies de signalisation évolutives-conservatrices chargées de réguler la durée de vie du corps. Les mutations des gènes affectant ces voies de signalisation peuvent entraîner une prolongation de l'espérance de vie de 30 à 100% dans les organismes modèles. Les mutations génétiques combinées peuvent provoquer un effet synergique qui augmente la durée de vie. L'effet des interventions pharmacologiques est généralement beaucoup plus faible que celui des mutations génétiques, même si elles agissent sur les mêmes voies de signalisation.
La présence d'un effet synergique avec plusieurs troubles génétiques combinés suggère que l'utilisation de ces médicaments qui affecteront simultanément plusieurs voies de signalisation évolutives conservatrices deviendra une direction future prometteuse possible. À ce jour, peu de données ont été enregistrées sur l'effet synergique de l'utilisation de médicaments visant à augmenter l'espérance de vie. Dans cet article, nous rendons compte des résultats d'une nouvelle étude in vivo dans laquelle de tels médicaments ont été utilisés. Nous avons démontré comment une combinaison de médicaments peut maximiser l'effet de la thérapie du fait qu'ils agissent sur plusieurs voies de signalisation, avec un effet de renforcement mutuel. Dans le même temps, il a été possible de minimiser la fréquence des effets indésirables et le niveau de perturbations compensatoires dans le développement du corps, car des changements ponctuels ont été effectués dans des voies de signalisation distinctes mais en interaction. Le but ultime de l'étude était de développer un schéma pharmacologique pour la population adulte, avec un effet prouvé sur le processus de vieillissement, égal ou supérieur à l'effet des mutations.
Comme il existe peu de marqueurs biologiques généralement reconnus du vieillissement, actuellement, pour évaluer les résultats de l'étude, ils comparent simplement la durée de vie totale des organismes. Un nématode de l'espèce Caenorhabditis elegans a été utilisé comme organisme modèle de courte durée. Ensuite, nous avons sélectionné plusieurs combinaisons de médicaments, de sorte que 2 groupes de médicaments ont été créés, dans chacun desquels il y avait trois médicaments. Comme précédemment publié dans des études, lors de l'utilisation de ces combinaisons de médicaments, il y avait une différence significative dans l'augmentation de l'espérance de vie et l'allongement de la vie saine des nématodes de C. elegans.
L'effet synergique obtenu avec la combinaison de médicaments s'est avéré comparable à celui observé après des mutations dirigées dans les gènes bien connus associés au vieillissement. Nous n'avons pas mis en évidence de perturbations compensatoires dans le développement des organismes de celles qui sont souvent trouvées et associées à une intervention pharmacologique. Nous avons pu déterminer indirectement que la pharmacothérapie ralentissait le taux de vieillissement naturel, car le niveau de certains marqueurs augmentait. De plus, nous avons conclu que le TGFβ (Transforming Growth Factor β1) était un facteur clé fournissant l'effet synergique de la voie de signalisation. De plus, l'étude a montré que dans les nématodes traités avec les combinaisons de médicaments ci-dessus, le rapport des lipides monoinsaturés aux polyinsaturés a changé le côté de la prévalence des premiers (augmentation du rapport des AGMI aux AGPI) et le niveau de peroxydation des lipides membranaires a diminué. Enfin, nous avons confirmé qu'un effet synergique similaire a également été déterminé chez les mouches des fruits de l'espèce Drosophila melanogaster.
Résultats
Choix des voies de signalisation et des cibles chez C. Elegans.Sur la base de la littérature scientifique moderne, nous avons trouvé plusieurs voies et mécanismes de signalisation évolutifs conservateurs liés au vieillissement (Supporting Material, Tableau S1). Parmi les cibles et les mécanismes que nous avons sélectionnés figuraient: la protéine kinase activée par l'AMP, la kinase c-Jun-N-terminale (JNK), la cible de rapamycine de mammifère (mTOR) et les mécanismes impliqués dans les processus: restriction calorique (CR), mitogomesis (l'effet de faibles doses de substances qui, à fortes doses, sont toxiques) et le métabolisme mitochondrial. Les cibles et processus ci-dessus sont considérés comme les principaux dans la régulation des voies de signalisation qui prolongent la vie. Pour chaque voie de signalisation, des médicaments ont été déterminés dont l'effet sur la longévité a été décrit dans au moins un des organismes modèles connus (nématodes, mouches des fruits ou souris).
Les personnes testées étaient particulièrement intéressantes pour nous. Par conséquent, nous avons préféré des composés médicinaux ayant une efficacité déclarée chez les mammifères ou approuvés chez l'homme. Initialement, nous avons trouvé 11 médicaments potentiels répondant aux critères ci-dessus (tableau auxiliaire S1). Nous avons ajouté de l'allantoïne à notre liste sur la base d'un rapport sur sa capacité à prolonger la vie de C. elegans et les résultats de l'analyse transcriptionnelle. Nous soupçonnons que son mécanisme d'action est différent des autres substances. Pour éviter les erreurs dans la mesure de l'espérance de vie des organismes après l'utilisation de médicaments, nous avons d'abord testé l'entrepreneur en utilisant la méthode à l'aveugle. La principale raison en est le fait que les résultats de l'étude peuvent dépendre grandement de l'exactitude des conditions expérimentales et varier considérablement d'un laboratoire à l'autre. Nous n'avons utilisé que les doses de médicaments décrites précédemment dans des articles scientifiques. L'efficacité de cinq médicaments qui affectent l'espérance de vie a été confirmée à plusieurs reprises dans notre laboratoire (figure 1, tableau explicatif S2). En règle générale, dans notre étude, l'efficacité des composés associés à une augmentation de la durée de vie des organismes était légèrement inférieure à celle des travaux publiés précédemment (schéma complémentaire 1, tableau explicatif S2).
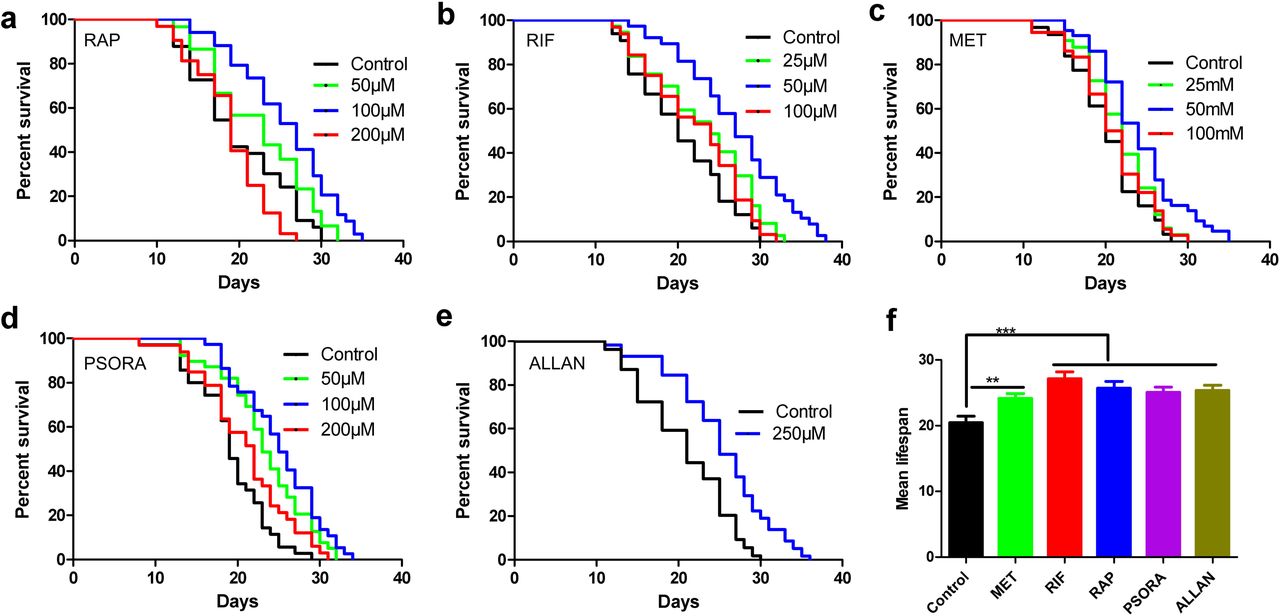 Fig. 1
Fig. 1Transcription, drogues et longévité
Pour évaluer l'efficacité des médicaments dans l'étude, nous avons effectué une analyse de transcriptome et déterminé les gènes différentiellement exprimés (DEG) et enrichi les voies de signalisation par rapport au contrôle. Nous avons remarqué certaines différences dans l'expression des gènes et l'activité de la voie de signalisation dans le groupe expérimental, qui n'étaient pas dans le groupe témoin. Les changements les plus importants dans l'expression des gènes et les voies de signalisation ont été causés par l'action d'une combinaison de médicaments composée de rifampicine, de rapamycine et de psora-4 (PSORA), où le dernier médicament a été administré après les deux premiers. Contrairement aux médicaments mentionnés, la metformine (MET) et l'allantoïne (ALLAN) ont affecté l'expression de moins de gènes (schéma 2a, tableau explicatif S3).
L'analyse des résultats de la transcription a montré que chaque substance médicamenteuse avait son propre profil unique des gènes qu'elle a modifiés. Dans le même temps, certains de ces gènes ont également été trouvés dans les profils transcriptionnels des médicaments restants (schéma 2a). Ainsi, MET a agi sur le travail de nombreux gènes «populaires», mais le nombre de gènes uniques impliqués était minime. Les préparations MET et PSORA ont modifié l'activité de presque tout le spectre des gènes «populaires», dont certains ont également été affectés individuellement par les médicaments présentés dans le schéma 2a.
Le composé ALLAN a affecté le plus petit nombre de gènes, mais la plupart d'entre eux appartenaient à un groupe unique. Moins de la moitié de ses gènes étaient représentés dans le spectre transcriptionnel d'autres médicaments. L'effet de l'utilisation du RIF et du RAP était significativement différent l'un de l'autre et de tout autre médicament. Sur la base des trois critères de l'analyse en composantes principales (ACP), nous avons conclu que le RIF, le RAP et le PSORA étaient très différents des autres médicaments. En revanche, les effets d'ALLAN et de MET étaient plus variables, mais très similaires. De plus, leurs résultats étaient quelque peu proches de ceux du groupe témoin.
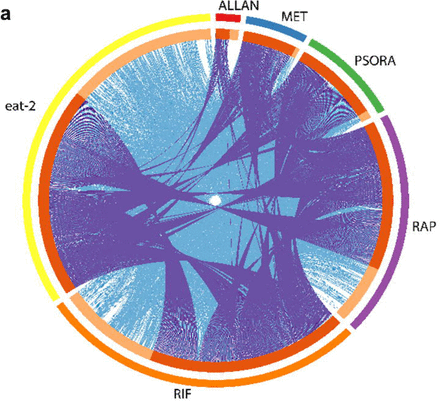
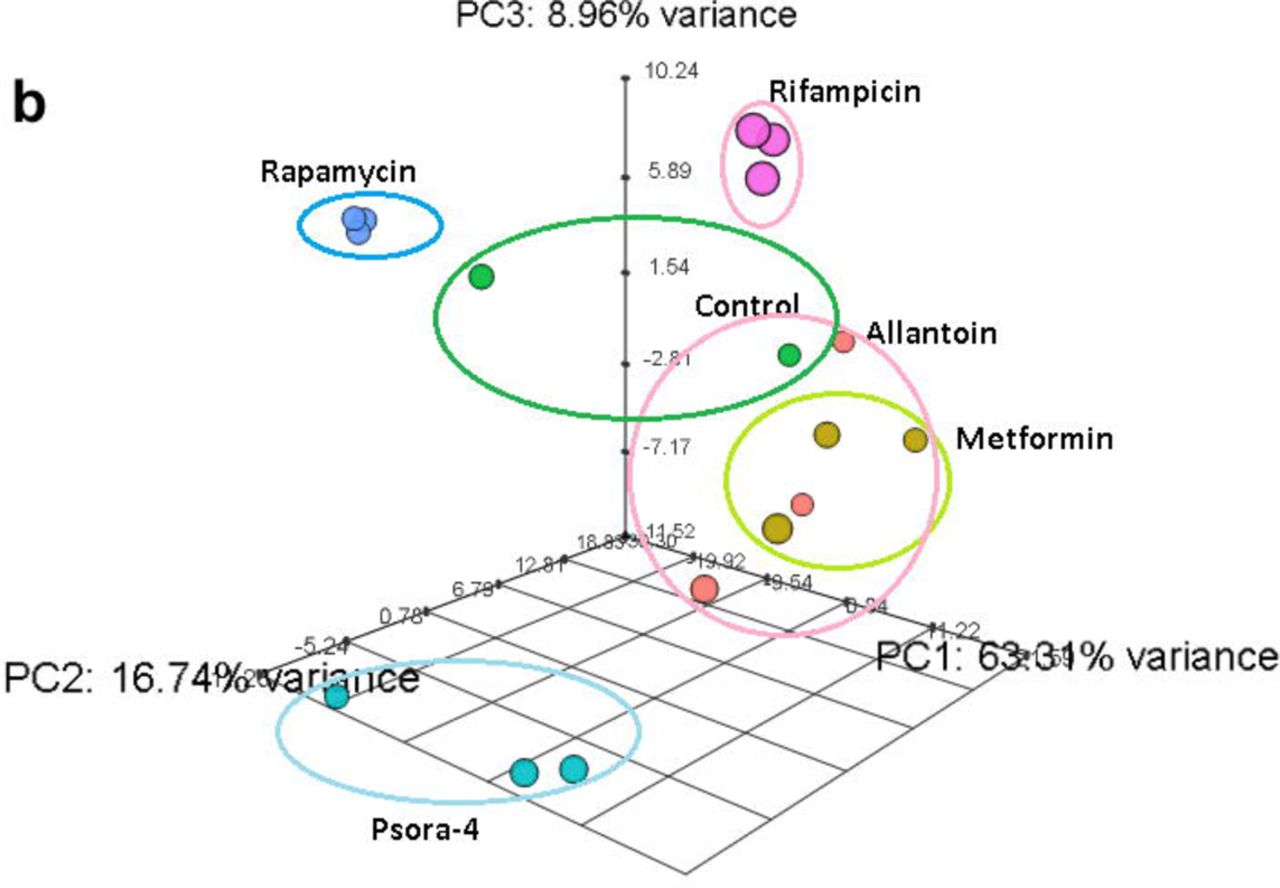
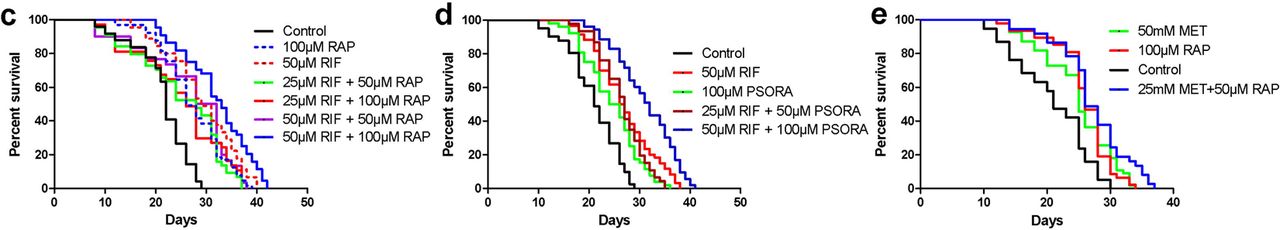

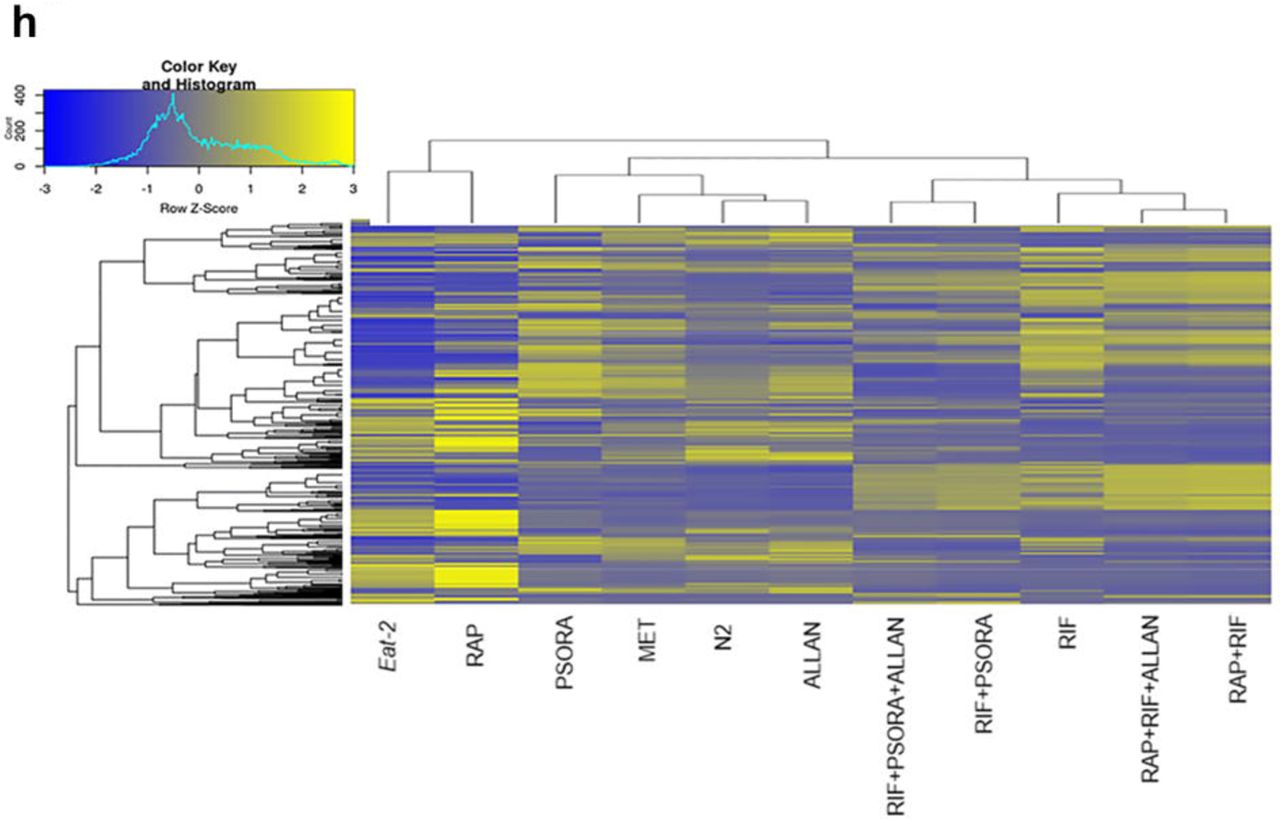 Fig.2
Fig.2Dans l'étape suivante, nous avons déterminé comment diverses combinaisons de médicaments affectent la durée de vie des nématodes. Comme les actions du MET et du RAP sont plus faciles à transférer aux humains, nous avons étudié ces médicaments en premier lieu. Cependant, il s'est avéré que la combinaison de MET et RAP à des doses optimales de 50 mg et 100 mg n'a pas conduit à un allongement de la vie encore plus long (schéma complémentaire 2 J, P). Nous avons effectué plusieurs autres études en utilisant toutes les combinaisons possibles de ces médicaments à des doses optimales et semi-optimales (schéma supplémentaire 2 JP).
L'utilisation du MET et du RAP à leurs doses semi-optimales a entraîné une augmentation de la durée de vie maximale des nématodes (schéma 2e, schéma supplémentaire 2 m, s), mais pas l'espérance de vie moyenne (schéma supplémentaire, 2p). Ce léger avantage du MET et du RAP est cohérent avec les résultats d'une autre étude chez la souris. Il a été prouvé que l'ajout de MET au RAP prolongeait principalement la vie des mâles, et chez les femelles, le résultat était à peine perceptible (quand il a été enregistré).
Ensuite, nous avons découvert séquentiellement les effets de 10 combinaisons de médicaments. Dans chaque combinaison de médicaments, il y avait deux des cinq médicaments possibles (schéma complémentaire 2 ma). L'analyse de l'effet synergique a été réalisée à l'aide du modèle HSA (Higher Single Activity model), qui estime le degré d'activité de l'un des deux médicaments.
Le résultat de l'utilisation combinée de divers médicaments a été considéré comme synergique, à condition qu'il dépasse largement le résultat obtenu de l'action de chaque médicament séparément et lorsque les doses des médicaments étaient les mêmes. Compte tenu de la définition ci-dessus, nous avons constaté que seules deux combinaisons de médicaments sur dix avaient un effet synergique (schéma 2c, d, schéma complémentaire 2 et tableau explicatif S2), fixé avec une combinaison de médicaments: RIF avec RAP et RIF avec PSORA. Trois combinaisons différentes de médicaments ont pu être faites avec ces médicaments, mais seulement deux d'entre eux étaient les plus différents les uns des autres selon l'analyse PCA. C'est dans les deux derniers qu'un effet synergique a été révélé (schéma 2b, schéma supplémentaire 4a, b).
Parmi les 8 paires de médicaments restantes, l'effet sur l'espérance de vie dans 4 était le même que pour le médicament le plus efficace dans la combinaison de médicaments correspondante. Dans 4 autres combinaisons, l'effet d'un médicament excluait mutuellement l'effet d'un autre. Dans ce dernier cas, l'absence de réactions toxiques et une augmentation de la durée de vie ont également été notées (schéma complémentaire 2, tableau explicatif S2).
Dans notre étude, l'utilisation de deux combinaisons de médicaments à effet synergique a conduit à un allongement de la vie plus significatif, par rapport aux données publiées précédemment dans la littérature scientifique. Cependant, l'augmentation de l'espérance de vie après la consommation de drogues était inférieure à un effet similaire des troubles mutationnels. À cet égard, nous nous posons des questions: les taux de survie réels sont-ils le maximum qui peut être atteint avec le traitement médicamenteux des animaux adultes? Allons-nous obtenir une augmentation supplémentaire de la durée de vie en ajoutant d'autres composés? Si la combinaison de médicaments comprend trois composés médicamenteux, le nombre de combinaisons possibles augmente à 30. Nous n'avons pas eu l'occasion de vérifier un tel nombre de combinaisons de médicaments.
Par conséquent, nous avons étudié sélectivement l'effet de certaines combinaisons de médicaments triples. Tout d'abord, nous avons considéré une combinaison de médicaments dans laquelle les trois composés médicamenteux étaient les plus différents les uns des autres sur la base des critères de la méthode PCA. Une autre condition était la présence d'un effet synergique du médicament lorsqu'il était utilisé conjointement avec d'autres médicaments (RAP, RIF et PSORA). Cependant, l'espérance de vie des nématodes lors de l'utilisation d'une combinaison des trois médicaments était pire que lors de l'utilisation d'une combinaison de médicaments double (schéma complémentaire 3a, tableau explicatif S2). Ensuite, nous avons testé l'efficacité de la triple combinaison de médicaments, qui comprenait le médicament ALLAN avec un profil unique des gènes impliqués (arc orange clair, schéma 2a).
Le profil d'activité des gènes ALLAN ne correspondait pas au profil des gènes actifs d'autres médicaments. Il diffère également du spectre du transcriptome mutant eat-2. Ainsi, nous avons émis l'hypothèse que le composé ALLAN a un mécanisme d'action unique et, par conséquent, nous l'avons ajouté à ces deux paires de combinaisons qui ont montré un effet synergique. Dans les deux cas, une augmentation statistiquement significative de l'espérance de vie moyenne et de son maximum a été observée (schéma 2f, g, schéma supplémentaire 3d-f et tableau auxiliaire s2). Le meilleur résultat a été la combinaison de trois médicaments: RAP, RIF et ALLAN, grâce auxquels la durée de vie moyenne des vers a doublé et la médiane et le maximum ont atteint respectivement 44 et 50 jours (tableau auxiliaire s2). L'effet résultant était comparable à l'effet des troubles mutationnels. Selon nos informations, cette extension de la durée de vie de C. elegans s'est avérée être la plus importante jamais publiée dans la littérature scientifique lors de l'utilisation de médicaments utilisés chez l'adulte.
Le mécanisme de la synergie médicamenteuse
Le Daf-16 / FOXO est un facteur de transcription qui joue un rôle clé dans la régulation de la durée de vie des organismes modèles, et probablement aussi des humains. Afin d'étudier le mécanisme d'action synergique des combinaisons de médicaments que nous avons identifiés, nous avons déterminé leur efficacité lorsque les vers présentaient une mutation négative dans la voie de signalisation Daf-16. L'effet de médicaments tels que RAP ou ALLAN, pris séparément, était indépendant de la voie de signalisation Daf-16. En comparaison, l'allongement de l'espérance de vie à l'aide du RIF est entièrement dû au travail de la voie Daf-16 et du PSORA partiellement (schéma 3a, schéma supplémentaire 8).
La combinaison synergique de médicaments RAP + RIF comprenait un médicament RIF, dont l'effet était entièrement dépendant de la voie Daf-16, et un autre médicament RAP avec un effet indépendant de cette voie de signalisation. Avec l'utilisation combinée de préparations RIF + PSORA, un effet synergique a également été enregistré, malgré le fait que l'activité des médicaments était associée au fonctionnement de la voie Daf-16 et que le nématode avait un gène Daf-16 mutant (schéma 3a, schéma supplémentaire 8).
De tels résultats étaient inattendus, car il s'est avéré que l'effet synergique n'était pas uniquement causé par la voie Daf-16: cet effet a été obtenu chez des mutants des vers du gène Daf-16 utilisant des médicaments dont les actions dépendaient totalement ou partiellement du fonctionnement de ce gène.
 Fig.3
Fig.3Selon divers auteurs, plusieurs des médicaments que nous avons testés étaient des mimétiques CR (restriction calorique), c'est-à-dire substances médicinales similaires à des composés synthétisés naturellement dans l'organisme, responsables d'une diminution de l'appétit. Nous avons utilisé les modèles C. elegans mutants eat-2 pour savoir si les combinaisons de médicaments et leurs médicaments synergiques influencent les voies de signalisation CR. Seul le composé RIF a prolongé la durée de vie des nématodes mutants eat-2. Par conséquent, tous les autres, à l'exception des préparations RIF, appartenaient aux mimétiques CR.
Ainsi, dans deux combinaisons de médicaments, RAP + RIF et RIF + PSORA, un composé appartenait aux mimétiques CR, et l'effet de l'autre ne dépendait pas de la mutation eat-2. L'utilisation combinée de RIF et de PSORA a entraîné une augmentation de la durée de vie des nématodes, tandis que l'ajout d'ALLAN à cette combinaison de médicaments n'a eu aucun effet sur l'augmentation de la durée de vie des vers. Nous pensons que ce schéma est dû au fait que dans cette combinaison de médicaments, ALLAN était le deuxième mimétique CR.Afin d'étudier davantage le mécanisme de la synergie des médicaments, nous avons fait un profil de transcriptome des combinaisons de médicaments avec un effet synergique et une combinaison de médicaments sans un tel effet. Les nématodes ont reçu un, deux ou trois composés médicamenteux pour détecter la présence ou l'absence de cet effet. La transcription des médicaments individuels attribués aux mimétiques CR - a été regroupée dans la même région que le profil de transcriptome des organismes mutants eat-2. Au contraire, le composé RIF n'avait pas d'activité mimétique CR et son transcrit était différent des résultats de l'analyse transcriptionnelle des mutants eat-2 et d'autres médicaments (schéma 2h).Il est intéressant de noter que les transcriptomes de combinaisons de médicaments ayant un effet synergique regroupés et les modèles de leurs expressions géniques différaient à la fois des expressions des médicaments individuels inclus dans la combinaison et des mutants eat-2 (schéma 2h, schéma supplémentaire 4c, d). Par rapport au groupe témoin, lors de l'utilisation de combinaisons synergiques de médicaments doubles et triples, la voie de signalisation TFGβ était souvent présentée (schéma 4a, schéma supplémentaire 6c, 7a, tableau auxiliaire s4). De plus, nous avons comparé à un transcrit la combinaison de médicaments avec un transcrit des composés médicamenteux qui y étaient inclus, ce dernier servant dans ce cas de groupe témoin (voir méthodes). Contrairement au groupe témoin, les combinaisons de médicaments ayant un effet synergique ont amélioré l'activité du TGFβ et plusieurs autres voies de signalisation.Dans les combinaisons de médicaments sans action synergique, ces voies n'étaient pas représentées dans le profil transcriptionnel (tableau auxiliaire s5).Certaines combinaisons de médicaments ont prolongé la vie de eat-2 aux nématodes mutants, mais il n'y a aucun médicament individuel dans ces combinaisons. Nous avons décidé de vérifier si les mutants eat-2 auront une activité accrue de la voie TGFβ après des combinaisons synergiques, contrairement aux vers eat-2 sans traitement médicamenteux. La seule voie de signalisation qui était sensiblement présente dans la transcription après avoir utilisé l'une des combinaisons synergiques de médicaments était la voie TGFβ (schéma supplémentaire 7b, tableau de support S6). Ce fut une surprise totale pour nous que cette voie ait été exclusivement déterminée par l'action de combinaisons synergiques de composés médicamenteux (schéma 4b, schéma supplémentaire 7a, c, tableau auxiliaire s7).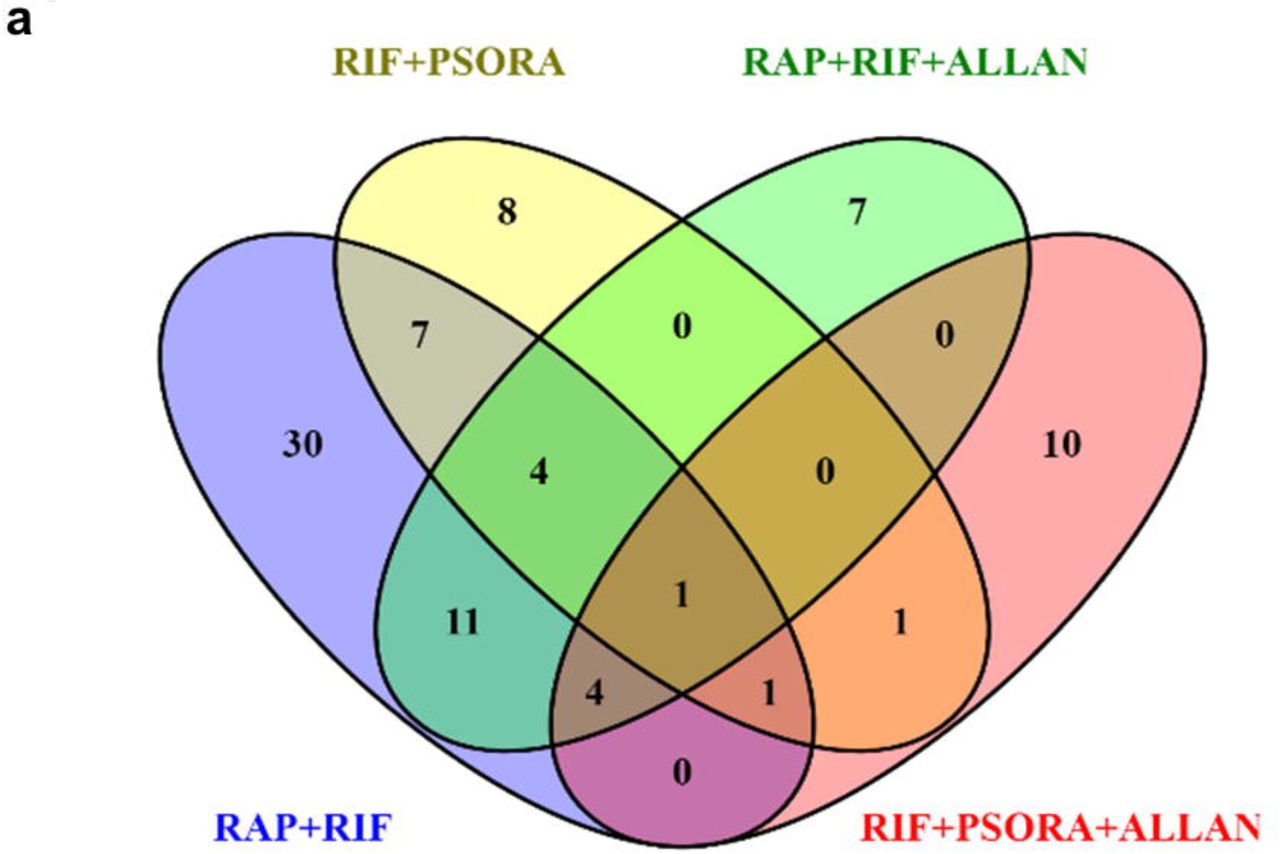

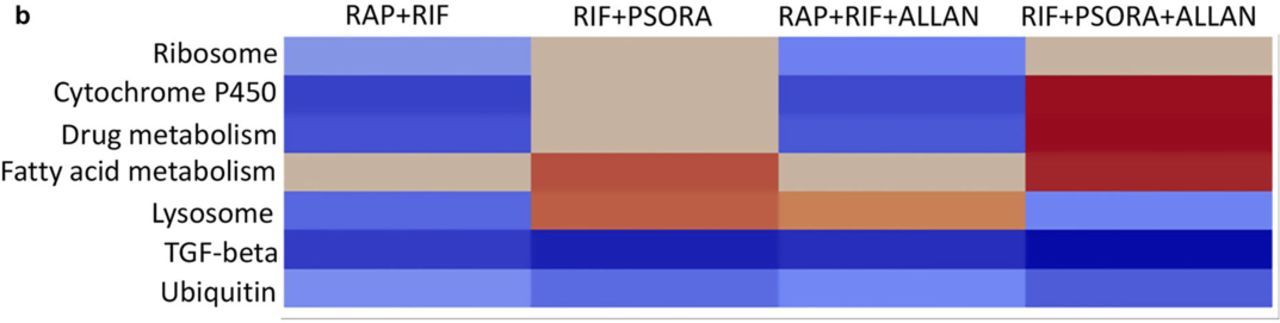

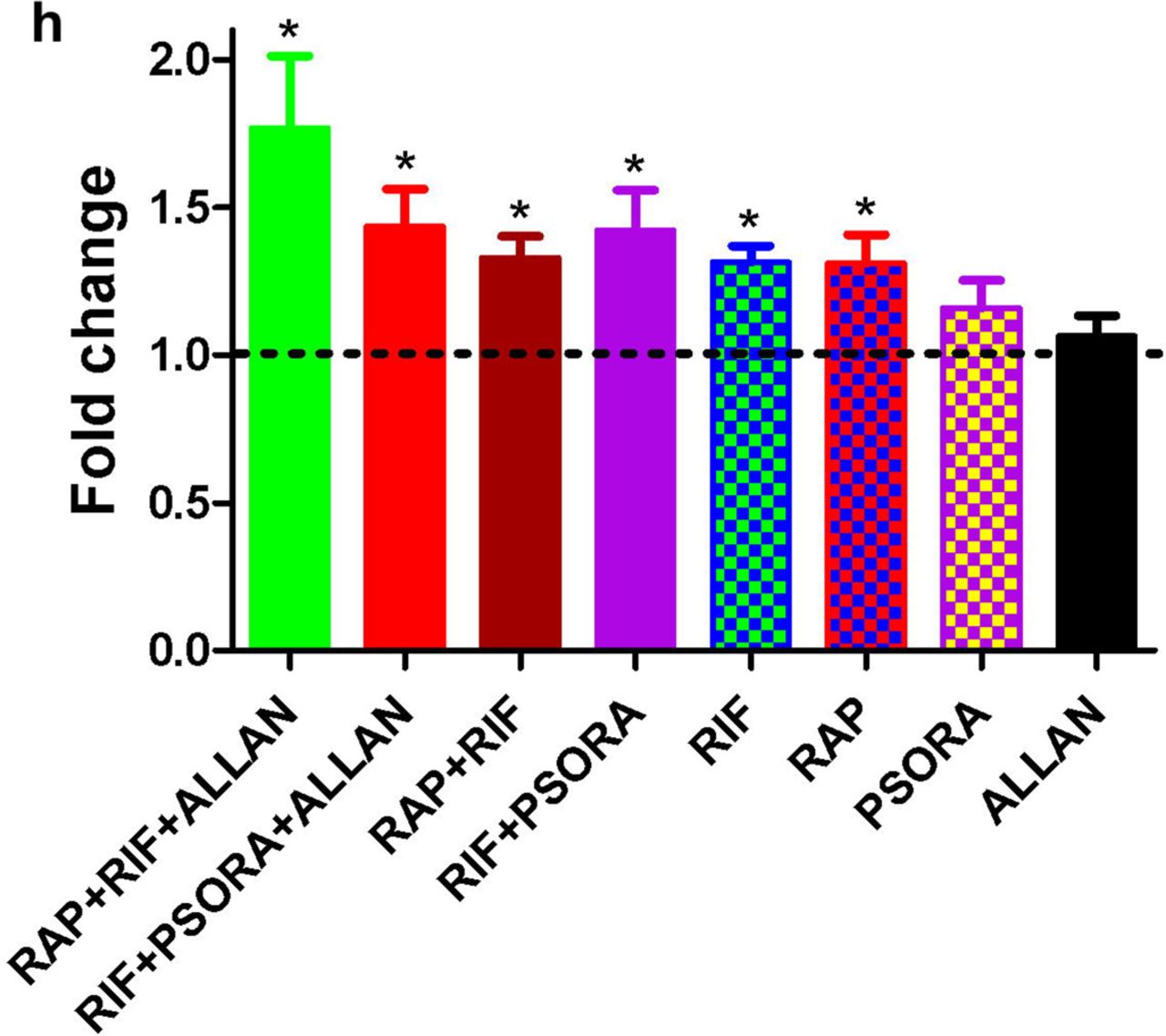
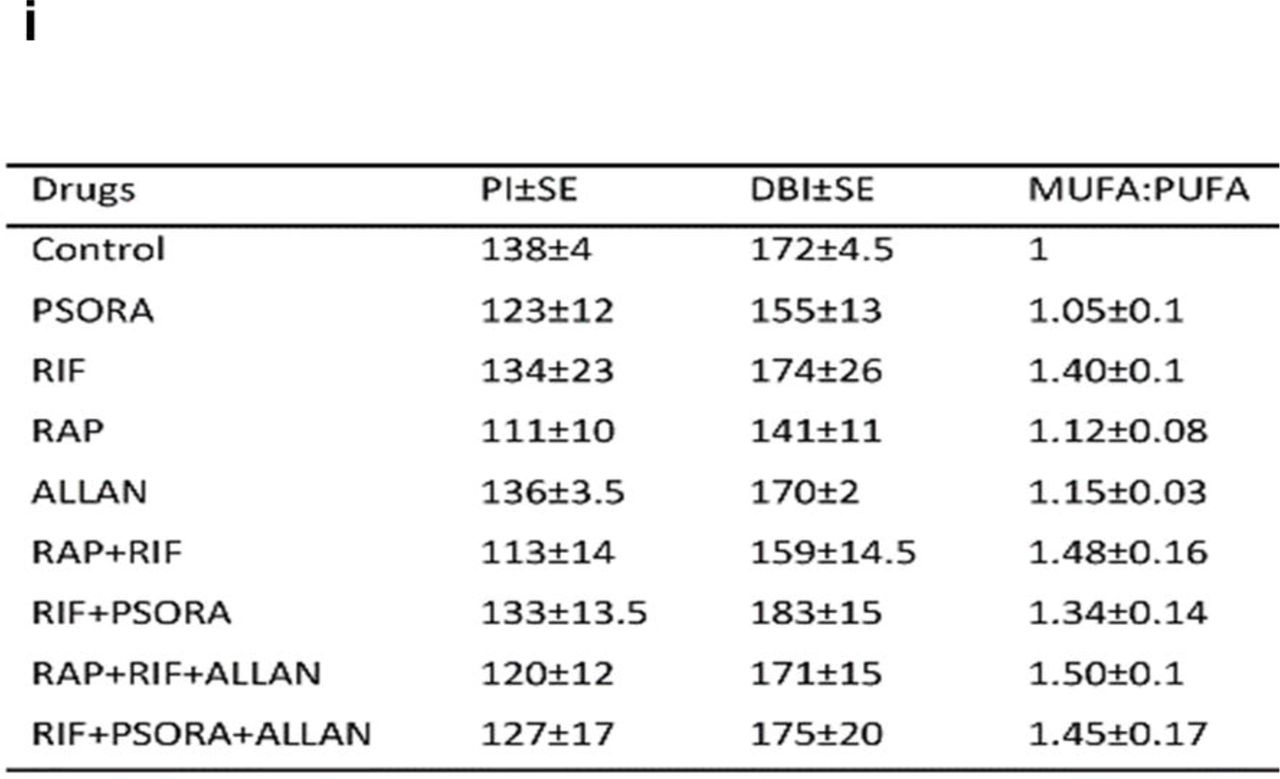 Fig.4
Fig.4Importance de la voie de signalisation du TGFβ pour la synergie médicamenteuse
L'activation de la voie de signalisation TGFβ révélée dans notre étude peut être le principal mécanisme par lequel un effet synergique est réalisé qui prolonge la durée de vie des organismes modèles. Auparavant, des études ont noté que la mutation TGF (daf-7) entraînait une augmentation de la durée de vie via la voie de signalisation de l'insuline. Les médiateurs daf-2 et daf-7 ont également régulé la transcription des gènes dépendants de daf-16 (schéma complémentaire 7d). Nous nous sommes demandé s'il était possible, avec l'aide des combinaisons de médicaments sélectionnées, de prolonger la vie des mutants daf-2, malgré le fait que l'espérance de vie des animaux due à cette mutation était déjà plus élevée. Pour commencer, nous avons déterminé la durée de vie des nématodes mutés daf-2 après chaque combinaison de médicaments.L'augmentation de la durée de vie a été enregistrée dans les combinaisons contenant du RAP: RAP + RIF et RAP + RIF + ALLAN. Cependant, le taux de croissance était presque le même que lors de l'utilisation uniquement du médicament RAP. Un effet synergique allongeant la durée de vie des nématodes n'a été observé dans aucune combinaison de médicaments (schéma 3c, schéma supplémentaire 8, tableau auxiliaire s2). L'action de PSORA a également contribué à augmenter la durée de vie des vers mutants daf-2, mais la combinaison de médicaments comprenant ce médicament (RIF + PSORA et RIF + PSORA + ALLAN) a eu un effet neutre sur la longévité des nématodes (schéma 3c et schéma complémentaire 8).À l'avenir, nous avons testé l'efficacité de toutes les combinaisons synergiques de médicaments et de substances médicamenteuses dont elles consistaient en mutants daf-7. En aucun cas, un effet synergique n'a été détecté. Nous sommes arrivés à la conclusion que la synergie des médicaments est due à la voie de signalisation du daf-7, même si dans ces conditions, les médicaments individuels de la combinaison sont efficaces en termes d'augmentation de l'espérance de vie (schéma 3d, schéma supplémentaire 8).Synergie médicamenteuse, MUFA et durée de vie
Comme indiqué précédemment dans les études, des réarrangements métaboliques se produisent dans les lignées de nématodes mutants de longue durée d'âge 1 et daf-2, entraînant une augmentation de la production et de l'accumulation de graisse. De plus, la voie TGFβ / daf-7 régule le métabolisme du triacylglycérol (TAG) et il est connu que les nématodes daf-7 mutants stockent plus de graisses. Ces informations et les données de nos travaux nous ont amenés à étudier si des combinaisons de médicaments caractérisés par une synergie affectent le profil lipidique des nématodes avec une voie de signalisation bloquée par TGFβ (Tableau Auxiliaire s3).Au stade initial, nous avons effectué une analyse du transcriptome de nos résultats afin de trouver des voies de signalisation qui modifient la composition lipidique, et avons constaté que les combinaisons de médicaments ayant un effet synergique augmentent le niveau d'homologue SREBP-1c: sbp-1 chez C. elegans. Il sert de principal facteur de transcription qui contrôle les gènes responsables de la synthèse de divers lipides et enzymes désaturases. Ces derniers participent à la formation d'acides gras monoinsaturés (AGMI) (schéma 4c, f). Par la suite, nous avons effectué une analyse des lipidomes par spectrométrie de masse pour détecter les changements dans le profil lipidique après exposition aux médicaments. Chez les nématodes, après l'utilisation de combinaisons synergiques de médicaments, les réserves de TAG, le rapport MUFA: PUFA (acides gras monoinsaturés / polyinsaturés) et la quantité de 16: 1 et 19 ont augmenté de manière significative:1 acides gras monoinsaturés (AGMI) (schéma 4f).En conséquence, une diminution de l'indice de double liaison (DBI) (montrant le degré d'insaturation des acides gras) et de l'indice de peroxydation lipidique (PI) a été observée (schéma 4i). Un IP faible indique que les lipides contiennent moins de doubles liaisons entre les carbones, réduisant ainsi la capacité des lipides à se peroxyder. Selon les résultats de divers auteurs, une diminution de la capacité de peroxydation était associée à une augmentation de l'espérance de vie, peut-être parce que les lipides étaient moins sensibles à l'oxydation dans le corps.On pense qu'en supprimant le processus de peroxydation, la résistance au stress oxydatif s'améliore. Dans notre travail, chez les vers après application de combinaisons synergiques de médicaments, en effet, une telle résistance a augmenté (schéma 5 e, f). De plus, nous avons noté une augmentation du niveau général de sphingomyéline dans les nématodes (schéma 4h). Les scientifiques ont montré que cet indicateur provoquait une augmentation de la durée de vie des vers grâce à une autophagie accrue. Fig.5La suppression du métabolisme énergétique et le blocage du travail de la chaîne membranaire de transport d'électrons (ETC) peuvent prolonger la vie de C. elegans. Ce fait n'explique pas les résultats de notre étude, car il n'a pas été possible pour les nématodes de détecter une diminution notable du taux de métabolisme basal (schéma 5i). La littérature scientifique décrit que le plus souvent la longévité s'est accompagnée de facteurs tels que: un ralentissement de la croissance et du développement, ainsi qu'une diminution de la fertilité. Nous n'avons pas trouvé que chez les vers qui recevaient différentes combinaisons synergiques de médicaments, la durée de la période de vie adulte et la fertilité générale ont changé de manière significative. Bien que, après l'ajout de ces combinaisons, une légère augmentation de la période de reproduction chez les nématodes ait été enregistrée (schéma 5a-c, schéma supplémentaire 9a).À l'étape suivante, nous avons déterminé: les indicateurs d'adaptation, le niveau de tolérance des situations stressantes et la viabilité des nématodes. Nous avons évalué la vitesse des mouvements spontanés, la résistance aux chocs thermiques, la résistance au stress oxydatif, et également calculé la viabilité des vers à l'échelle de la mobilité spontanée, calculée par la méthode de Herdon (Herndon). Dans le groupe témoin, la durée de vie active était d'environ 50% de la durée de vie totale des nématodes. Un indicateur similaire chez les vers traités avec les préparations RIF + PSORA + ALLAN ou RAP + RIF + ALLAN a atteint respectivement 57% et 63% de leur durée de vie prolongée (schéma 5d, données supplémentaires 9c). Ainsi, la durée de vie absolue et la période relative d'activité active des nématodes ont considérablement augmenté.Nous avons observé que lorsque le dernier ver est mort dans le groupe témoin, dans l'autre, plus de la moitié des individus ont montré un niveau optimal d'activité vitale (schéma 5d, données supplémentaires 9c). L'analyse des mouvements spontanés a montré que dans le groupe expérimental, quel que soit l'âge des vers, leur mobilité après l'action de combinaisons médicamenteuses telles que: RIF + PSORA + ALLAN ou RAP + RIF + ALLAN était significativement plus élevée que celle des nématodes du groupe témoin. En effet, la mobilité spontanée des personnes âgées (18 jours de vie) dans lesquelles des médicaments ont été utilisés ne diffère pas de l'activité motrice des jeunes vers (7 jours de vie) dans le groupe témoin (schéma 5g). De plus, la pharmacothérapie des vers a augmenté leur résistance à la chaleur et au stress oxydatif (analyse toxicologique, schéma 5e, f, schéma supplémentaire 9b).Nos observations indiquent qu'après l'action de combinaisons synergiques de médicaments, les nématodes allongent la durée de vie active, augmentent la résistance aux facteurs de stress et même à la mobilité des individus, alors que les changements compensatoires de leur développement physiologique sont absents ou minimes.Compte tenu de ces résultats, nous doutons que l'augmentation de l'espérance de vie soit due à un ralentissement du taux de vieillissement biologique. Le taux de vieillissement peut être exprimé comme un indicateur du temps pendant lequel la mortalité des individus double (MRDT ou temps de doublement de l'intensité de la mortalité). En utilisant la plate-forme analytique Survcurv, nous avons déterminé ce paramètre dans des organismes modèles après avoir appliqué des combinaisons de médicaments synergiques. Avec l'effet combiné des préparations RIF + PSORA + ALLAN, le niveau de nématode MRDT était significativement plus élevé que le même indicateur dans le groupe témoin (MRDT = 3,7 et 3 jours, P <0,0001, respectivement).Le taux de mortalité des jeunes vers (IMR) dans le groupe expérimental était également significativement plus faible (IMR du groupe témoin = 2,7e-3, IMR sous l'action de RIF + PSORA + ALLAN = 8.5e-4, RAP + RIF + ALLAN = 9.3e-4, P <0,001). Nous avons conclu que grâce à l'utilisation de combinaisons synergiques de médicaments, le processus de vieillissement des nématodes ralentissait et la résistance à divers facteurs négatifs chez les jeunes augmentait, ce qui a finalement conduit à une prolongation de leur vie.
Fig.5La suppression du métabolisme énergétique et le blocage du travail de la chaîne membranaire de transport d'électrons (ETC) peuvent prolonger la vie de C. elegans. Ce fait n'explique pas les résultats de notre étude, car il n'a pas été possible pour les nématodes de détecter une diminution notable du taux de métabolisme basal (schéma 5i). La littérature scientifique décrit que le plus souvent la longévité s'est accompagnée de facteurs tels que: un ralentissement de la croissance et du développement, ainsi qu'une diminution de la fertilité. Nous n'avons pas trouvé que chez les vers qui recevaient différentes combinaisons synergiques de médicaments, la durée de la période de vie adulte et la fertilité générale ont changé de manière significative. Bien que, après l'ajout de ces combinaisons, une légère augmentation de la période de reproduction chez les nématodes ait été enregistrée (schéma 5a-c, schéma supplémentaire 9a).À l'étape suivante, nous avons déterminé: les indicateurs d'adaptation, le niveau de tolérance des situations stressantes et la viabilité des nématodes. Nous avons évalué la vitesse des mouvements spontanés, la résistance aux chocs thermiques, la résistance au stress oxydatif, et également calculé la viabilité des vers à l'échelle de la mobilité spontanée, calculée par la méthode de Herdon (Herndon). Dans le groupe témoin, la durée de vie active était d'environ 50% de la durée de vie totale des nématodes. Un indicateur similaire chez les vers traités avec les préparations RIF + PSORA + ALLAN ou RAP + RIF + ALLAN a atteint respectivement 57% et 63% de leur durée de vie prolongée (schéma 5d, données supplémentaires 9c). Ainsi, la durée de vie absolue et la période relative d'activité active des nématodes ont considérablement augmenté.Nous avons observé que lorsque le dernier ver est mort dans le groupe témoin, dans l'autre, plus de la moitié des individus ont montré un niveau optimal d'activité vitale (schéma 5d, données supplémentaires 9c). L'analyse des mouvements spontanés a montré que dans le groupe expérimental, quel que soit l'âge des vers, leur mobilité après l'action de combinaisons médicamenteuses telles que: RIF + PSORA + ALLAN ou RAP + RIF + ALLAN était significativement plus élevée que celle des nématodes du groupe témoin. En effet, la mobilité spontanée des personnes âgées (18 jours de vie) dans lesquelles des médicaments ont été utilisés ne diffère pas de l'activité motrice des jeunes vers (7 jours de vie) dans le groupe témoin (schéma 5g). De plus, la pharmacothérapie des vers a augmenté leur résistance à la chaleur et au stress oxydatif (analyse toxicologique, schéma 5e, f, schéma supplémentaire 9b).Nos observations indiquent qu'après l'action de combinaisons synergiques de médicaments, les nématodes allongent la durée de vie active, augmentent la résistance aux facteurs de stress et même à la mobilité des individus, alors que les changements compensatoires de leur développement physiologique sont absents ou minimes.Compte tenu de ces résultats, nous doutons que l'augmentation de l'espérance de vie soit due à un ralentissement du taux de vieillissement biologique. Le taux de vieillissement peut être exprimé comme un indicateur du temps pendant lequel la mortalité des individus double (MRDT ou temps de doublement de l'intensité de la mortalité). En utilisant la plate-forme analytique Survcurv, nous avons déterminé ce paramètre dans des organismes modèles après avoir appliqué des combinaisons de médicaments synergiques. Avec l'effet combiné des préparations RIF + PSORA + ALLAN, le niveau de nématode MRDT était significativement plus élevé que le même indicateur dans le groupe témoin (MRDT = 3,7 et 3 jours, P <0,0001, respectivement).Le taux de mortalité des jeunes vers (IMR) dans le groupe expérimental était également significativement plus faible (IMR du groupe témoin = 2,7e-3, IMR sous l'action de RIF + PSORA + ALLAN = 8.5e-4, RAP + RIF + ALLAN = 9.3e-4, P <0,001). Nous avons conclu que grâce à l'utilisation de combinaisons synergiques de médicaments, le processus de vieillissement des nématodes ralentissait et la résistance à divers facteurs négatifs chez les jeunes augmentait, ce qui a finalement conduit à une prolongation de leur vie.Préservation de l'effet de la synergie médicamenteuse chez les mouches drosophiles
L'un des principaux enjeux de la recherche sur le processus de vieillissement est la question du transfert du résultat obtenu de la prolongation de la vie d'une espèce à une autre. Pour cette raison, nous avons étudié si l'effet des synergies médicamenteuses prolongeant la vie de C. elegans sera préservé dans les expériences sur Drosophila melanogaster. Auparavant, dans des études, les scientifiques ont montré que le RAP augmentait la durée de vie des mouches des fruits, alors que le MET n'était pas efficace. Nous avons systématiquement évalué l'effet des préparations individuelles et de leurs combinaisons sur la durée de vie des mouches des fruits mâles. Au début, nous avons démontré que les composés médicinaux RAP et ALLAN prolongeaient la durée de vie moyenne des mouches des fruits, tandis que RIF et PSORA augmentaient uniquement l'espérance de vie maximale des organismes (schéma 6, tableau explicatif s2).Un effet synergique qui prolonge la vie des mouches a été révélé dans des combinaisons de médicaments à base du composé RAP: RAP + RIF et RAP + RIF + ALLAN (schéma 6a). Nous n'avons pas trouvé d'augmentation de la durée de vie moyenne des mouches lors de l'utilisation de combinaisons de médicaments contenant du PSORA: RIF + PSORA et RIF + PSORA + ALLAN (schéma 6b). Cependant, en comparaison avec les résultats de l'action de médicaments individuels, la combinaison de médicaments RIF + PSORA a conduit à un effet synergique qui augmente la durée de vie maximale des organismes (schéma 6c). La mouche des fruits Drosophila melanogaster ayant conservé l'effet de synergie médicamenteuse, nous pensons que les résultats de nos travaux confirment l'existence d'un mécanisme évolutif conservateur qui détermine le fonctionnement de cet effet synergique. Fig.6
Fig.6La discussion
Dans ce travail, nous avons pu trouver plusieurs combinaisons de médicaments à effet synergique. Ils ont influencé sélectivement certaines voies de signalisation associées au vieillissement et à la longévité. De plus, les chemins de signalisation pourraient se croiser. Même si ces combinaisons de médicaments n'étaient utilisées qu'à l'âge adulte, la durée de vie active de C.elegans a été doublée. La taille de l'effet des interventions médicamenteuses était comparable à l'effet après des mutations classiques qui ralentissent le vieillissement. À notre connaissance, cette étude est devenue la plus importante en termes de nombre et de volume d'interventions médicamenteuses chez les animaux adultes.
Lors de l'utilisation de combinaisons médicinales synergiques qui augmentent la durée de vie des vers, nous n'avons pu détecter aucun trouble compensatoire négatif concomitant ou trouble du développement de l'animal. Des troubles similaires ont été observés dans des organismes présentant des mutations dans les gènes associés au vieillissement. De plus, l'effet médicamenteux positif noté n'était pas dû à une diminution du travail de la chaîne membranaire de transport d'électrons (ETC) ou à l'inhibition du métabolisme chez les vers. L'évaluation de ces indicateurs a été réalisée en fonction du niveau de consommation d'oxygène.
En effet, les animaux qui ont reçu des combinaisons de médicaments dépassaient le groupe témoin d'organismes en termes d'activité motrice. La forme physique et l'activité étaient les mêmes chez les individus plus âgés du groupe expérimental et chez les plus jeunes du groupe témoin (schéma 5g). L'analyse de la mortalité a montré que l'effet synergique des combinaisons de médicaments ralentit le taux de vieillissement biologique d'environ 20% (schéma supplémentaire 10). Pour tester l'effet positif de la synergie des médicaments et son conservatisme évolutif, nous avons effectué plusieurs expériences sur la mouche des fruits de Drosophila melanogaster. Deux des quatre combinaisons de médicaments ont confirmé l'innocuité d'un effet synergique.
Au cours de l'évolution, les nématodes sont plus proches des mammifères que des mouches. Par conséquent, ces mécanismes conservateurs et ces voies de signalisation chez les mouches des fruits et les nématodes sont anciens. Probablement, au départ, le mécanisme d'action synergique existait chez l'ancêtre commun à ces trois classes d'animaux.
Afin d'étudier le mécanisme d'action de la synergie médicamenteuse qui prolonge la vie des vers, nous avons réalisé plusieurs expériences d'épistase (Epistasis-suppression de l'action d'une paire de gènes alléliques par le génome d'une paire non allélique) et une analyse de transcriptome. En conséquence, nous avons pu constater que les voies de signalisation daf-2 / daf-16 (IGF / FOXO) et TGF (daf-7) jouent un rôle important dans le fonctionnement de l'effet synergique (schéma 4j). La relation entre ces deux voies a également été confirmée dans d'autres études. Leurs auteurs rapportent que le daf-7 régulait la durée de vie des animaux via la voie de signalisation de l'insuline, et la voie neuronale TGF était associée à l'apport en nutriments et à la longévité. De plus, le daf-7 contrôlait le métabolisme de C. elegans et le processus de stockage des graisses. Les mutations allongeant la vie de C. elegans ont agi sur le métabolisme lipidique des vers en augmentant la quantité de lipides monoinsaturés et en diminuant la quantité de lipides polyinsaturés.
Ces résultats sont cohérents avec les résultats de notre étude. La synergie médicamenteuse a augmenté le niveau du principal facteur de transcription sbp-1, qui affecte le métabolisme lipidique et la synthèse des lipides monoinsaturés (schéma 4c, f, schéma supplémentaire 5). L'analyse spectrale de masse du lipidome nématode, dans laquelle diverses combinaisons de médicaments à effet synergique ont été utilisées, a révélé des changements dans le métabolisme des graisses: activation du facteur sbp-1, accumulation de triacylglycérol et augmentation du rapport des lipides mono- et polyinsaturés dans le sens d'une augmentation de la première (y compris dans deux classes de lipides - phosphatidylcholine et phosphatidyléthanolamine). Enfin, dans la littérature scientifique, il est décrit que la prédominance des lipides monoinsaturés sur les polyinsaturés se trouve dans le profil lipidique des membranes érythrocytaires des enfants dont les parents ont survécu 90 ans ou plus.
Les scientifiques du monde entier s'intéressent beaucoup à la capacité potentielle du MET et, peut-être, du composé RAP, de ralentir le développement de troubles liés à l'âge et de prévenir les maladies humaines. Étant donné l'attention accrue portée à cette question, nous voulons mentionner les expériences dans lesquelles l'efficacité de la combinaison des préparations MET et RAP chez C. elegans et les souris était faible. Ces résultats ont déçu de nombreux scientifiques.
Dans nos travaux, nous avons démontré que l'espérance de vie était déterminée par un complexe de voies de signalisation et de gènes et molécules biochimiques en interaction. L'influence simultanée de certaines voies de signalisation sur plusieurs cibles peut entraîner un effet positif notable et parfois un résultat imprévisible. Dans cette étude, basée sur le principe de la preuve, nous avons utilisé des médicaments qui agissent sur les voies de signalisation clés.
Soudain, nous avons découvert un effet synergique, qui était de nature universelle et évolutive conservatrice. Les résultats de nos travaux confirment la validité de l'utilisation de médicaments qui ralentissent l'activité de nombreuses voies de signalisation conservatrices à la fois pour ralentir le taux de vieillissement biologique. Si les scientifiques parviennent à transférer ce principe d'action aux personnes, cela augmentera considérablement l'efficacité des soins médicaux et le bien-être économique de la société.
Traduction: Tatyana Gneteeva.