À mesure que les outils pour étudier la biologie s'améliorent, les chercheurs commencent à révéler les détails des microprotéines, qui, apparemment, sont essentielles à certains processus cellulaires, y compris ceux liés au cancer. Les protéines sont constituées de chaînes d'acides aminés liés, et la protéine humaine moyenne contient environ 300 résidus d'acides aminés. Pendant ce temps, les microprotéines contiennent moins de 100 résidus d'acides aminés. Les scientifiques ont récemment montré que l'une des microprotéines, PIGBOS, composée de 54 acides aminés, aide à atténuer le stress cellulaire.
Les travaux réalisés par Alan Saghatelian et al. a été publié dans Nature Communications.
L'étude a commencé lorsque les scientifiques ont découvert le PIGBOS dans les mitochondries.
La première tentative de détection de la protéine PIGBOS à travers la protéine fluorescente verte (GFP) a échoué. La microprotéine était trop petite par rapport à la taille de la GFP. L'équipe de scientifiques a résolu ce problème en essayant une approche moins courante appelée GFP partagée, dans laquelle ils ne combinaient qu'une petite partie de la GFP, appelée bêta, avec PIGBOS.
Les chercheurs ont pu voir le PIGBOS et étudier comment il interagit avec d'autres protéines. Lorsqu'ils ont cartographié l'emplacement du PIGBOS, ils ont réalisé qu'il se trouvait sur la membrane mitochondriale externe, prêt à entrer en contact avec des protéines sur d'autres organites. Ils ont été surpris de voir que le PIGBOS interagit avec une protéine appelée CLCC1, qui fait partie d'un organite appelé réticulum endoplasmique (ER).
«Le PIGBOS sert de jonction entre les mitochondries et les urgences», explique un autre co-auteur de l'ouvrage, Qian Chu. "Nous avions l'habitude de ne pas voir cela dans les microtéines - et rarement vu dans les protéines ordinaires."
Les chercheurs ont découvert que le PIGBOS se lie en fait au CLCC1 pour réguler le stress dans les urgences. Sans PIGBOS ER, il est susceptible de subir un stress, ce qui conduit à une chaîne d'événements lorsque la cellule essaie de nettoyer les protéines déformées nocives (réponse à un mauvais repliement des protéines, UPR). Si une cellule ne peut pas se débarrasser de ces protéines, elle déclenche une séquence d'autodestruction et meurt.
Les scientifiques ne s'attendaient pas à voir le rôle de la protéine mitochondriale dans la réaction de l'EPU. Cette nouvelle compréhension du PIGBOS ouvre la porte à de futurs traitements pouvant cibler les cellules de stress.
«À l'avenir, nous pourrions envisager la façon dont le PIGBOS est impliqué dans des maladies comme le cancer», explique Q. Chu. "Chez les patients atteints de cancer, les urgences sont plus stressantes que chez une personne normale, donc la gestion des urgences liées au stress peut être un bon objectif."
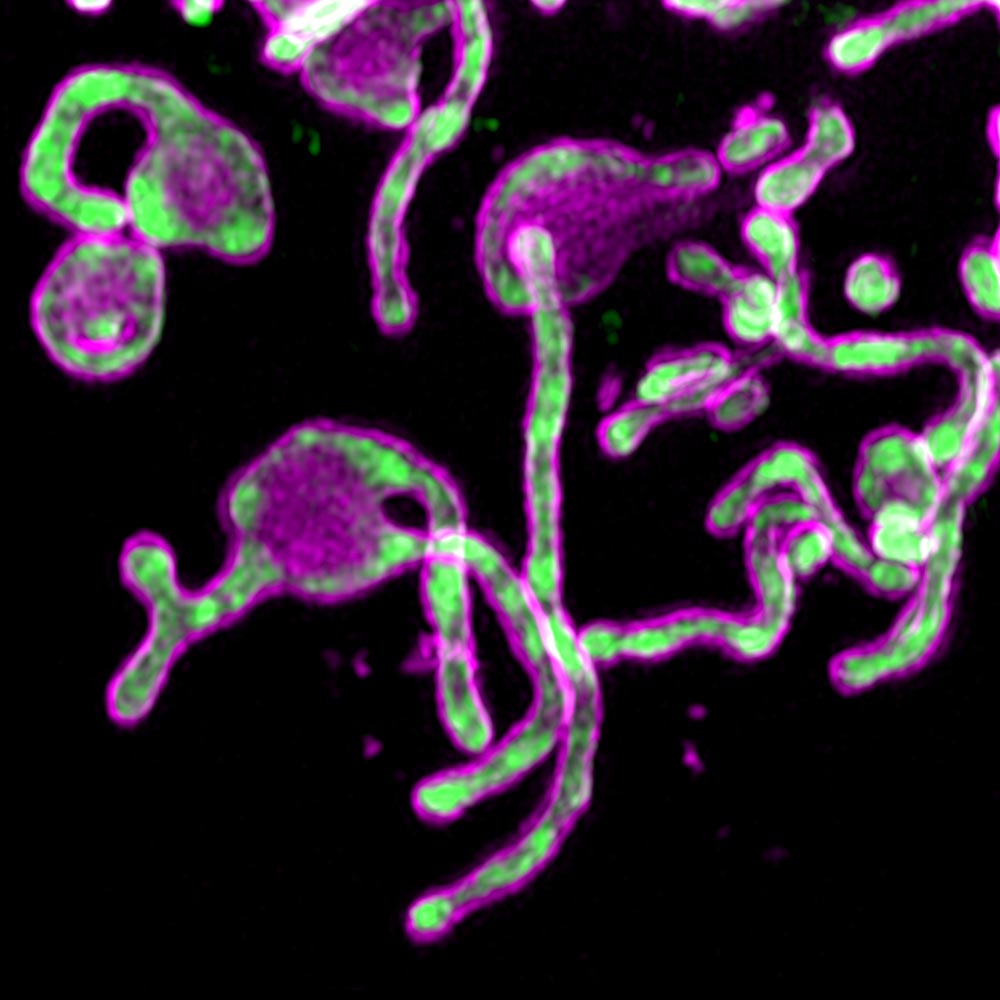 Fig. 1. Imagerie microprotéique PIGBOSwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-disease
Fig. 1. Imagerie microprotéique PIGBOSwww.salk.edu/news-release/mysterious-microproteins-have-major-implications-for-human-diseaseLes chercheurs sont intéressés à étudier le rôle d'autres protéines mitochondriales dans le stress ER, ainsi que le fonctionnement du PIGBOS dans les modèles animaux. L'équipe progresse également dans la caractérisation d'une vaste bibliothèque de microtéines qui peuvent être critiques en biologie cellulaire.
Que sont les microprotéines?
Le terme «microprotéines» fait référence à de petites protéines qui sont codées par de petits cadres de lecture ouverts (smORF). Les progrès de la technologie de la génomique et de la protéomique indiquent que les génomes de mammifères contiendraient des centaines à des milliers de microtéines codées par les smORF. En tant que partie importante et encore peu étudiée du génome, les microtéines offrent une excellente occasion d'acquérir une nouvelle compréhension de la biologie moderne.
Ce n'est pas un hasard si la revue américaine The Scientist a qualifié les microprotéines de "matière noire du protéome humain". Bien que le premier d'entre eux, Id, ait été découvert il y a environ 30 ans. Une caractéristique commune de la famille des protéines Id chez les mammifères est leur régulation du destin cellulaire. Les protéines id agissent dans divers tissus et cellules, y compris les myoblastes, le système nerveux et le système immunitaire. Outre le fait qu'elles agissent comme modulateurs du mécanisme de transcription et affectent le sort des cellules de développement, les protéines Id affectent également le contrôle du cycle cellulaire et sont surexprimées dans diverses tumeurs humaines. La fonction moléculaire des protéines Id dans les processus de développement est bien connue, mais on en sait peu à ce jour sur la fonction des protéines Id chez l'adulte.
À ce jour, seuls quelques smORF et microtéines sont bien caractérisés. Par exemple, certains smORF spécifiques au muscle nous ont permis de décrire de nouvelles voies qui contrôlent la fonction et le développement musculaire. La microprotéine humaine MOTS-C régule l'homéostasie métabolique, la microprotéine NoBody (polypeptide dissociant le corps P non annoté) interagit avec les protéines de clivage de l'ARNm, qui sont les composants moléculaires de la première étape enzymatique dans la voie de dégradation de l'ARNm. Et une microtéine appelée CYREN régule le choix de la voie de réparation de l'ADN pendant le cycle cellulaire.
Le mécanisme d'action actuellement connu des microprotéines est de supprimer la formation de complexes protéiques. Et voici à quoi ça ressemble. De nombreuses protéines remplissent leurs fonctions en agissant dans le cadre de complexes multi-protéiques. La formation de ces complexes est strictement régulée et médiée par des domaines d'interaction protéine-protéine. La perturbation du complexe ou de la capacité des protéines à former des homodimères, des hétérodimères ou des multimères peut avoir de graves conséquences sur la fonction cellulaire. À cet égard, la formation de dimères et de multimères peut être perturbée par les microtéines. Les microprotéines se comportent comme des régulateurs post-traductionnels, formant des dimères homotypiques avec leurs cibles, et agissent par suppression dominante négative de la fonction du complexe protéique.
En termes simples, les microprotéines interfèrent avec le travail complexe de protéines plus grandes, inhibant certains processus cellulaires et en stimulant d'autres. Des études montrent que l'action des microtéines est évolutivement conservatrice et commune aux règnes animal et végétal. Les résultats d'études primaires montrent que les microprotéines sont impliquées dans les processus immunitaires, contrôlent la destruction des molécules d'ARN défectueuses, protègent les bactéries de la chaleur et du froid, dictent la période de floraison des plantes et servent de source de toxines à de nombreux types de poisons animaux. Selon les scientifiques, il semble que les microprotéines soient impliquées dans tous les processus biologiques. Juste avant, ils ne faisaient pas attention.
Il est probable que de nombreux autres processus cellulaires clés sont également médiés par des microtéines non décrites. La détection et la caractérisation des smORF et des microtéines constituent une tâche de recherche importante.
Malgré les mystères restants, les scientifiques testent déjà l'utilisation potentielle de ces molécules. Une entreprise vend des insecticides dérivés de microprotéines trouvées dans le poison d'un atracide australien. Dans les essais cliniques, un agent de contraste basé sur une autre minuscule protéine du venin de scorpion est testé. La tâche de cette substance est d'isoler les limites des tumeurs afin que les chirurgiens puissent les extraire avec une plus grande précision. De nombreuses sociétés pharmaceutiques recherchent désormais des micro-protéines à potentiel médical.
Comment ils peuvent être minuscules n'est pas encore clair. La drosophile a besoin d'une microprotéine avec 11 acides aminés pour développer des pattes normales, et certains microbes peuvent produire des protéines de moins de dix acides aminés de longueur. Mais même les plus grosses microtéines n'atteignent pas les protéines de taille moyenne, telles que l'alpha-amylase, une enzyme de 496 acides aminés présente dans notre salive et décomposent l'amidon.
Seule la détection récente d'une petite quantité de microtéines est associée au critère de reconnaissance des gènes établi il y a une vingtaine d'années. Lorsque les scientifiques analysent le génome du corps, ils scannent souvent des cadres de lecture ouverts (ORF). Afin de ne pas noyer dans une énorme quantité de données, dans le passé, les chercheurs ont généralement exclu tout SRO avec une protéine de moins de 100 acides aminés chez les eucaryotes ou 50 acides aminés dans les bactéries. Par exemple, dans la levure, cette condition a limité la liste des OPC à environ six mille.
L'affaiblissement de ce critère montre que les cellules contiennent beaucoup plus d'OPC. Plus tôt cette année, les scientifiques ont identifié des fragments du génome des microbes qui habitent quatre parties du corps humain, y compris les intestins et la peau. Lors de la recherche de petits OPC pouvant coder des protéines de cinq à 50 acides aminés de long, les chercheurs ont trouvé environ quatre mille familles de microtéines potentielles. Près de la moitié d'entre elles ne sont pas similaires aux protéines connues, mais la séquence d'un petit SRO suggère que la protéine correspondante est située dans les ribosomes - et cela indique qu'elle peut jouer un rôle fondamental. Lorsque les scientifiques ont ignoré les petits OPC, non seulement les gènes avec certaines fonctions rares ont été manqués, mais les gènes avec des fonctions clés.
D'autres cellules contiennent également un grand nombre d'OPC courts: la levure, par exemple, est capable de produire plus de 260 000 molécules avec un spectre de deux à 99 acides aminés. Mais les cellules n'utilisent presque certainement pas tous ces SRO, et certaines des chaînes d'acides aminés qu'elles produisent peuvent ne pas être fonctionnelles.
Weissman et al. ont trouvé les microprotéines d'une autre manière: en utilisant la méthode qu'ils ont inventée, visant à une identification plus répandue du type de protéines produites par les cellules. Pour former une protéine, la cellule copie d'abord le gène dans un messager d'ARN. Ensuite, les ribosomes lisent l'ARNm et se lient aux acides aminés dans un ordre spécifique. En séquençant l'ARNm attaché aux ribosomes, Weissman et son équipe déterminent avec précision lesquels d'entre eux se transforment réellement en protéines et où le ribosome commence à «lire» sur l'ARN. Dans une étude cellulaire de 2011, un scientifique de son équipe a appliqué cette méthode de profilage des ribosomes, également appelée Ribo-seq, aux cellules souches embryonnaires de souris et a découvert que les cellules produisent des milliers de protéines imprévues, dont beaucoup dans lesquelles le nombre d'acides aminés sera inférieur au seuil de 100 unités. «Il était clair que l'univers standard ignorait le vaste univers des protéines, dont beaucoup étaient courtes», explique Weissman.
Saghatelian et ses collègues ont adopté une troisième approche pour détecter l'abondance de microtéines dans nos propres cellules. Les scientifiques ont utilisé l'analyse spectrométrique de masse, dans laquelle les protéines sont divisées en fragments triés en fonction de la masse, afin d'identifier le spectre d'identification de chaque protéine. Saghatelyan et ses collègues ont appliqué cette méthode à des mélanges de protéines de cellules humaines, puis en ont soustrait les signes de types de protéines connus. Cette méthode a révélé des spectres de 86 protéines minuscules auparavant inconnues, dont les plus petites avaient une longueur de 18 acides aminés, comme l'ont noté les scientifiques dans un article de la revue Nature Chemical Biology en 2013.
La petite taille limite le potentiel protéique. Les protéines plus grosses se combinent dans des formes complexes visant à la mise en œuvre de certaines fonctions, par exemple, catalyser les réactions chimiques. Les protéines contenant de 50 à 60 acides aminés ne sont pas susceptibles de former des composés. Et par conséquent, ils ne conviennent pas à la formation d'enzymes ou de protéines structurales.
Cependant, leur petite taille ouvre également certaines possibilités. Ils sont assez petits pour s'insérer dans les recoins de grosses protéines qui fonctionnent comme des canaux et des récepteurs. Les petites protéines partagent souvent de courtes séquences d'acides aminés avec leurs plus gros partenaires et peuvent donc se lier et modifier l'activité de ces protéines. Les microprotéines liées peuvent également diriger de grosses molécules vers de nouveaux endroits - par exemple, en facilitant leur pénétration dans les membranes cellulaires.
En raison de leur attirance pour les protéines plus grosses, les protéines plus petites peuvent donner aux cellules un moyen réversible d'activer ou de désactiver les protéines plus grosses. Dans une étude de 2016 publiée dans la revue PLOS Genetics, Stephan Wenkel et ses collègues ont génétiquement modifié des plantes d'Arabidopsis pour produire une quantité supplémentaire de deux petites protéines. Les plantes fleurissent généralement à un moment où la journée est assez longue, mais après la naissance d'une quantité excessive de deux types de microtéines, la floraison a été retardée. Les petites protéines ont provoqué ce retard en bloquant la grosse protéine en floraison appelée CONSTANS. Ils lient CONSTANS à d'autres protéines inhibitrices qui le désactivent.
En 2016, Saghatelyan et ses collègues ont découvert que les cellules humaines produisent une protéine contenant 68 acides aminés, qu'ils ont appelée NoBody. Cette protéine peut aider à la destruction des molécules d'ARN défectueuses ou inutiles. Le nom "Nikto" reflète le rôle de cette protéine dans la prévention de la formation de corps processifs, de mystérieux amas dans le cytoplasme, où la destruction de l'ARN peut se produire. Lorsqu'il n'y a pas assez de protéines, des corps plus processifs se forment, ce qui accélère la destruction de l'ARN et modifie la structure interne de la cellule. "Cela prouve que les petites protéines peuvent avoir un effet énorme à l'intérieur de la cellule", disent les scientifiques.
Les muscles dépendent de nombreuses microprotéines différentes. Au cours du développement de l'embryon, les cellules musculaires individuelles fusionnent en fibres qui déclenchent la contraction. Myomixer 84-amino acide protein se combine avec une protéine plus grande pour connecter les cellules, comme Olson et al.ont montré en 2017 dans son travail dans la revue Science. Sans lui, les embryons de souris ne peuvent pas former de muscles et sont presque transparents.
De plus, à mesure qu'elle se développe, la myoréguline entre en vigueur, ce qui aide à réguler l'activité musculaire. Lorsqu'un muscle reçoit un stimulus, l'entrepôt de cellules libère du calcium, stimulant la contraction des tissus et la production d'énergie. Ensuite, une pompe à ions, une protéine appelée SERCA, commence à retourner le calcium au stockage, permettant au tissu musculaire de se détendre. La mioréguline se lie à SERCA et l'inhibe. Cet effet limite la fréquence de la contraction musculaire, fournissant probablement une réserve d'énergie pour une urgence, par exemple, lors de la fuite d'un prédateur. Une autre petite protéine, DWORF, a l'effet inverse d'activer SERCA et de stimuler la contraction musculaire systématique.
Même des organismes soigneusement étudiés, tels que la bactérie E. coli (Escherichia coli), cachent de petites protéines inattendues qui jouent un rôle important. Storz et al. a rapporté en 2012 qu'une protéine de 49 acides aminés jusque-là inconnue appelée AcrZ aide ce microbe à survivre lorsqu'il est exposé à certains types d'antibiotiques en stimulant une pompe sans médicament.
le venin produit par une variété d'organismes - y compris les araignées, les scolopendres et les mollusques toxiques - regorge également de minuscules protéines. De nombreux composants du poison immobilisent ou tuent, bloquant les canaux pour le sodium ou d'autres ions nécessaires à la transmission des influx nerveux. Les petites protéines "frappent ces canaux ioniques avec une précision et une puissance étonnantes, disent les scientifiques. Ce sont les principaux composants des poisons, et c'est avec eux que la plupart des conséquences pharmacologiques et biologiques sont associées.
L'insecte australien géant mangeur de poissons, par exemple, ne se contente pas de mâchoires pointues et de parties buccales en forme de pic pour vaincre sa proie. Il présente à ses victimes une dose contenant plus de 130 protéines, dont 15 représentent moins de 100 acides aminés.
Contrairement aux grosses protéines, comme les anticorps, les microprotéines ingérées à partir de comprimés ou d'injections peuvent pénétrer dans les cellules et modifier leurs fonctions. Le captopril, le premier d'une classe de médicaments à haute pression connus sous le nom d'inhibiteur de l'enzyme de conversion de l'angiotensine, a été développé à partir de la petite protéine trouvée dans le venin de la chaleur commune, une espèce de vipère vénéneuse toxique. Ce médicament, approuvé pour la vente aux États-Unis en 1981, a été découvert par hasard, avant même que les scientifiques reconnaissent les petites protéines comme un groupe distinct. Jusqu'à présent, seules quelques microtéines ont été mises sur le marché ou lors d'essais cliniques.
Les chercheurs sur le cancer essaient d'utiliser la microprotéine trouvée dans le venin de scorpion jaune, qui est courante en Afrique et au Moyen-Orient. Cette molécule est mystérieusement attirée par les tumeurs. En l'ajoutant à une substance colorante fluorescente, les scientifiques s'attendent à mettre en évidence les limites des tumeurs cérébrales afin que les chirurgiens puissent exciser en toute sécurité les zones touchées par le cancer. Il illumine la tumeur. Ainsi, vous pouvez voir ses frontières et détecter la présence de métastases. Dans les essais cliniques, les chercheurs évaluent maintenant si une double molécule aidera les chirurgiens à éliminer les tumeurs cérébrales chez les enfants.
L'importance des petites protéines dans la médecine est encore inconnue, mais elles ont déjà retourné un certain nombre de déclarations de biologistes. Norbert Hübner du Centre Max Delbrück de médecine moléculaire de Berlin et ses collègues ont découvert des dizaines de nouvelles microtéines dans les cellules cardiaques humaines. Le groupe a révélé leur source inattendue: de courtes séquences dans de longs ARN non codants, c'est-à-dire dans une espèce dont on pensait auparavant qu'elle ne produisait pas de protéines. En identifiant 169 longs ARN non codants, probablement lus par les ribosomes, Huybner et son équipe ont utilisé l'un des types de spectrométrie de masse pour confirmer que plus de la moitié d'entre eux produisent des microprotéines dans les cellules cardiaques.
leur document de performance a été publié cette année dans Cell.Les séquences d'ADN d'autres protéines minuscules peuvent également être trouvées dans des endroits non conventionnels. Par exemple, certains sont dans les cadres de lecture ouverts, OPC, de plus grandes protéines. Les scientifiques pensaient auparavant que ces séquences aident à contrôler la production de protéines plus grosses, mais produisent rarement elles-mêmes des protéines. Certaines séquences codantes de microtéines nouvellement détectées se trouvent même dans des séquences codant pour d'autres protéines plus longues.Ces surprises génomiques peuvent éclairer la façon dont de nouveaux gènes apparaissent, explique la biologiste des systèmes évolutifs Anne-Ruxandra Carvunis de l'Université de Pittsburgh, en Pennsylvanie. Les scientifiques pensaient auparavant que la plupart des gènes apparaissent lorsque les gènes existants se multiplient ou fusionnent, ou lorsque les espèces échangent de l'ADN. Cependant, selon Karvunis, les microprotéines indiquent que des protogènes peuvent se former lorsque des mutations définissent de nouveaux signaux de démarrage et d'arrêt dans la partie non codante du génome. Si l'OPC résultant produit une protéine utile, les nouvelles séquences resteront dans le génome et passeront par le processus de sélection naturelle, évoluant davantage en gènes plus grands codant pour des protéines plus complexes.Dans une étude de 2012, Carvounis et ses collègues ont découvert que la levure transforme plus d'un millier de SRO courts en protéines. Et cela suggère que ces séquences sont des protogènes. Dans une nouvelle étude, Carvounis et son équipe ont testé si les jeunes SRO pouvaient être bénéfiques pour les cellules. Ils ont génétiquement modifié la levure afin d'augmenter le résultat de 285 SRO nouvellement évolutifs, dont la plupart ciblent des molécules plus petites que les protéines standard ou un peu plus que cela. Dans près de 10% des protéines, une augmentation de leurs niveaux a stimulé la croissance cellulaire dans au moins un milieu.«Les microprotéines sont un domaine en croissance rapide», explique A. Saghatelian. "Mais je pense que notre étude a vraiment influencé la compréhension actuelle de l'influence des microprotéines sur la biochimie et la biologie cellulaire."Liens :Régulation de la fonction protéique par les «micro- protéines» Le nouvel univers des mini-protéines bouleverse la biologie cellulaire et la génétiqueRégulation de la réponse au stress ER par une microprotéine mitochondriale