
Tout système, aussi complexe et multicouche soit-il, a sa propre base - la base sans laquelle il ne fonctionnerait pas comme il fonctionne. Dans la biosphère de notre planète, il y a aussi des briques de base sur lesquelles tout repose. Ce sont des autotrophes - des organismes qui peuvent convertir des composés inorganiques en composés organiques. Aujourd'hui, nous vous rencontrerons une étude dans laquelle des scientifiques israéliens ont créé en laboratoire un nouveau type de bactéries qui se nourrissent de dioxyde de carbone. Quelles méthodes ont été utilisées dans le processus de développement, comment la bactérie s'est-elle comportée et qu'est-ce que ce travail peut signifier pour l'humanité? Nous en apprenons à travers le rapport du groupe de recherche. Allons-y.
Base d'étude
Les autotrophes peuvent être appelés l'une des créatures les plus anciennes de la planète. On pense que les premiers autotrophes sont apparus il y a deux milliards d'années, lorsqu'une bactérie hétérotrophique (incapable de synthétiser des substances organiques à partir de substances inorganiques) par évolution a acquis la capacité de photosynthèse. Le terme lui-même a été proposé en 1892 par le scientifique allemand Albert Bernhard Frank.
 Albert Bernhard Frank
Albert Bernhard FrankCertains organismes sont au carrefour de la synthèse autotrophique et hétérotrophique, car ils obtiennent du carbone à partir de composés organiques, mais de l'énergie à partir de composés inorganiques. Suivant cette logique, les autotrophes peuvent être divisés en plusieurs principaux: phototrophes, chimiotrophes, radiotrophes, lithotrophes et mixotrophes. Il existe également des groupes de transition, dont les représentants sont extrêmement difficiles à attribuer à l'un ou l'autre bord du spectre de synthèse, mais leur classification n'est pas encore terminée.
Les phototrophes , comme leur nom l'
indique , utilisent les photons comme source d'énergie, ou plutôt d'énergie solaire. C'est à partir de ces organismes qu'un tel type de nutrition que la photosynthèse se produit.
Les chimiotrophes sont une chimie plus proche que la physique. Ces organismes utilisent diverses réactions redox comme sources d'énergie, c'est-à-dire chimiosynthèse.
Les
radiotrophes , les plus mal étudiés et en même temps les plus curieux, sont le résultat d'un phénomène appelé «radio-stimulation des champignons». Il s'agit du processus de stimulation du métabolisme fongique microscopique dû aux rayonnements ionisants. Pour la première fois, ces organismes ont été découverts en 1991 dans le cadre de moisissures noires, dont des échantillons ont été obtenus de la centrale nucléaire de Tchernobyl. Un peu plus tard (en 2006), des scientifiques de New York ont testé l'hypothèse de la radio-stimulation des champignons et ont constaté que trois champignons de l'espèce Cladosporium sphaerospermum, Wangiella dermatitidis et Cryptococcus neoformans, qui contiennent le pigment mélanine, ont augmenté leur biomasse et accumulé de l'acétate (acide acétique, CH
3 OH) ) dans un environnement où le niveau de rayonnement a dépassé la norme de 500 fois.
Les lithotrophes transforment les composés inorganiques en énergie et en carbone dont ils ont besoin par la respiration aérobie ou anaérobie. Seuls les représentants des archées (unicellulaires sans noyau et organites membranaires) et des bactéries peuvent se vanter d'une chimiolithotrophie.
Les mixotrophes sont des soldats universels, car ils peuvent utiliser plusieurs types d'aliments différents en même temps (ou alternativement, selon les circonstances), c'est-à-dire être à la fois phototrophes et chimiotrophes, par exemple.
Les auteurs de l'étude que nous envisageons aujourd'hui estiment qu'une compréhension plus fine des processus d'activité vitale des autotrophes permettra d'appliquer à grande échelle les connaissances acquises. Et à leur avis, la meilleure façon d'étudier l'autotrophie est de créer un organisme autotrophique synthétique. Théoriquement, vous pouvez créer une bactérie qui se nourrira de dioxyde de carbone. Mais appeler ce processus un langage simple ne tourne pas. Les chercheurs eux-mêmes identifient trois étapes principales qui doivent être franchies pour que leur travail soit réalisé.
Premièrement, pour une transition complète vers la nutrition autotrophique, le corps doit utiliser le mécanisme de fixation du CO
2 sur le chemin où le carbone entrant se compose exclusivement de CO
2 , et les molécules de sortie sont des molécules organiques qui entrent dans le métabolisme central du carbone et fournissent les 12 principaux précurseurs de la biomasse.
Deuxièmement, le corps doit utiliser des mécanismes enzymatiques pour obtenir un pouvoir régénérateur en collectant de l'énergie non chimique (lumière, électricité, etc.) ou par des processus redox qui ne sont pas des sources de carbone.
Troisièmement, le corps doit réguler et coordonner les moyens de collecter l'énergie et de fixer le CO2, afin qu'ils maintiennent ensemble une croissance régulière lorsque le CO2 est la seule source de carbone.
Auparavant, des études ont été menées dans lesquelles ils ont essayé de créer un organisme qui se nourrit de CO
2 , mais dans ces travaux, il y avait un gros défaut - la présence de composés organiques multivarbonés à l'intérieur du corps, qui servait de source de nourriture de «réserve». En d'autres termes, il n'a pas encore été possible de créer un organisme hétérotrophique qui prendra le carbone exclusivement du CO
2 .
Comme base méthodologique pour leurs recherches, les scientifiques ont utilisé
le cycle de Calvin (
cycle de Calvin-Benson-Bassam) - une série de réactions biochimiques lors de la photosynthèse dans les plantes, les cyanobactéries, etc. Ce cycle est le mécanisme de fixation du dioxyde de carbone le plus courant.
Et le principal expérimental était la bactérie
Escherichia coli , mieux connue de nous sous le nom "E. coli".
Résultats de recherche
Tout d'abord, il a fallu procéder à une réorganisation métabolique et à une évolution en laboratoire de l'organisme afin de réaliser la transition vers l'autotrophie. Plusieurs composés candidats ont été considérés comme pouvant servir de donneurs d'électrons pour la fixation du CO
2 , ce qui permettrait aux bactéries de se transférer pour terminer l'autotrophie.
Le formiate * a été choisi comme source d'électrons, car ce composé organique à un carbone peut servir de source pour la partie réductrice du processus, mais ne soutient pas naturellement la croissance d'
E. Coli et n'est pas absorbé dans la biomasse.
Formates * - sels et esters d'acide formique.
Le potentiel de récupération du formiate (E
0 = 420 mV) est suffisamment faible pour réduire le NAD
+ , le principal support électronique de la cellule (E
0 = 280 mV dans
E. coli ). Un autre avantage est qu'elle peut être obtenue par voie électrochimique à partir de sources renouvelables, tandis que la biomasse sera carbone-négative.
Afin de collecter les électrons du formiate et de les diriger vers le réservoir de récupération d'énergie cellulaire principal NADH (nicotinamide adénine dinucléotide), le FDH (formiate déshydrogénase) lié à NAD
+ de la bactérie méthylotrophique
Pseudomonas sp .
Une analyse stœchiométrique (rapport massique du composé chimique) du réseau métabolique dans
E. coli a montré que l'ajout de FDH, Rubisco (ribulose bisphosphate carboxylase) et Prk (phosphoribulokinase) au réseau métabolique d'
E. Coli serait suffisant pour la croissance autotrophique (image ci-dessous).
 Image 1: Schéma d'une bactérie chimiotrophique modifiée en laboratoire E. coli.
Image 1: Schéma d'une bactérie chimiotrophique modifiée en laboratoire E. coli.Malheureusement, la coexpression de trois enzymes recombinantes dans la souche primaire d'
E. Coli (BW25113) n'a pas conduit à une croissance dans des conditions autotrophes. Étant donné que l'analyse stoechiométrique ne prend pas en compte la cinétique de l'enzyme, le niveau d'expression et de régulation, il a été décidé d'utiliser l'évolution adaptative en laboratoire comme outil d'optimisation métabolique pour atteindre la croissance autotrophique.
Cette méthode est due au fait que l'expression hétérologue d'un mécanisme enzymatique étranger élargit l'espace des réactions métaboliques possibles pour la cellule, offrant la possibilité d'une croissance autotrophique. Le problème est qu'il n'y a aucune garantie que le flux nécessaire passera par un ensemble de réactions récemment élargi.
Par conséquent, puisque le métabolisme central d'
E. Coli est adapté à la croissance hétérotrophe, il est probable qu'une distribution de flux qui soutient la croissance hétérotrophe sera utilisée. C'est précisément pour cette raison que l'évolution en laboratoire a été utilisée, capable de rediriger le flux le long de la voie métabolique souhaitée.
L'un des processus les plus importants de l'évolution en laboratoire est le réarrangement du métabolisme central pour établir la dépendance du flux de carboxylation de Rubisco et l'adaptation du milieu de croissance pour supprimer le flux à travers les voies hétérotrophes originales (
2A ). En d'autres termes, il a fallu faire en sorte que la bactérie cesse d'utiliser les mécanismes hétérotrophes du métabolisme pour passer à l'autotrophie.
 Image n ° 2: schéma de la stratégie évolutive développée pour convertir la bactérie hétérotrophique E. coli en une chimiotrophie.
Image n ° 2: schéma de la stratégie évolutive développée pour convertir la bactérie hétérotrophique E. coli en une chimiotrophie.Tout d'abord, au cours de l'évolution artificielle, trois gènes codant pour deux enzymes du métabolisme central du carbone ont été exclus: la phosphofructokinase (Pfk) dans la glycolyse et la glucose-6-phosphate déshydrogénase (Zwf) dans la voie oxydante du pentose phosphate. Le premier a deux isoenzymes codées par deux gènes (pfkA et pfkB). Lorsque les cellules sont cultivées sur du
xylose *, ce réarrangement garantit que la croissance cellulaire dépend de la carboxylation de Rubisco, qui est nécessaire pour la transition vers la chimiotrophie.
Le xylose * est un monosaccharide pentose (C 5 H 10 O 5 ).
Ensuite, une expression hétérologue de Rubisco, Prk, anhydrase carbonique (CA), qui convertit le CO
2 et le bicarbonate et FDH, a été réalisée. Ensuite, le processus de croissance des cellules dans des
chemostats à teneur limitée en xylose
* , qui soutient les cellules en famine de carbone constante.
Chemostat * est une méthode de culture de micro-organismes lorsque l'équilibre et la concentration optimaux des substrats sont maintenus dans le milieu nutritif où ils se développent.
Un tel milieu de culture permet aux cellules de proliférer (croissance tissulaire par division cellulaire), mais ralentit les voies
cataboliques hétérotrophes
* .
Catabolisme * - décomposition métabolique de substances complexes en substances plus simples ou oxydation d'une substance (métabolisme énergétique).
Le chemostat, où les cellules ont été cultivées, contenait également un excès de formiate et était constamment purgé avec de l'air enrichi en CO
2 ( teneur en CO
2 de 10%).
Ainsi, ce milieu de croissance ralentit l'hétérotrophie, provoquant une tendance à l'autotrophie des cellules. Les cellules sont littéralement obligées de réduire leur dépendance à la contribution externe du carbone du sucre organique.
La méthode de culture était prête, il fallait la vérifier. Une fois par semaine, des échantillons ont été prélevés des chemostats et testés pour la croissance dans des conditions autotrophes. En particulier, ce sont des conditions chimio-organotrophiques pour Escherichia coli, qui consistent en un milieu de type M9 avec addition de 30 mM (millimolaire) de formiate de sodium dans une atmosphère à haute teneur en CO
2 (10%), mais sans autre source de carbone.
Après environ 200 jours de propagation dans des chemostats, ce qui équivaut à environ 150 générations, une croissance a été détectée dans des milieux dépourvus de xylose (c'est-à-dire dans des conditions autotrophes). Ce phénotype était présent dans tous les échantillons de cette journée. Au 350ème jour, le xylose a été complètement exclu du milieu de culture (
2B ). Une croissance et une turbidité soutenues impliquaient la présence exclusive de cellules indépendantes du xylose dans le chimiostat. Il a été constaté que les échantillons avaient besoin d'un milieu avec une concentration élevée de CO
2 pour leur croissance, ce qui suggère un mécanisme de fixation du carbone.
Ensuite, les scientifiques ont choisi l'un des
clones les plus robustes en croissance
* pour une analyse plus approfondie. Le
temps de doublement a été établi
* 18 ± 4 heures (
2C ).
Clone * - dans ce cas, nous entendons un groupe de cellules génétiquement identiques.
Doubler le temps * - le temps qu'il faut pour que quelque chose double.
Il était nécessaire de s'assurer que les cellules cultivées sont vraiment autotrophes, et pendant leur croissance, il n'y avait pas de sources de carbone «cachées» ou d'activation de formiate hétérotrophes. Pour cela, des expériences ont été menées sur le marquage des isotopes.
Pour commencer, les clones évolués ont été cultivés dans un milieu avec du formiate marqué au
13 C et du
13 CO
2 (10 générations jusqu'à l'obtention d'un état isotopique stable). Ensuite, une analyse de
13 marqueurs C pour divers métabolites a été réalisée par chromatographie liquide et spectrométrie de masse en tandem.
13 C * - carbone-13, un isotope stable du carbone.
Métabolites * - produits métaboliques de tout composé.
La méthode de la chromatographie liquide et de la spectrométrie de masse en tandem * est une méthode de recherche chimique qui combine la chromatographie liquide séparant les mélanges de plusieurs composants et la spectrométrie de masse, qui garantit l'identité structurelle des composants individuels.
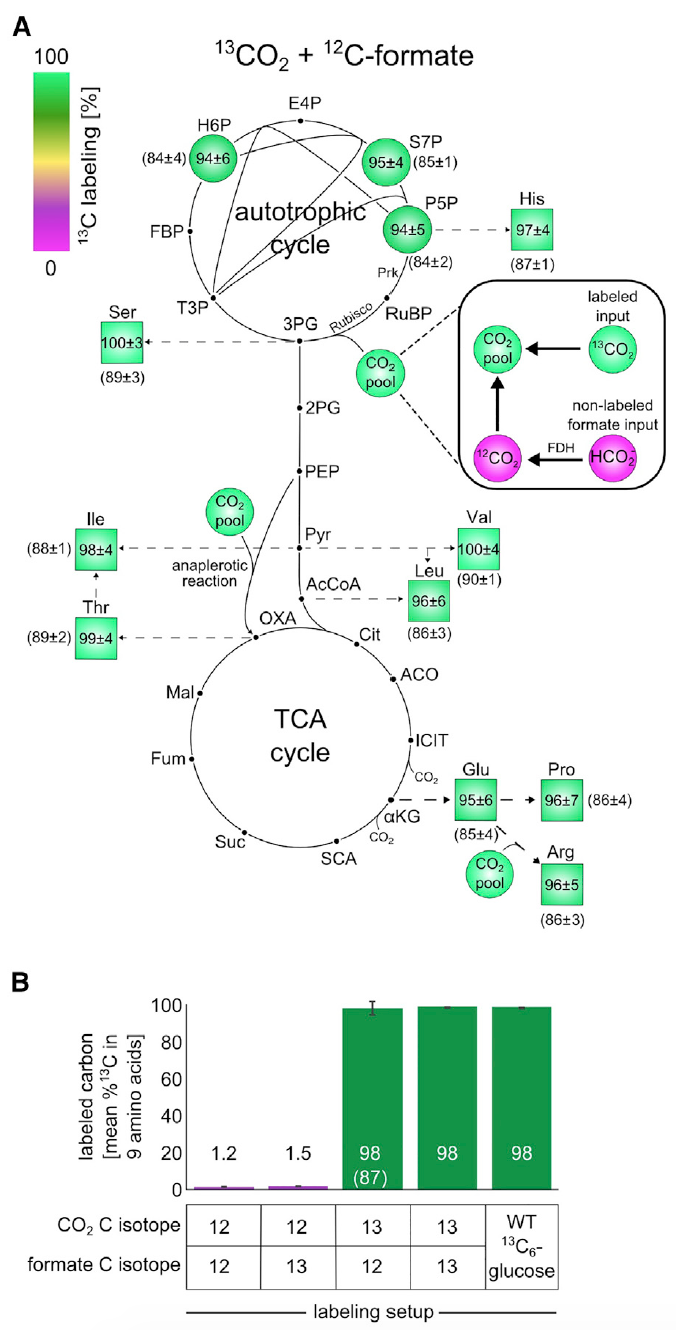 Image 3: Des expériences de marquage isotopique utilisant du 13 C montrent que tous les composants de la biomasse sont formés à partir de CO 2 comme seule source de carbone.
Image 3: Des expériences de marquage isotopique utilisant du 13 C montrent que tous les composants de la biomasse sont formés à partir de CO 2 comme seule source de carbone.L'analyse a montré qu'environ 98% des atomes de carbone dans les éléments constitutifs de la biomasse du métabolisme central ont été marqués avec succès. Ces données correspondent à du formiate marqué et du CO
2 contenant environ 99% de
13 C et 1% de bicarbonate non marqué dissous dans un milieu nutritif.
Cette observation est une preuve irréfutable que le carbone dans la biomasse des cellules provient précisément du CO
2 et du formiate.
De plus, il a été vérifié si le formiate est concentré dans la biomasse. Pour cela, les cellules ont été cultivées en milieu M9 (la concentration de CO
2 dans l'atmosphère était de 10%, comme dans les expériences précédentes) en utilisant du formiate marqué au carbone-13.
Le schéma de marquage du
13 C pour les éléments constitutifs de la biomasse après croissance dans un environnement donné a montré une marque de
13 C à 1-2% (
3B ), qui est la valeur attendue sur la base de la teneur en
13 C naturel et d'une petite quantité de formiate étiqueté. En d'autres termes, les résultats ont montré que les cellules n'assimilent pas le formiate.
La totalité des résultats des expériences ci-dessus suggère avec confiance que la source de carbone pour les cultures cultivées est exclusivement le CO2 et le formiate. Et cela, à son tour, indique une autotrophie à cent pour cent des cellules d'
E. Coli qui ont subi une évolution en laboratoire.
Les scientifiques ont mené une autre expérience pour vérifier cette déclaration, où du
13 CO
2 marqué et du formiate non marqué ont été utilisés. En raison du coût élevé du
13 CO
2 , les navires dans lesquels l'expérience a été menée ont été fermés. Cette petite nuance est extrêmement importante, car en raison de l'environnement fermé (dans les expériences précédentes, les conteneurs ont été ventilés), du CO
2 non marqué accumulé en raison de l'oxydation du formiate s'est accumulé. Et cela déforme les résultats de l'observation. Cependant, le processus de «contamination» pourrait être surveillé et même corrigé à l'œil nu grâce à l'analyse du glutamate marqué.
Cette expérience a montré qu'environ 85 à 90% des atomes de carbone dans les éléments constitutifs de la biomasse du métabolisme central ont été marqués avec succès. Comme on peut le voir sur les images
3A et
3B , si nous appliquons l'ajustement pour le composant marqué au
13 C, le marquage des atomes dans la biomasse sera presque de 100%, ce qui indique la nature autotrophique du développement des
bactéries E. coli .
Le fait que les bactéries soient devenues autotrophes ne fait aucun doute. Reste à savoir quel type de changements génétiques, c'est-à-dire des mutations, se sont produits au cours de l'évolution en laboratoire.
Pour clarifier cela, les scientifiques ont isolé six clones capables de croissance autotrophique sur le formiate et séquencé leur génome et leurs
plasmides * .
Les plasmides * sont des molécules d'ADN physiquement séparées des chromosomes et capables de se répliquer de manière autonome (le processus de création de deux molécules d'ADN filles basées sur la molécule d'ADN parent).
Deux clones (clone 1 et 2) ont été isolés lorsque le xylose était encore présent dans le milieu de culture (250e jour d'évolution), trois clones (clone 3, 4 et 5) après que le xylose a été exclu du milieu de culture du chimiostat ( 400ème jour d'évolution). Le dernier clone (clone 6) est isolé après la propagation de l'un des clones précédemment isolés (clone 1) pendant plusieurs cycles de dilution en série.
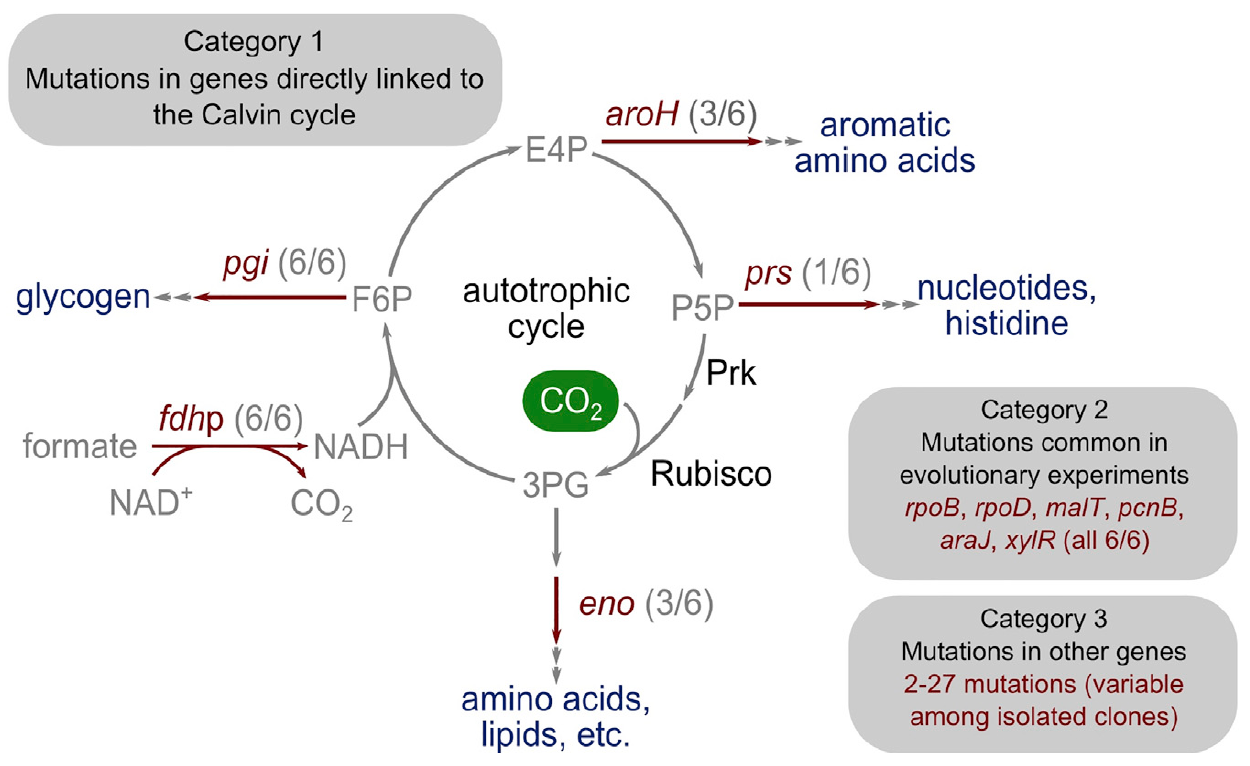 Image 4: La base génétique de la transition vers l'autotrophie.
Image 4: La base génétique de la transition vers l'autotrophie.Étonnamment, le nombre de mutations était assez faible. Les chercheurs les ont divisés en trois catégories principales.
La première catégorie comprend les gènes codant pour des enzymes ayant un lien métabolique direct avec la fonction du cycle de Calvin. Ce gène, qui code pour la ribose phosphate diphosphokinase, dirige le ribose phosphate dans la biomasse.
La deuxième catégorie de gènes mutés comprend ceux qui ont muté lors d'expériences antérieures sur l'évolution adaptative en laboratoire: pcnB (R161P), rpoB (D866E), rpoD (F563S), malT (E359K) et araJ (W156). Les scientifiques associent ces mutations au processus même d'évolution en laboratoire, c'est-à-dire qu'elles ne sont pas nécessairement associées au processus de transition des bactéries vers l'autotrophie. De même, une mutation a été découverte dans le gène xylR codant pour une protéine régulatrice des opérons responsables du catabolisme du sucre D-xylose (E337K). Il est associé à une famine prolongée de xylose dans un chimiostat pendant la culture, mais n'est en aucun cas associé à l'autotrophie.
La troisième catégorie de mutations comprend celles qui n'ont pas de rôle caractéristique et peuvent résulter d'un phénomène tel que «l'auto-stop génétique». Dans différents isolats, il existe de 2 à 27 gènes mutés supplémentaires, dont certains peuvent être des mutations du phénotype autotrophique, mais ne sont pas strictement nécessaires pour cela.
À l'avenir, les scientifiques ont l'intention de mener des études supplémentaires sur les mutations génétiques pour déterminer lesquelles sont fondamentales et nécessaires à la transition des bactéries vers l'autotrophie.
Pour une connaissance plus détaillée des nuances de l'étude, je vous recommande de consulter le
rapport des scientifiques et
les documents supplémentaires qui s'y rapportent.
Épilogue
Dans cette étude, les scientifiques ont pu obtenir d'excellents résultats. Tout d'abord, il convient de noter l'évolution en laboratoire - un processus contrôlé par les scientifiques, leur permettant de transformer le corps selon un nouveau "design".
E. coli a été littéralement forcé par la manipulation évolutive de devenir un autotroph, absorbant le CO
2 pour se fournir en carbone. Une telle bactérie mutante peut être extrêmement utile pour une société souffrant du réchauffement climatique, dont l'une des raisons est précisément le dioxyde de carbone. , ,
2 , . «» , . -, . -, , ,
2 . , , .
La bactérie qui sauvera le monde du réchauffement climatique, ça sonne incroyable, même un peu de science-fiction. Mais, même si une telle bactérie est créée, elle ne dégage pas une personne de la responsabilité de la situation environnementale de la planète. Car ce n'est purement pas là où ils nettoient, mais où ils ne salissent pas.Merci de votre attention, restez curieux, prenez soin de la planète et passez une bonne semaine de travail, les gars. :)
Un peu de publicité :)
Merci de rester avec nous. Aimez-vous nos articles? Vous voulez voir des matériaux plus intéressants? Soutenez-nous en passant une commande ou en recommandant à vos amis
des VPS basés sur le cloud pour les développeurs à partir de 4,99 $ , un
analogue unique de serveurs d'entrée de gamme que nous avons inventés pour vous: Toute la vérité sur les VPS (KVM) E5-2697 v3 (6 cœurs) 10 Go DDR4 480 Go SSD 1 Gbit / s à partir de 19 $ ou comment diviser le serveur? (les options sont disponibles avec RAID1 et RAID10, jusqu'à 24 cœurs et jusqu'à 40 Go de DDR4).
Dell R730xd 2 fois moins cher au centre de données Equinix Tier IV à Amsterdam? Nous avons seulement
2 x Intel TetraDeca-Core Xeon 2x E5-2697v3 2.6GHz 14C 64GB DDR4 4x960GB SSD 1Gbps 100 TV à partir de 199 $ aux Pays-Bas! Dell R420 - 2x E5-2430 2.2Ghz 6C 128GB DDR3 2x960GB SSD 1Gbps 100TB - à partir de 99 $! Pour en savoir plus sur la
création d'un bâtiment d'infrastructure. classe utilisant des serveurs Dell R730xd E5-2650 v4 coûtant 9 000 euros pour un sou?