एक घातक ट्यूमर अन्य प्रकार के ट्यूमर और बीमारियों से भिन्न होता है, जिसमें इसकी कोशिकाएं शरीर में स्वस्थ कोशिकाओं के समान होती हैं। इसलिए, वैज्ञानिकों को एक मुश्किल काम का सामना करना पड़ता है: कोशिकाओं के बीच अंतर करना और केवल संक्रमित लोगों को नष्ट करना। कहानी के दौरान, डॉक्टरों को यह करने के लिए अलग-अलग विचार थे। आज,
एटलस बात करेगा कि ऑन्कोलॉजी कैसे विकसित हुई और आज कैंसर का इलाज कैसे किया जाता है।
 दृष्टांत: माइकल कोवाल्स्की
दृष्टांत: माइकल कोवाल्स्कीहिप्पोक्रेटिक हास्य सिद्धांत
18 वीं शताब्दी तक, ऑन्कोलॉजिकल रोगों का अध्ययन करना मुश्किल था: उपयुक्त उपकरण अभी तक आविष्कार नहीं किए गए थे, चर्च ने शव परीक्षा को मना किया था, और प्लेग और चेचक ने अधिक जीवन का दावा किया और ध्यान आकर्षित किया। इसलिए, प्राचीन काल से, घातक ट्यूमर के कुछ रिकॉर्ड हमारे पास पहुंच गए हैं, लेकिन फिर भी वे हैं।

कैंसर का पहला उल्लेख एडविन स्मिथ के पेपिरस में पाया गया है - प्राचीन मिस्र का चिकित्सा पाठ, जो ईसा पूर्व 16 वीं शताब्दी का है। इस
पेपिरस को देखा और पढ़ा जा सकता है। केस नंबर 45 घातक ट्यूमर का वर्णन करता है। यह भी ध्यान देता है कि कोई उपचार विधि नहीं है।
हिप्पोक्रेट्स (400 ईसा पूर्व) सौम्य और घातक ट्यूमर के बीच अंतर करने वाला पहला था। उनका मानना था कि मानव शरीर में चार हास्य, या तरल पदार्थ होते हैं - रक्त, बलगम, पीले और काले पित्त - और किसी भी असंतुलन से बीमारी होती है। यह माना जाता था कि घातक ट्यूमर का कारण एक निश्चित स्थान पर काली पित्त का जमा होना था। हिप्पोक्रेट्स ने कहा कि उपचार के बिना, रोगी अधिक समय तक जीवित रह सकते हैं: काले पित्त पहले ही पूरे शरीर में फैल चुके हैं और उन्हें हटाया नहीं जा सकता है।
बेशक, मानव शरीर में कोई काली पित्त नहीं है, लेकिन पूरे शरीर में ट्यूमर के प्रसार का विचार सही था। घातक कोशिकाएं अंततः ट्यूमर से अलग हो जाती हैं और मेटास्टेस देती हैं।
डॉक्टरों और उपचारकर्ताओं ने 1300 वर्षों से हास्य सिद्धांत का उपयोग किया है। इस अवधि के दौरान, धार्मिक कारणों से ऑटोप्सी पर प्रतिबंध लगा दिया गया, जिसने ट्यूमर के अध्ययन को सीमित कर दिया। प्राचीन काल और मध्य युग में उपलब्ध उपचार सर्जरी, मोक्सीबस्टन, रक्तपात और अनुष्ठान थे।
पहली सर्जरी
सर्जरी चिकित्सा की सबसे पुरानी शाखाओं में से एक है। हालांकि, मध्यकाल में, रक्त के बड़े नुकसान, सर्जरी के बाद संक्रमण का एक उच्च जोखिम, और एंटीसेप्टिक्स की अनुपस्थिति के कारण हस्तक्षेपों ने हमेशा वांछित परिणाम नहीं दिए।
Galenरोमन चिकित्सक गैलेन (130-200 वर्ष ईस्वी) ने प्रारंभिक अवस्था में स्तन कैंसर के शल्य चिकित्सा उपचार के बारे में लिखा था, लेकिन इस पद्धति को बड़े और "छिपे हुए" ट्यूमर के इलाज के लिए प्रभावी नहीं माना। उन्होंने हास्य सिद्धांत का पालन किया और सुझाव दिया कि काले पित्त को शरीर से पूरी तरह से हटाया नहीं जा सकता है। इस दृष्टिकोण ने कई लोगों के जीवन को बचाया: मध्य युग में, रोगियों की अक्सर सर्जरी के दौरान या उसके बाद जटिलताओं के कारण मृत्यु हो जाती थी।
हास्य सिद्धांत को रद्द करना16 वीं शताब्दी में शव परीक्षा पर प्रतिबंध हटाने के बाद, एंड्रियास वेसालियस ने मानव शरीर के लिए पहला शारीरिक गाइड संकलित किया, और एक सदी बाद मैथ्यू बेली ने विभिन्न विकृतियों की संरचना का वर्णन किया। हास्य सिद्धांत को संशोधित करना पड़ा, क्योंकि वैज्ञानिकों को कोई काला पित्त नहीं मिला।

17 वीं शताब्दी में, ट्यूमर को हटाने के लिए शल्य चिकित्सा पद्धतियों का विकास शुरू हुआ। स्तन कैंसर को दूर करने के लिए एक ऑपरेशन के दौरान जर्मन सर्जन विल्हेम फेब्री ने बढ़े हुए लिम्फ नोड्स के साथ एक ट्यूमर को उकसाया, और डच सर्जन एड्रियन हेल्वेटियस ने स्तन को पूरी तरह से हटाने के लिए एक मास्टेक्टॉमी किया। कुछ साल बाद, उन्होंने एक मामले के बारे में लिखा: “तब से, रोगी पूरी तरह से ठीक हो गया है। दर्द पूरी तरह से बंद हो गया, निशान ठीक हो गए, और वह स्वास्थ्य की उसी स्थिति का आनंद लेती है जो कैंसर से पहले थी। ”
1850 के दशक में, जर्मन वैज्ञानिक रुडोल्फ विरचो ने ट्यूमर में अनियंत्रित कोशिका विभाजन की खोज की। उन्होंने इस घटना को नियोप्लासिया कहा, और उनका मुख्य कार्य, सेलुलर पैथोलॉजी, कैंसर के कारणों को समझने का आधार बन गया।
संज्ञाहरण और एंटीसेप्टिक1846 में, संज्ञाहरण का आविष्कार किया गया था। इससे दर्द की समस्या हल हो गई, क्योंकि इससे पहले लोगों के दिमाग में सर्जरी करनी पड़ती थी। और 1867 में, फ्रांसीसी डॉक्टर जोसेफ लिस्टर ने पाया कि कार्बोलिक एसिड मरहम एक एंटीसेप्टिक के रूप में काम करता है और सर्जरी के बाद घावों को ठीक करने में मदद करता है।
एनेस्थेसिया और पहले एंटीसेप्टिक ने सर्जरी की संभावनाओं का विस्तार किया है, और हर जगह ऑपरेशन किए जाने लगे। हालांकि, कुछ मामलों में, ट्यूमर फिर से प्रकट हुआ। फिर सर्जनों ने हस्तक्षेप की मात्रा का विस्तार करना शुरू कर दिया, जिससे अंततः कट्टरपंथी सर्जरी की एक विधि का उदय हुआ।
रेडिकल सर्जरीसर्जन विलियम हालस्टेड ने सोचा था कि सर्जरी के दौरान जितना अधिक ऊतक हटाया जाएगा, उतना कम होगा कि वह रिलैप्स हो जाए। निष्कर्ष पूरी तरह से सही नहीं है, क्योंकि घातक कोशिकाएं पूरे शरीर में भी फैल सकती हैं और सर्जरी से पहले अन्य ऊतकों को मेटास्टेसाइज कर सकती हैं।

केवल 1970 के दशक में नैदानिक परीक्षणों के दौरान यह साबित हुआ कि कम व्यापक संचालन उतना ही प्रभावी है जितना कि कट्टरपंथी। दुर्भाग्य से, इस समय तक, कट्टरपंथी मास्टेक्टॉमी ने बहुत लोकप्रियता हासिल की और स्तन कैंसर के इलाज के लगभग एकमात्र सही तरीका माना गया।
आधुनिकता1990 के दशक में, सर्जनों ने स्वस्थ मानव ऊतक में हस्तक्षेप को कम किया। आज, संचालन दो प्रकारों में विभाजित हैं: खुले और न्यूनतम इनवेसिव। ओपन सर्जरी के लिए, डॉक्टर ट्यूमर, अस्वस्थ ऊतकों और संभवतः लिम्फ नोड्स को हटाने के लिए एक बड़ा चीरा बनाता है।
न्यूनतम इनवेसिव ऑपरेशन करने के लिए, डॉक्टर कई छोटे चीरों का निर्माण करता है, एक कैमरा (लैप्रोस्कोप) के साथ एक पतली ट्यूब का उपयोग करके ट्यूमर का पता लगाता है, और उपकरणों के साथ एक और चीरा के माध्यम से ट्यूमर को हटाता है। इस ऑपरेशन के बाद, रोगी तेजी से ठीक हो जाता है।
विकिरण चिकित्सा
19 वीं शताब्दी के अंत में, वैज्ञानिकों ने घातक कोशिकाओं को मारने के लिए एक्स-रे की क्षमता पर ध्यान आकर्षित किया। तब किसी को भी अंदाजा नहीं था कि विनाशकारी विकिरण स्वस्थ ऊतक को कैसे प्रभावित करता है।
एक्स-रे ट्यूबएक्स-रे की खोज 1895 में की गई थी, साथ ही साथ कट्टरपंथी सर्जरी के विकास के लिए। एक साल बाद, एक युवा डॉक्टर एमिल ग्रुबे ने देखा कि विकिरण स्रोतों के साथ काम करने वाले लोगों की त्वचा और नाखून कैसे नष्ट हो गए। उन्होंने सुझाव दिया कि किरणें ट्यूमर कोशिकाओं को भी मारती हैं, और ऑन्कोलॉजी के उपचार के लिए विकिरण चिकित्सा का उपयोग करने वाली पहली थी।
इस पद्धति ने तेज़ी से लोकप्रियता हासिल की: यूरोप और संयुक्त राज्य अमेरिका ने विकिरण चिकित्सा की पेशकश करने वाले नए क्लीनिक खोले। यह उन मामलों में प्रभावी था जहां ट्यूमर को अन्य अंगों में फैलने का समय नहीं था।
विकिरण का उपयोग करने का विचार बहुत अच्छा था, लेकिन इसने एक्स-रे ट्यूब के दो महत्वपूर्ण नुकसानों को ध्यान में नहीं रखा: एक अमानवीय विकिरण प्रवाह और अपर्याप्त मर्मज्ञ शक्ति। अधिकांश खुराक अन्य ऊतकों द्वारा अवशोषित या बिखरे हुए हैं। इस प्रकार, एक्स-रे स्वस्थ कोशिकाओं में उत्परिवर्तन की संख्या में वृद्धि करते हैं, जो नए ट्यूमर के गठन की ओर जाता है। इस विकल्प को एक उपयुक्त उपचार नहीं माना जा सकता है।
रेडियम1902 में, वैज्ञानिकों पियरे और मैरी क्यूरी ने रेडियम के रेडियोधर्मी गुणों की खोज की। पहली नज़र में, यह पदार्थ एक्स-रे की तुलना में अधिक गहरा हो गया और उपचार के अधिक अवसर प्रदान किए। रेडियम की खोज के 10 वर्षों के बाद से, कई डॉक्टरों और वैज्ञानिकों को जो जोखिम के खतरों से अवगत नहीं हैं, उन्होंने विभिन्न घातक बीमारियों का विकास किया है। यह तब तक जारी रहा जब तक कि रेडियोधर्मी विकिरण को मापने के लिए पहले डॉसमीटर और मानक दिखाई नहीं दिए।
इलेक्ट्रॉन त्वरक और रेडियोधर्मी कोबाल्ट1940 में, डोनाल्ड केर्स्ट ने एक बिट्रॉन, एक चक्रीय इलेक्ट्रॉन त्वरक को इकट्ठा किया। डिवाइस उच्च ऊर्जा और मर्मज्ञ क्षमता वाले कणों का उत्सर्जन करता है, इसलिए जब इसका उपयोग किया जाता है तो कुछ बिखरी हुई किरणें होती हैं। 1951 में स्वीडिश न्यूरोसर्जन लार्स लेसेल ने गामा नाइफ का विकास किया। इसमें रेडियोधर्मी कोबाल्ट के विकिरण के कई स्रोत हैं और उच्च ऊर्जा का एक समान बीम देता है। आज ट्यूमर का इलाज करने के लिए बेटट्रॉन और गामा चाकू का सफलतापूर्वक उपयोग किया जाता है।

विकिरण सीधे या परोक्ष रूप से कोशिकाओं के डीएनए को नष्ट कर देता है। दूसरे मामले में, कोशिकाओं में निहित पानी मुक्त कणों - चार्ज कणों में बदल जाता है जो डीएनए को नुकसान पहुंचाते हैं। विकिरण समझ में नहीं आता है कि कौन से कोशिकाएं नष्ट, स्वस्थ या घातक हैं, इसलिए, उपकरणों को सावधानीपूर्वक समायोजन की आवश्यकता होती है ताकि खुराक चोटी वांछित गहराई पर गिर जाए।
आधुनिकताआज ऑन्कोलॉजी में एक्स-रे, गामा किरणों और आवेशित कणों का उपयोग किया जाता है। वे शरीर में प्रवेश कर सकते हैं और एक विशेष उपकरण के माध्यम से घातक कोशिकाओं पर कार्य कर सकते हैं या ट्यूमर (ब्रैकीथेरेपी) के बगल में रोगी के शरीर में रखी रेडियोधर्मी सामग्री से आ सकते हैं।
तीसरे प्रकार की विकिरण चिकित्सा भी है - प्रणालीगत। एक रोगी को रेडियोधर्मी तरल, जैसे आयोडीन के साथ इंजेक्ट किया जाता है, जो ट्यूमर कोशिकाओं को ढूंढता है और मारता है। लेकिन इस मामले में, आइसोटोप की सटीक मात्रा को ध्यान में रखना मुश्किल है जो शरीर अवशोषित करता है, और खुराक हानिकारक हो सकती है।
कीमोथेरपी
सर्जरी और विकिरण चिकित्सा का उपयोग ठोस ट्यूमर के इलाज के लिए किया जाता था जो हेमटोपोइएटिक प्रणाली की कोशिकाओं से विकसित नहीं होते हैं। किसी को नहीं पता था कि लिम्फोमा और ल्यूकेमिया का इलाज कैसे किया जाता है।
मस्टर्ड गैसइन रोगों के इलाज के लिए विषाक्त पदार्थों का उपयोग करने का विचार प्रथम विश्व युद्ध के बाद उत्पन्न हुआ। उस समय, मस्टर्ड गैस, मस्टर्ड गैस को रासायनिक हथियार के रूप में इस्तेमाल किया जाता था। उन्होंने त्वचा और श्लेष्म झिल्ली को जला दिया, और सफेद रक्त कोशिकाओं को भी मार दिया: वे घायल में व्यावहारिक रूप से अनुपस्थित थे।
वैज्ञानिकों ने सोचा कि अगर सरसों की गैस लिम्फोमा का इलाज कर सकती है, तो लसीका ऊतक का एक ट्यूमर। इस बीमारी के साथ, लिम्फोसाइट्स अनियंत्रित रूप से विभाजित होते हैं और लिम्फ नोड्स और अन्य अंगों के कामकाज को बाधित करते हैं, इसलिए लिम्फोसाइटों की कमी सही निर्णय लगती थी। 1942 में, जानवरों के अध्ययन के बाद, लिम्फोमा के साथ एक मरीज को सरसों गैस की 10 खुराक दी गई। लिम्फोसाइटों की संख्या तेजी से गिर गई, और ट्यूमर कम हो गया, लेकिन बाद में फिर से बढ़ने लगा। इसका मतलब यह था कि चिकित्सा ने काम किया, लेकिन खुराक पूरी तरह से ठीक होने के लिए पर्याप्त नहीं थी।
विस्मरण इसलिए हुआ क्योंकि सरसों गैस को एल्केलेटिंग एजेंटों के समूह में शामिल किया गया था जो कोशिकाओं के डीएनए को नष्ट करते हैं और उन्हें विभाजित होने से रोकते हैं। लेकिन फिर भी उनका कुछ पता नहीं चला।
 मेथोट्रेक्सेट अग्रदूत
मेथोट्रेक्सेट अग्रदूत1947 में, डॉक्टर सिडनी फ़र्बर ने दिखाया कि एक फोलिक एसिड व्युत्पन्न, अमेथोप्टेरिन, बच्चों में तीव्र ल्यूकेमिया के विकास को रोकता है, जो कि श्वेत रक्त कोशिकाओं के अनियंत्रित विभाजन की विशेषता है। यह दवा मेथोट्रेक्सेट का अग्रदूत था, जिसका आज भी उपयोग किया जाता है।
अमेथोप्टेरिन के साथ उपचार के एक कोर्स के बाद रोगियों के अस्थि मज्जा बायोप्सी के परिणाम सामान्य थे। कीमोथेरेपी ने 6 महीने तक के बच्चों के जीवन को लंबा कर दिया, लेकिन फिर बीमारी वापस आ गई। फार्बर ने अपनी सारी ताकत एक इलाज खोजने में लगा दी जो पूरी तरह से ल्यूकेमिया को ठीक कर सकता है। तब यह मानना मुश्किल था कि एक ही बार में कई विषाक्त पदार्थों का उपयोग करना आवश्यक था, और एक नहीं।
1950 में, गर्ट्रूड एलियन ने 6-मर्कैप्टोप्यूरिन (6-एमपी) दवा विकसित की, जिसे जल्दी से ल्यूकेमिया वाले बच्चों में उपयोग के लिए मंजूरी मिल गई। उनके बाद, डॉक्टरों ने फिर से एक छोटी सी छूट देखी।
संयोजन कीमोथेरेपीबाद में, यादृच्छिक क्लिनिकल परीक्षण किए गए, जिसके दौरान यह स्पष्ट हो गया कि एक प्रोलॉग्स के बजाय दो दवाओं के उपयोग से प्रमोशन होता है और प्रैग्नेंसी में सुधार होता है।
1956 में, डॉ। मिन चिउ ली ने नैदानिक रूप से पुष्टि की कि चार दवाओं के संयोजन ने गर्भवती महिलाओं में मेटास्टैटिक कोरियोकार्सिनोमा को ठीक कर दिया। नेशनल इंस्टीट्यूट ऑफ ऑन्कोलॉजी ने पहले इन कार्यों को रोगियों के आक्रामक और अनावश्यक उपचार के रूप में माना, और वैज्ञानिक को काम से निलंबित कर दिया गया। केवल बाद में यह स्पष्ट हो गया कि ली के उपचार के पूर्ण दौर से गुजरने वाली केवल वही महिलाएं बची हैं। यह कीमोथेरेपी के साथ पहला पूर्ण इलाज था।
सहायक रसायन चिकित्सा60 और 70 के दशक में, वैज्ञानिकों ने सर्जरी के बाद स्तन कैंसर के लिए अतिरिक्त उपचार के रूप में कीमोथेरेपी का उपयोग करने की कोशिश की। सर्जन नैदानिक परीक्षणों में जाने के लिए अनिच्छुक थे: कोई भी रोगियों में अतिरिक्त दुष्प्रभावों से निपटने के लिए नहीं चाहता था। लेकिन वे गलत थे।
वास्तव में, कोई भी ट्यूमर एक प्रणालीगत बीमारी है। सूक्ष्म कोशिकाओं के रूप में प्रारंभिक अवस्था में भी घातक कोशिकाएं पूरे शरीर में फैलती हैं। वे ट्यूमर को हटाने के बाद भी शरीर में रहते हैं, इसलिए स्थानीय उपचार के तरीके पर्याप्त नहीं हैं। दवा उपचार की मदद से रोग को व्यवस्थित रूप से प्रभावित करना आवश्यक है। उदाहरण के लिए, एडजुवेंट थेरेपी (सर्जरी के बाद कीमोथेरेपी) रिलेप्स और मृत्यु के जोखिम को कम कर सकती है।
कई अध्ययनों ने स्तन कैंसर और कोलोरेक्टल कैंसर के उपचार के लिए सहायक रसायन चिकित्सा के लाभ को दिखाया है। इसके अलावा 1974 में, मेटास्टेटिक वृषण कैंसर के मामले में एक सकारात्मक प्रभाव साबित हुआ था और ठोस ट्यूमर के इलाज के लिए कीमोथेरेपी का उपयोग किया गया था।
कीमोथेरेपी ड्रग्स कोशिका विभाजन को धीमा और धीमा कर देती हैं। उपचार के दौरान, जो कोशिकाएं विभाजित होती हैं, वे जल्दी मर जाती हैं। ये न केवल घातक कोशिकाएं हैं, बल्कि स्वस्थ भी हैं, जो साइड इफेक्ट की ओर जाता है: बालों के झड़ने, मतली और संक्रमण के लिए संवेदनशीलता।
प्रतिरक्षा चिकित्सा
इम्यूनोथेरेपी कैंसर के उपचार का एक अपेक्षाकृत नया प्रकार है। यह दवाओं के उपयोग पर आधारित है जो रोगी की प्रतिरक्षा कोशिकाओं को प्रशिक्षित करती हैं। यह डीएनए की संरचना की खोज, प्रतिरक्षा प्रणाली के घातक कोशिकाओं और कोशिकाओं की विशेषताओं के अध्ययन के लिए संभव बनाया गया था।
कोली का टीका1891 में, विलियम कॉली ने नोट किया कि कैंसर के रोगियों को जिन्हें स्कार्लेट ज्वर या एरिथिपेलेटस बीमारी थी, को छूट मिली थी। उसके बाद, उन्होंने उन्नत कैंसर वाले रोगियों को स्ट्रेप्टोकोकल बैक्टीरिया का प्रशासन करना शुरू किया। ट्यूमर कम हो गया, लेकिन संक्रमण से रोगियों की मृत्यु हो गई। तब कोल्या ने वैक्सीन को गर्म किया और मरीज़ों को मृत स्ट्रेप्टोकोकी पेश किया।
उस समय के लिए परिणाम प्रभावशाली था: रोगियों को बरामद किया और कई वर्षों तक जीवित रहे। हालांकि, कोल्या वैक्सीन व्यापक नहीं है। वैज्ञानिक इस तंत्र की व्याख्या नहीं कर सके कि ट्यूमर पर बैक्टीरिया कैसे कार्य करते हैं, और संक्रमण का खतरा अधिक था। हर कोई कीमो और विकिरण चिकित्सा में अधिक रुचि रखता था।
1976 में, बीसीजी वैक्सीन, जिसका उपयोग तपेदिक को रोकने के लिए किया गया था, का उपयोग मूत्राशय के कैंसर के इलाज के लिए सफलतापूर्वक किया गया था। यह प्रतिरक्षा प्रणाली को सक्रिय करता है और शरीर को इस प्रकार के कैंसर से लड़ने में मदद करता है।
मोनोक्लोनल एंटीबॉडी1975 में, जार्ज कोलेर और सीजर मिलस्टीन ने एक ट्यूमर सेल और लिम्फोसाइट के सेल हाइब्रिड उत्पादन के लिए एक विधि पर एक लेख प्रकाशित किया। हाइब्रिडोमा तकनीक से कुछ ऊतकों के ट्यूमर की एंटीजन विशेषताओं का पता लगाने, उन्हें एंटीबॉडी प्राप्त करने और ट्यूमर के निदान और टाइपिंग के लिए उनका उपयोग करने की अनुमति मिलती है। इस तरह के एंटीबॉडी को मोनोक्लोनल कहा जाता है: वे प्रतिरक्षा क्लोन कोशिकाओं द्वारा निर्मित होते हैं जो एक ही मूल कोशिका से आते हैं।
अन्य प्रकार के एंटीबॉडी कैंसर कोशिकाओं को लेबल करते हैं जिससे प्रतिरक्षा प्रणाली को खोजना और नष्ट करना आसान हो जाता है।
1990 के दशक के उत्तरार्ध में, FDA ने पहले चिकित्सीय मोनोक्लोनल एंटीबॉडीज, रीटक्सिमैब और ट्रैस्टुजुमाब को मंजूरी दी। पहला लिम्फोमा के इलाज के लिए है, और दूसरा स्तन कैंसर के लिए है।
2010 में, स्टीफन रोसेनबर्ग ने काइमरिक एंटीजन रिसेप्टर थेरेपी की सफलता की घोषणा की। यह एक घातक ट्यूमर के उपचार के लिए रोगी की टी कोशिकाओं के आनुवंशिक संशोधन पर आधारित है।
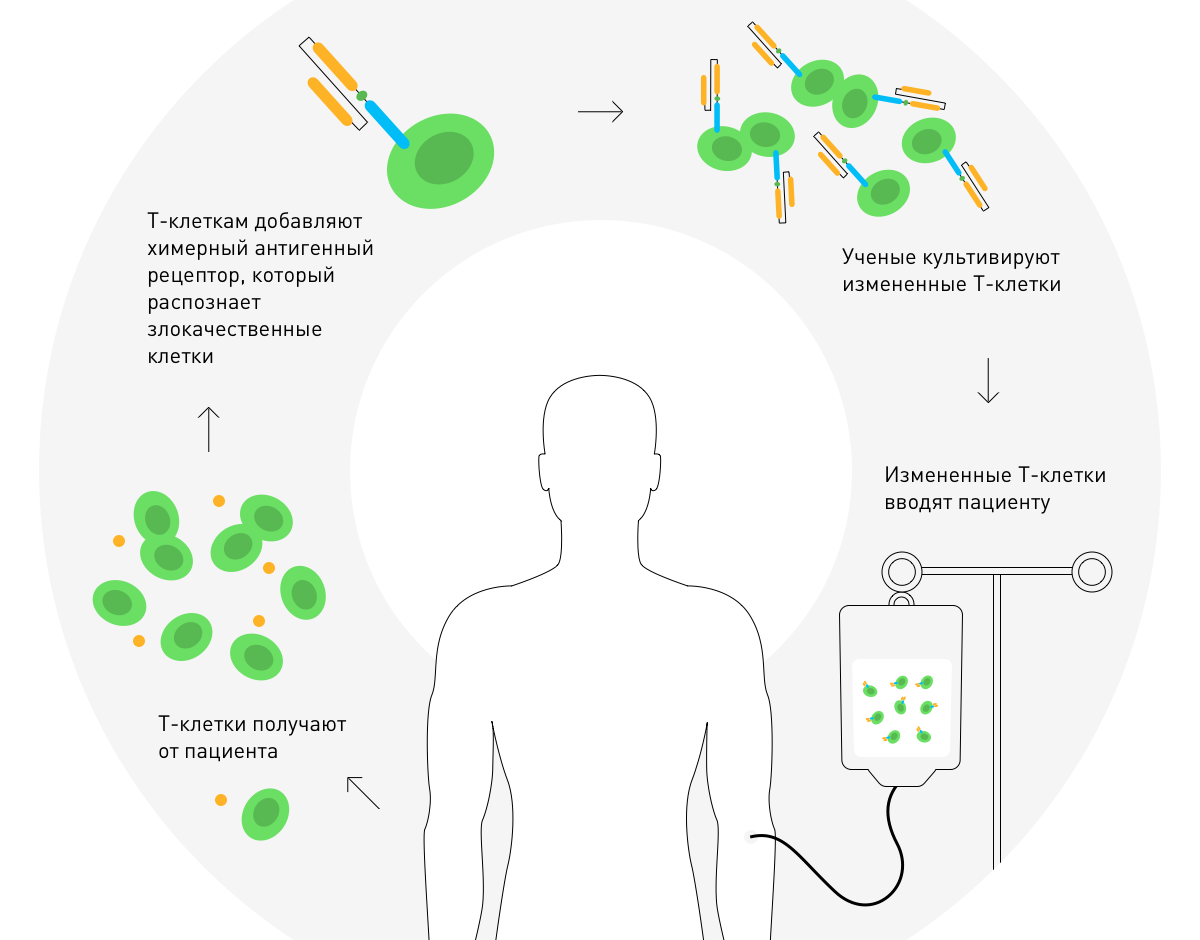 साइटोकिन्स
साइटोकिन्सइम्यूनोथेरेपी का एक अन्य तरीका साइटोकिन्स की मांसपेशियों या शिराओं में परिचय है, जैविक रूप से सक्रिय प्रोटीन जो प्रतिरक्षा प्रतिक्रिया को नियंत्रित करते हैं। इंटरल्यूकिन -2 प्रतिरक्षा प्रणाली की कोशिकाओं को तेजी से विभाजित करने में मदद करता है, और इंटरफेरॉन - वायरल संक्रमण और घातक ट्यूमर से लड़ने के लिए।
नियंत्रण अंकएक और आशाजनक क्षेत्र प्रतिरक्षा नियंत्रण बिंदुओं पर प्रभाव है, जो प्रतिरक्षा प्रणाली की प्रतिक्रिया को दबाता है। वैज्ञानिकों ने टी कोशिकाओं पर नियंत्रण बिंदुओं को अवरुद्ध करना सीखा है, जो प्रतिरक्षा प्रणाली को घातक कोशिकाओं को पहचानने और उन पर हमला करने में मदद करता है। इस पद्धति को कैंसर के उपचार के लिए FDA द्वारा पहले ही अनुमोदित किया जा चुका है।
आणविक निदान का उपयोग करके इष्टतम उपचार का चयन किया जा सकता है। वैज्ञानिकों ने रोगी की सर्जिकल सामग्री या बायोप्सी की जांच की, जो प्रोटो-ऑनकोजीन और दमन जीन में उत्परिवर्तन की पहचान करती है। म्यूटेशन का सेट प्रत्येक ट्यूमर के लिए अलग-अलग है, इसलिए उपचार व्यक्तिगत होना चाहिए। अगली बार,
एटलस आणविक निदान के बारे में विस्तार से बात करेंगे।