पिछले दशकों में, विज्ञान ने कैंसर के उपचार में महत्वपूर्ण प्रगति की है, और यद्यपि हम अभी भी इस भयानक बीमारी को पूरी तरह से दूर करने से दूर हैं, डॉक्टरों के पास ट्यूमर को नष्ट करने या उनके विकास को सीमित करने के लिए अधिक से अधिक उपकरण हैं। मुख्य बात यह है कि वे कैंसर रोगियों को लंबे समय तक जीने का अवसर देते हैं।
ऐसे उपकरणों में से एक कैंसर कोशिकाओं से लड़ने के लिए किसी व्यक्ति की अपनी प्रतिरक्षा के सक्रियण है। इसके लिए एक संपूर्ण क्षेत्र समर्पित है - इम्यूनो-ऑन्कोलॉजी। इस पर बहुत ध्यान केंद्रित किया जाता है, यह इस क्षेत्र में है कि आज सबसे अधिक शोध किया जाता है और सबसे आशाजनक दवाओं का विकास किया जा रहा है।
हम
मेडिसिन में 24/7 सक्रिय रूप से इम्यूनोथेरेपी का उपयोग करते हैं - और हम देखते हैं कि यह अच्छे परिणाम देता है। सच है, हम इस तथ्य के साथ सामना कर रहे हैं कि कई रोगियों को उपचार के इस तरीके के बारे में बिल्कुल भी नहीं पता है या इसे अभी तक अपर्याप्त रूप से अध्ययन किया गया है और विश्वसनीय नहीं है।
इस प्रकाशन में, हम प्रश्नों को स्पष्ट करने की कोशिश करेंगे: इम्यूनोथेरेपी क्या है, यह कैसे काम करता है और कौन मदद कर सकता है।
 जूडी पर्किन्स। उसे टर्मिनल स्तन कैंसर था जो पूरी तरह से नवीनतम इम्यूनोथेरेपी पद्धति से ठीक हो गया था।छिपा हुआ खतरा। कैंसर कैसे होता है
जूडी पर्किन्स। उसे टर्मिनल स्तन कैंसर था जो पूरी तरह से नवीनतम इम्यूनोथेरेपी पद्धति से ठीक हो गया था।छिपा हुआ खतरा। कैंसर कैसे होता हैकैंसर कोशिका उत्परिवर्ती विद्रोही हैं जो सिस्टम को पछाड़ने में कामयाब रहे हैं।
जीवन की प्रक्रिया में, शरीर की सभी कोशिकाएं विकास के कड़ाई से परिभाषित चरणों से गुजरती हैं, निर्दिष्ट कार्य करती हैं, सख्त नियमों के अनुसार गुणा करती हैं, और अंत में वृद्ध हो जाती हैं और मर जाती हैं। यह एक प्राकृतिक प्रक्रिया है। पुरानी कोशिकाओं की क्रमबद्ध मृत्यु जिसने बहुत अधिक क्षति जमा की है, एपोप्टोसिस कहलाती है।
हालांकि, आनुवंशिकता या प्रतिकूल बाहरी कारकों के प्रभाव में, कुछ कोशिकाएं आनुवंशिक त्रुटियों और "विद्रोही" को जमा करती हैं: वे प्रकृति द्वारा निर्धारित एल्गोरिदम के अनुसार रहने से इनकार करते हैं, अनियंत्रित रूप से गुणा करना शुरू करते हैं या समय पर मर नहीं जाते हैं। यह असामान्य नहीं है। संभावित रूप से, कैंसर कोशिकाएं समय-समय पर प्रत्येक में दिखाई दे सकती हैं - यह सामान्य है। लगभग हमेशा ऐसे "अपस्टार्ट" शरीर की आंतरिक सुरक्षा सेवा -
प्रतिरक्षा द्वारा मारे जाते हैं।
इस प्रक्रिया में मुख्य भूमिकाओं में से एक टी-लिम्फोसाइट्स द्वारा निभाई जाती है, या, अधिक सरलता से,
टी-कोशिकाएं । वे एक
एंटीजन (शरीर के लिए एक पदार्थ
) का जवाब देते हैं, संभावित दुश्मनों को पहचानते हैं और नष्ट करते हैं: उदाहरण के लिए, रोगाणुओं या अनुचित दाता सामग्री। आम तौर पर, टी-लिम्फोसाइट्स शरीर की कोशिकाओं को भी मारते हैं, जो नियमों के अनुसार नहीं बदलना और व्यवहार करना शुरू कर देते हैं। इसलिए, कैंसर हर किसी में नहीं होता है - बहुमत में, प्रतिरक्षा फैलने से पहले विकारों का सामना करती है।
लेकिन कैंसर जीवित रहना चाहता है और ट्यूमर कोशिकाएं अधिक से अधिक संसाधनों को पकड़ने की कोशिश कर रही हैं, ताकि "अधिक सफल" बन सकें। वे तेजी से गुणा करते हैं, संवहनी विकास कारक (ट्यूमर को अधिक रक्त और पोषक तत्वों को आकर्षित करने के लिए) का स्राव करते हैं, दवाओं के प्रतिरोध को विकसित करते हैं, ट्यूमर के ऊतकों के विकास को बढ़ाने के लिए स्टेम सेल (पुनर्जनन के लिए एक अनुरोध के साथ भ्रामक संकेत भेजते हैं)।
कैंसर कोशिकाएं भेस में विशेष सफलता प्राप्त करती हैं: उनमें से कुछ अपनी सतह से विशेष एंटीजन प्रोटीन निकालते हैं जिससे टी कोशिकाएं उन्हें पहचान सकती हैं। अन्य लोग विशेष अणुओं का स्राव करते हैं जो प्रतिरक्षा प्रणाली को दबाते हैं, और कुछ मैक्रोफेज (प्रतिरक्षा कोशिकाओं के प्रकारों में से एक) के साथ संकर भी बनाते हैं - और सचमुच सुपरपॉवर बन जाते हैं!
एक ओर, शरीर की सामान्य कोशिकाओं के साथ रिश्तेदारी उन्हें इस में मदद करती है - एक प्रकार का जन्मजात भेस। दूसरी ओर, कैंसर कोशिकाओं की आनुवंशिक परिवर्तनशीलता उन्हें अनुकूलन क्षमता में वृद्धि देती है। सेल के डीएनए में उसके उत्परिवर्तन (अशिष्टता में रूपांतरण) के समय जितना अधिक म्यूटेशन जमा हुआ है, उतनी ही अधिक संभावना है कि वह प्रतिरक्षा प्रतिक्रिया से बच सके और एक सफल कैप्चर प्लान विकसित कर सके।
शक्ति का जागरण। नोबेल खोजों का इतिहासमानव प्रतिरक्षा वास्तव में निर्दयी हत्यारों की एक वास्तविक सेना है, और प्रत्येक "लड़ाकू ऑपरेशन" के बाद एक और दुश्मन को बेअसर करने के लिए, उन्हें फिर से आश्वस्त किया जाना चाहिए और एक सैन्य से एक शांतिपूर्ण स्थिति में स्थानांतरित किया जाना चाहिए। यह तंत्र तापमान को सामान्य मानों तक कम कर देता है और खतरे से गुजरने पर सूजन को रोकता है और संक्रमण को हरा दिया गया है।
2018 में, फिजियोलॉजी या मेडिसिन में नोबेल पुरस्कार अमेरिकी जेम्स एलिसन और जापानी त्सुक होन्जो को उसी क्षेत्र में उनकी स्वतंत्र खोजों के लिए प्रदान किया गया था: यह बिल्कुल आक्रामक से शांत मोड में कैसे स्विच होता है।
पहले वैज्ञानिकों में से कोई भी कैंसर के इलाज के बारे में नहीं सोचता था। वे दोनों एक स्पष्ट समझ चाहते थे कि प्रतिरक्षा प्रतिक्रिया कैसे काम करती है। उस समय तक, यह स्पष्ट था कि टी-कोशिकाओं की सतह पर और एंटीजन-प्रेजेंटिंग कोशिकाओं (
एपीसी ) की सतह पर रिसेप्टर अणु होते हैं जो एक दूसरे पर कार्य करते हैं, प्रतिरक्षा प्रणाली को भड़काने या धीमा करते हैं।
टीसीआर की खोज की गई थी
- एक टी-सेल रिसेप्टर जिसके द्वारा टी सेल एपीसी में "दुश्मन" प्रोटीन को पहचानते हैं।
हमें मुख्य हिस्टोकोम्पैटिबिलिटी कॉम्प्लेक्स एमएचसी (मेजर हिस्टोकंपैटिबिलिटी कॉम्प्लेक्स) मिला, जिसकी मदद से एपीसी टी कोशिकाओं की पहचान के लिए विदेशी प्रोटीन के टुकड़े पेश करते हैं। इस परिदृश्य की खोज के लिए पीटर डोहर्टी और रॉल्फ ज़िन्करनगेल ने अपना नोबेल पुरस्कार प्राप्त किया।
वैज्ञानिकों ने समझा कि टी कोशिकाओं की सतह पर रिसेप्टर्स एपीसी की सतह पर सह-उत्तेजक पदार्थों के साथ मिलकर काम करते हैं। टी कोशिकाओं की सतह से प्रोटीन
CD28 को
1980 में वापस अलग कर दिया गया
था , जल्द ही APC की सतह पर B7 अणु पाया गया। प्रयोगों के दौरान, एलिसन समूह के शोधकर्ताओं ने
बी 7 जीन को कैंसर कोशिकाओं में स्थानांतरित कर दिया, और उन्हें स्वस्थ ऊतक द्वारा अस्वीकार कर दिया गया। यह पता चला कि बी -7 टी-सेल पर सीडी 28 से बांधता है, और इस तरह अपना काम शुरू करता है: टी-सेल ट्यूमर सेल को नष्ट कर देता है, जिसकी सतह पर बी 7 प्रोटीन "बाहर चिपक जाता है"।
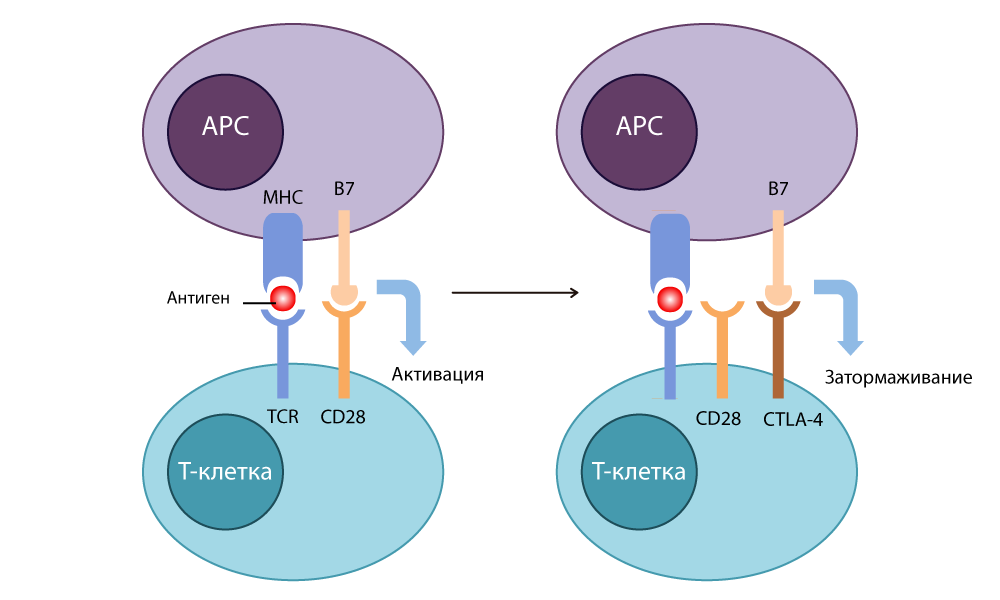
1987 में , एलिसन ने
साइटोटॉक्सिक टी-लिम्फोसाइट एंटीजन -4 CTLA-4 (साइटोटॉक्सिक टी-लिम्फोसाइट-जुड़े एंटीजन -4) की खोज की - और पाया कि इस प्रोटीन की संरचना लंबे समय से ज्ञात CD28 के समान है, और यह B7 से भी बंधने में सक्षम है - हालाँकि, यह बिल्कुल विपरीत तरीके से काम करता है: यह प्रतिरक्षा प्रतिक्रिया को रोकता है।
 CTLA-4 कार्रवाई
CTLA-4 कार्रवाईसबसे पहले, डॉक्टर ऑटोइम्यून बीमारियों से लड़ने के लिए इस "ब्रेक" का उपयोग करने जा रहे थे (जब प्रतिरक्षा स्वस्थ शरीर की कोशिकाओं पर हमला करना शुरू करती है)। लेकिन एलीसन एक शानदार चीज के साथ आए: ब्रेक पर दबाव न डालें, लेकिन इसे बंद कर दें।
उन्होंने एक अवरोधक एंटीबॉडी (स्विच) विकसित किया जो CTLA-4 को बांधता है और इसे प्रतिरक्षा प्रतिक्रिया को बंद करने के लिए B7 के साथ बंद होने से रोकता है। सीडी 28 से बंधे बी 7 अणु, टी सेल सक्रिय हो गए और फिर से मारने के लिए तैयार थे। जब उन्होंने 1995 में कैंसर के साथ कैंसर के चूहों पर प्रयोग किए, तो यह स्पष्ट हो गया कि चालाक कैंसर कोशिकाएं भी ऐसे टी-लिम्फोसाइटों को बंद ब्रेक के साथ छिपा नहीं सकती थीं। 2010 में, आशाहीन रोगियों पर सफल अध्ययन किया गया है। कुछ रोगियों में, मेलेनोमा मेटास्टेस के साथ गायब हो गया - एक अविश्वसनीय परिणाम!
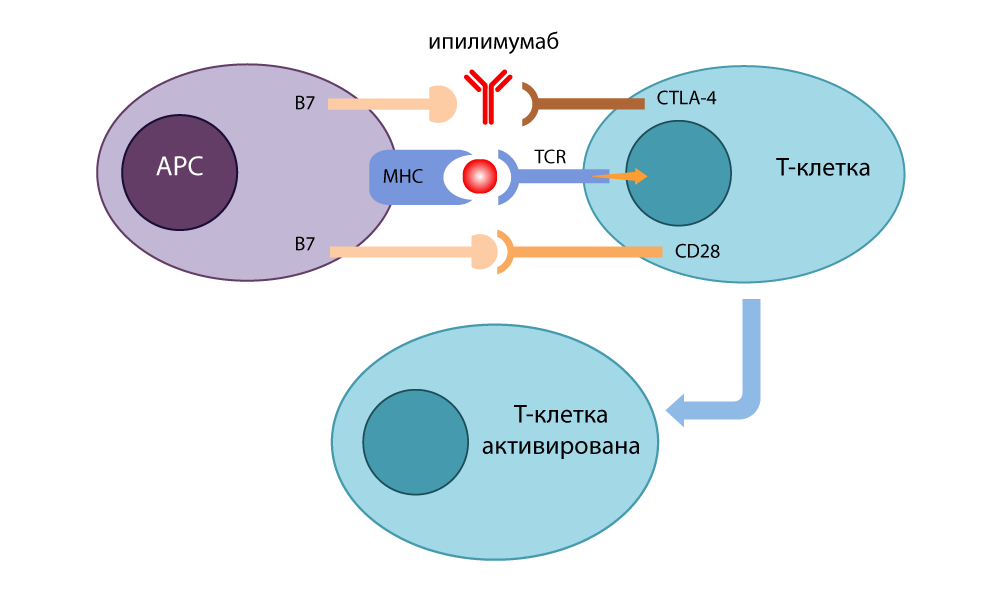 CTLA-4 अवरोधक की कार्रवाई - ipilimumab
CTLA-4 अवरोधक की कार्रवाई - ipilimumabउसी समय, क्योटो में,
तस्कु होनजो को टी सेल की सतह पर एक और रिसेप्टर अणु मिला:
पीडी -1 (प्रोग्राम्ड सेल डेथ प्रोटीन -1 , प्रोग्रामेबल सेल्युलर डेथ प्रोटीन -1)। प्रयोगों के दौरान (लंबे समय तक पीड़ित चूहों पर), जापानी ने पाया कि इस प्रोटीन को जीन एन्कोडिंग को अक्षम करने से चूहों में ऑटोइम्यून रोग के लक्षण भड़काते हैं - अर्थात, पीडी -1 निषेध ने टी-लिम्फोसाइटों के "ब्रेक" को भी बंद कर दिया और उन्हें आक्रामक और सक्रिय बना दिया।
होन्जो ने पाया कि पीडी -1 टी सेल को स्लीप मोड में डाल देता है जब यह एंटीजन-प्रेजेंटिंग सेल (APC) की सतह पर PD-L1 / PD-L2 प्रोटीन से बंध जाता है। पीडी -1 अवरोधक ने इस लिंक को खोला और टी कोशिकाओं को फिर से सक्रिय किया। इस "ब्रेक" की कार्रवाई CTLA-4 की कार्रवाई के समान थी, लेकिन इसने एक अलग मार्ग लिया।
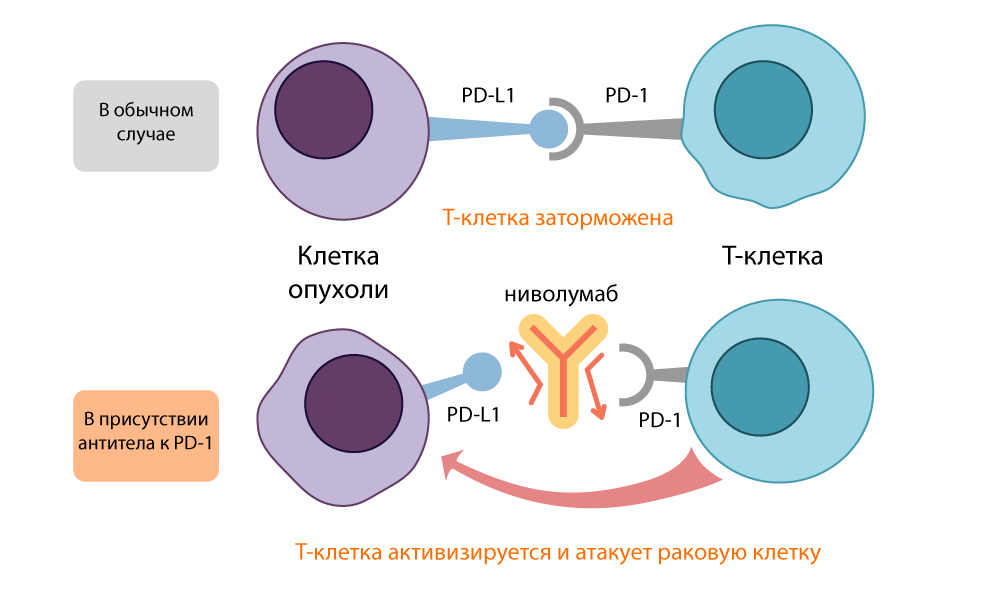 पीडी-एल 1 अवरोधक की क्रिया - निवोलुमब
पीडी-एल 1 अवरोधक की क्रिया - निवोलुमबदोनों खुले "निरोधात्मक" अणु, CTLA-4 और PD-1, को
प्रतिरक्षा नियंत्रण बिंदु (चौकियों) कहा जाता था - यह उनकी संख्या और गतिविधि है जो टी कोशिकाओं को निर्णय लेते हैं: शांत करते हैं या लड़ना शुरू करते हैं।
यह पता चला कि CTLA-4 ब्लॉकर्स सामान्य रूप से सभी टी कोशिकाओं में प्रतिरक्षा को सक्रिय करते हैं, और PD-1 अवरोधक ट्यूमर पर अधिक विशेष रूप से कार्य करता है, क्योंकि कई कैंसर कोशिकाएं "दूसरा पहेली टुकड़ा," PD-L1 / PD-L2 अणु ले जाती हैं। इस वजह से, पीडी -1 अवरोधकों के साथ उपचार जटिलताओं का कम जोखिम देता है।
प्रतिरक्षा वापस आ जाती है। चौकी अवरोधक क्या मदद करते हैंएलीसन और होन्जो ने न केवल शारीरिक प्रक्रियाओं की समझ के लिए एक गंभीर योगदान दिया, बल्कि लागू चिकित्सा में मौलिक रूप से नए व्यावहारिक अनुसंधान की एक लहर शुरू की।
प्रतिरक्षा नियंत्रण बिंदुओं (आईसीटी) के निषेध की खोज समाधान खोजने के लिए एक मौलिक रूप से नए क्षेत्र को खोलती है। इससे पहले, कैंसर का मुकाबला करने के तरीके: सर्जरी, विकिरण और कीमोथेरेपी - कैंसर के कोशिकाओं के विनाश पर, सीधे ट्यूमर पर ही लक्षित थे। अब डॉक्टरों के पास पूरी तरह से अलग दिशा में अनुसंधान के लिए एक विशाल क्षेत्र है: अपने वातावरण के साथ कैंसर कोशिकाओं की बातचीत को बदलना।
वैसे, यह मौलिक अंतर था जिसने डॉक्टरों को वास्तविक सफलता दी। अब तक, ट्यूमर अपने स्थान के आधार पर प्रभावित हुआ है। स्तन कैंसर के लिए, पेट के कैंसर के लिए एक दवा, एक पूरी तरह से अलग है। और 2017 में ICT अवरोध करनेवाला पेम्ब्रोलिज़ुमैब ऑन्कोलॉजी के इतिहास में पहली बार किसी भी अंग में किसी भी कैंसर के उपचार के लिए एक दवा के रूप में दर्ज किया गया था - अगर केवल परीक्षणों से पुष्टि होती है कि ट्यूमर की एक विशेष संपत्ति है: माइक्रोसैटेलाइट अस्थिरता। यही है, उसके डीएनए विशेष रूप से उत्परिवर्तन के लिए प्रवण हैं। पहले, कुछ सामान्य लक्षणों के लिए कैंसर का इलाज करना संभव नहीं था। यह एक बड़ी उपलब्धि है।
क्रांति कैंसर के सबसे आक्रामक प्रकारों के खिलाफ नई दवाओं के उपयोग के परिणाम थे: चरण IV में मेटास्टैटिक मेलेनोमा को असाध्य माना जाता था। और ऐसे निदान के साथ रोगियों को जो 2010 में दवा ipilimumab (CTLA-4 अवरोधक) के पाठ्यक्रम से गुजरना पड़ा - जीवन का एक अतिरिक्त वर्ष प्राप्त किया - ट्यूमर का विकास बंद हो गया। उनमें से 58% में, ट्यूमर एक तिहाई कम हो गया।
निवोलुमब (पीडी -1 अवरोधक) के साथ गैर-छोटे सेल फेफड़ों के कैंसर के उपचार में, रोगियों की मृत्यु का जोखिम 40% कम हो गया।
पेम्ब्रोलीज़ुमब (एक पीडी -1 अवरोधक) ने मेलेनोमा के लिए इलाज किए गए समूह में ट्यूमर के विकास में 43% की कमी देखी। 74% रोगी वर्ष के दौरान गिरावट के बिना रहते थे, 18 महीनों तक 71% थे। यह महत्वपूर्ण है कि दवा को निर्धारित करने के प्रभाव ने रोग के विकास के सभी चरणों में दुष्प्रभाव को प्रभावित किया।
आज, CTLA-4 और PD-1 इनहिबिटर मेलेनोमा का इलाज करते हैं (इनोप्लेबल सहित), नॉन-स्माल सेल लंग कैंसर, सिर और गर्दन का स्क्वैमस सेल कार्सिनोमा, रीनल सेल कार्सिनोमा, कुछ प्रकार के लिम्फोमा, मलाशय, मूत्राशय के कैंसर और ट्यूमर के साथ। माइक्रोसैटेलाइट अस्थिरता।
विशेष रूप से रुचि के अध्ययन हैं जो एंटी-पीडी -1 और एंटी-सीटीएलए -4 दवाओं के
साथ संयोजन चिकित्सा की प्रभावशीलता दिखाते हैं।
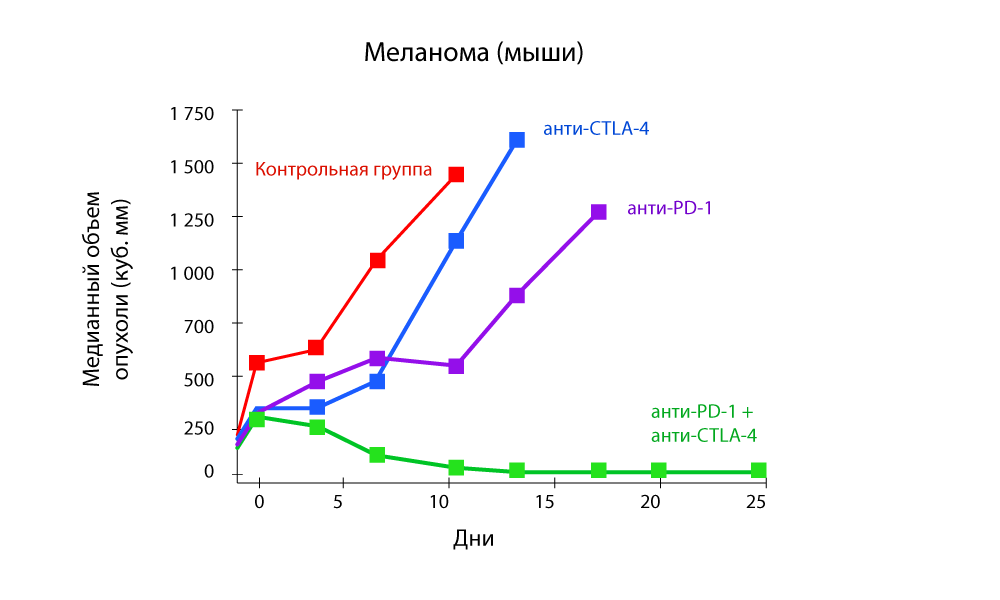 ट्यूमर की मात्रा में परिवर्तन - एंटी-पीडी -1 और एंटी-सीटीएलए -4 दवाओं के संयोजन के साथ एक तेज कमी
ट्यूमर की मात्रा में परिवर्तन - एंटी-पीडी -1 और एंटी-सीटीएलए -4 दवाओं के संयोजन के साथ एक तेज कमी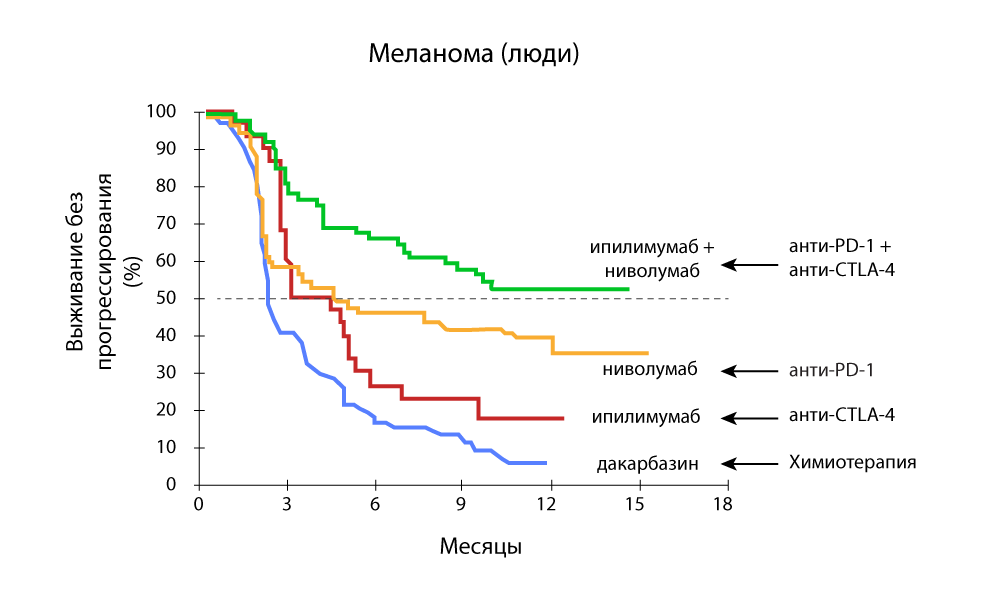 प्रगति-मुक्त अस्तित्व - एंटी-पीडी -1 और एंटी-सीटीएलए -4 दवाओं का संयोजन अधिक प्रभावी है
प्रगति-मुक्त अस्तित्व - एंटी-पीडी -1 और एंटी-सीटीएलए -4 दवाओं का संयोजन अधिक प्रभावी है24/7 मेडिसिन में, हम सफलतापूर्वक रूसी संघ में पंजीकृत होने के बाद से पेम्ब्रोलीज़ुमैब और निवोलुमाब का उपयोग कर रहे हैं। हमने सभी विदेशी अनुसंधानों का पालन किया और शस्त्रागार को फिर से भरने के लिए तत्पर थे।
क्लोन का हमला। आनुवंशिक रूप से संशोधित प्रतिरक्षाप्रतिरक्षा नियंत्रण बिंदु के अवरोधक सुर्खियों में रहने योग्य हैं, लेकिन यह तंत्र अभी भी सही नहीं है और किसी भी कैंसर का इलाज नहीं कर सकता है। यह अच्छा है कि इम्यूनोथेरेपी संबंधित अनुसंधान क्षेत्रों में सक्रिय रूप से विकसित हो रहे हैं। सबसे आशाजनक में से एक
सीएआर-टी थेरेपी है ।
विधि के नाम पर अक्षर T हमारी प्रतिरक्षा के सभी समान अपरिवर्तनीय T कोशिकाएं हैं। CAR (Chimeric antigen रिसेप्टर) एक Chimeric Antigen रिसेप्टर है। रिसेप्टर को काइमेरिक क्यों कहा जाता है? क्योंकि यह विभिन्न कोशिकाओं से लिए गए कई हिस्सों से इकट्ठा किया जाता है - आनुवंशिक इंजीनियरों के कौशल का उपयोग करके।
साधारण टी कोशिकाओं में एक विशिष्ट
TCR रिसेप्टर
(T-cell रिसेप्टर) होता है । वह अपने पथ में शरीर की सभी कोशिकाओं को "महसूस" करता है और, अगर यह कोशिका की सतह पर कुछ विदेशी अणु को महसूस करता है, तो टी-सेल को एक सक्रिय संकेत भेजता है। यह, बदले में, या तो अवांछित विदेशी के साथ ही व्यवहार करता है, या विशेष सक्रिय पदार्थ (साइटोकिन्स) जारी करता है और अन्य प्रतिरक्षा कोशिकाओं को "इसे छांटने" के लिए कहता है। टी कोशिकाओं को बहुत कुशलता से मारें।
सच है, बहुत सटीक नहीं है। एंटीजन हैं की तुलना में हमारे पास बहुत कम TCR प्रजातियां हैं। इसलिए, टी कोशिकाएं अपने टीसीआर द्वारा कई एंटीजन को पहचान सकती हैं, लेकिन केवल लगभग। कैंसर कोशिकाएं अक्सर हमारी सुरक्षा प्रणाली की इस कमजोरी का फायदा उठाती हैं और "अपना" होने का दिखावा करती हैं।
विकास ने उस समस्या को हल कर दिया जो सबसे अच्छी हो सकती है: मानव शरीर में अजनबियों की पहचान करने के लिए एक और तंत्र है:
एंटीबॉडी । ये विशेष प्रोटीन हैं जो प्रतिरक्षा कोशिकाओं के एक और वर्ग द्वारा स्रावित होते हैं: बी-लिम्फोसाइट्स। टी-कोशिकाओं के विपरीत बी-कोशिकाएं, प्रत्येक "क्लाइंट" के लिए एक अलग दृष्टिकोण रखती हैं।
एंटीबॉडी अक्षर Y के रूप में एक प्रोटीन संरचना है। इस "कांटे" के दोनों सिरों पर ऐसी जगहें हैं जो एंटीजन से बंधी हैं। ये खंड एंटीजन की प्रत्येक अगली पीढ़ी में एंटीजन के अधिक निकट फिट करने के लिए बदल सकते हैं - पहेली टुकड़ों के चयन की तरह। जब एक विदेशी प्रतिजन का पता लगाया जाता है, तो बी-कोशिकाएं अरबों एंटीबॉडी का स्राव करती हैं, जिनमें से एंटीजन के लिए सबसे सटीक मिलान के लिए चयन किया जाता है। परिणाम एक संदर्भ एंटीबॉडी है, "प्रशिक्षित" विशेष रूप से एक विशिष्ट "एलियन" - एंटीजन के बहुत सटीक मान्यता के लिए।
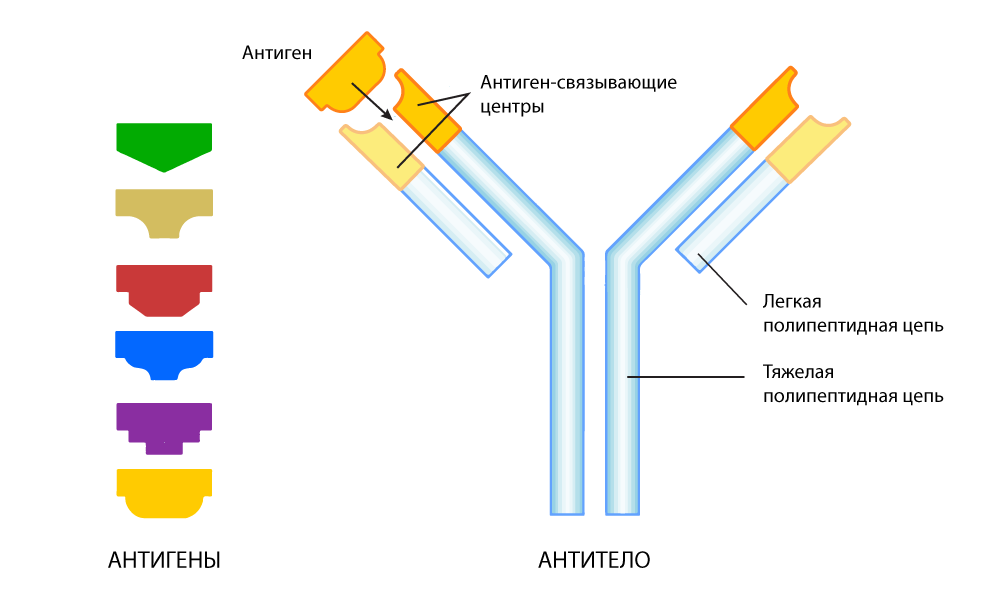 एक एंटीबॉडी एक विशिष्ट प्रतिजन खोजने के लिए अनुकूलित
एक एंटीबॉडी एक विशिष्ट प्रतिजन खोजने के लिए अनुकूलितहालांकि, पहचानने का मतलब हमेशा तटस्थ करना नहीं है। इसके साथ, एंटीबॉडीज में कठिनाइयां हैं - अपने दम पर वे "दुश्मन" से दूर कर सकते हैं, सभी मामलों में किसी भी तरह से नहीं।
इसलिए, 1989 में, एक इज़राइली रसायनज्ञ और प्रतिरक्षाविज्ञानी ज़ेलिग अशखर नेत्रहीन टी-कोशिकाओं की घातक शक्ति और एंटीबॉडी के लक्ष्य वाले स्नाइपर के संयोजन के
साथ आए । उन्होंने प्रोटीन एंटीबॉडी के टर्मिनल वर्गों को अलग कर दिया, जो कुछ कैंसर कोशिकाओं के प्रतिजन को कसकर बांधने में सक्षम हैं, और उन्हें टी-सेल में "प्रत्यारोपित" किया गया - उन्होंने एंटीजन की मान्यता के लिए जिम्मेदार TCR के हिस्से को बदल दिया।
इसके बाद, उन्होंने एक अमेरिकी सहयोगी, स्टीफन रोसेनबर्ग के साथ मिलकर काम करना शुरू किया, वे संवेदनशील और चयनात्मक दोनों तरह के काइमेरिक रिसेप्टर को अधिक कुशल डिजाइन बनाने में कामयाब रहे।
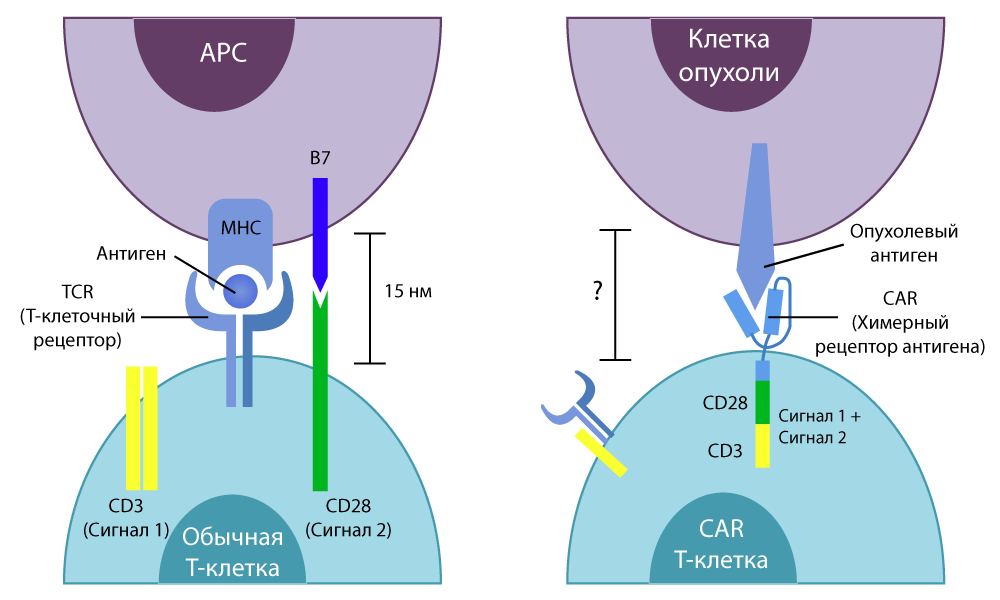 पारंपरिक टी कोशिकाओं और सीएआर-टी कोशिकाओं के बीच का अंतर
पारंपरिक टी कोशिकाओं और सीएआर-टी कोशिकाओं के बीच का अंतरइन विट्रो अध्ययनों में अच्छे परिणाम दिखाई दिए हैं। फिर वैज्ञानिकों ने फिर से चूहों का इलाज किया, फिर श्रमसाध्य रूप से तकनीक को मनुष्यों में स्थानांतरित कर दिया।
समय के साथ, CAR-T थेरेपी ने एक आधुनिक रूप दिया है।
- सबसे पहले, आणविक-आणविक परीक्षण की मदद से, मानव ट्यूमर कोशिकाओं में विशिष्ट उत्परिवर्तन निर्धारित किए जाते हैं, जिस पर एंटीबॉडी "ट्यून" हो सकते हैं।
- फिर एक व्यक्ति अपने स्वयं के टी कोशिकाओं को लेता है, बायोइन्जिनियरिंग विधियों का उपयोग करके बदलता है, टीसीआर "ट्रांसप्लांटिंग" कार के बजाय, पहचाने गए उत्परिवर्तन के अनुरूप होता है।
- फिर, संशोधित कार-टी कोशिकाओं को इन विट्रो में गुणा किया जाता है और मानव शरीर में वापस पेश किया जाता है, जहां वे कैंसर कोशिकाओं को सफलतापूर्वक पहचानते हैं और मारते हैं।
2010 में शुरू किए गए नैदानिक परीक्षणों में, उत्साहजनक परिणाम तुरंत प्राप्त हुए थे: लिम्फोमा के उपचार में, 13 में से 12 रोगियों में सुधार दिखा, और 4 ने छूट शुरू की। ल्यूकेमिया के उपचार में, 33 में से 17 लोगों में छूट हुई।
2018 में, अमेरिकन ऑन्कोलॉजिस्ट्स का
एक लेख नेचर मेडिसिन में छपा, जिसमें बताया गया कि दो साल से वे एक ऐसे मरीज को देख रहे हैं, जो सीएआर-टी थेरेपी के बाद पूरी तरह से स्वस्थ है। उसे मेटास्टेस के साथ मेटास्टेटिक स्तन कैंसर से ठीक किया गया था। कश्ती में उसकी यह तस्वीर लेख की शुरुआत में दी गई है: उपचार के बाद, वह काम पर लौट आई और शिविर में चली गई।
नई उम्मीद। क्या इम्यूनोथेरेपी एक रामबाण दवा होगी?अन्य कैंसर उपचारों की तरह, इम्यूनोथेरेपी की अपनी सीमाएं हैं। इस तथ्य के बावजूद कि कुछ मामलों में, रोगी प्रतिरक्षा नियंत्रण बिंदु अवरोधकों के साथ चिकित्सा के लिए एक बहुत अच्छी प्रतिक्रिया देते हैं, 60% मामलों में या तो अधिग्रहित या प्राथमिक प्रतिरोधक विरोधी PD-1 या विरोधी CTLA-4 दवाओं का विकास होता है: ट्यूमर बस प्रतिक्रिया नहीं करता है उपचार के लिए या जल्दी से आदत डाल लेता है और इसे "प्राप्त करना" सीखता है।
PD-1, PD-L1 / 2, CTLA-4, CD28 और B7 के अलावा, टी-कोशिकाओं और ट्यूमर कोशिकाओं की सतहों पर कई अन्य सह-रिसेप्टर हैं, जिनके प्रभाव का अभी तक अध्ययन नहीं किया गया है और साथ ही साथ नियंत्रण बिंदुओं के काम भी हैं, लेकिन वे भी प्रभावित करते हैं प्रतिरक्षा प्रतिक्रिया के लिए। काम के क्षेत्रों में से एक इन सह-रिसेप्टर्स पर प्रभाव है।
इसके अलावा, आईसीटी थेरेपी टीके, साइटोकिन्स, बीटा-ब्लॉकर्स की शुरूआत से पूरक है - और यह दृष्टिकोण
कुछ मामलों में भी अच्छी तरह से काम करता है।
सीएआर-टी थेरेपी अभी भी बहुत महंगी है और अभी भी केवल व्यावसायिक उपयोग के चरण में है: ईशर और रोसेनबर्ग के वैज्ञानिक समूहों में विकास चल रहा है, अन्य शोधकर्ता - प्रत्येक समूह विशेष प्रकार के कैंसर के खिलाफ निर्देशित कार्रवाई के साथ विशेष प्रकार के सीएआर-टी बनाता है। लेकिन अभी तक यह केवल शोध, परीक्षण और परीक्षण है। इससे पहले कि यह एक अच्छी तरह से स्थापित जन उपचार पद्धति में बदल जाए - लेकिन इसके बाद भी 100% गारंटी देना संभव नहीं होगा।
लेकिन जब वैज्ञानिक अनुसंधान कर रहे हैं, डॉक्टर उन उपलब्धियों का उपयोग करते हुए प्रायोगिक उपचार की शुरुआत कर रहे हैं जो पहले से मौजूद हैं। और सबसे अधिक ध्यान देने योग्य प्रभाव ऑन्कोलॉजी के क्लासिक "तीन स्तंभों" के साथ इम्यूनोथेरेपी का संयोजन है: विकिरण और कीमोथेरेपी, सर्जरी। इन तरीकों को जोड़ते समय, तालमेल हमेशा प्राप्त होता है: एक साथ वे बदले में अधिक कुशलता से काम करते हैं।
यदि, अब तक, मानक इम्यूनोथेरेपी दवाओं को थेरेपी की तीसरी, पांचवीं पंक्ति (बारी) में शामिल किया गया था, तो अब डॉक्टर उन्हें तुरंत निर्धारित करने के लिए आगे बढ़ रहे हैं, साथ ही लक्षित मोनोक्लोनल एंटीबॉडी के साथ कीमोथेरेपी और थेरेपी के साथ: ऐसे मरीज़ अक्सर डायनामिक्स और दिखाते हैं लंबे समय तक जीवित रहना।रूस में, सभी प्रमुख इम्युनोप्रेपरेशन पहले से ही पंजीकृत हैं। हालाँकि, समस्या यह है कि उनमें से प्रत्येक के लिए स्वास्थ्य मंत्रालय अलग से प्रमाण प्रस्तुत करता है। यही है, दवा के मूल निर्देशों में, उदाहरण के लिए, नौ विभिन्न प्रकार के कैंसर निर्धारित किए जा सकते हैं, जिसमें दवा निर्धारित की जा सकती है, और हमारे देश में यह उनमें से केवल छह के लिए पंजीकृत है। और इसलिए हर दवा के साथ। नतीजतन, जबकि लगभग 50% ट्यूमर अभी तक इस सूची में शामिल नहीं हैं। तदनुसार, अनिवार्य चिकित्सा बीमा के लिए उपचार के हिस्से के रूप में, एक डॉक्टर इन दवाओं को सभी रोगियों को नहीं लिख सकता है।इसके अलावा, राज्य बजट क्लीनिक के डॉक्टर उपचार प्रोटोकॉल के लिए कड़ाई से सीमित हैं। और अगर प्रोटोकॉल में नियंत्रण बिंदु अवरोधकों को केवल 3 लाइनों पर, मानक "रसायन विज्ञान" की दो लाइनों के बाद 3 वें स्थान पर निर्धारित किया जाता है, तो डॉक्टर को बस उन्हें संरक्षित करने का अधिकार नहीं है, भले ही उनका मानना है कि इससे रोगी को मदद मिलेगी।वैसे, एक सामान्य समस्या योग्यता की कमी है। विधि, हालांकि यह खुद को साबित करने में कामयाब रही, देश में कई डॉक्टरों के लिए अभी भी नया है। ड्रग्स सभी पश्चिमी हैं, और 2-3 साल की देरी से हमारे पास पहुंचती हैं। और, यह देखते हुए कि केवल कुछ वर्षों के लिए इम्यूनोथेरेपी का सक्रिय रूप से उपयोग किया गया है, कई अभी भी उनके पास अनुभव नहीं है। इसके अलावा, इम्यूनोथेरेपी के उपयोग के लिए विशिष्ट ज्ञान की आवश्यकता होती है।निजी चिकित्सा में, हम बजट तक सीमित नहीं हैं। यदि "चिकित्सा 24/7" मेंरोगी एक ट्यूमर का उल्लेख कर रहा है जिसके लिए एक इम्यूनोथेरेपी दवा अभी तक पंजीकृत नहीं हुई है, हम सुझाव देते हैं कि वह एक आणविक आनुवंशिक अध्ययन से गुजरता है। परिणामों के अनुसार, यह स्पष्ट हो जाता है कि उनका ट्यूमर इम्यूनोथेरेपी का जवाब देगा या नहीं। यदि हां, तो डॉक्टर के पास इसे संरक्षित करने का पूरा अधिकार है। इसलिए, हमारे अस्पताल में हम लगभग सभी प्रकार के कैंसर के लिए इम्यूनोथेरेपी का उपयोग करते हैं - यह बहुत अच्छे परिणाम देता है। यहां तक कि चरण III-IV रोगियों में सुधार दिखाते हैं। Immunopreparations हमें लोगों के जीवन का विस्तार करने का अवसर देते हैं, यहां तक कि उन मामलों में भी जिन्हें निराशाजनक माना जाता था।निजी और सार्वजनिक दोनों प्रकार के क्लीनिकों में आम रोगी स्वयं होते हैं। वे हमेशा अच्छी तरह से नहीं समझते हैं कि यह किस तरह का तरीका है, यह कैसे काम करता है, इसलिए अविश्वास। हमें उम्मीद है कि इस लेख ने यह समझने और समझने में मदद की कि आज इम्यूनोथेरेपी ऑन्कोलॉजिस्टों के करीब ध्यान देने के योग्य है। परिणामों को देखते हुए, वह पहले से ही शास्त्रीय तरीकों से एक स्तर पर खड़े होने के लिए तैयार है। भयानक बीमारी एक कदम आगे बढ़ जाएगी।