 Kristal cair dalam fase nematik
Kristal cair dalam fase nematikAnda mungkin melewati sekolah bahwa suatu zat bisa dalam tiga
fase termodinamika : padat, cair, dan gas. (Istilah "fase" digunakan bersama dengan istilah "negara", dan tidak satu pun dari mereka memiliki definisi yang jelas dan diterima secara universal). Untuk siswa muda, ini adalah penyederhanaan yang berguna, tetapi pada kenyataannya ada lebih banyak fase. Dalam seratus tahun terakhir, kami telah menemukan keberadaan ratusan fase padat yang berbeda - beberapa di antaranya digunakan untuk membuat chip silikon di komputer Anda. Selain itu, ada puluhan fase kristal cair - beberapa di antaranya membuat gambar di layar Anda. Dan kita bahkan belum menyentuh hal-hal yang benar-benar eksotis: fase kuantum, cairan superfluida, plasma quark-gluon, kondensat Bose-Einstein, dan sebagainya. "Fase topologis."
Tetapi pertama-tama, kembali ke awal dan diskusikan apa “fase” itu. Seperti banyak konsep dasar, yang terbaik dijelaskan dengan sebuah contoh. Pertimbangkan segelas air tempat beberapa es batu mengapung. Hanya ada satu zat dalam gelas: air. Banyak molekul H2O.
Dan meskipun molekul es identik dengan molekul di air sekitarnya, jelas ada perbedaan besar di antara mereka. Yang paling jelas adalah bahwa salah satunya solid, mempertahankan bentuknya, sementara yang lain mengalir dengan bebas dan berbentuk kapal. Ada juga perbedaan dalam kepadatan, konduktivitas listrik dan banyak properti lainnya. Oleh karena itu, kami mengatakan bahwa air cair dan es adalah fase berbeda dari zat yang sama. (Air adalah satu-satunya zat yang seseorang temui dengan tiga fase berbeda secara terus-menerus. Ini adalah salah satu alasan mengapa air adalah zat khusus).
Bagaimana es dan air menunjukkan perilaku yang sama sekali berbeda? Anda mungkin tergoda untuk mengatakan bahwa semuanya tergantung pada suhu: airnya hangat, esnya dingin, dan karena itu, molekul air berperilaku berbeda. Tetapi pada suhu 0 ° C dan tekanan atmosfer normal, es dan air cair stabil - yaitu, mereka dapat hidup tanpa batas waktu dan tidak berubah.
Tetapi jika perbedaan utama bukanlah suhu, lalu apa?
Skala besar dan kecil
Para ilmuwan telah lama membahas hubungan antara sifat makroskopik dari berbagai bahan, dan susunan mikroskopis dari partikel-partikel dari mana mereka dibuat. Salah satu upaya paling awal dilakukan pada tahun 1611 oleh Johannes Kepler dalam karya dengan judul yang indah: "Kepingan salju heksagonal: hadiah Tahun Baru". Kepler berpendapat bahwa enam kali lipat simetri kepingan salju dapat dijelaskan dengan mengasumsikan bahwa es dibuat dari bola kecil yang dikemas dalam heksagonal.
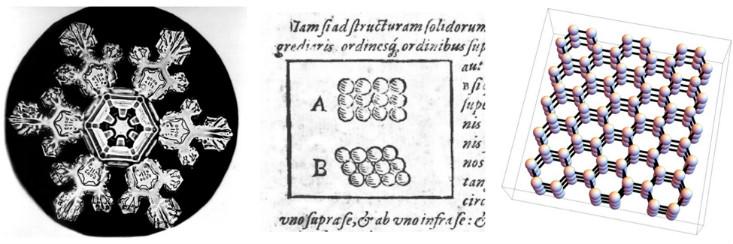
Sekarang kita tahu bahwa asumsi Kepler tentang susunan atom khusus sedikit salah - rencananya tidak mencerminkan bentuk tiga dimensi dan interaksi kompleks molekul air. (Dalam mendukungnya, katakanlah bahwa kimia belum ditemukan, dan keberadaan atom akhirnya terbukti hampir 300 tahun kemudian). Namun, dia berada di jalur yang benar. Simetri enam kali lipat dari kepingan salju berasal dari fakta bahwa molekul air berbaris dalam struktur tiga dimensi dengan simetri enam kali lipat (dan ada juga
kristal salju segitiga , dan tidak ada yang tahu persis mengapa).
Dalam bahasa fisika modern, Kepler menyarankan bahwa salju adalah padatan kristal, suatu fase materi yang memiliki sifat-sifatnya karena fakta bahwa atom atau molekulnya berbaris dalam barisan periodik, atau kisi kristal. Fisikawan menggunakan kata "kristal" untuk menggambarkan struktur mikroskopis, tidak peduli apakah materi itu terlihat seperti berlian, sebutir pasir atau kepingan salju. Oleh karena itu, bagi fisikawan, banyak logam dan keramik adalah kristal, karena atom atau molekulnya tersusun dalam kisi periodik - dalam versi tiga dimensi tertentu dari gambar Kepler tahun 1611.
Ini menjelaskan es dalam segelas air. Bagaimana dengan air cair? Dalam zat apa pun, pada suhu di atas nol absolut (-273 ° C), molekul-molekul terus bergerak dan memantul kata bola bilyar setelah mengalami gangguan yang kuat. Suhu suatu zat adalah ukuran kecepatan pergerakan molekul.
Dalam cairan, gerakan termal acak ini cukup kuat untuk mengatasi kekuatan yang menahan molekul dalam kisi. Dan tanpa kisi ini, molekul dapat bergerak jauh lebih bebas. Ini menjelaskan mengapa cairan itu mati ketika Anda mendorongnya dengan jari Anda, dan es tidak. Menariknya, ada zat-zat, khususnya kaca jendela, dengan mikrostruktur yang sepenuhnya acak, tetapi pada tingkat makroskopik, mereka berperilaku, meskipun demikian, sebagai zat padat. Memahami perilaku mereka adalah yang paling penting dari pertanyaan terbuka fisika material.
Fase yang fantastis
Dalam bahan tiga dimensi - seperti es asli, dan bukan seperti pada sketsa Kepler - semuanya menjadi lebih rumit, karena dalam tiga dimensi ada banyak cara untuk mengatur molekul dalam struktur periodik. Sebagai contoh, ada sekitar 17 fase es (kira-kira karena jumlah ini tergantung pada bagaimana mengklasifikasikannya), yang terbaru pertama kali dibuat dan dipelajari oleh para ilmuwan Italia tahun lalu. Fase yang berbeda terjadi pada suhu dan tekanan yang berbeda, dan meskipun semuanya padat, masing-masing memiliki kepadatan, kekuatan, reaksi terhadap medan listrik dan medan magnet, konduktivitas termal, dll. Karena adanya perbedaan-perbedaan ini dalam perilaku makroskopis, kami menyebutnya fase yang berbeda. Di bawah kondisi "normal" - suhu dan tekanan di permukaan bumi - es biasanya dalam bentuk "ice I
h ". Bentuk kristal heksagonal yang stabil ini justru bertanggung jawab atas simetri kepingan salju enam kali lipat.
Menurut label berbagai fase es, es IX sebenarnya ada. Untungnya, pada suhu dan tekanan di permukaan Bumi, ia jauh lebih rapuh daripada "es sembilan" lainnya - fase stabil, karena itu> lautan dikeraskan secara dahsyat dalam novel Kurt Vonnegut yang berjudul "Cradle for the Cat".
Dan itu belum semuanya, bahkan dengan zat yang begitu akrab. Lainnya, fase es yang belum ditemukan dapat ada pada tekanan sangat tinggi di pusat-pusat gas raksasa seperti Uranus dan Neptunus. Dalam kondisi ekstrem seperti itu, pada tekanan 10 juta atm. dan banyak lagi, air harus membentuk fase padat kristal yang sangat aneh. Di antara mereka ada fase konduktif logam, yang seharusnya terlihat mengkilap jika Anda mengetahui cara memolesnya.
Opsi menengah
Koneksi antara struktur mikro dan properti makro adalah ide utama sains dan teknik, yang digunakan dalam pengembangan banyak bahan. Misalnya, kristal cair adalah komponen utama layar laptop, televisi, dan smartphone. Molekul kristal cair memiliki struktur panjang luar biasa yang menyerupai tongkat. Karena itu, mereka dapat berada dalam beberapa fase yang berbeda, dengan sifat tidak ditemukan dalam bahan konvensional.
Misalnya, pada suhu tinggi, molekul-molekulnya berantakan. Setiap "tongkat" berada di tempat acak, seperti molekul dalam air cair, dan berorientasi ke arah yang sewenang-wenang. Ini adalah fase isotropik. Pada suhu yang lebih rendah, molekul bisa masuk ke fase nematik, di mana mereka berada secara acak, seperti dalam air cair, tetapi diarahkan ke arah yang sama. Karena tidak ada kisi yang terbentuk, fase nematik mengalir seperti cairan, tetapi karena batang diarahkan dalam satu arah, ia memiliki urutan mikroskopis. Oleh karena itu, mereka disebut "kristal cair".
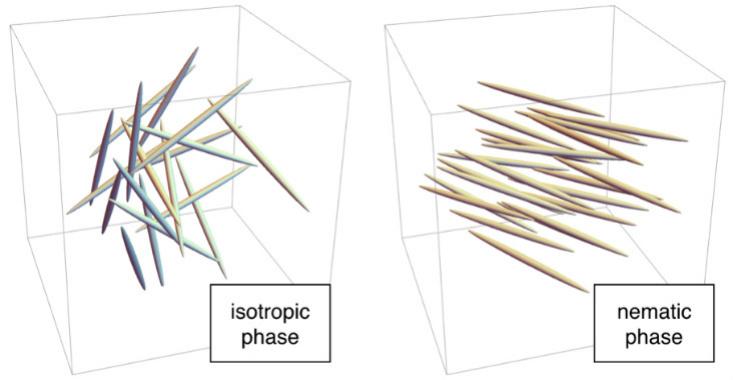
Untungnya bagi manusia modern, fase nematik memiliki sifat yang tidak biasa terkait dengan arah. Ketika tertabrak medan listrik, molekul berbaris di sepanjang itu. Pada layar LCD, molekul dalam fase nematik berperilaku seperti filter polarisasi: perangkat yang mentransmisikan cahaya ketika molekul diorientasikan dengan cara khusus (misalnya, dari atas ke bawah), dan menunda ketika mereka berorientasi secara tegak lurus. Karena filter polarisasi diperlukan untuk pekerjaan seperti itu, filter ditempatkan di antara sumber cahaya dan layar di ponsel dan layar. Dalam LCD, elektroda kecil di sebelah setiap piksel menciptakan medan listrik yang mengontrol posisi molekul di dalamnya, dan karenanya memancarkan cahaya. Skema kerja ini digunakan dalam tampilan IPS (“in-plane switching”). Ada opsi lain, misalnya, layar TN yang menggunakan fase nematik terpelintir yang lebih eksotis.
Memodelkan miniatur
Jelas bahwa mikrostruktur membantu menjelaskan sifat-sifat bahan yang kami temui dan buat. Tetapi bisakah kita melihat tatanan mikroskopis dalam kehidupan nyata? Untuk zat biasa, seperti es, garam atau logam, ini sulit karena atom dan molekulnya sangat kecil. Molekul air kurang dari sepersejuta meter - tidak dapat dilihat dalam mikroskop cahaya konvensional, dan sangat sulit untuk dilihat bahkan menggunakan teknik mikroskopis modern.
Untungnya, tidak hanya atom dan molekul yang dapat mengatur secara mandiri dalam fase. Di laboratorium Chaikin di Pusat Penelitian Bahan Lunak Universitas New York, kami menggunakan bidang keras kecil untuk mempelajari fase materi. Mereka disebut koloid, dan mereka dapat dibuat dari berbagai bahan, seperti kaca, plastik atau logam. Koloid di laboratorium 3.000 kali lebih besar dari molekul air - ukurannya sebanding dengan bakteri atau inti sel hewan. Untuk spesialis dalam bahan, koloid adalah sesuatu seperti "partikel ideal" - cukup besar untuk terlihat di bawah mikroskop, dan cukup kecil untuk membentuk fase yang sebagian besar mirip dengan bahan biasa.
 Foto ini menunjukkan koloid plastik yang dilapisi dengan komposisi kimia, yang karenanya saling tolak, berada di permukaan air.
Foto ini menunjukkan koloid plastik yang dilapisi dengan komposisi kimia, yang karenanya saling tolak, berada di permukaan air.Di laboratorium kami, kami membuat koloid dengan lapisan khusus yang memungkinkannya melekat pada permukaan air. Ketika mereka menempel pada tetesan, kita dapat mengambil mikrophotograf yang indah - seperti ini. Anda dapat melihat struktur mikroskopis dari berbagai fase pada mereka, dan bagaimana orientasi mereka mengarah pada penampilan sifat makroskopis seperti kekerasan. Sebagai contoh, kita sekarang mempelajari bagaimana perilaku partikel kita berubah tergantung pada penggunaan tetesan bola atau permukaan air yang rata. Apakah kehadiran partikel pada bola membantu atau menghambat pembentukan kristal dan penampilan sistem seperti padatan? Ini dapat membantu kita memahami sifat-sifat struktur penting yang memiliki bentuk bulat atau lebih kompleks. Jika, misalnya, kita akan tahu lebih banyak tentang pelapis protein yang melindungi gen HIV, kita bisa belajar cara memecahnya dan mengalahkan virus.
Ketika kristal memburuk
Salah satu tahap paling penting dalam mempelajari tatanan mikroskopis adalah studi tentang kondisi di mana tatanan itu terganggu. Misalnya, jika Anda melihat gambar koloid di kisi kristal, Anda akan melihat bahwa urutannya heterogen. Anda dapat melihat ketidaksempurnaan dan penyimpangan, cacat.
 Gambar diambil dengan mikroskop confocal - cat fluorescent ditambahkan ke sampel, yang kemudian diterangi oleh laser
Gambar diambil dengan mikroskop confocal - cat fluorescent ditambahkan ke sampel, yang kemudian diterangi oleh laserCacat serupa terjadi pada kristal atom atau molekul, dan mereka memainkan peran penting. Misalnya, mereka menentukan kerapuhan suatu material - jenis muatan apa yang dapat ditahannya sebelum pecah. Selain itu, karena cacat dapat memengaruhi konduktivitas listrik suatu bahan, produsen semikonduktor menghabiskan miliaran dolar untuk memproduksi kristal tunggal silikon - blok silikon raksasa dengan hampir tanpa cacat. Di sisi lain, kadang-kadang kekurangan mikroskopis ini sangat membantu. Penelitian baru-baru ini berfokus pada pengelolaan dan pengendalian cacat pada graphene untuk mengoptimalkannya sebagai filter untuk desalinasi.
Kami menggunakan kristal koloid untuk mengamati bagaimana cacat muncul, bergerak, dan berinteraksi satu sama lain. Seperti studi fase, mempelajari kristal koloid dapat membantu kita memahami cacat pada bahan lain. Seperti di banyak bidang kehidupan, terkadang ketidaksempurnaan adalah bagian yang paling menarik.