
Ketika suhu tertentu terlampaui, sel menjadi tidak dapat digunakan dan mati. Salah satu penjelasan paling sederhana untuk intoleransi panas seperti itu adalah bahwa protein yang diperlukan untuk kehidupan adalah mereka yang mengekstraksi energi dari makanan atau sinar matahari, mempertahankan diri dari intrusi, menghancurkan limbah, dll. - Sering memiliki bentuk yang sangat akurat. Mulai dari helai yang panjang, mereka kemudian diputar dalam bentuk spiral, "jepit rambut" dan bentuk lainnya yang ditentukan oleh urutan komponen mereka. Dan bentuk-bentuk ini memainkan peran besar dalam kegiatan mereka. Tetapi ketika suhu mulai naik, ikatan yang menahan struktur protein terputus: pertama yang terlemah, lalu yang terkuat. Adalah logis bahwa penyebaran kehilangan struktur protein harus mematikan, tetapi sampai saat ini, rincian persis bagaimana ini membunuh sel-sel yang terlalu panas tidak jelas.
Sekarang, ahli biofisika dari Sekolah Teknik Tinggi Swiss di Zurich telah mempelajari perilaku masing-masing protein dalam sel dari empat organisme berbeda dengan peningkatan suhu. Studi ini dan pengumpulan data yang kaya yang
diterbitkan dalam jurnal Science menunjukkan bahwa pada suhu yang cukup untuk kematian sel - manusia, atau sel Escherichia coli E. coli - hanya beberapa protein kunci yang dihancurkan. Selain itu, kelimpahan protein dalam sel secara tak terduga dikaitkan dengan stabilitasnya. Penelitian telah memungkinkan para ilmuwan untuk dengan cepat membiasakan diri dengan aturan-aturan mendasar yang dengannya kerja protein dan pengurutannya dibangun, dan konsekuensinya, seperti yang sudah jelas, memperpanjang lebih jauh daripada kematian sederhana akibat panas.
Paola Piccotti , ahli biofisika yang mengarahkan penelitian itu, menjelaskan bahwa percobaan itu didorong oleh pertanyaan lama dan tidak terselesaikan: mengapa beberapa sel bertahan hidup pada suhu tinggi, sementara yang lain mati? Bakteri Thermus thermophilus hidup bahagia di sumber air panas dan pemanas rumah [pada suhu optimal 65 ° C - kira-kira. trans.], sedangkan sel E. coli merana pada suhu di atas 40 ° C. Bukti yang meyakinkan menunjukkan bahwa poin di sini adalah perbedaan stabilitas protein dari organisme ini. Tetapi melacak protein dalam sel hidup, yang akan menjadi metode studi yang ideal, sangat tidak nyaman. Isolasi protein dalam tabung reaksi tidak memberikan semua jawaban, karena di dalam tubuh protein saling menempel dan memengaruhi kimia satu sama lain, atau mereka saling mendukung dalam bentuk yang diperlukan. Untuk memahami apa sebenarnya dan mengapa itu berantakan, perlu untuk mengamati protein pada saat mereka masih saling mempengaruhi.
Bagaimana panas menghancurkan protein
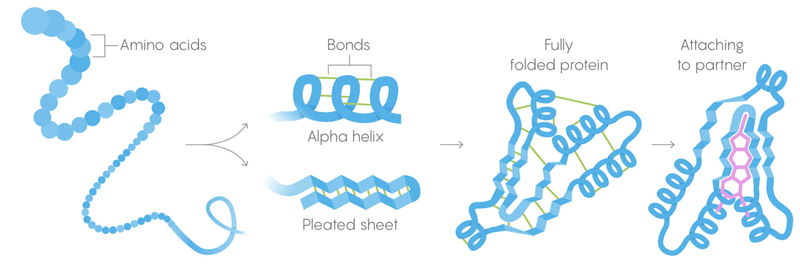 1) Struktur utama protein adalah rantai panjang asam amino, dikombinasikan menjadi urutan yang diberikan oleh gen.
1) Struktur utama protein adalah rantai panjang asam amino, dikombinasikan menjadi urutan yang diberikan oleh gen.
2) Struktur sekunder adalah asam amino yang juga terlipat menjadi konfigurasi yang dimiliki oleh ikatan antarmolekul yang lemah.
3) Struktur tersier - ikatan lemah menstabilkan lokasi bagian lurus dan bengkok dari struktur tiga dimensi protein. Lokasi mereka memungkinkan protein untuk mengikat molekul yang diinginkan.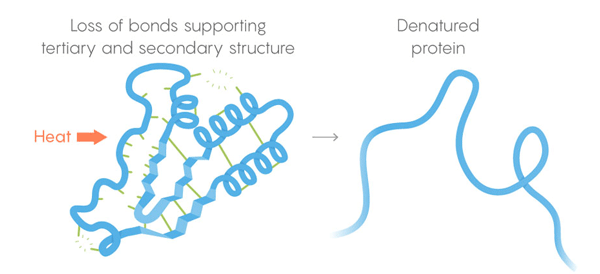 Kematian termal. Ikatan lemah kehilangan kemampuan mereka untuk mempertahankan struktur tersier dan sekunder, dan protein mendenaturasi, yaitu, terungkap. Tetapi tidak semua protein terungkap pada suhu yang sama - lingkungan protein dalam sel dapat memberikan stabilisasi tambahan.
Kematian termal. Ikatan lemah kehilangan kemampuan mereka untuk mempertahankan struktur tersier dan sekunder, dan protein mendenaturasi, yaitu, terungkap. Tetapi tidak semua protein terungkap pada suhu yang sama - lingkungan protein dalam sel dapat memberikan stabilisasi tambahan.Untuk menyelesaikan tugas tersebut, tim mengembangkan prosedur pemantauan otomatis. Mereka memotong sel dan memanaskan isinya secara bertahap, melepaskan pada setiap tahap enzim yang memisahkan protein. Enzim-enzim ini sangat baik dalam memotong protein yang tidak terlipat, sehingga para peneliti yang berdasarkan pada sisa-sisa protein yang terpotong dapat menilai protein mana yang hancur pada suhu tertentu. Dengan demikian, mereka mampu membuat kurva denaturasi untuk masing-masing dari ribuan protein yang dipelajari. Lengkungan kurva berubah dari struktur protein yang tidak tersentuh pada suhu yang nyaman untuknya menjadi keadaan berkembang penuh pada suhu tinggi. Untuk mencari perbedaan antara kurva berbagai spesies makhluk hidup, percobaan dilakukan pada sel manusia, E.coli, T. thermophilus dan ragi. "Penelitian itu indah," kata
Alan Drummond , ahli biologi di University of Chicago, merujuk pada skala dan keakuratan proses.
Selama pengamatan, terlihat jelas bahwa protein semua makhluk hidup tidak membuka sekaligus dengan meningkatnya suhu. “Kami melihat bahwa hanya sebagian kecil protein yang runtuh pada tahap paling awal,” kata Piccotti, “dan ini adalah protein utama.” Dalam diagram dengan jalinan ikatan protein-protein, protein yang paling rapuh dari subset kecil ini sering memiliki sejumlah besar ikatan, yang berarti bahwa mereka mempengaruhi banyak proses yang terjadi dalam sel. "Tanpa protein ini, sel tidak bisa bekerja," kata Piccotti. "Ketika mereka menghilang, seluruh jaringan hancur." Dan dengan itu, jelas, kehidupan sel berhenti.
Paradoks ini - protein paling penting yang ternyata paling rapuh - mungkin merupakan refleksi bagaimana evolusi menciptakannya untuk melakukan tugas yang sesuai. Jika suatu protein memiliki banyak peran, ketidakstabilannya dan kecenderungannya untuk membuka dan membungkus ulang dapat menjadi keuntungan, karena dapat memungkinkannya untuk mengambil bentuk yang berbeda, cocok untuk tugas yang berbeda. “Banyak dari protein utama ini memiliki fleksibilitas yang besar, yang membuatnya kurang stabil,” tetapi pada saat yang sama memberi mereka kemampuan untuk mengikat berbagai molekul target dalam sel, Piccotti menjelaskan. “Kemungkinan besar, ini adalah bagaimana mereka mengatasi fungsi mereka. Ini kompromi. ”
Setelah mempelajari E. coli dengan hati-hati, yang datanya terkumpul memiliki kualitas terbaik, para peneliti menemukan hubungan antara kelimpahan protein - jumlah salinan dalam sel - dan stabilitasnya. Semakin banyak salinan protein dari sel, semakin banyak suhu yang dibutuhkan untuk menghancurkannya. Ternyata sejumlah besar salinan tidak berkorelasi dengan kekritisan protein untuk bertahan hidup. Beberapa protein kunci sangat jarang. Hubungan antara kelimpahan dan keandalan ini menegaskan gagasan yang dikemukakan oleh Drummond sepuluh tahun yang lalu - sistem seluler yang membuat protein memiliki kecenderungan untuk membuat kesalahan dari waktu ke waktu. Kesalahan biasanya merusak protein. Jika protein ini ditemukan berlimpah, dan protein seperti itu muncul di dalam sel seratus atau ribuan kali sehari, maka salinan yang terlipat secara keliru yang diproduksi dalam jumlah besar dapat menyumbat sel. Dengan demikian, akan bermanfaat bagi tubuh untuk berevolusi sehingga protein paling banyak juga paling stabil, yang dikonfirmasi oleh data yang diperoleh oleh tim Piccotti.
Untuk memahami kualitas protein apa yang membuatnya stabil, para peneliti membandingkan data dari E. coli dan T. Thermophilus. Protein E. coli mulai hancur pada suhu 40 ° C, dan hampir sepenuhnya terdegradasi pada suhu 70 ° C. Tetapi pada suhu ini, protein T. thermophilus baru saja mulai merasa tidak nyaman - beberapa dari mereka mempertahankan bentuknya bahkan pada suhu 90 ° C. Tim menemukan bahwa T. thermophilus biasanya memiliki protein lebih pendek, dan beberapa jenis bentuk dan komponen protein lebih umum terjadi pada yang paling stabil.
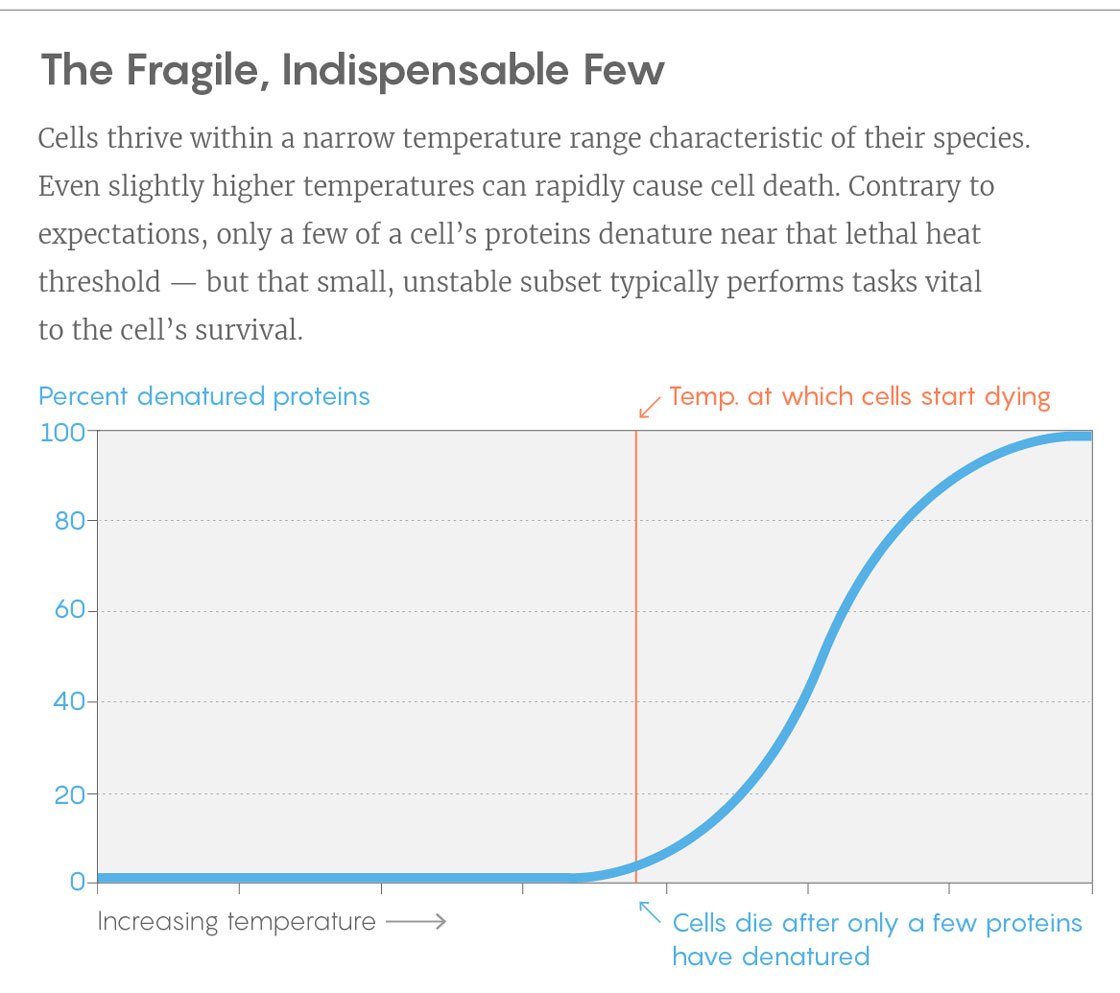 Contoh kurva dari percobaan. Vertikal - persentase protein yang tidak dilipat, suhu horizontal. Bilah vertikal adalah suhu di mana sel-sel mulai mati. Untuk melakukan ini, balikkan hanya beberapa protein utama.
Contoh kurva dari percobaan. Vertikal - persentase protein yang tidak dilipat, suhu horizontal. Bilah vertikal adalah suhu di mana sel-sel mulai mati. Untuk melakukan ini, balikkan hanya beberapa protein utama.Penemuan dapat membantu para peneliti mengembangkan protein yang stabilitasnya disesuaikan dengan kebutuhan mereka. Dalam banyak proses industri di mana bakteri digunakan, meningkatkan suhu akan meningkatkan kembalinya - tetapi segera bakteri mulai mati karena panas. Akan menarik untuk mengetahui apakah kita dapat menstabilkan bakteri dengan membuat protein utama lebih tahan terhadap suhu, kata Piccotti.
Banyaknya informasi tentang betapa mudahnya protein tertentu terungkap sangat menyenangkan beberapa ahli biologi. Probabilitas agregasi secara langsung tergantung pada stabilitas protein: penampilan benjolan dari protein yang tidak berkembang yang saling menempel. Agregat protein dapat berubah menjadi mimpi buruk bagi sel dan mengganggu pelaksanaan tugas utama. Misalnya, mereka dituduh menyebabkan beberapa masalah neurologis serius, seperti penyakit Alzheimer, di mana plak protein yang tidak tersumbat menyumbat otak.
 Paola Piccotti
Paola PiccottiTetapi ini tidak berarti bahwa agregasi hanya terjadi pada organisme yang menderita penyakit tertentu. Sebaliknya, para peneliti menyadari bahwa itu mungkin terjadi sepanjang waktu, dan bahwa sel-sel sehat memiliki metode yang dengannya mereka mengatasinya. "Saya pikir fenomena ini menjadi semakin umum," kata Michele Vendruscolo, seorang ahli biokimia di Universitas Cambridge. “Kebanyakan protein tidak terlipat dengan baik dan agregat di dalam sel. Hal terpenting yang didirikan tim Piccotti adalah lamanya waktu di mana setiap protein yang dipilih dalam keadaan diperluas. Kali ini menentukan tingkat kemungkinan agregasi protein. ” Beberapa protein hampir tidak pernah berbalik dan tidak agregat, yang lain berperilaku dalam kondisi tertentu, sementara yang lain melakukannya sepanjang waktu. Menurut ahli biokimia, deskripsi rinci protein dalam karya baru akan sangat memudahkan studi dan pemahaman tentang perbedaan antara protein. Beberapa kurva denaturasi menunjukkan bahwa protein mereka teragregasi setelah dibuka. "Mereka berhasil melacak kedua tahap - baik penyebaran dan agregasi berikutnya," kata Vendruscolo. "Itulah keindahan dari penelitian ini."
Dan meskipun banyak ilmuwan tertarik pada agregat karena kerusakan yang ditimbulkannya, beberapa melihat fenomena ini dari sudut pandang yang berbeda. Drummond mengatakan sudah menjadi jelas bahwa beberapa kelompok agregasi bukan hanya potongan-potongan sampah yang tergantung di dalam sangkar. Mereka mengandung protein aktif yang terus menjalankan fungsinya.
Bayangkan dari kejauhan Anda melihat asap mengepul dari sebuah gedung, kata Drummond. Di sekitar gedung Anda melihat beberapa sosok, dan Anda membayangkan bahwa ini adalah tubuh yang diambil dari reruntuhan. Tetapi jika Anda mendekat, Anda mungkin menemukan bahwa mereka adalah orang-orang hidup yang melarikan diri dari gedung yang terbakar, menunggu insiden itu berakhir. Ini adalah kasus dengan studi agregat, kata Drummond: peneliti menemukan bahwa protein dalam agregat bukan korban, tetapi selamat. "Sekarang bidang ilmu baru tumbuh dengan kecepatan yang eksplosif," katanya.
Penggumpalan protein mungkin bukan pertanda kerusakan, tetapi cara bagi protein untuk mempertahankan fungsinya dalam situasi yang sulit. Misalnya, ia dapat melindungi mereka dari lingkungan. Dan ketika kondisinya membaik, protein dapat meninggalkan agregat dan melipat lagi. "Bentuk mereka berubah dengan suhu sedemikian rupa sehingga pada pandangan pertama tampaknya lipat tidak tepat," kata Drummond. "Tapi itu masuk akal." Dalam sebuah
artikel di majalah Cell dari 2015, ia dan rekannya mengidentifikasi 177 protein ragi yang mempertahankan fungsinya setelah mereka memasuki agregat. Dalam sebuah
makalah yang diterbitkan pada bulan Maret, tim ini menjelaskan bahwa jika salah satu protein diubah sehingga tidak dapat teragregasi, ini akan menyebabkan masalah serius dalam fungsi sel.
Secara umum, penelitian ini mengklaim bahwa protein secara mengejutkan merupakan struktur dinamis. Pada awalnya, mereka mungkin tampak seperti mesin kaku yang mengerjakan tugas tetap yang cocok untuk satu bentuk tertentu. Namun pada kenyataannya, protein dapat mengambil beberapa bentuk berbeda selama berfungsi normal. Dan pada saat yang tepat, bentuknya dapat berubah sangat banyak sehingga terlihat seperti memburuk, meskipun pada kenyataannya mereka justru menguat. Pada tingkat molekuler, kehidupan dapat menjadi koneksi permanen dan pemutusan ikatan.