Neurogenesis adalah proses multi-tahap pembentukan sel-sel saraf baru dalam sistem saraf pusat yang matang (SSP), yang merupakan fungsi adaptifnya.
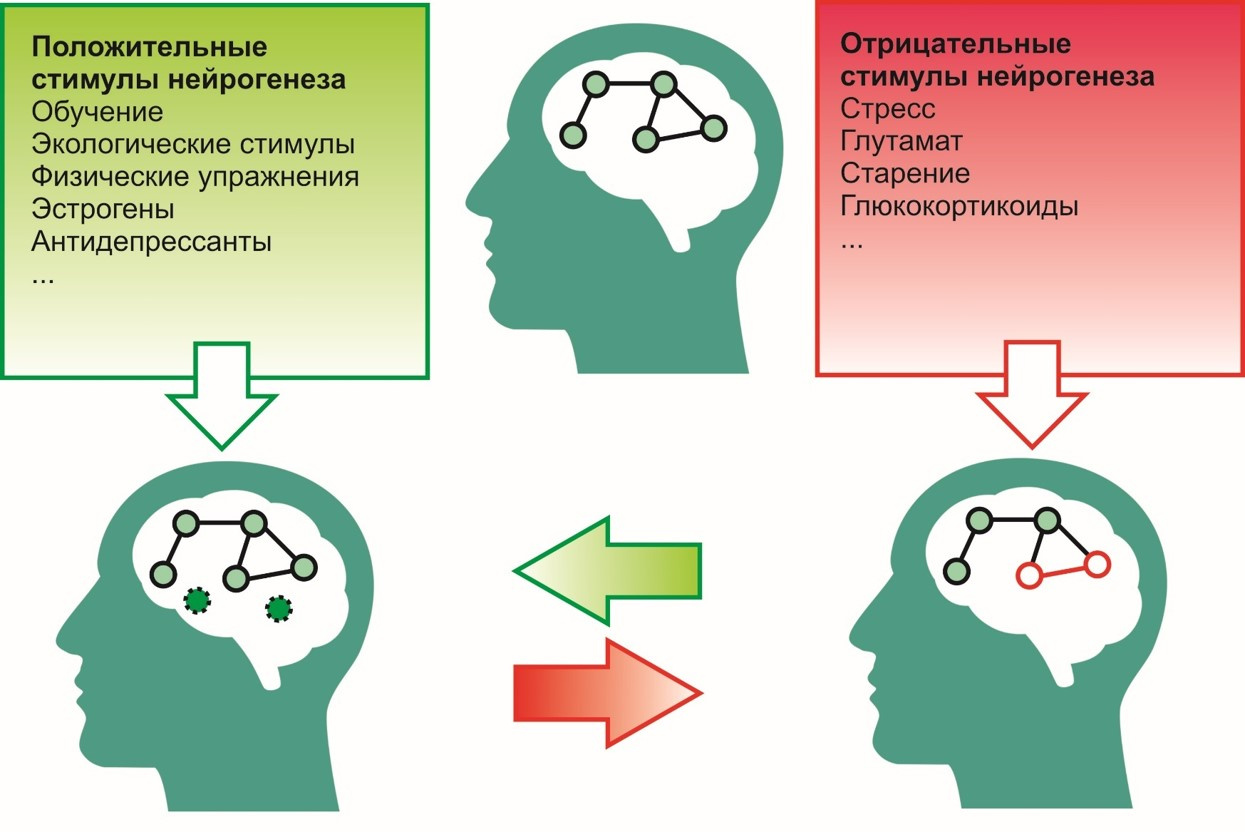
Untuk insentif positif, mis. Insentif yang berkontribusi pada proses neurogenesis meliputi:
- proses belajar
- lingkungan ekologis (lingkungan yang menguntungkan),
- latihan fisik (mis. berlari)
- antidepresan
- estrogen dll
Ke negatif -
- stres
- aktivitas glutamat yang berlebihan dalam sistem saraf pusat,
- paparan glukortikoid (kortisol - hormon stres),
- penuaan dan lainnya.
Selama bertahun-tahun dalam neurobiologi sentral, ada dogma-dogma sentral yang tidak memungkinkan kemungkinan terjadinya neurogenesis.
 Gagasan tentang tidak adanya neurogenesis di otak vertebrata dewasa didasarkan pada empat prinsip:
Gagasan tentang tidak adanya neurogenesis di otak vertebrata dewasa didasarkan pada empat prinsip:- Klinis. Pasien yang menderita patologi neurologis dengan lesi dominan pada sistem saraf pusat tidak mengalami pemulihan fungsional. Gangguan serebrovaskular, lesi traumatis dan penyakit neurodegeneratif, seperti penyakit Parkinson dan Alzheimer, adalah patologi sistem saraf pusat dengan progresif dan memburuknya kondisi klinis pasien. Secara umum, berbagai metode pengobatan hanya dapat menghilangkan gejala, tetapi tidak menghentikan perkembangan penyakit.
- Fungsional Hal ini didasarkan pada kenyataan bahwa sistem saraf pusat mengendalikan banyak proses kompleks: pengaturan emosi, gerakan, refleks, dll. Mengelola proses rumit semacam itu membutuhkan penyetelan yang sangat tepat dan tepat. Diyakini bahwa pembentukan sel-sel saraf baru, diferensiasi dan migrasi mereka dapat mengganggu organisasi struktural dan fungsional dari jalur saraf yang ada dan mengganggu sistem saraf pusat.
- Terkait dengan teori memori dan pembelajaran. Untuk waktu yang lama, diyakini bahwa "kenangan" adalah ekstraksi informasi dari jaringan saraf yang terbentuk selama proses pelatihan. Dalam konteks ini, pembentukan sel-sel saraf baru dianggap sebagai peristiwa yang tidak sesuai dengan memori.
- Teknis dan eksperimental. Kurangnya kemampuan teknis untuk menemukan neurogenesis dan sel punca saraf dalam sistem saraf pusat yang matang.
Tahapan pembentukan ide tentang neurogenesis otak yang matang- 60-an - Joseph Altman et al. Sel-sel gyrus dentate dari hippocampus dapat termasuk timidin radioaktif, yang diintegrasikan ke dalam DNA pembagi sel, yang memungkinkan mereka untuk divisualisasikan. Karena kurangnya penanda molekuler, tidak mungkin untuk membuktikan bahwa itu adalah neuron yang diberi label.
DOI: 10.1126 / science.135.3509.1127
- 70-an - Michael Kaplan dan James Hinds. Mereka mereproduksi percobaan Altman dan dikonfirmasi dengan mikroskop elektron bahwa itu adalah neuron (dentate gyrus dan olfactory bulb) yang ditandai.
DOI: 10.1126 / science.887941
- 80-an - Fernando Notteboom. Dia menunjukkan bahwa selama musim kawin di inti otak burung kenari yang bertanggung jawab untuk vokalisasi dan pelatihan, jumlah neuron meningkat tajam.
DOI: 10.1038 / scientificamerican0289-74
- 90-an - Peter Ericsson et al. Untuk pertama kalinya, pembentukan neuron baru di hippocampus manusia ditunjukkan.
DOI: 10.1038 / 3305
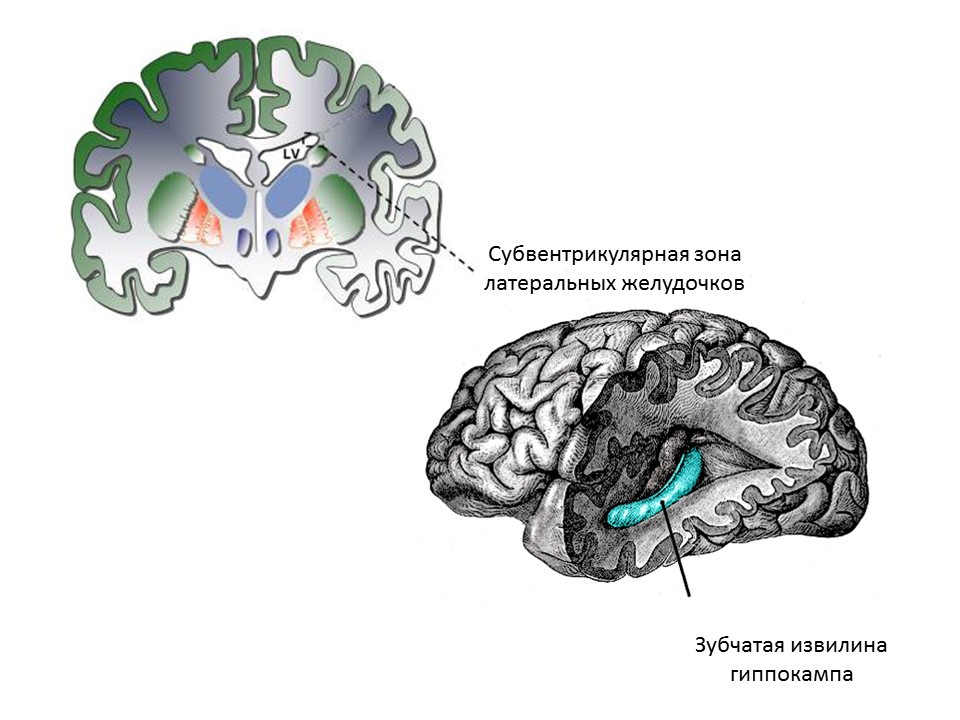
Zona neurogenik utama otak orang dewasa (atau dewasa) adalah dentate gyrus dari hippocampus dan zona subventrikular ventrikel lateral. Zona ditunjukkan pada gambar.
 Tahapan neurogenesis pada dentate gyrus dari hippocampus otak dewasa
Tahapan neurogenesis pada dentate gyrus dari hippocampus otak dewasa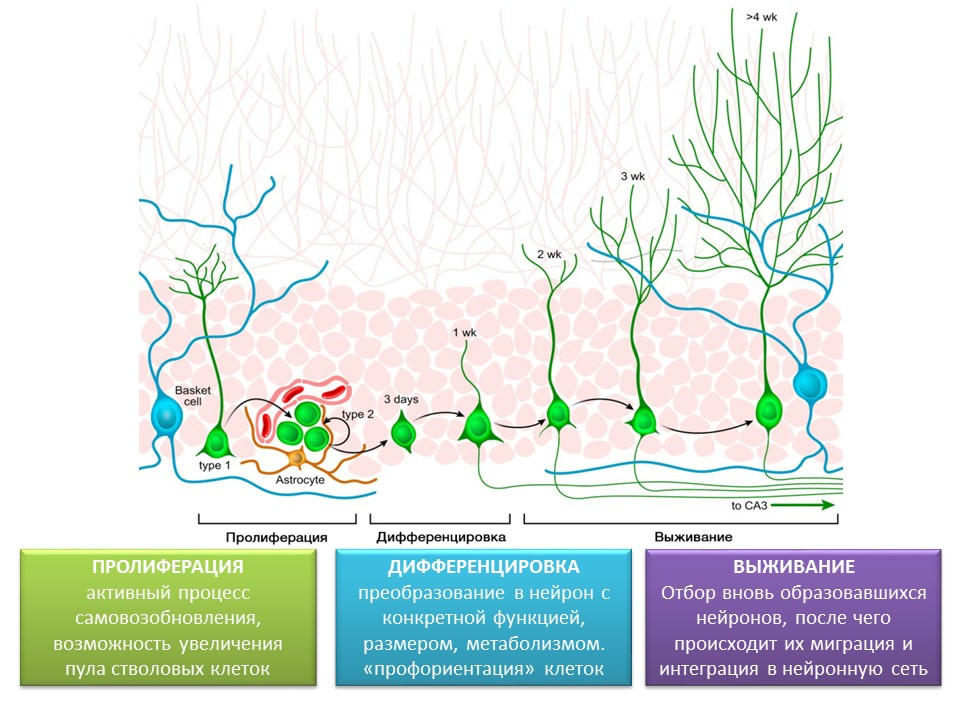
Proliferasi adalah proses aktif pembaruan diri, kemungkinan bertambahnya kumpulan sel induk.
Diferensiasi - konversi menjadi neuron dengan fungsi, ukuran, metabolisme tertentu. Bahkan, "bimbingan karier" sel saraf masa depan.
Kelangsungan hidup adalah pemilihan neuron yang baru terbentuk, setelah itu mereka bermigrasi dan berintegrasi ke dalam jaringan saraf. Pemilihan sel-sel saraf adalah apoptosis (kematian terprogram) dari bagian neuron yang terbentuk. Sel-sel yang tersisa bermigrasi ke daerah otak yang sesuai dan berintegrasi ke dalam jaringan saraf.
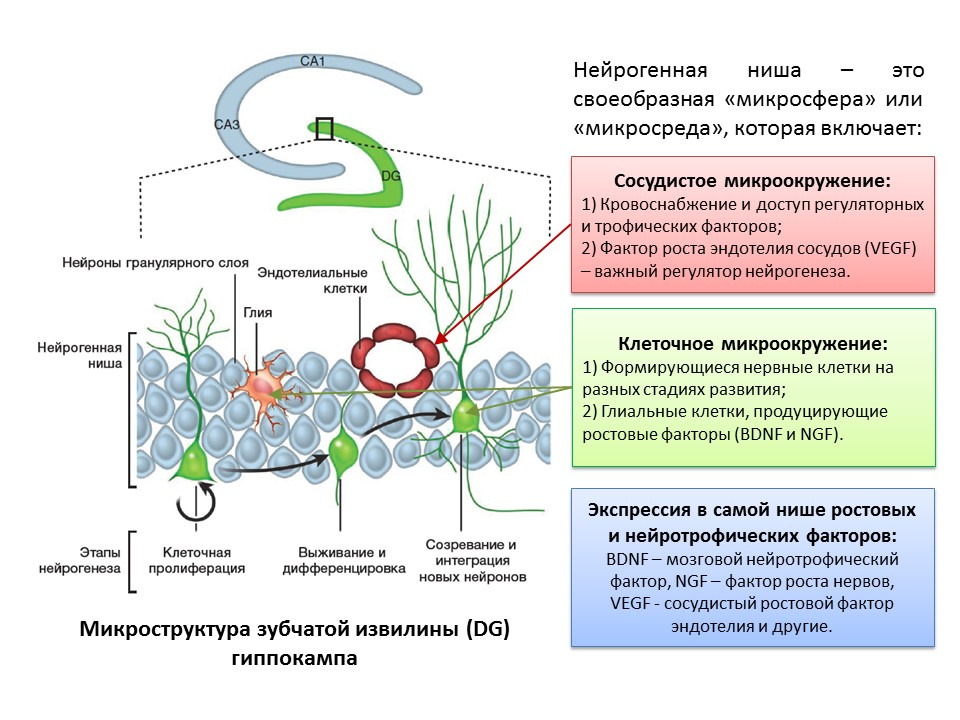
Istilah "neurogenesis" terkait erat dengan konsep "ceruk neurogenik." "Ceruk neurogenik" itu sendiri adalah "mikrosfer" di mana proses neurogenesis itu sendiri terjadi. Ceruk neurogenik meliputi:
- lingkungan mikro vaskular, yang, pertama, memasok darah ke ceruk itu sendiri dan memastikan pengiriman berbagai molekul pengatur (sel punca dibentuk dan ditransformasikan berdekatan dengan pembuluh darah, dan kedua, faktor pertumbuhan endotel vaskular (VEGF) merupakan faktor pengaturan penting yang tidak hanya dalam proses angiogenesis (pertumbuhan pembuluh baru dalam sistem vaskular yang sudah ada) dan vasculogenesis (pembentukan sistem pembuluh darah embrionik), tetapi juga merupakan pengatur langsung neurogenesis;
- lingkungan mikro sel, yang meliputi sel-sel saraf pada berbagai tahap perkembangan dan sel glial yang melakukan fungsi trofik (mereka menghasilkan faktor pertumbuhan, misalnya, faktor neurotropik otak - BDNF dan faktor pertumbuhan saraf - NGF);
- ekspresi dalam ceruk faktor pertumbuhan dan regulasi. Selain sel glial dan struktur dewasa lain dari ceruk, sel induk mampu menghasilkan faktor regulasi dan pertumbuhan, sehingga melakukan regulasi diri (regulasi autokrin).
Penilaian proses neurogenesis menggunakan penanda spesifik
Masalah penting dan menarik yang patut mendapat perhatian khusus adalah pertanyaan tentang bagaimana mendeteksi neurogenesis di jaringan otak mamalia dewasa.
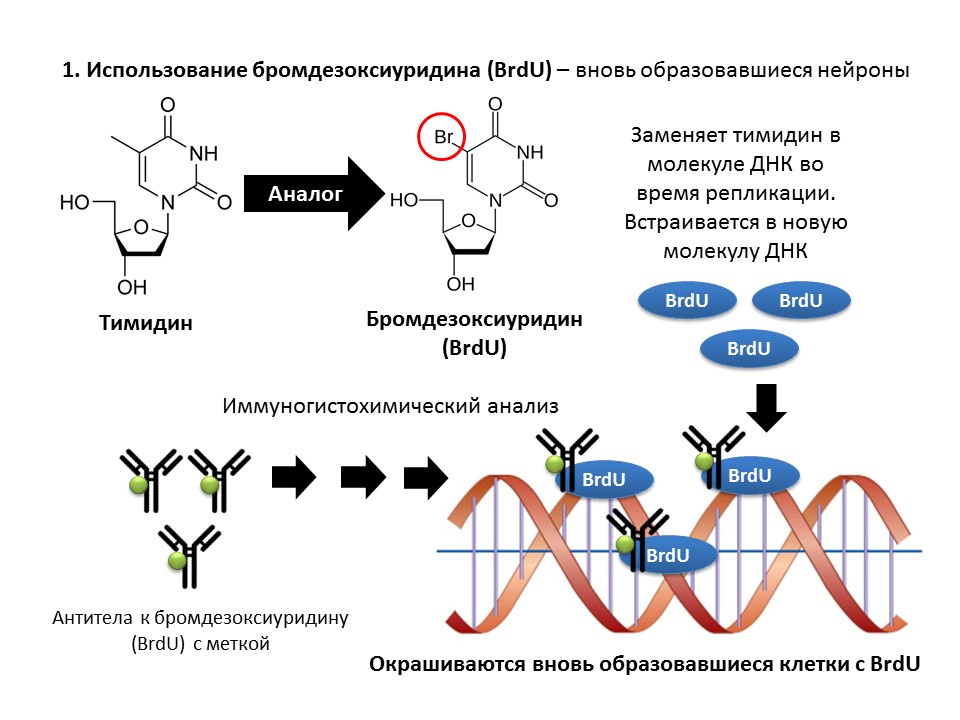
Bromodeoxyuridine (BrdU) adalah analog struktural timidin - komponen molekul DNA. Ketika dimasukkan ke dalam tubuh, BrdU dimasukkan ke dalam DNA yang membagi sel alih-alih timidin, memberikan kesempatan untuk mendeteksi sel-sel yang baru terbentuk dan memisahkannya dari yang "lama". Setelah mendapatkan sampel jaringan otak, mereka diperlakukan dengan antibodi terhadap BrdU (antibodi berisi label fluorescent), yang berikatan dengan BrdU melalui mekanisme reaksi imunokimia antigen-antibodi dan memungkinkan penentuan kolorimetri BrdU. Dengan demikian, pada mikropreparasi dimungkinkan untuk mengukur sel yang diberi label dengan BrdU, yang disebut sel positif BrdU.
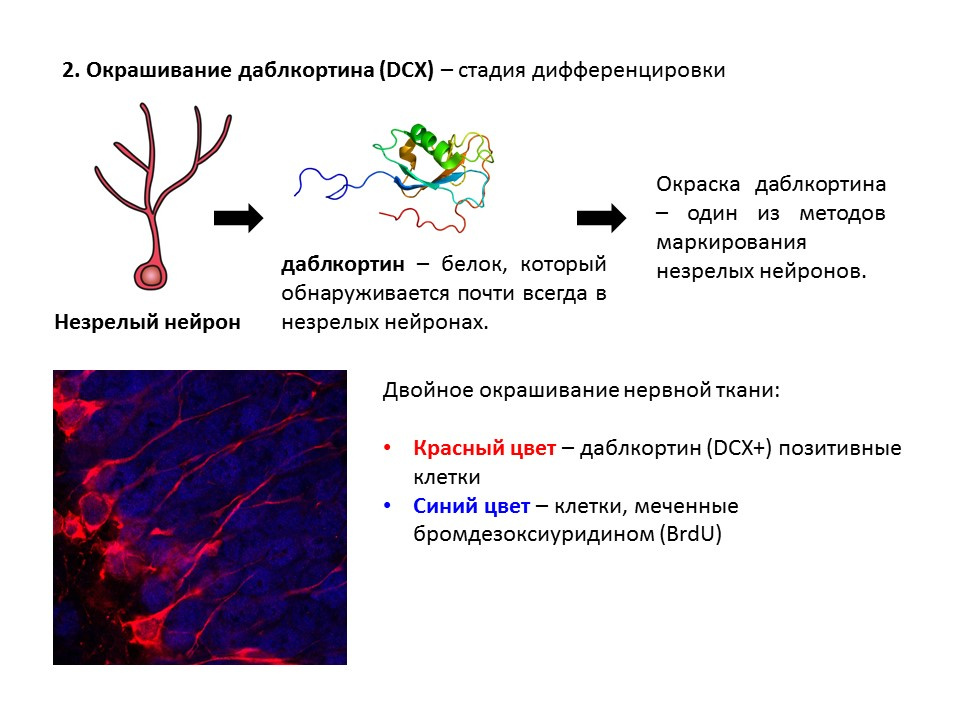
Doublecortin adalah protein yang hampir selalu ditemukan di neuron yang belum matang dan memungkinkan mereka untuk dideteksi.
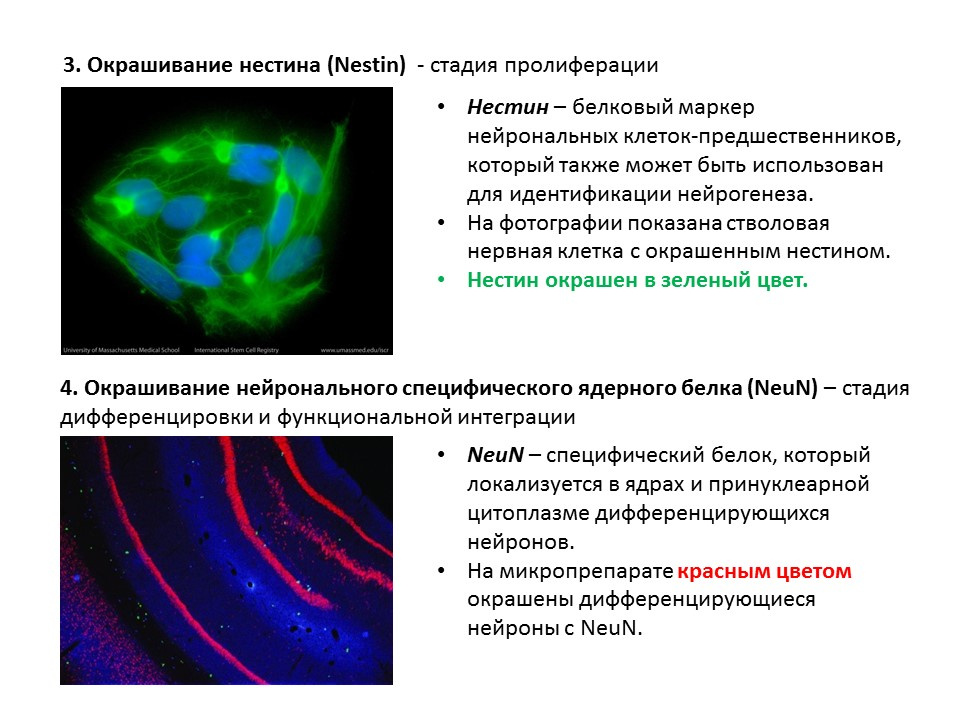
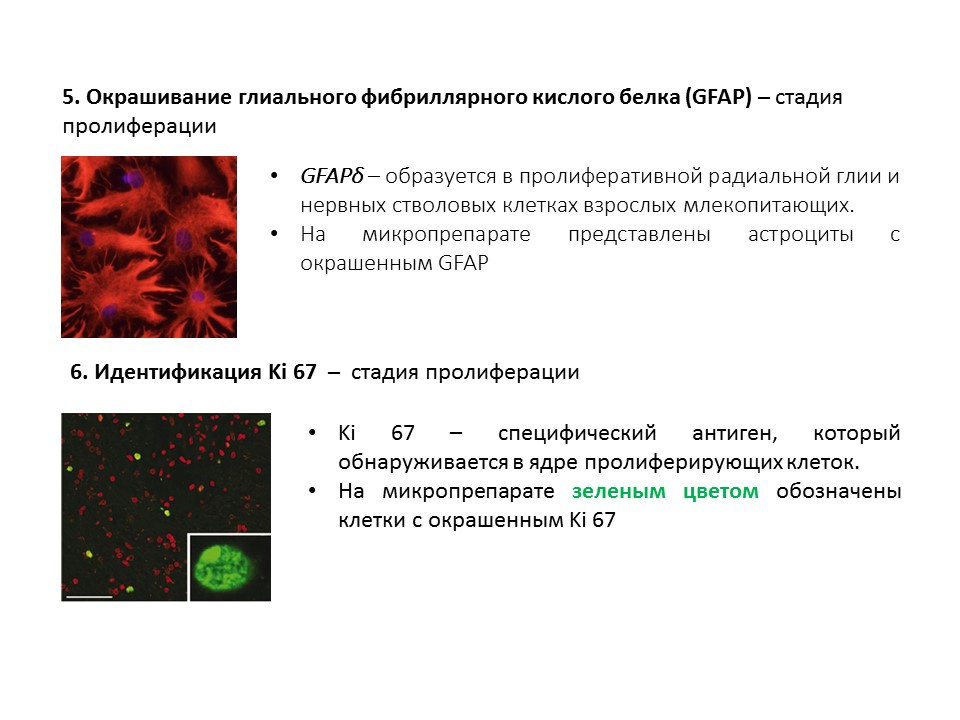 Diagram ringkasan dari metode utama untuk mendeteksi berbagai tahap neurogenesis, yang merangkum informasi sebelumnya yang disajikan.
Diagram ringkasan dari metode utama untuk mendeteksi berbagai tahap neurogenesis, yang merangkum informasi sebelumnya yang disajikan.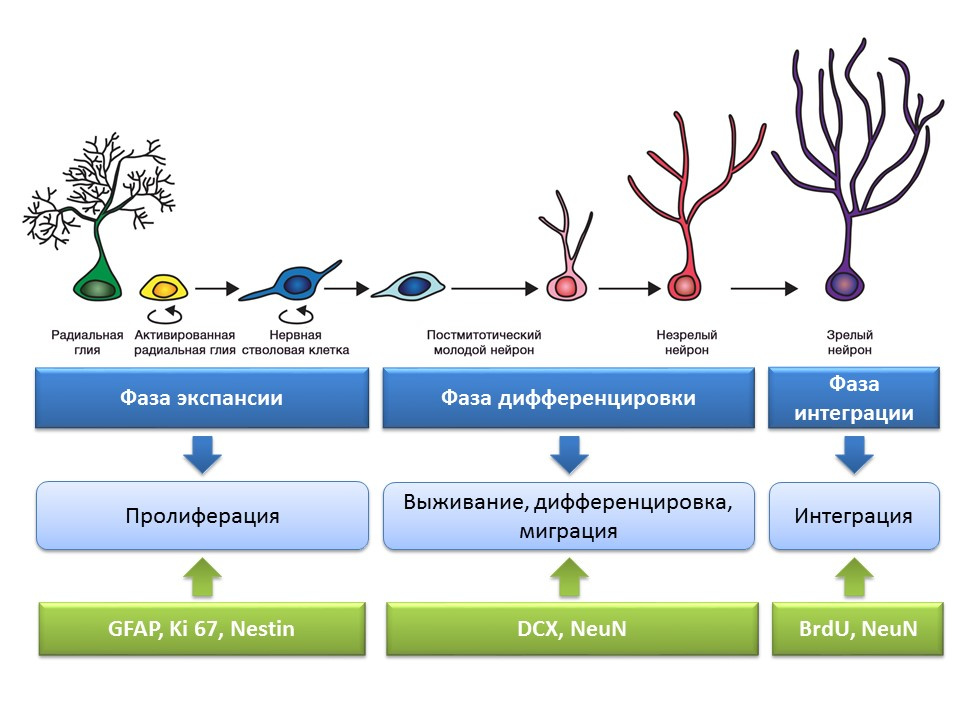
Regulasi neurogenesis di otak yang matang
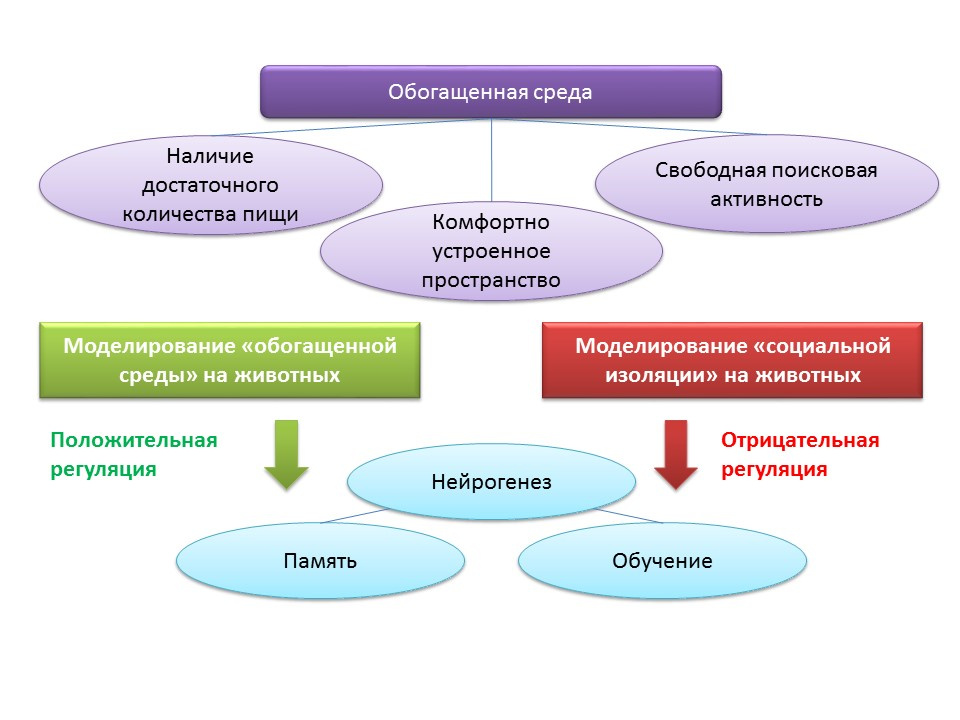
Faktor lingkungan regulasi neurogenesis dikaitkan dengan konsep "lingkungan yang diperkaya". Istilah "lingkungan yang diperkaya" itu sendiri mencakup lingkungan hidup yang menguntungkan, yaitu keberadaan makanan yang cukup, ruang yang nyaman dan peluang untuk kegiatan pencarian gratis.
 DOI: 10.1002 / hipo.22218DOI: 10.1038 / 386493a0DOI: 10.1016 / j.brainres.2011.08.00.007DOI: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229
DOI: 10.1002 / hipo.22218DOI: 10.1038 / 386493a0DOI: 10.1016 / j.brainres.2011.08.00.007DOI: 10.1016 / j.neuroscience.2011.10.040PMID: 9547229Dalam percobaan pada hewan, ditemukan bahwa tinggal di “lingkungan yang diperkaya” memiliki efek positif pada neurogenesis: produksi faktor pertumbuhan dan peningkatan neurotropin, jumlah sel yang berkembang biak dan kelangsungan hidup mereka. Peningkatan neurogenesis berkorelasi dengan peningkatan fungsi kognitif pada hewan (terutama dengan pembelajaran dan memori).
Tikus percobaan C57BL / 6J disimpan selama 2 bulan di ruang terlindung di bawah kondisi stasiun biologis (dalam rawa hutan), dan kelompok kontrol disimpan dalam kondisi laboratorium standar. Pada hewan dari kelompok eksperimen, peningkatan jumlah sinapsis eksitasi dan penghambatan tercatat dibandingkan dengan kelompok kontrol. Eksperimen ini menunjukkan bahwa kondisi lingkungan dapat mempengaruhi morfologi dan fungsi sistem saraf pusat tikus yang ditempatkan di lingkungan yang diperkaya.
Menjaga hewan dalam kondisi isolasi sosial di laboratorium, sebaliknya, bertindak sebagai regulator neurogenesis negatif.
Selain itu, penempatan hewan di "lingkungan yang diperkaya" setelah iskemia otak berkontribusi pada penguatan proses regeneratif di zona neurogenik otak.
Hasil studi tersebut bukanlah sesuatu yang luar biasa, karena dalam kursus rehabilitasi kedokteran modern dan liburan kesehatan digunakan.
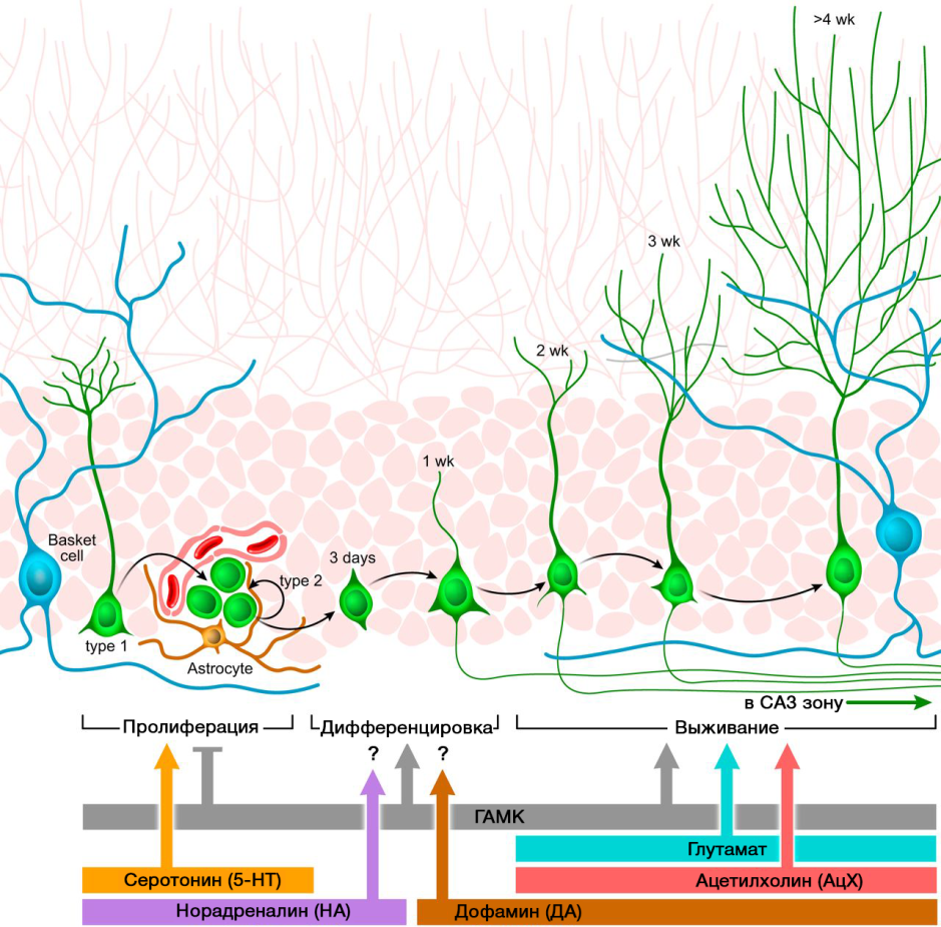
Peran penting dalam regulasi neurogenesis dimainkan oleh neurotransmiter sistem saraf pusat. Gambar menunjukkan diagram ringkasan dari peraturan tersebut.
 DOI: 10.1152 / physrev.00004.2014
DOI: 10.1152 / physrev.00004.2014Peran pengaturan neurotransmiter SSP yang disajikan dalam proses neurogenesis berkorelasi dengan kekurangan atau kelebihan molekul-molekul ini dalam berbagai penyakit pada sistem saraf pusat yang terkait dengan perubahan tingkat neurogenesis.
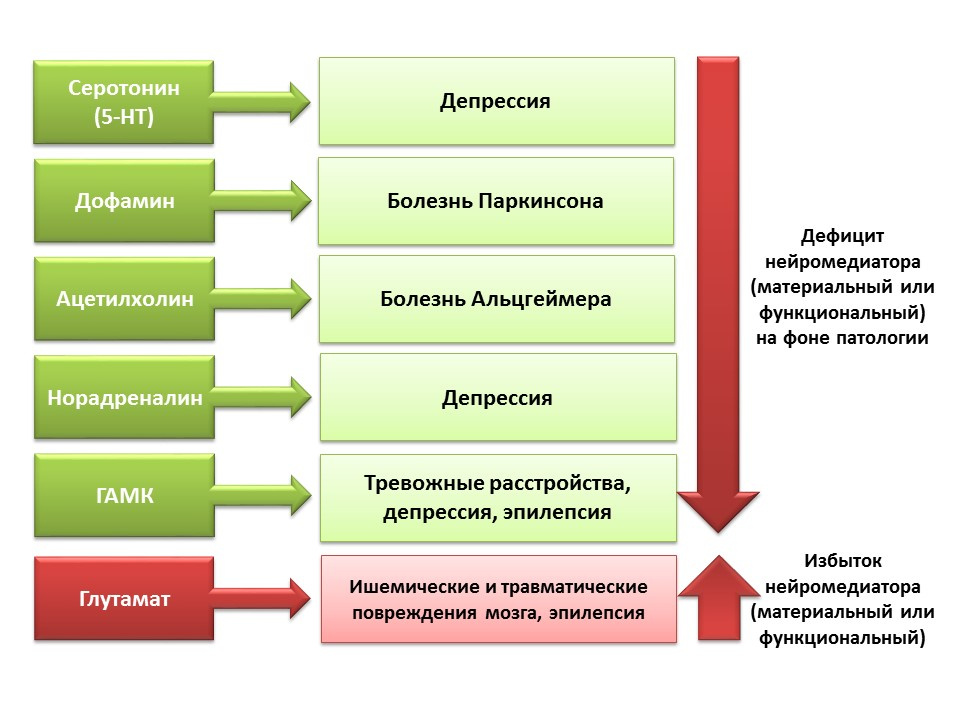
Karena kemungkinan manipulasi farmakologis dari sistem neurotransmitter sistem saraf pusat, kita dapat mengevaluasi kontribusi neurotransmitter ke berbagai tahap neurogenesis otak dewasa.
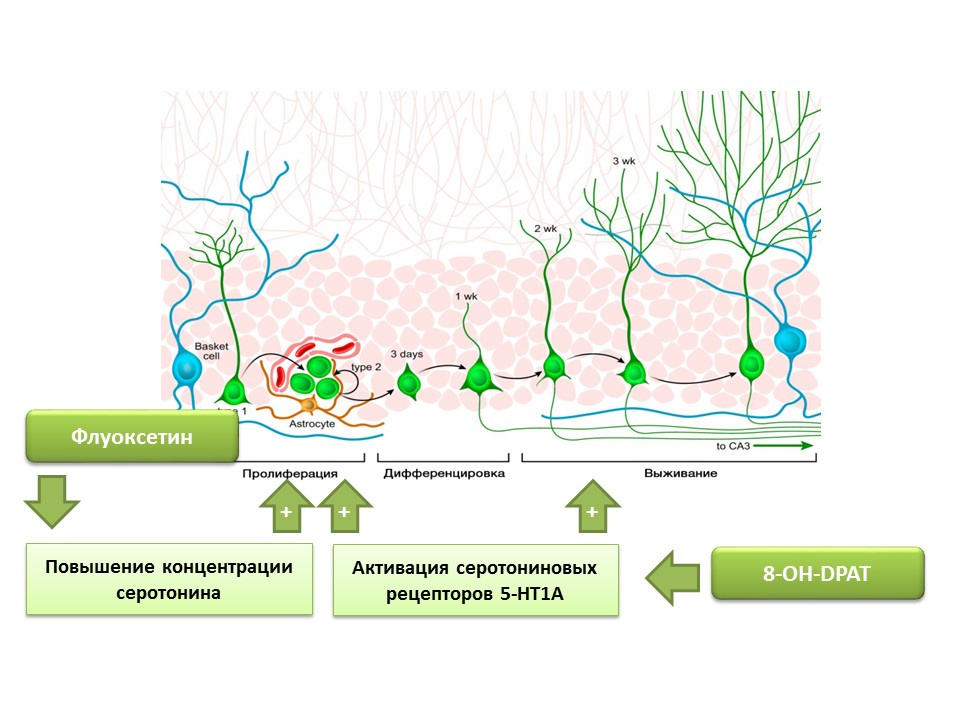
Telah ditetapkan bahwa fluoxetine (antidepresan dari kelompok selective serotonin reuptake inhibitor), yang dapat meningkatkan konsentrasi serotonin dalam sistem saraf pusat, meningkatkan proliferasi sel-sel batang saraf di dentate gyrus dari hippocampus tikus dan primata. Kemudian, serotonin subtipe 1A reseptor (reseptor 5-HT1A) terdeteksi pada sel induk sendiri dan ini konsisten dengan kemampuan zat 8-OH-DPAT (aktivator selektif dari reseptor ini) untuk merangsang proliferasi dan kelangsungan hidup neuron baru pada gyrus dentate pada hewan percobaan (tikus dan hippocampus pada hewan percobaan). tikus).
Primata terkena stres kronis (isolasi sosial), setelah itu perilaku depresi dan cemas dievaluasi, serta neurogenesis hippocampal (post-mortal). Stres kronis menyebabkan penurunan neurogenesis dalam kombinasi dengan defisit perilaku (peningkatan perilaku depresi dan cemas). Pengobatan dengan fluoxetine (antidepresan yang meningkatkan konsentrasi serotonin dalam sistem saraf pusat dengan menghambat reuptake-nya) merangsang neurogenesis dan mencegah perilaku depresi dan cemas.
DOI: 10.1371 / journal.pone.0017600
Eksperimen lain menegaskan peran serotonin dalam regulasi neurogenesis dewasa. Stimulasi kronis reseptor serotonin 5-HT1A dengan 8-OH-DPAT pada tikus menyebabkan peningkatan proliferasi sel-sel induk saraf dan kelangsungan hidup neuron yang berbeda dalam gyrus dentate dari hippocampus dan zona subventrikular, serta peningkatan gliogenesis.
DOI: 10.1016 / j.euroneuro.2009.11.00.00
Eksperimen yang disajikan mengkonfirmasi peran pengaturan penting serotonin dalam proses neurogenesis di otak orang dewasa.
 DOI: 10.4161 / cc.8.18.9512DOI: 10.1016 / j.neuropharm.2011.01.026
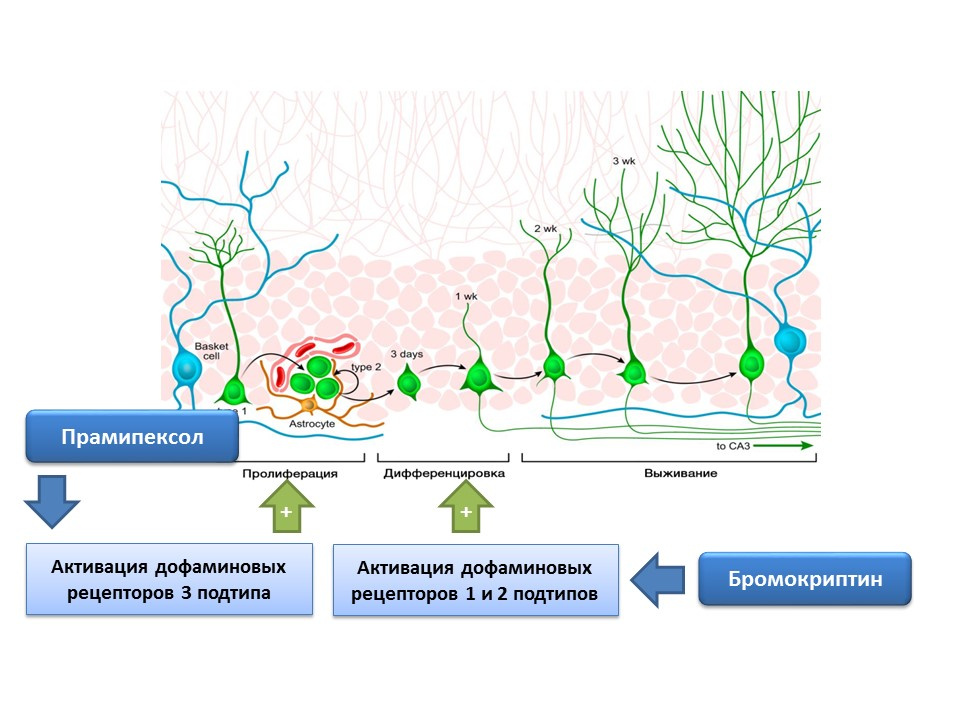
DOI: 10.4161 / cc.8.18.9512DOI: 10.1016 / j.neuropharm.2011.01.026Dopamin juga aktif terlibat dalam regulasi neurogenesis. Telah ditunjukkan bahwa aktivasi reseptor dopamin tipe 1 dan 2 (D1 dan D2) dengan bromokriptin meningkatkan proses diferensiasi sel induk syaraf, sementara stimulasi reseptor D3 dengan pramipexole menyebabkan peningkatan proliferasi.
Pramipexole, agonis reseptor dopamin dengan afinitas yang lebih besar untuk reseptor D3 daripada D2, digunakan pada penyakit Parkinson, yang secara efektif menghilangkan gejala penyakit ini. Selain itu, obat ini memiliki aktivitas neuroprotektif. Dalam sebuah percobaan, efek pramipexole pada neurogenesis dalam kultur sel tikus dievaluasi. Itu menunjukkan bahwa pengobatan kultur sel dengan pramipexole menyebabkan peningkatan ukuran neurosfer (kelompok sel batang yang baru terbentuk) dan sel yang mengandung doublecortin (neuron imatur). Efek stimulasi pramipexole pada neurogenesis dieliminasi oleh penghambat reseptor dopamin - U99194A dan sulpiride. Selain itu, pramipexole telah terbukti meningkatkan rilis BDNF. Hasil yang disajikan menunjukkan bahwa efektivitas pramipexole pada penyakit Parkinson tidak hanya terkait dengan pengisian defisiensi dopamin fungsional, tetapi juga dengan efek stimulasi pada neurogenesis, dan juga menunjukkan peran pengaturan penting dopamin pada tahap proliferasi sel batang saraf.
DOI: 10.1016 / j.neuropharm.2011.01.026
Kehadiran reseptor dopamin dari subtipe 1 dan 2 pada sel-sel induk syaraf dikonfirmasi secara eksperimental, dan peran pengaturan penting dopamin dalam proliferasi dan diferensiasi dalam kultur sel saraf juga ditunjukkan. Secara khusus, pengobatan kultur sel zona subventrikular dengan bromokriptin (stimulator reseptor dopamin subtipe D1 dan D2) dalam kondisi kerusakannya oleh neurotoksin MPTP (memodelkan penyakit Parkinson dalam kultur sel) menyebabkan peningkatan proliferasi dan diferensiasi sel.
DOI: 10.4161 / cc.8.18.9512
Norepinefrin mampu meningkatkan jumlah prekursor sel induk saraf melalui aktivasi reseptor beta-3-adrenergik. Efek ini ditunjukkan menggunakan agonis beta-3-adrenoreseptor selektif (aktivator) - zat BRL37344.
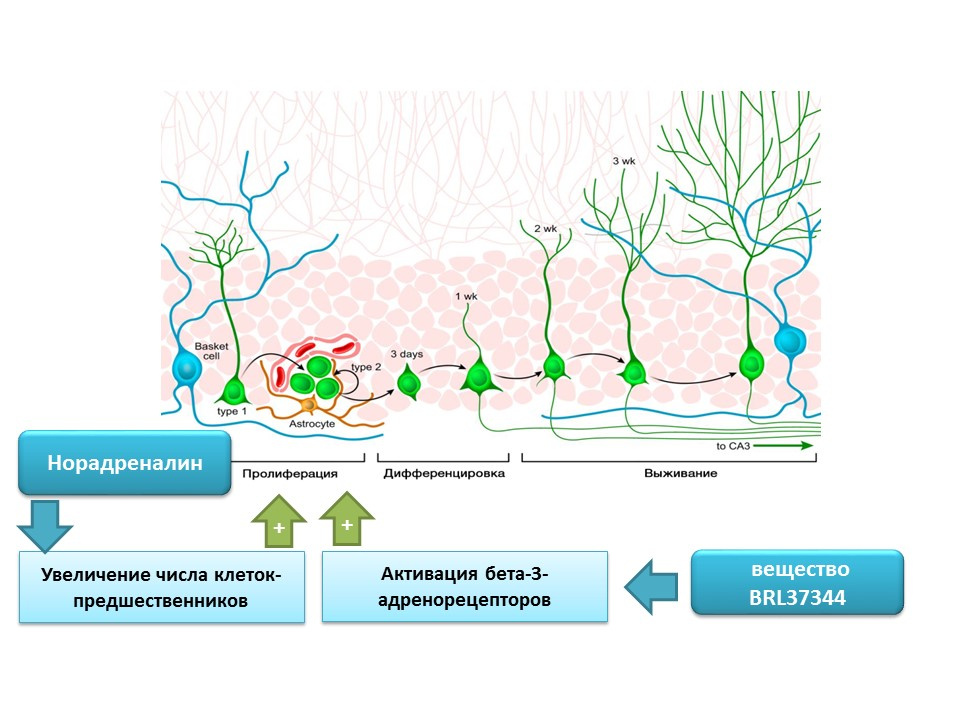
Peran pengaturan norepinefrin dalam proses neurogenesis dewasa dievaluasi dalam studi in vitro yang komprehensif (dalam kultur sel) in vivo (pada tikus). Penambahan norepinefrin ke kultur sel menyebabkan peningkatan ukuran neurosfer (akumulasi sel batang saraf). Administrasi sistemik dari agonis beta-3-adrenoreseptor selektif menyebabkan peningkatan proliferasi sel-sel induk saraf di hippocampus tikus. Studi-studi ini mengkonfirmasi keberadaan adrenoreseptor pada sel saraf yang belum matang, dan juga menunjukkan peran regulasi norepinefrin, yang, tampaknya, diwujudkan melalui reseptor beta-3-adrenergik.
DOI: 10.1523 / JNEUROSCI.3780-09-09Sel-sel induk syaraf, seperti yang disebutkan sebelumnya, mampu menghasilkan faktor pengaturan sendiri. Salah satu faktor ini adalah gamma-aminobutyric acid (GABA) - mediator penghambat utama sistem saraf pusat. Secara khusus, dalam kultur prekursor sel saraf murine, ditunjukkan bahwa sel-sel batang saraf meningkatkan sintesis GABA, yang pada gilirannya meningkatkan proliferasi dengan mengaktifkan glia radial (memunculkan sel-sel induk) dan berkontribusi pada peningkatan ukuran neurosfer (akumulasi sel induk) dalam percobaan.
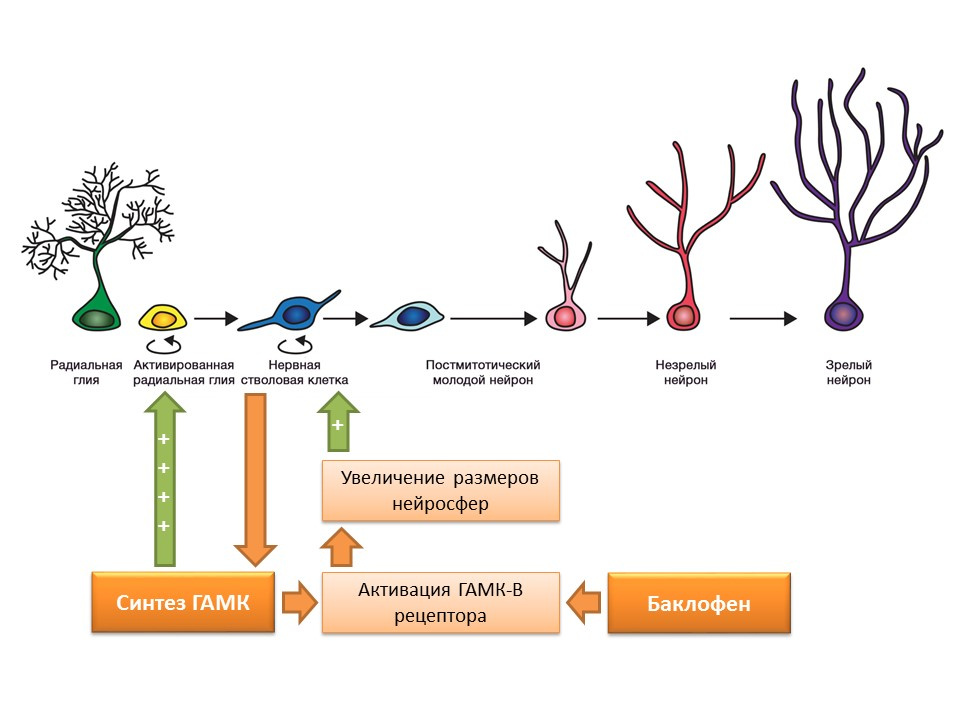
Ditemukan bahwa efek GABA ini diwujudkan melalui reseptor GABA-B. Studi ini menggunakan agonis reseptor GABA-B selektif - baclofen.
DOI: 10.1002 / jcp.21422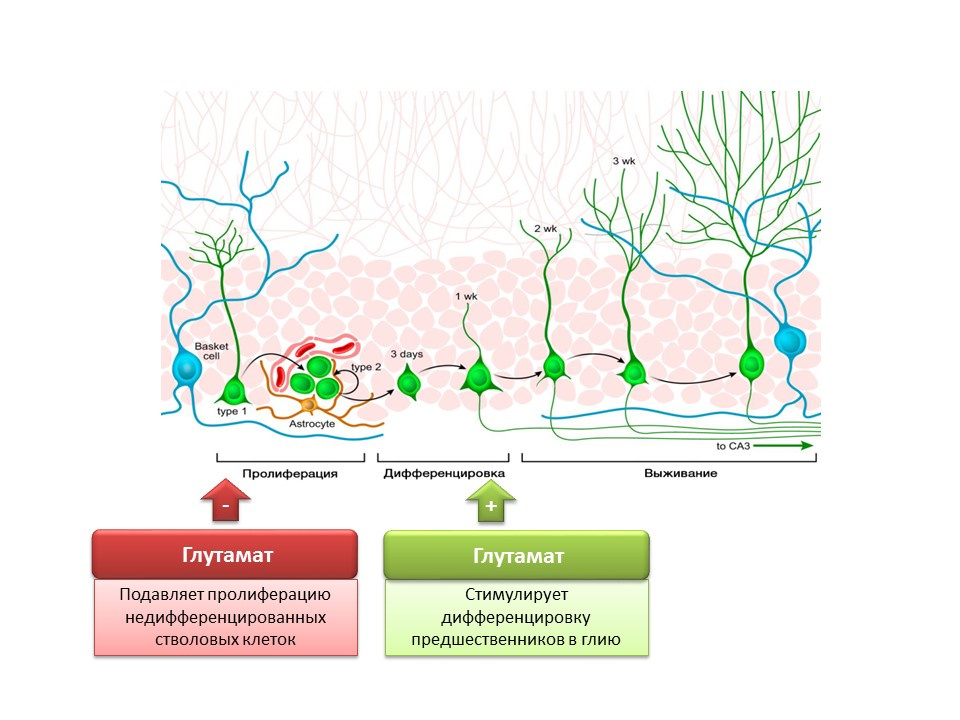 Nakamichi N, Takarada T, Yoneda Y. Neurogenesis dimediasi oleh asam gamma-aminobutyric dan pensinyalan glutamat. J. Pharmacol Sci. 2009; 110 (2): 133-49
Nakamichi N, Takarada T, Yoneda Y. Neurogenesis dimediasi oleh asam gamma-aminobutyric dan pensinyalan glutamat. J. Pharmacol Sci. 2009; 110 (2): 133-49Peran mediator utama yang menarik dalam sistem saraf pusat ada dua. Di satu sisi, glutamat menghambat proliferasi sel batang yang tidak terdiferensiasi. Di sisi lain, itu merangsang diferensiasi prekursor ke garis glial. Dipercayai bahwa rasio glutamat dan GABA tertentu diperlukan untuk mengatur diferensiasi sel induk syaraf menjadi beberapa jenis neuron tertentu. Sebagai contoh, glutamat, seperti yang telah disebutkan, mempromosikan pembentukan sel glial (astrosit), dan GABA mempromosikan pembentukan neuron yang mensintesis GABA itu sendiri (GABAergic neuron).
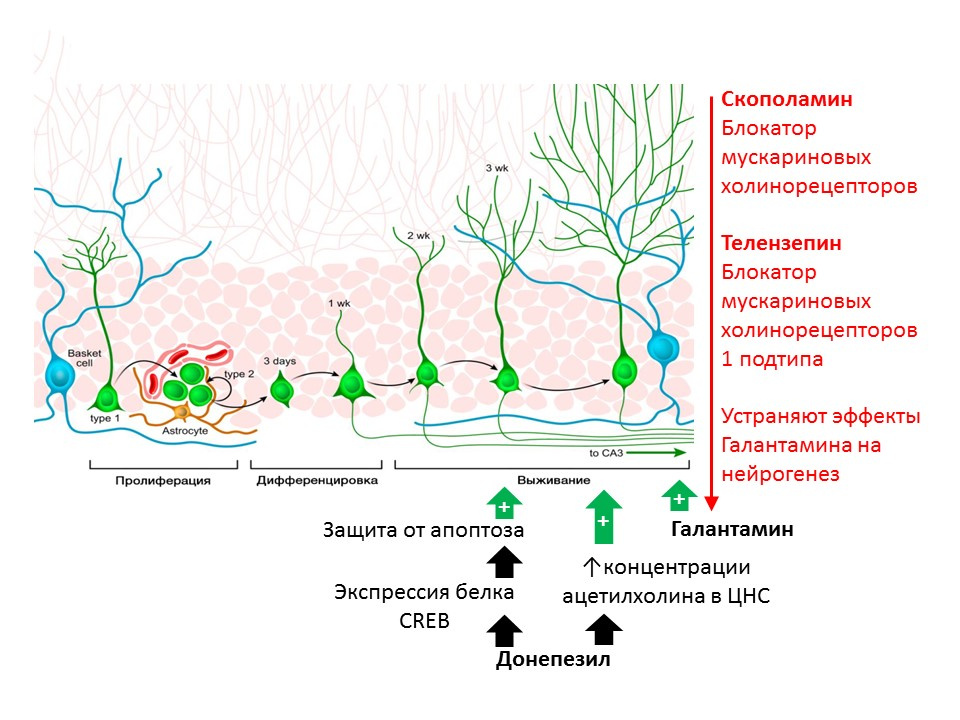 Kotani S et al. H. Donepezil, inhibitor asetilkolinesterase, meningkatkan neurogenesis hippocampal dewasa. Chem Biol Interact. 2008; 175 (1-3): 227-30
Kotani S et al. H. Donepezil, inhibitor asetilkolinesterase, meningkatkan neurogenesis hippocampal dewasa. Chem Biol Interact. 2008; 175 (1-3): 227-30
Kita Y et al. Galantamine mempromosikan neurogenesis hippocampal dewasa melalui reseptor muskarinik dan α7 pada tikus. Int J Neuropsychopharmacol. 2014; 17 (12): 1957-68.Peran pengaturan asetilkolin (ACX) ditunjukkan pada tikus menggunakan zat yang mencegah kehancurannya (inhibitor asetilkolinesterase - enzim yang memecah ACX). Donepezil dan galantamine meningkatkan konsentrasi ACX dalam sistem saraf pusat (donepezil juga meningkatkan ekspresi protein CREB, sebuah faktor transkripsi, dengan demikian meningkatkan perlindungan neuron imatur dari apoptosis) dan meningkatkan kelangsungan hidup neuron yang belum matang. Efek positif dari galantamine pada neurogenesis dihilangkan dengan skopolamin (penghambat semua subtipe reseptor muskarinik muskarinik) dan telenzepine (pemblokir subtipe 1 dari reseptor cholinergik muskarinik), yang menunjukkan realisasi efek ACh pada neurogenesis melalui aktivasi reseptor muskarinik tipe 1 (
Kotani S et al. H. et al. Dr. inhibitor, meningkatkan neurogenesis hippocampal dewasa. Chem Biol Interact. 2008; 175 (1-3): 227-30; Kita Y dkk. Galantamine mempromosikan neurogenesis hippocampal dewasa melalui Muscarinic dan α7 nicotinic receptor pada tikus. Int J Neuropsychopharmacol 2014; 17 (12): 1957-68. ).
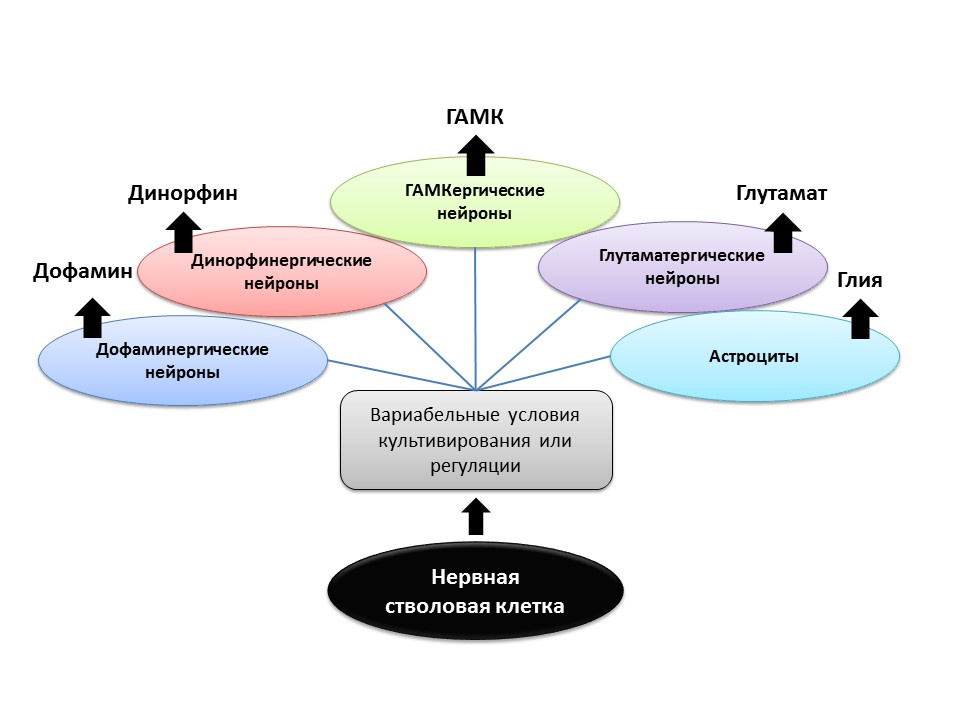
SumberShetty AK. Sel-sel nenek moyang dari daerah CA3 dari hippocampus tikus hari ke-19 embrio menghasilkan fenotipe neuron spesifik daerah secara in vitro. Hippocampus. 2004; 14 (5): 595-614
Gómez-Lira G et al. Diprogram dan diinduksi fenotip dari sel granul hippocampal. J Neurosci. 2005; 25 (30): 6939-46
Nakamichi N, Takarada T, Yoneda Y. Neurogenesis dimediasi oleh asam gamma-aminobutyric dan pensinyalan glutamat. J. Pharmacol Sci. 2009; 110 (2): 133-49
Arena E. Rekayasa fenotip dopaminergik dalam sel batang / prekursor: peran Nurr1, sinyal yang diturunkan dari glia, dan Wnts. Ann NY Acad Sci. 2005; 1049: 51-66
Di bawah kondisi eksperimental (pada hewan atau dalam kultur sel), ditunjukkan bahwa dengan mengubah rasio faktor pengatur dan menambahkan neurotransmiter ke sel induk syaraf itu sendiri, fenotipe neurotransmitter (yaitu, fungsi sel masa depan) dari neuron yang baru terbentuk dapat "diprogram". Jadi, misalnya, kultur sel induk dengan astrosit memungkinkan Anda mendapatkan populasi neuron glutamatergik (neuron yang menghasilkan glutamat), dan dengan dopamin - dopaminergik.
Ada kemungkinan bahwa tindakan terarah seperti itu di masa depan dapat digunakan untuk pembentukan sel-sel saraf sel fenotipe tertentu. Sebagai contoh, jika kita tahu jenis apa yang hilang pada penyakit tertentu (dengan penyakit Parkinson, yang dopaminergik mati, dengan Alzheimer, kolinergik).
Tetapi saat ini, aspek neurogenesis ini masih belum diselidiki sepenuhnya, dan masih terlalu dini untuk berbicara tentang pengaturan neurogenesis yang diprogramkan (ada beberapa studi).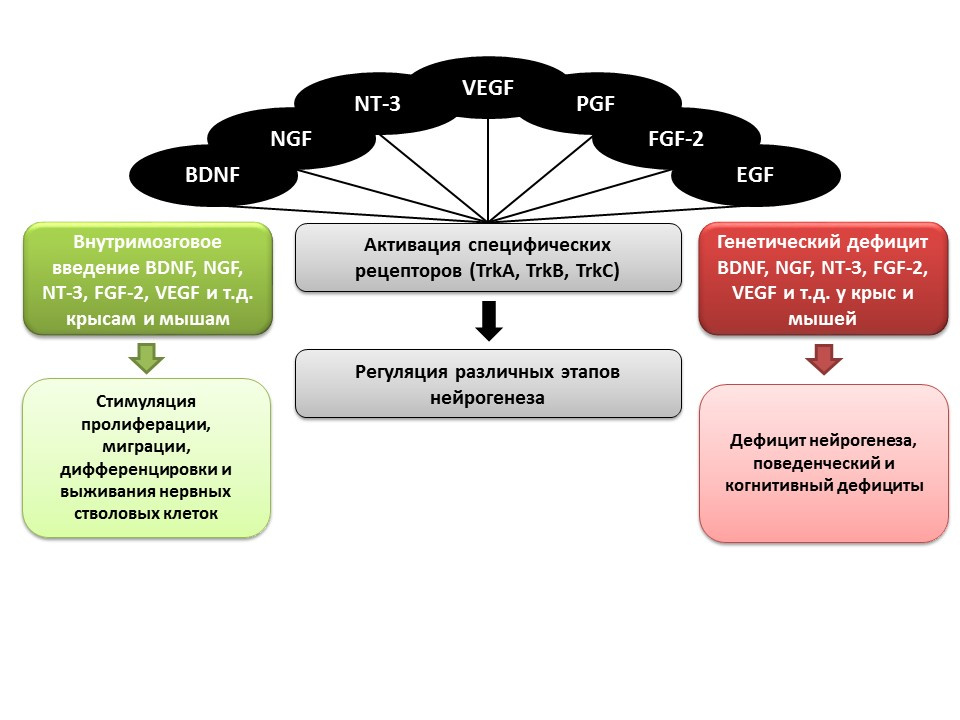
SumberPencea V et al. Infusion of BDNF into the lateral ventricle of the adult rat leads to new neurons in the parenchyma of the striatum, septum, thalamus, and hypothalamus. J.Neurosci. 2001;21:6706–6717
Bath KG et al. Variant brain-derived neurotrophic factor (Val66Met) alters adult olfactory bulb neurogenesis and spontaneous olfactory discrimination. J Neurosci. 2008; 28:2383–2393
Gascon E, Vutskits L, Zhang H, et al. Sequential activation of p75 and TrkB is involved in dendritic development of subventricular zone-derived neuronal progenitors in vitro. Eur J Neurosci. 2005;21:69–80
Kahn MA, Kumar S, Liebl D, et al. Mice lacking NT-3, and its receptor TrkC, exhibit profound deficiencies in CNS glial cells. Glia. 1999;26:153–165
Shimazu K, Zhao M, Sakata K, et al. NT-facilitates hippocampal plasticity and learning and memory by regulating neurogenesis. Learn Mem. 2006; 13(3):307-15)
Zhao M, Li D, Shimazu K, et al. Fibroblast growth factor receptor-1 is required for long-term potentiation, memory consolidation, and neurogenesis. Biol Psychiatry. 2007;62:381–390
Peran penting dalam regulasi neurogenesis, seperti yang disebutkan sebelumnya, dimainkan oleh faktor pertumbuhan dan neurotropik, termasuk:- cerebral neurotrophic factor (BDNF)
- faktor pertumbuhan saraf (NGF)
- neurotrophin-3 (NT-3)
- faktor pertumbuhan endotel vaskular (VEGF)
- faktor pertumbuhan trombosit (PGF)
- fibroblast growth factor-2 (FGF-2)
- faktor pertumbuhan epidermis (EGF)
Dalam percobaan pada hewan (tikus dan tikus), ditunjukkan bahwa pemberian intraserebral dari faktor-faktor di atas meningkatkan semua tahap neurogenesis. Defisiensi kongenital (tikus transgenik dengan gen faktor yang relevan yang gagal) menyebabkan gangguan neurogenesis, serta defisit perilaku dan kognitif. Data ini mengkonfirmasi peran pengaturan penting dari faktor-faktor ini dalam neurogenesis.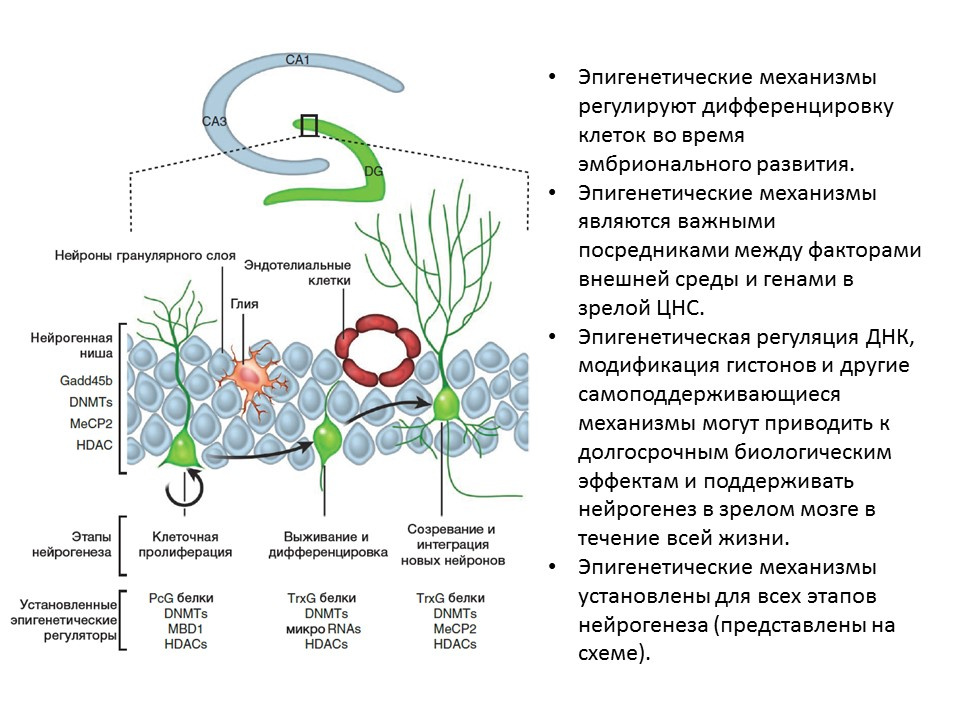 Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. koreografer epigenetik neurogenesis di otak mamalia dewasa. Nat Neurosci. 2010; 13 (11): 1338-44.Faktor regulasi epigenetik telah ditetapkan untuk semua tahap neurogenesis, misalnya:
Ma DK, Marchetto MC, Guo JU, Ming GL, Gage FH, Song H. koreografer epigenetik neurogenesis di otak mamalia dewasa. Nat Neurosci. 2010; 13 (11): 1338-44.Faktor regulasi epigenetik telah ditetapkan untuk semua tahap neurogenesis, misalnya:- histone deacetylases (HDACs)
- DNA methyl transferase (DNMTs)
- RNA mikro
- dan lainnya.
SumberCoras R, Siebzehnrubl FA, Pauli E, et al. Low proliferation capacities of adult hippocampal stem cells correlate with memory dysfunction in humans. Brain. 2010;133(11):3359-72
Cheyne JE, Grant L, Butler-Munro C, et al. Synaptic integration of newly generated neurons in rat dissociated hippocampal cultures. Mol Cell Neurosci. 2011;47(3):203-14
Hernández-Rabaza V, et al. Neuroscience. 2009;159(1):59-68).
Mochizuki N, Moriyama Y, Takagi N, et al. Intravenous injection of neural progenitor cells improves cerebral ischemia-induced learning dysfunction. Biol Pharm Bull. 2011;34(2):260-5
Sahay A., Hen R. Hippocampal neurogenesis and depression. Novartis Found Symp. 2008;289:152-60
Toni N, Laplagne DA, Zhao C, et al. Neurons born in the adult dentate gyrus form functional synapses with target cells. Nat Neurosci. 2008; 11:901–7
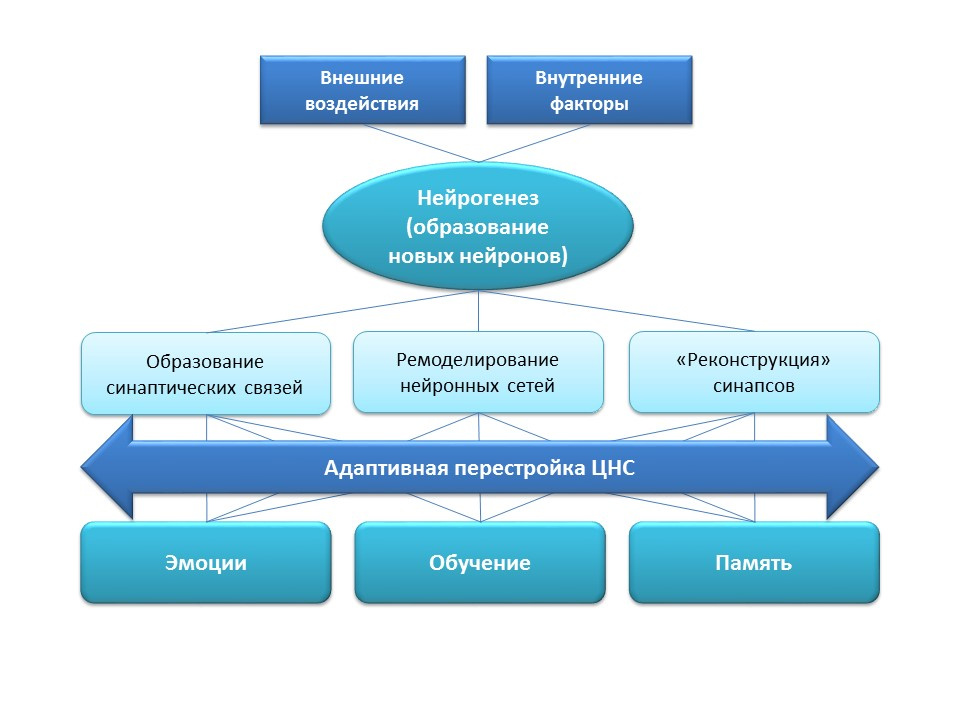
Neurogenesis melakukan fungsi adaptif yang penting dalam sistem saraf pusat, yang terdiri dalam pembentukan koneksi sinaptik baru (dengan partisipasi sel-sel saraf baru), remodeling (restrukturisasi) jaringan saraf yang ada tergantung pada pengaruh faktor eksternal (pelatihan, aktivitas fisik, stres, dll.), "Rekonstruksi" dari koneksi sinaptik yang hilang (di bawah pengaruh faktor eksternal dan internal).Semua perubahan adaptasi ini memiliki dampak langsung pada respons emosional, proses pembelajaran, dan memori. Neurogenesis membantu sistem saraf mempertahankan "plastisitas" -nya, mengubah dan membangun kembali dalam kondisi dan tugas baru.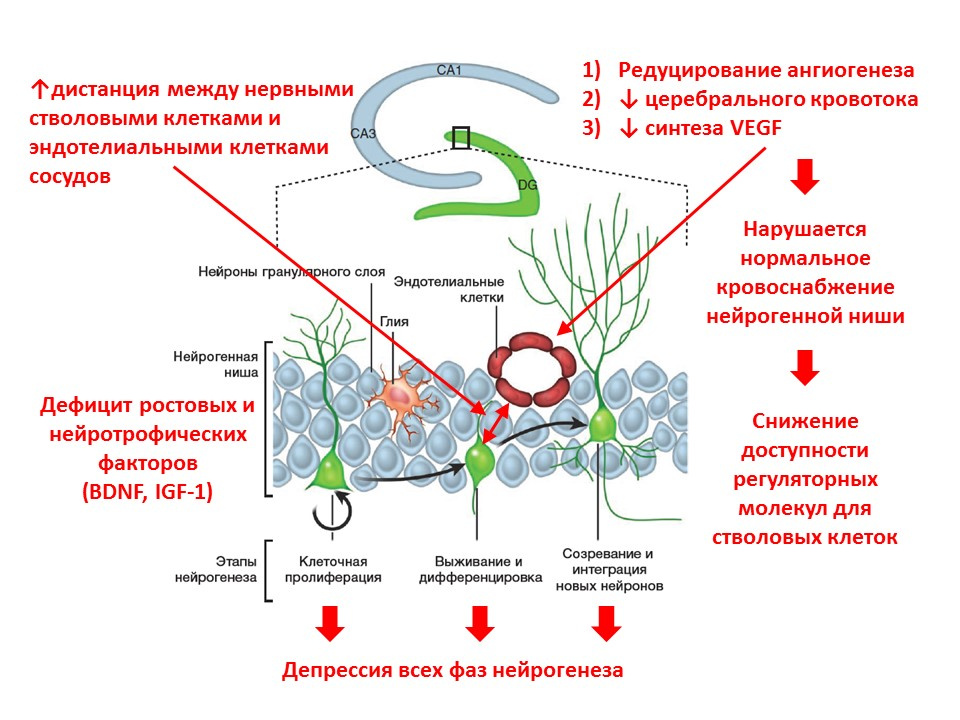
SumberLichtenwalner RJ et al. Neuroscienc 2001;107, 603–613
Luo J, et al. Aging Cell. 2006;5(2):139-52
Cuppini R et al. Hippocampus. 2006;16(2):141-8;
Shetty AK, Hattiangady B, Shetty GA. Glia 2005; 51, 173–186
Drapeau E, Nora Abrous D. Aging Cell. 2008;7(4): 569-89
Hattiangady B, Shetty AK. Neurobiol. Aging.2008; 29: 129–177
Seiring bertambahnya usia, proses neurogenesis mulai memudar. Pada tingkat molekuler, penuaan disertai dengan perubahan neurogenesis berikut:- kekurangan faktor pertumbuhan dan neurotropin - salah satu regulator utama;
- keseimbangan neurotransmitter otak berubah (jumlah beberapa mediator menurun, yang lain meningkat, sebaliknya);
- intensitas semua fase neurogenesis menurun;
- pasokan darah ke ceruk neurogenik berkurang (angiogenesis berkurang, ekspresi faktor pertumbuhan endotel vaskular - VEGF berkurang), yang mengurangi ketersediaan faktor pengaturan untuk sel punca;
- jarak antara sel punca saraf dan sel endotel vaskular meningkat (normal, sel punca ditransformasikan di dekat pembuluh).
Namun, perubahan yang berkaitan dengan usia dalam neurogenesis tidak dapat diubah, dan fungsi otak adaptif dapat distimulasi.- , , .. (Jakubs K et al. Inflammation regulates functional integration of neurons born in adult brain. J Neurosci. 2008 Nov 19;28(47):12477-88).
- , . . (Bachstetter AD et al. Fractalkine and CX3CR1 regulate hippocampal neurogenesis in adult and aged rats. Neurobiol Aging. 2011;32(11):2030-44).
Gambar menunjukkan informasi tentang stimulasi neurogenesis pada tikus tua dengan induksi peradangan saraf dan pemberian protein fralin. Data ini menunjukkan fakta bahwa otak mempertahankan fungsi adaptif yang dibawa neurogenesis.
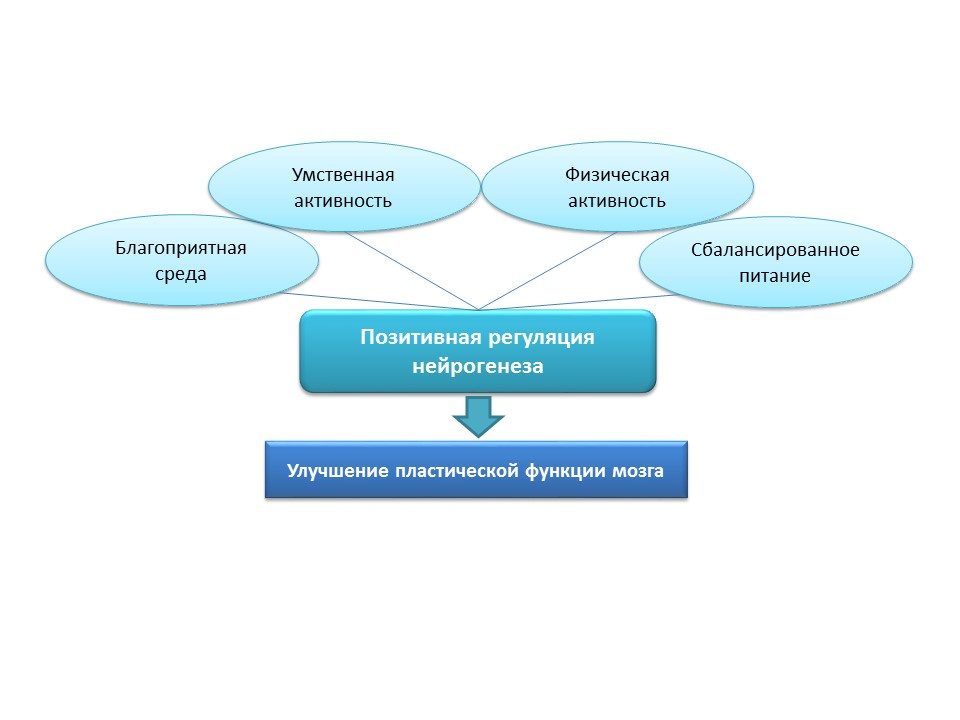
Untuk stimulasi alami neurogenesis pada orang tua, strategi ini tampaknya terlalu agresif, oleh karena itu, rangsangan positif alami harus dianggap sebagai "pelatihan" dan faktor neurogenesis "pendukung": lingkungan yang menguntungkan, aktivitas mental, aktivitas fisik, nutrisi seimbang.
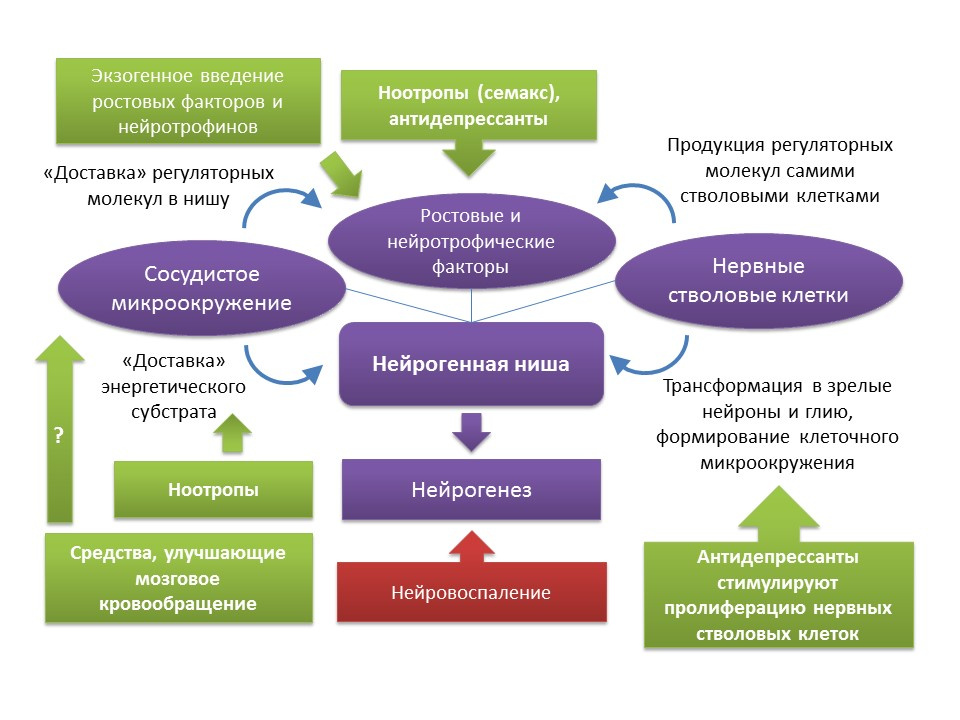 Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV et al. Int J Pept Res Ther (2016) 22: 197.
Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV et al. Int J Pept Res Ther (2016) 22: 197.
Jakubs K et al. Peradangan mengatur integrasi fungsional neuron yang lahir di otak orang dewasa. J Neurosci. 2008 19 Nov; 28 (47): 12477-88
Agen Taupin P. Nootropic merangsang neurogenesis. Expert Opin Ther Pat. 2009 Mei; 19 (5): 727-30.Seperti disebutkan sebelumnya, meskipun ada perubahan terkait usia yang dialami oleh ceruk neurogenik, fungsi neurogenesis dapat dipulihkan jika ada insentif tertentu. Perlu dicatat bahwa tingkat penuaan dan perubahan terkait usia dalam neurogenesis yang terkait dengan proses ini heterogen dan ditentukan oleh karakteristik individu tubuh. Secara khusus, diyakini bahwa orang dengan tingkat neurogenesis yang awalnya lebih tinggi memiliki tingkat neuroplastisitas otak yang lebih tinggi dan, oleh karena itu, lebih tahan terhadap perubahan terkait usia dalam sistem saraf pusat. Namun, saat ini tidak ada cara untuk memiliki efek komprehensif pada seluruh ceruk neurogenik. Seperti disebutkan sebelumnya, ceruk neurogenik itu sendiri adalah sejenis lingkungan mikro yang mencakup banyak elemen (lingkungan mikro seluler dan vaskular, seperangkat faktor pertumbuhan dan neurotropik). Di satu sisi, ada pengalaman farmakologis yang cukup solid dalam regulasi neurogenesis karena efek pada komponen individu dari "lingkungan mikro" ini (pengenalan atau induksi molekul pengaturan endogen; stimulasi oleh obat proliferasi, diferensiasi dan kelangsungan hidup neuron yang baru terbentuk; peningkatan sirkulasi otak dan metabolisme energi dalam sistem saraf pusat). Di sisi lain, itu adalah fakta yang diketahui bahwa sel-sel induk itu sendiri menghasilkan pertumbuhan dan faktor-faktor neurotropik - BDNF, NGF, VEGF, dll. (
Guzman R. Terapi stroke seluler: dari penggantian sel hingga dukungan trofik. Tinjauan Ahli Terapi Kardiovaskular.2009; 7 (10) ): 1187-1190 ). Hal ini dapat mengarah pada kesimpulan bahwa, untuk mengembalikan fungsi ceruk neurogenik, seseorang dapat menggunakan, misalnya, terapi dengan sel-sel induk sendiri atau dengan agen yang dapat merangsang proliferasi sel-sel induk saraf. Dengan cara tersebut, sebagaimana telah disebutkan, adalah antidepresan dari berbagai kelompok farmakologis. Bukti klinis dari penurunan risiko pikun setelah pengobatan (seringnya komplikasi setelah depresi pada usia lebih dini) dari pengobatan antidepresan dapat secara tidak langsung mengkonfirmasi kesimpulan seperti itu. Perlu dicatat bahwa data tentang efek antidepresan terhadap risiko demensia kontroversial. Dengan demikian, ditemukan bahwa penggunaan antidepresan trisiklik dikaitkan dengan penurunan risiko demensia, sementara MAO inhibitor (monoamine oksidase), antidepresan heterosiklik dan SSRI (selektif serotonin reuptake inhibitor), sebaliknya, dapat meningkatkan risiko atau tidak memiliki efek pada perkembangan demensia (
Kessing LV, Forman JL, Andersen PK. Apakah antidepresan terus melindungi terhadap demensia pada pasien dengan gangguan depresi berat? Int Clin Psychopharmacol. 2011; 26 (6): 316-22; Lee CW et al. Pengobatan antidepresan dan risiko demensia: sebuah studi kasus-kontrol retrospektif berbasis populasi J Clin Psychiatry. 2016 Jan; 77 (1): 117-22; quiz 122 ). Namun demikian, data klinis ini memerlukan kehati-hatian ketika menafsirkan, karena ulasan klinis ini tidak memperhitungkan sejumlah faktor (riwayat merokok pasien, konsumsi alkohol, tingkat keparahan dan bentuk gangguan depresi, patologi yang bersamaan, dll.).
Kelompok obat lain yang menarik yang dapat dianggap sebagai agen neurogenik potensial adalah nootropik. Obat-obatan nootropik memiliki sejumlah fitur khusus: 1) bertindak hanya terhadap latar belakang patologi fungsi mnestik; 2) memiliki sifat kumulatif tindakan; 3) beragam mekanisme aksi dan struktur kimianya; 4) bertindak seperti psikostimulan, tetapi tidak memiliki efek samping yang melekat; 5) sampai saat ini, tidak ada data yang meyakinkan tentang kemanjuran klinis nootropics. Dipercayai bahwa obat-obatan nootropik memiliki efek kompleks pada sistem saraf pusat: mereka meningkatkan sirkulasi otak, metabolisme energi, berinteraksi dengan reseptor dari sebagian besar neurotransmiter (GABA, glutamat, asetilkolin). Dalam studi eksperimental, kemampuan potensial nootropik tertentu untuk merangsang neurogenesis telah ditunjukkan. Secara khusus, piracetam meningkatkan proses diferensiasi dalam kultur sel batang saraf manusia (
agen Taupin P. Nootropic merangsang neurogenesis. Ahli Opin Ther Pat. 2009 Mei; 19 (5): 727-30 ), obat lain nootropik Semax meningkatkan ekspresi gen lebih dari 20 pertumbuhan dan faktor neurotropik di otak tikus setelah pemberian intraperitoneal dalam kondisi pemodelan stroke iskemik (
Medvedeva, EV, Dmitrieva, VG, Stavchansky, VV dan lain-lain. Int J Pept Res Ther (2016) 22: 197 ), yang juga menunjukkan potensi efek proneirogenik dari obat tersebut. . Mengingat pengetahuan yang buruk tentang nootropik, sulit untuk berbicara tentang mekanisme spesifik aktivitas neurogenik mereka, di mana baik efek kompleksnya pada sistem saraf pusat dan beberapa komponen tertentu dapat berperan. Jelas, masalah ini membutuhkan studi lebih lanjut yang lebih rinci.
Kelompok obat lain yang dapat merangsang neurogenesis adalah pengoreksi sirkulasi otak (misalnya, nimodipine atau pentoxifylline). Namun, data tentang efek obat ini pada neurogenesis langka. Dalam percobaan pada tikus, ditunjukkan bahwa pengobatan dengan pentoxifylline meningkatkan memori jangka pendek dan penurunan apoptosis neuron hippocampal dalam kondisi iskemia serebral, yang dapat menunjukkan sifat neuroprotektifnya (
Park JH et al. Pentoxifylline Mengurangi Perinatal Hipoksik-Iskemia-Terinduksi Memori Jangka Pendek) oleh Menekan Apoptosis dalam Hippocampus of Rat Pups. Int Neurourol J 2016; 20 (2): 107-113 ). Nimodipine, sebaliknya, menunjukkan kemampuan untuk menekan neurogenesis yang distimulasi iskemia dalam hippocampus tikus (Luo CX dkk. Blokade saluran Ca yang diberi tegangan tipe L menghambat neurogenesis yang diinduksi iskemia dengan meregulasi ekspresi iNOS pada tikus dewasa. Jurnal neurokimia, 2005) , yang, tampaknya, terkait dengan mekanisme aksi langsungnya - blokade saluran kalsium tipe-L.
Untuk mendapatkan gambaran lengkap tentang manipulasi farmakologis dari ceruk neurogenik dalam kondisi perubahan terkait usia, diperlukan penelitian yang lebih terperinci yang akan memperluas pemahaman tentang aktivitas obat neurogenik dalam kondisi yang relevan dan memungkinkan kita untuk menyimpulkan bahwa ada arahan yang menjanjikan dalam menciptakan obat yang akan mencegah dan memperbaiki penurunan yang berkaitan dengan usia dalam aktivitas neurogenik otak.
Peran neurogenesis dalam berbagai patologi sistem saraf pusat
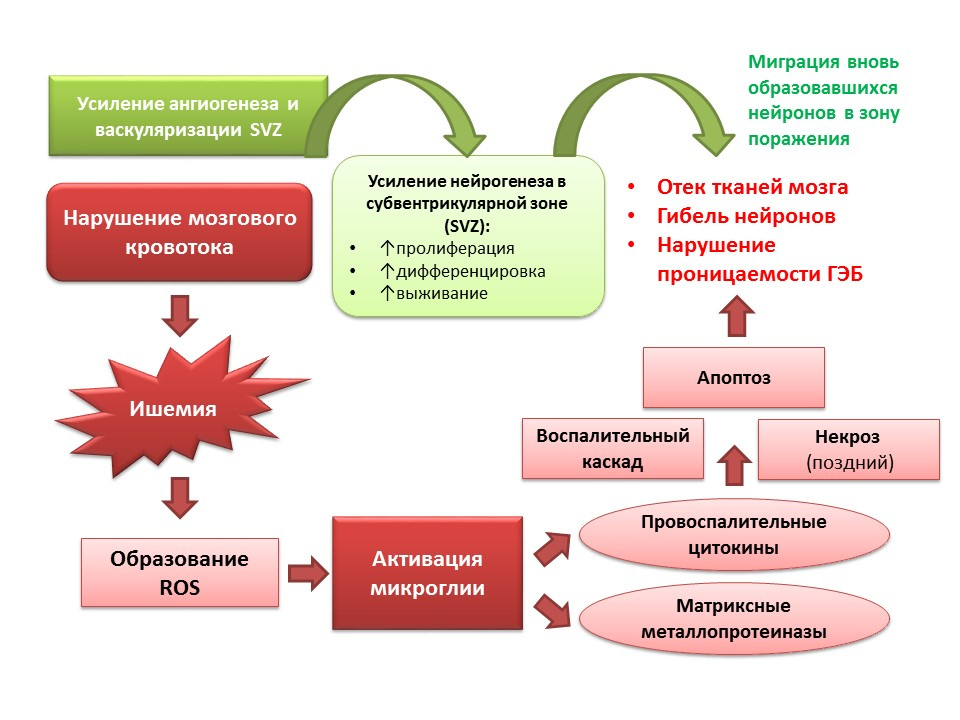
SumberBordt, EA, Polster, BM (2014). NADPH Spesies Oksigen Reaktif yang diturunkan dari Oksidase dan Mitokondria dalam Aktivasi Mikroglial Proinflamasi: A Bipartisan Affair? Radic Biol Med Gratis, 34-46
Liu J, Solway K, Messing RO, Sharp FR. Peningkatan neurogenesis pada dentate gyrus setelah iskemia global sementara pada gerbil. J Neurosci. 1998; 18 (19): 7768-78
Zhang ZG, Zhang L, Jiang Q, dkk. VEGF meningkatkan angiogenesis dan meningkatkan kebocoran sawar darah-otak di otak iskemik. J Clin Invest. 2000; 106: 829-38
Nakayama D, T Matsuyama, Ishibashi-Ueda H, et al. Sel-sel punca / progenitor saraf yang diinduksi cedera dalam korteks serebral manusia pasca stroke. Eur J Neurosci. 2010; 31 (1): 90-8)
Minger SL, Ekonomou A, Carta EM, dkk. Neurogenesis endogen di otak manusia setelah infark serebral. Regen Med. 2007; 2 (1): 69-74).
Neurogenesis juga melakukan fungsi adaptif dengan latar belakang patologi SSP. Secara khusus, stroke iskemik menyebabkan kematian sel-sel saraf (skema patogenesis yang disederhanakan ditunjukkan pada slide). Namun, dengan iskemia, sejumlah kecil neuron mati dengan cepat (menit) - inilah yang disebut nukleus iskemia. Sebagian besar neuron kekurangan glukosa dan oksigen, tetapi mereka tetap dapat bertahan selama beberapa jam (jendela terapeutik untuk membantu) - inilah yang disebut penumbra atau penumbra iskemia. Di bawah kondisi kerusakan otak iskemik, neurogenesis diaktifkan di zona subventrikular ventrikel lateral dan neuron yang baru terbentuk bermigrasi ke zona penumbra.
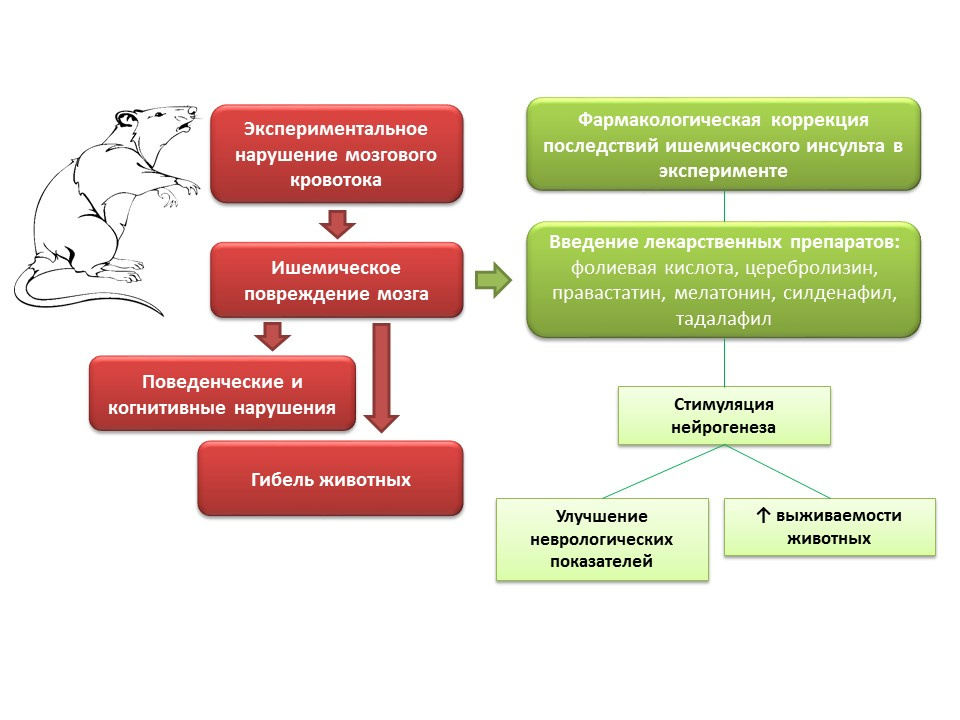
SumberZhang, RL, Zhang, ZG, & Chopp, M. (2013). Menargetkan nitric oxide dalam pengobatan restoratif subakut stroke iskemik. Pendapat Ahli tentang Obat Investigasi, 22 (7), 843-851.
Chern CM, Liao JF, Wang YH, Shen YC. Melatonin memperbaiki fungsi saraf dengan mempromosikan neurogenesis endogen melalui reseptor melatonin MT2 pada tikus iskemik-stroke. Radic Biol Med Gratis. 2012; 52 (9): 1634-47
Zhang X, Huang G, Liu H, dkk. Asam folat meningkatkan pensinyalan takik, neurogenesis hipokampus, dan fungsi kognitif pada model tikus iskemia serebral. Nutr Neurosci. 2012; 15 (2): 55-61
Zhang C, Chopp M, Cui Y, dkk. Cerebrolysin meningkatkan neurogenesis di otak iskemik dan meningkatkan hasil fungsional setelah stroke. J Neurosci Res. 2010 15 November; 88 (15): 3275-81
Zhang RL, Zhang Z, Zhang L, dkk. Pengobatan yang tertunda dengan sildenafil meningkatkan neurogenesis dan meningkatkan pemulihan fungsional pada tikus tua setelah iskemia serebral fokal. J Neurosci Res. 2006; 83 (7): 1213-9
Zheng Z, Chen B. Efek Pravastatin pada perlindungan saraf dan neurogenesis setelah iskemia serebral pada tikus. Neurosci Bull. 2000; 23 (4): 189-97
Dalam percobaan pada hewan, ketika memodelkan gangguan aliran darah otak, gangguan neurologis (defisit kognitif dan perilaku) diamati, serta sebagian besar kematian hewan. Pengenalan obat-obatan kepada hewan-hewan ini dengan mekanisme aksi yang berbeda, tetapi dengan fitur umum - kemampuan untuk merangsang neurogenesis (asam folat, serebrolysin, pravastatin, melatonin, sildenafil, tadalafil) - meningkatkan parameter neurologis hewan dan secara signifikan mengurangi kematian.
Apa prospek untuk memanipulasi neurogenesis untuk kerusakan otak iskemik?- Kemungkinan menggunakan obat-obatan tertentu dari kelompok neuroprotektor (cerebrolysin) sebagai bagian dari perawatan kompleks stroke iskemik akut untuk mencegah kematian neuron di penumbra.
- Bagi banyak obat yang telah menunjukkan kemampuan untuk menstimulasi neurogenesis dan meningkatkan keadaan neurologis hewan setelah memodelkan stroke iskemik, efek ini tidak mendasar, oleh karena itu, penggunaan klinisnya diperumit dengan adanya efeknya sendiri, yang mungkin tidak diinginkan.
- Di sisi lain, studi tentang mekanisme yang mendasari efek neuroprotektif adalah tugas yang penting, karena dapat memberikan dasar untuk pengembangan obat baru yang sangat efektif secara fundamental untuk terapi restorasi stroke iskemik.
- Regulasi farmakologis neurogenesis, dengan latar belakang kerusakan otak iskemik, membuka kemungkinan menciptakan kelompok obat baru yang mengurangi kematian dan meningkatkan kualitas hidup pasien setelah stroke iskemik.
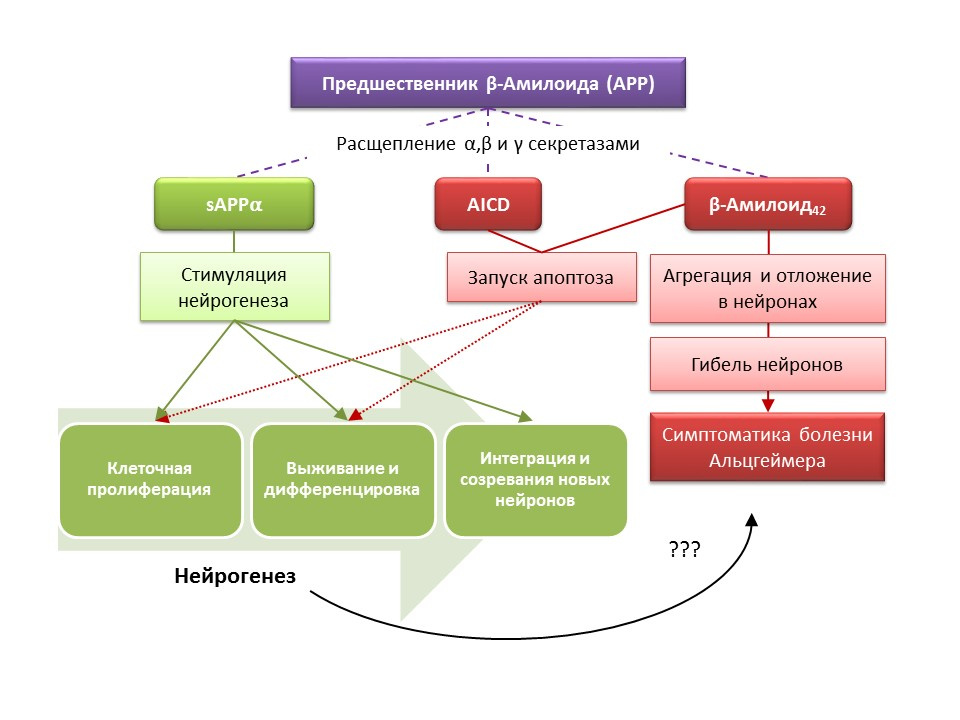
SumberYu Y et al. Peningkatan neurogenesis hippocampal pada tahap progresif fenotip penyakit Alzheimer dalam model tikus transgenik ganda APP / PS1. Hippocampus. 2009; 19 (12): 1247-53
Ghosal K, Stathopoulos A, Pimplikar SW. Domain intraseluler APP merusak neurogenesis dewasa pada tikus transgenik dengan menginduksi peradangan saraf. Plo satu. 2010; 5 (7): e11866
Mu Y, Gage FH. Neurogenesis hippocampal dewasa dan perannya dalam penyakit Alzheimer. Mol Neurodegener. 2011; 6: 85
Jin K, Peel AL, Mao XO, dkk. Peningkatan neurogenesis hippocampal pada penyakit Alzheimer. Proc Natl Acad Sci USA. 2004; 101 (1): 343–347
Penyakit Alzheimer (AD) adalah penyakit neurodegeneratif yang disertai dengan kematian neuron kolinergik (neuron yang menghasilkan asetilkolin). Penyebab penyakit Alzheimer saat ini tidak diketahui secara pasti, penyakit ini dianggap multifaktorial. Patogenesis AD didasarkan pada pelanggaran metabolisme protein beta-amiloid, yang masing-masing fraksi diendapkan di neuron sistem saraf pusat dan menyebabkan kematiannya. Fraksi amiloid mempengaruhi neurogenesis dengan cara yang berbeda, sehingga prekursor amiloid-alfa (sAPPα) yang dapat larut menstimulasi semua tahapan neurogenesis, sedangkan domain intraseluler dari prekursor amiloid (AICD) dan beta-amillo-42 menyebabkan apoptosis sel batang saraf, mengurangi proliferasi dan tingkat kelangsungan hidup. Aktivasi neurogenesis tercatat sudah pada tahap awal AD, ketika masih belum ada neurodegenerasi dan demensia. Rupanya, neurogenesis terhadap DA juga memainkan fungsi adaptif. Pada sebagian besar model hewan AD (tikus transgenik dengan gangguan metabolisme beta-amiloid) dan bahan post-mortem dari pasien AD, tercatat peningkatan jumlah sel positif-BrdU. Namun, ada bukti kurangnya perubahan neurogenesis pada beberapa model hewan AD dan bahan post-mortem dari beberapa pasien dengan AD. Akhirnya, pertanyaan tetap terbuka tentang kemampuan sel yang baru terbentuk untuk menggantikan neuron yang mati pada AD.
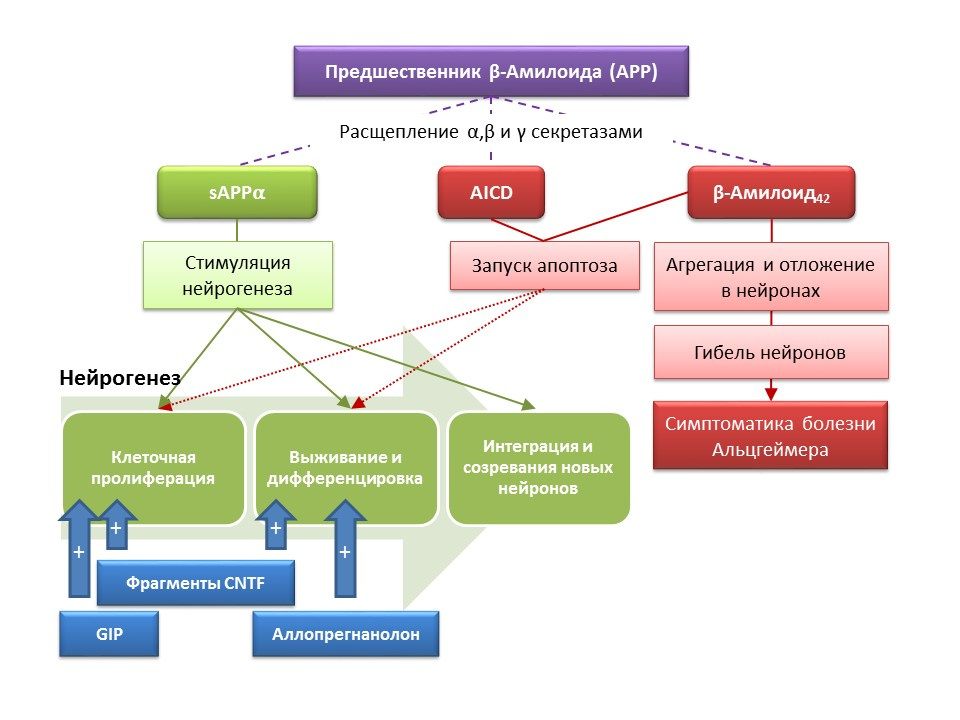 DOI: 10.3233 / JAD-2011-110914DOI: 10.1016 / j.ejphar.2011.11.007DOI: 10.1371 / journal.pone.0024293
DOI: 10.3233 / JAD-2011-110914DOI: 10.1016 / j.ejphar.2011.11.007DOI: 10.1371 / journal.pone.0024293Studi eksperimental pada pendekatan baru untuk koreksi farmakologis penyakit Alzheimer telah menunjukkan kemampuan sejumlah zat untuk merangsang neurogenesis pada tikus transgenik (pada tikus, metabolisme normal beta-amiloid adalah model hewan dari penyakit Alzheimer) dalam kombinasi dengan peningkatan reaksi perilaku (reaksi penelitian orientasi, pembelajaran dan memori):
- Pengenalan fragmen fungsional CNTF ciliary neurotrophin peptides 6 dan 6A merangsang pembentukan sel induk baru dan kelangsungan hidup neuron yang baru terbentuk di zona subventrikular, dentate gyrus dari hippocampus dan umbi olfaktorius (Rockenstein E, Ubhi K, Doppler E, dkk. Perbandingan efek neurogenik regional. peptida dan serebrolysin yang diturunkan dari CNTF pada tikus transgenik AβPP J Alzheimers Dis. 2011; 27 (4): 743-52)
- Pemberian peptida insulinotropic (GIF) yang bergantung pada glukosa dengan sifat faktor pertumbuhan menyebabkan peningkatan proliferasi sel batang saraf pada dentate gyrus hippocampus (Faivre E, Hamilton A, Hölscher C. Efek pemberian GIP akut dan kronis yang komparatif pada kognisi, plastisitas sinaptik dan neurogenesis) pada tikus. Eur J Pharmacol. 2012; 674 (2-3): 294-306)
- Administrasi kronis dan subkronik dari steroid alopregnanolon neuroaktif berkontribusi terhadap kelangsungan hidup neuron yang baru terbentuk (Chen S, Wang JM, Irwin RW, dkk. Allopregnanolone mempromosikan regenerasi dan mengurangi beban β-amiloid dalam model praklinis penyakit Alzheimer. PLoS One.2011; 6 ( 8): e24293; Singh C, Liu L, Wang JM, dkk. Neurobiol Aging. 2012; 33 (8): 1493-506)
Hasil menunjukkan prospek untuk penggunaan zat yang merangsang neurogenesis untuk mengurangi gejala penyakit Alzheimer, serta untuk mengurangi laju perkembangan neurodegenerasi, yang merupakan pendekatan baru yang secara fundamental baru untuk koreksi obat dari penyakit ini.
Prospek untuk manipulasi neurogenesis pada penyakit Alzheimer- Etiologi pasti penyakit Alzheimer masih belum diketahui hingga saat ini, yang membuatnya sulit untuk menemukan obat baru yang ditujukan untuk penyebab penyakit tersebut.
- Data yang diperoleh selama pemodelan genetik penyakit Alzheimer pada hewan dan studi materi post-mortal pada orang dengan AD bertentangan.
- Pada saat yang sama, pada model hewan penyakit Alzheimer, ditunjukkan bahwa peningkatan neurogenesis sudah diamati pada tahap awal penyakit (sebelum gangguan fungsi kognitif). Dipercaya bahwa peningkatan ini dapat dianggap sebagai reaksi protektif-adaptif dari sistem saraf pusat.
- Dalam model hewan penyakit Alzheimer, ditunjukkan bahwa sejumlah zat (fragmen aktif dari neutrotrophin ciliary - CNTF, insulinotropic peptide yang tergantung glukosa - GIP, dan allopregnanolone) dapat merangsang neurogenesis dan meningkatkan pola perilaku tikus.
- Kelemahan signifikan dari manipulasi ini adalah fakta bahwa pelanggaran neurogenesis, tampaknya, bukanlah penyebab penyakit Alzheimer, tetapi hanya gejala. Namun, prospek terapi tersebut mungkin memperlambat perkembangan penyakit dan menunda perkembangan demensia.
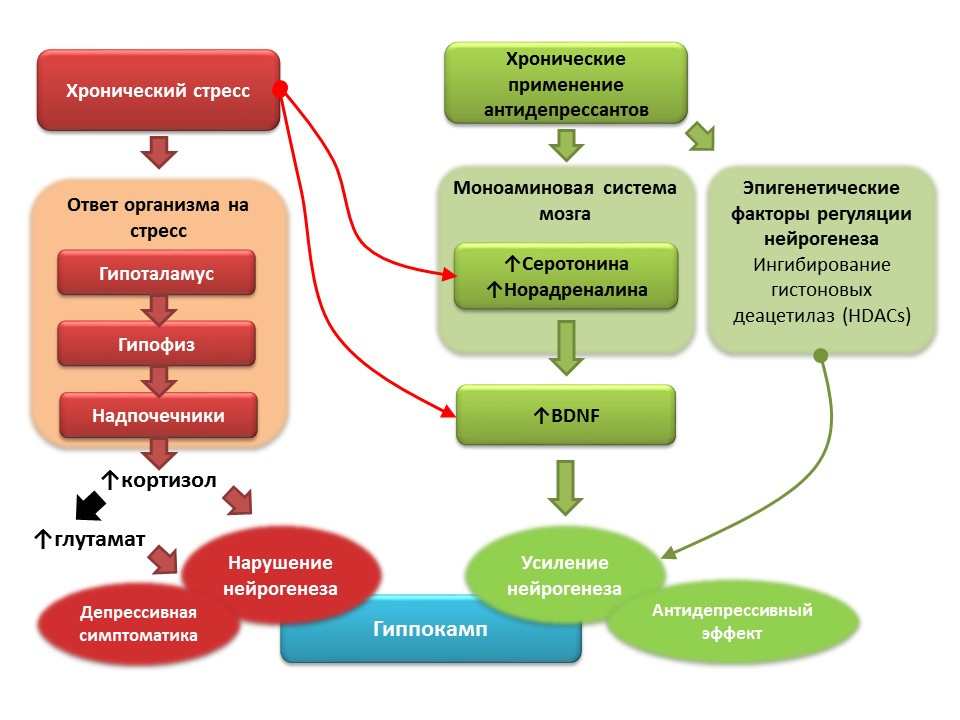 DOI: 10.1016 / j.pharma.2013.02.02.006PMID: 11124987DOI: 10.1186 / s13045-017-0499-7
DOI: 10.1016 / j.pharma.2013.02.02.006PMID: 11124987DOI: 10.1186 / s13045-017-0499-7Terhadap latar belakang depresi klinis (gangguan depresi mayor), penurunan neurogenesis dan penurunan volume hippocampus, yang dipulihkan setelah pemberian antidepresan, juga dicatat. Dipercayai bahwa stres kronis berperan sebagai faktor pemicu dalam patogenesis gangguan depresi, yang memicu serangkaian reaksi yang bergantung pada stres yang menghasilkan hiperproduksi kortisol dan peningkatan konsentrasi glutamat dalam sistem saraf pusat. Faktor-faktor ini mengganggu plastisitas otak (dan neurogenesis khususnya) dan berkontribusi pada perkembangan gejala depresi. Sebaliknya, penggunaan antidepresan kronis menstimulasi neurogenesis, meningkatkan konsentrasi dalam sistem saraf pusat monoamina (serotonin dan norepinefrin), faktor neurotropik otak. Beberapa antidepresan juga memiliki mekanisme tambahan untuk mengatur neurogenesis. Sebagai contoh, amitriptyline mampu menghambat deasetilase histone, yang memainkan peran regulator epigenetik neurogenesis, dan dengan demikian merangsang proliferasi sel batang saraf.
Prospek untuk Memanipulasi Neurogenesis dalam Depresi- Sebagian besar antidepresan, terlepas dari kelompok dan mekanisme aksi, mampu merangsang neurogenesis dalam kondisi pemodelan depresi pada model hewan.
- Pada orang dengan depresi, penggunaan kronis antidepresan mengembalikan volume hippocampus, penurunan yang biasanya dicatat pada gangguan depresi.
- Mekanisme kerja umum dari semua antidepresan adalah efek pada sistem monoamine, khususnya, kemampuan untuk meningkatkan konsentrasi serotonin dan norepinefrin dalam sistem saraf pusat.
- Sejumlah penelitian eksperimental telah menunjukkan peran penting monoamina (serotonin dan norepinefrin) dalam regulasi neurogenesis hippocampal di otak orang dewasa.
- Arah yang menjanjikan tampaknya menjadi studi rinci lebih lanjut tentang mekanisme regulasi neurogenesis oleh serotonin dan norepinefrin, pemahaman yang dapat membantu dalam pengembangan cara baru koreksi farmakologis dari depresi depresi.
- Namun, tidak semua antidepresan dapat merangsang neurogenesis sendiri, beberapa hanya mengembalikan tingkat neurogenesis awal, dikurangi dengan stres kronis.
- Oleh karena itu, area penting lainnya adalah studi tentang mekanisme antidepresan yang tidak terkait dengan sistem monoamina. Misalnya, efek antidepresan pada regulator epigenetik neurogenesis.
- Arah terpisah diwakili oleh pengembangan persiapan berdasarkan faktor neurotropik otak (BDNF) dan penurunan efek glutamat pada sistem saraf pusat (blocker reseptor NMDA glutamat).
Perspektif umum dan pendekatan untuk studi neurogenesis1. Studi tentang mekanisme molekuler regulasi neurogenesis di otak dewasa.- Sistem apa yang terlibat dalam regulasi neurogenesis di otak orang dewasa dan gangguan apa yang menyebabkan penghambatan neurogenesis?
- Pertimbangan sistem ini dan komponen masing-masing sebagai target potensial untuk koreksi obat neurogenesis.
- Pencarian untuk "formula" obat baru yang dapat mengatur proses neurogenesis di otak orang dewasa.
2. Penelitian lebih lanjut harus menjawab pertanyaan: sejauh mana neuron yang baru terbentuk dapat menggantikan sistem saraf pusat yang hilang selama patologi tertentu?3. Penting untuk mengevaluasi konsekuensi yang mungkin dari stimulasi eksogen jangka panjang dari neurogenesis dewasa.4. Penting untuk mengembangkan strategi komprehensif untuk koreksi gangguan neurogenesis, yang akan memperhitungkan semua faktor utama:- Kebutuhan akan angiogenesis
- Neurogenesis itu sendiri
- Sinaptogenesis
- Renovasi Aksonal
- Menciptakan kondisi eksternal yang menguntungkan