Protein memainkan peran penting dalam semua organisme hidup, melakukan banyak fungsi berbeda. Seperti yang Anda tahu, mereka tersusun dari asam amino. Untuk memenuhi fungsinya, protein harus bukan hanya rantai asam amino tertentu, tetapi memiliki bentuk spasial tertentu, yaitu, cocok di ruang angkasa. Karena berbagai alasan, kerusakan dapat terjadi pada lipatan normal protein ke dalam struktur yang diinginkan. Kemudian, alih-alih protein terlipat yang tidak tepat, yang cenderung menyatu dalam kelompok, agregat protein adalah fibril amiloid. Agregat yang paling terkenal adalah β-amiloid (Aβ, Abeta), mungkin terkait dengan perkembangan neuropatologi, serta beberapa jenis kanker dan salah satu penyebab demensia pada orang dengan sindrom Down.
Struktur protein tersebut memiliki diameter sekitar 5-10 nm dan panjang hingga 800 nm, dan terdiri dari dua atau lebih filamen multi-arah paralel yang membentuk struktur spesifik - konformasi lintas-beta-lipatan. Struktur inilah yang menentukan sifat optik spesifik amiloid - kemampuan birefringence. Dan penemuan properti ini adalah dasar untuk diagnosis amiloidosis. Mikroskopi pewarnaan dengan preparasi pewarna merah Kongo dalam amiloid cahaya terpolarisasi mengubah warna merah menjadi cahaya hijau [1].
Akumulator protein abnormal disebut oleh penulis konsep SENS "debris ekstraseluler" (sampah ekstraseluler) dan menentukan salah satu penyebab penuaan, yang tampaknya cukup adil. Fibril amiloid, karena strukturnya, tidak tunduk pada aksi enzim khusus yang memecah protein (protease), dan karena itu memiliki sifat menumpuk di jaringan tubuh, mengganggu pekerjaan mereka. Sifat struktural dan kimia-fisik amiloid tergantung pada protein prekursor utama, yang kandungannya dalam fibril adalah sekitar 80%, dan ini menentukan sifat spesifik untuk setiap jenis amiloidosis. Istilah amiloidosis mengacu pada sekelompok penyakit turunan atau didapat yang berhubungan dengan deposisi ekstraseluler dari fibril protein tidak larut yang menyebabkan gangguan struktural jaringan dan disfungsi organ. Saat ini, lebih dari 20 protein prekursor amiloidogenik dan jumlah varian klinis amiloidosis yang sama diketahui. Selain β-amiloid yang terkenal, ada amiloid AA yang terkait dengan rheumatoid arthritis, penyakit jantung, penyakit ginjal dan peradangan usus, amiloid AIAPP yang terlibat dalam patogenesis diabetes mellitus tipe 2, dan lainnya [2].
 β-amiloid.
β-amiloid.SENS penulis melihat cara untuk memecahkan masalah akumulasi agregat protein dalam penggunaan antibodi aktif katalitik khusus, yang disebut abzym (abzyme bahasa Inggris, enzim antibodi), yang dipilih secara khusus untuk amiloid dan mengeluarkannya dari jaringan. Baru-baru ini, satu metode yang menjanjikan telah dikembangkan sebagai bagian dari pendekatan ini. Sekelompok antibodi manusia telah ditemukan yang memiliki aktivitas katalitik terhadap antigen spesifik, memecahnya menjadi fragmen yang lebih kecil dan kurang berbahaya, daripada menangkapnya untuk dihilangkan atau dihancurkan oleh sel-sel kekebalan tubuh lainnya. Menggunakan antibodi katalitik baru ini sebagai terapi penargetan amiloid menawarkan keuntungan potensial dibandingkan dengan penyerapan antibodi yang digunakan dalam vaksin amiloid lainnya. Yang pertama adalah bahwa pengurangan dosis diperlukan untuk secara efektif menghilangkan agregat ekstraseluler dari jaringan. Ini karena sekuestrasi antibodi dapat menangkap dan kemudian hanya mengangkut satu molekul amiloid pada suatu waktu. Sementara abzim mengikat ke molekul amiloid, giling dan kemudian beralih ke yang berikutnya, yang memungkinkan setiap molekul antibodi dengan cepat menghancurkan beberapa molekul amiloid. Lain adalah bahwa antibodi katalitik milik kelas yang lebih efisien diangkut melalui penghalang darah-otak yang melindungi otak kita, sementara antibodi pengurutan lebih sulit untuk mengatasi penghalang ini [3].
Amiloid yang paling terkenal dan paling banyak dipelajari saat ini adalah β-amiloid, yang oleh banyak peneliti dikaitkan dengan penyakit Alzheimer. Patologi ini dideskripsikan lebih dari seabad yang lalu oleh A. Alzheimer, yang merupakan orang pertama yang menunjukkan gejala patomorfologis utama penyakit ini - plak pikun yang tidak dapat larut ditemukan di otak orang mati yang menderita penyakit ini. Saat ini di dunia ada lebih dari 40 juta orang dengan diagnosis penyakit Alzheimer - kemungkinan mengembangkan patologi ini berlipat dua setiap lima tahun setelah 65 tahun. Dan perkiraan jangka panjang WHO mengenai peningkatan besar pada pasien tersebut dalam beberapa dekade mendatang sangat pesimistis.
Diketahui bahwa plak yang tidak larut dalam otak pasien dibentuk terutama oleh β-amiloid peptida (Aβ), yang memiliki berat molekul 4 kDa dan panjang sekitar 40 residu asam amino. Aβ adalah fragmen protein transmembran dari protein prekursor amiloid (amiloid protein prekursor, APP), yang ditemukan di banyak jaringan tubuh, termasuk dalam sinapsis neuron. APP terlibat dalam beberapa proses fisiologis yang terkait dengan neuroplastisitas, pembentukan sinapsis, dan perlindungan saraf (kelangsungan hidup sel-sel saraf) [4].
Tidak seperti pendahulunya, Aβ adalah racun bagi sel-sel saraf, berkontribusi terhadap degenerasi dan kematiannya. Ini terbentuk dengan memisahkan domain N-terminal ekstraseluler (sAPP) dari protein prekursor. Proses ini dapat dilakukan oleh dua sekretase berbeda - α-sekretase dan β-sekretase, yang memiliki perbedaan mendasar dalam aksinya. Dalam kasus pertama, fragmentasi terjadi antara residu asam amino dalam urutan Aβ, yang mencegah pembentukan amiloid peptida. Kedua, patologis, di bawah pengaruh β-secretase, proses fragmentasi karena fitur-fiturnya berakhir pada pembentukan Aβ. Jalur kedua ini terkait dengan perkembangan neuropatologi lebih jarang, dan mengapa fragmentasi protein prekursor mengikutinya tetap tidak sepenuhnya jelas [5].
 β-sekretase.
β-sekretase.Neurotoksisitas Aβ dikaitkan dengan pelanggaran homeostasis kalsium, eksitotoksisitas, proses inflamasi, stimulasi stres oksidatif dan apoptosis. Pendapat yang berlaku adalah bahwa akumulasi Aβ di otak adalah proses patologis murni karena ketidakmungkinan menghilangkan Aβ dari jaringan otak. Saat ini diketahui bahwa Aβ dapat dihilangkan dari otak dengan setidaknya 2 cara: perivaskular (melalui getah bening) dan proteolitik (pembelahan oleh berbagai enzim) [6, 7]. Oleh karena itu, pembentukan usia tua penyakit Alzheimer dengan akumulasi yang menyertai fibril amiloid yang tidak larut dapat dikaitkan dengan berbagai faktor stimulasi. Yang mungkin bersifat genetik dan mungkin terkait dengan stres, hipoksia, iskemia, dan stroke di masa lalu [8].
β-amiloid mengoksidasi kolesterol dan asam lemak tak jenuh ganda, membentuk bentuk paling beracun dari spesies oksigen reaktif - radikal hidroksil dan hidrogen peroksida. Rasemisasi asam L-aspartat dalam protein berumur panjang mendorong pembentukan β-amiloid dan α-synuklein. Akumulasi patologis yang terakhir diamati pada penyakit Parkinson, penyakit Alzheimer, penyakit Levy dan penyakit neurodegeneratif lainnya.
Tanda patomorfologis lain dari neurodegenerasi pada penyakit Alzheimer adalah agregat protein tau hiperfosforilasi (protein τ): filamen heliks berpasangan (PHF) dan kusut neurofibrillary (NFT). Secara fisiologis, protein τ terlibat dalam stabilisasi mikrotubulus neuron, yang memastikan transfer melalui sitoplasma neuron organel seluler, glikoprotein, dan zat lainnya. Pada penyakit Alzheimer, protein τ adalah hyperphosphorylated, kehilangan kemampuan normalnya untuk menstabilkan mikrotubulus dan terakumulasi dalam sel dengan struktur neurotoksik yang tidak larut. Apa yang terjadi sebelumnya selama pembentukan patologi - pembentukan agregat amiloid atau protein τ - bukanlah pertanyaan yang jelas. Tetapi, jelas, kedua proses ini saling terkait dan merangsang satu sama lain. Jadi, kedua protein patologis menunjukkan sifat prion yang mirip dengan protein prion PrPsc: bentuk protein yang terlipat secara salah berdasarkan jenis reaksi berantai merangsang transformasi protein normal menjadi protein yang tidak beraturan dalam neuron sehat yang mengelilinginya. Di antara mereka sendiri, Aβ dan τ-protein juga berinteraksi dengan jenis prion: dijelaskan bagaimana Aβ mengaktifkan protein kinase GSK3 dengan memfosforilasi protein τ dan menyebabkannya terbentuk secara tidak tepat [5].
 protein τ.
protein τ.Baru-baru ini, diyakini bahwa meskipun penyakit prion dan penyakit Alzheimer memiliki kesamaan biokimia tertentu, patologi kedua, tidak seperti yang pertama, tidak menular dan tidak ditularkan dari satu organisme ke organisme lain. Namun pada 2015, berita pertama yang mengganggu muncul. Dalam jurnal Nature, sebuah artikel diterbitkan oleh ahli saraf Inggris di mana mereka berbicara tentang kemungkinan rute penularan Aβ dari satu orang ke orang lain. Para penulis melakukan penelitian otopsi pada otak delapan orang yang meninggal karena penyakit Creutzfeldt-Jakob. Pada enam orang yang tewas, selain cedera yang terkait dengan penyakit yang mendasarinya, akumulasi amiloid yang luas ditemukan di otak. Apa yang tidak biasa baik untuk usia muda orang mati, maupun untuk patologi ini. Tidak ada cacat yang terkait dengan amiloidogenesis dan neuropatologi juga ditemukan dalam genom mereka. Para peneliti menyarankan bahwa Aβ dimasukkan ke dalam tubuh almarhum selama injeksi hormon pertumbuhan yang terinfeksi amiloid. Dengan cara yang sama seperti beberapa ratus orang yang sebelumnya terinfeksi dan meninggal karena suntikan hormon pertumbuhan yang mengandung prion [9].
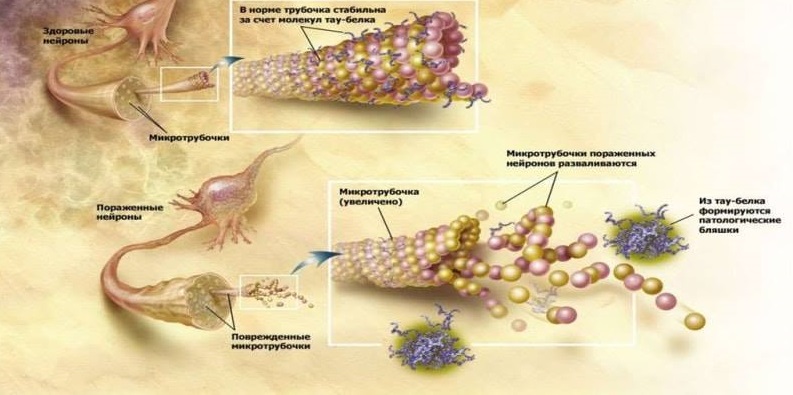 Fungsi protein τ adalah normal dan patologis.
Fungsi protein τ adalah normal dan patologis.Konfirmasi dari infeksi penyakit Alzheimer dapat menjadi studi lain di mana tikus laboratorium dengan peningkatan amiloidogenesis dan tikus normal secara operasi dikombinasikan dengan aliran darah. Akibatnya, tikus sehat mulai menumpuk Aβ di otak, yang tidak khas untuk tikus ini. Penelitian ini untuk pertama kalinya menunjukkan potensi penetrasi Aβ dengan darah ke otak dan partisipasi selanjutnya dalam pengembangan neurodegenerasi [10].
Hubungan antara akumulasi β-amiloid dan protein τ dalam jaringan dengan neuropatologi terkait usia menentukan kebutuhan untuk mencari metode yang efektif untuk mengidentifikasi agregat protein ini sebagai biomarker neuropatologi masa depan dan penuaan yang dipercepat. Saat ini, beberapa metode seperti itu sudah diketahui.
Deposito amiloid dalam jaringan otak dapat dideteksi menggunakan tomografi emisi positron, ketika β-amiloid ditentukan oleh isotop radioaktif yang dimasukkan ke dalam tubuh dan terhubung ke amiloid.
Salah satu biomarker paling sensitif dalam diagnosis dini penyakit Alzheimer dan Congestive Disorders (UKI) moderat dalam transisi ke fase patologi saat ini dianggap sebagai kadar amiloid Aβ-42, total protein-τ dan protein terfosforilasi dalam protein serebrospinal (CSF). Selain itu, amiloid dengan patologi menunjukkan penurunan kadar, dan kadar cairan serebrospinal dari protein τ, total dan terfosforilasi, meningkat. Hal ini disebabkan oleh fakta bahwa pada orang sehat tidak ada akumulasi amiloid dalam bentuk plak dan, oleh karena itu, sejumlah besar amiloid bebas ditemukan dalam cairan serebrospinal. Nilai protein τ yang rendah menunjukkan tidak adanya kerusakan sitoskeleton neuronal.
Korelasi signifikan ditemukan antara usia dan perlambatan dalam ekskresi β-amiloid dari sistem saraf, yang mungkin terkait dengan sklerosis pembuluh limfatik dan penurunan kemampuan drainase mereka. Mengembalikan drainase adalah salah satu perawatan yang menjanjikan untuk penyakit Alzheimer, yang diusulkan oleh Leucadia, sebuah wawancara dengan pendiri yang diterjemahkan dan diterbitkan di
habr.com/post/371513Jadi, konsentrasi Aβ-42 dalam cairan serebrospinal pada level 716,9 ± 94,2 ng / ml dapat dianggap sebagai indikator normal untuk orang sehat. Dan level Aβ-42, menunjukkan peningkatan risiko neuropatologi, adalah <209 ng / ml. Untuk protein τ, kadar 73,9 ± 51,7 ng / ml dianggap nilai normal dalam cairan serebrospinal. Peningkatan kadar protein τ menjadi 231,6 ± 158,5 ng / ml mungkin sudah menunjukkan adanya proses neurodegeneratif aktif. Menurut ide-ide saat ini, studi gabungan kadar Aβ-42 dan τ-protein dalam cairan serebrospinal menunjukkan sensitivitas yang tinggi dalam diagnosis dini neuropatologi - 94% dari kemungkinan mendiagnosis penyakit Alzheimer [11].
Segera, munculnya metode imunologi dan spektrometri massa ultra-sensitif untuk diagnosis amiloidosis (rasio protein Aβ42 / 40 atau APP669-711 / Aβ42) dan neurodegenerasi (protein dan neurofilamen) dalam plasma darah diharapkan [12]. Ada juga metode “tanpa tanda” untuk mendeteksi protein terlipat yang tidak benar dalam plasma [13].
Penulis ulasan: Denis Odinokov, Alexey Rzheshevsky.
Daftar literatur yang digunakan- Rameev V., Kozlovskaya L. Amyloidosis: metode diagnosis dan pengobatan modern. Farmakoterapi yang efektif. Urologi dan Nefrologi. 2012. No. 11, hal.6-15.
- Butler L.I., Karpova O.Yu., Alexandrova E.N., Petrova S.Yu. Amiloidosis jantung pada lansia. Arsip Penyakit Dalam. 2015. No. 6 (26), hlm. 28-36.
- AmyloSENS: Menghapus sampah dari sel-sel ..
- 4Lee, V., Goedert, M., Trojanowski, J. (2001) Neurodegenerative tauopathies, Annu. Rev. Neurosci., 24, 1121–1159.
- Tatarnikova O.G., Orlov M.A., Babkova N.V. Amiloid beta dan protein Tau: struktur, interaksi dan sifat prion-like. Kemajuan dalam Kimia Biologis, vol. 55, 2015, hal. 351-390.
- Weller, R., Yow, H., Preston, S., Mazanti, I., Nicoll, J. (2002) Penyakit serebrovaskular adalah faktor utama dalam kegagalan penghapusan beta amiloid dari otak manusia yang menua, Ann. NY Acad. Sci., 977, 162–168.
- Nalivaeva, N., Fisk, L., Belyaev. N., Turner, A. (2008) Enzim yang menurunkan amiloid sebagai target terapi pada penyakit Alzheimer, Curr. Alzheimer Res., 5, 212-224.
- Fisk, L., Nalivaeva, N., Boyle, J., Peers C., Turner A. (2007) Efek hipoksia dan stres oksidatif pada ekspresi neprilysin dalam sel neuroblastoma manusia dan neuron dan astrosit kortikal tikus, Neurochem. Res. 32, 1741-1748.
- Jaunmuktane Z., Mead S., Ellis M., Wadsworth JDF, Nicoll AJ, Kenny J., dkk .. (2015). Bukti untuk transmisi manusia dari patologi amiloid-β dan angiopati amiloid serebral. Alam 525, 247-250.
- XL Bu, Y Xiang, WS Jin, J Wang, LL Shen, ZL Huang, K Zhang, YH Liu, F Zeng, JH Liu, HL Sun, ZQ Zhuang, SH Chen, XQ Yao, B Giunta, YC Shan, J Tan , XW Chen, ZF Dong, HD Zhou, XF Zhou, W Song & YJ Wang. Protein amiloid-β yang diturunkan dari darah menginduksi patologi penyakit Alzheimer. Psikiatri Molekuler. 2017
- V.Yu. Lobzin, A.Yu. Emelin, L.A. Alekseeva. Biarkarker Liquorological dari neurodegeneration dalam diagnosis awal gangguan kognitif. Buletin Akademi Medis Militer Rusia. 2013, No. 4, hal. 15-20.
- Blennow, Kaj, dan Henrik Zetterberg. "Biomarker untuk penyakit Alzheimer - status saat ini dan prospek untuk masa depan." Jurnal kedokteran internal (2018).
- Nabers, Andreas, et al. "Biomarker darah amiloid mendeteksi penyakit Alzheimer." Kedokteran molekuler EMBO (2018).