Mitokondria - pekerja kecil atau bos besar?Jika Anda berpikir bahwa kisah paling penting bagi kita untuk hidup bersama dimulai selama pernikahan, maka ini sama sekali tidak terjadi. Kisah paling penting dalam kehidupan setiap orang dimulai lebih dari satu miliar tahun yang lalu ketika nenek moyang kita yang bersel satu yang jauh dipaksa untuk menandatangani "kontrak pernikahan" dengan mereka yang sekarang kita sebut mitokondria (lihat teori simbiogenesis).
Mitokondria memiliki dua membran (internal dan eksternal) dan bahan herediternya sendiri dalam bentuk DNA (Gbr. 1). Pada membran dalam mitokondria terdapat sistem fosforilasi oksidatif, operasi yang menyediakan oksidasi substrat energi dengan pembentukan ATP.
Fig. 1 . Struktur skematik mitokondria
Dalam kontrak pernikahan sel dan mitokondria tidak ada klausul "dalam penyakit dan kesehatan" - dan baik. Jika mitokondria menjadi tua, sel dapat membunuhnya selama mitofag, dan mitokondria, pada gilirannya, mengatur proses apoptosis pada sel-sel tua dan disfungsional. Jika proses saling kontrol kualitas terganggu, mekanisme penuaan diluncurkan. Mekanisme apoptosis terganggu, jumlah radikal bebas yang tidak dikendalikan oleh mitokondria meningkat. Ini menyebabkan peradangan sistemik, kerusakan pada DNA sel. Dengan demikian, ada hubungan yang kuat antara disfungsi MX, penyakit terkait usia, penuaan, dan disfungsi metabolisme [1]. Disfungsi metabolik adalah pengendara konstan dari kiamat penuaan.
"Seperti tupai di roda" - dinamika mitokondria
Tidak semua penyebab gangguan metabolisme terletak pada makan berlebihan kita. Gangguan metabolisme terutama terkait dengan ketidakmampuan mitokondria untuk mengatasi nutrisi. Mitokondria dalam sel tidak mudah. Kita “memberi makan” sel kita terlalu banyak atau terlalu sedikit, dan menyajikannya dengan “permintaan” untuk memberikan energi dalam bentuk ATP, yang jumlahnya harus persis sesuai dengan kebutuhan kita. Untuk secara teratur "keluar" dari situasi ini, mitokondria benar-benar menggunakan beberapa "gerakan" - fisi dan fusi. "Mitodomotion" ini disatukan dengan nama "dinamika mitokondria". Keseimbangan antara pembelahan mitokondria dan fusi adalah mekanisme utama adaptasi bioenergetik dengan kebutuhan metabolisme sel [2, 3].
Kebanyakan mitokondria ditemukan dalam jaringan dengan kebutuhan energi tinggi - otot, hati, jaringan adiposa coklat, dan otak. Tidak mengherankan bahwa dinamika mitokondria dalam jaringan ini telah dipelajari dengan lebih baik.
Jadi, jika sel dari salah satu jaringan ini (kecuali untuk beberapa neuron di otak, lebih lanjut tentang itu nanti) menerima sejumlah besar nutrisi (asupan melebihi biaya), maka mitokondria berada dalam keadaan terbagi (terfragmentasi). Jika sel dalam keadaan lapar (pendapatan kurang dari biaya), maka mitokondria bergabung dan mereka berada dalam keadaan terhubung. [3,4]. Inilah cara homeostasis sel dipertahankan (Gbr. 2).
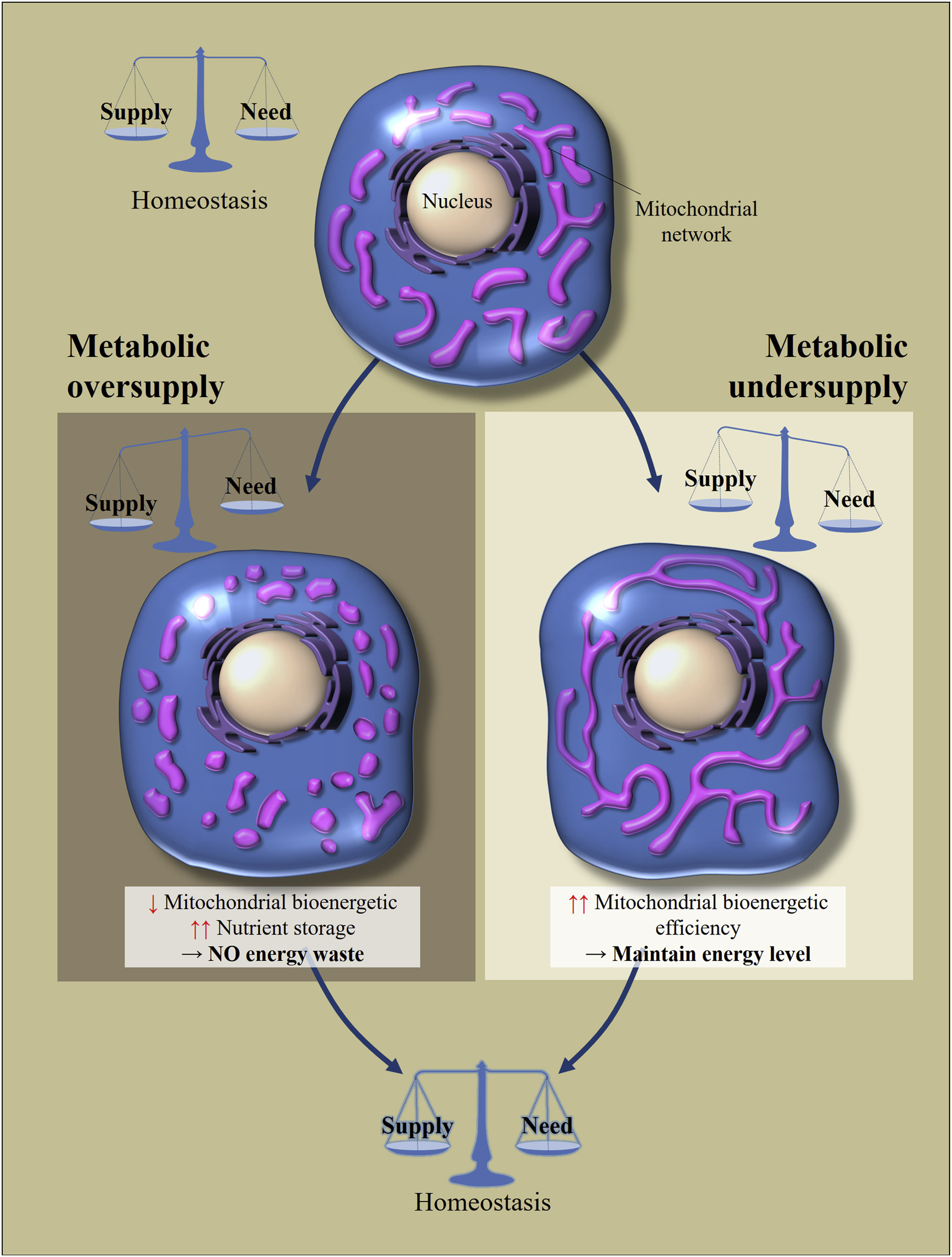 Fig. 2
Fig. 2 Regulasi morfologi dan efisiensi bioenergi mitokondria dalam menanggapi kelebihan atau kekurangan asupan nutrisi [dari 2]
Homeostasis metabolik sel tergantung pada keseimbangan antara asupan nutrisi dan konsumsinya. Perubahan pasokan nutrisi menyebabkan adaptasi seluler untuk mengembalikan keseimbangan. Kelebihan nutrisi menyebabkan fragmentasi jaringan mitokondria, yang menyebabkan penurunan efisiensi bioenergi mitokondria. Ini akan menghindari hilangnya energi. Sebaliknya, dengan kelaparan metabolik, mitokondria menjadi lebih lama untuk meningkatkan efisiensi bioenergi.Apa trik gerakan ini? Jika sel dalam keadaan lapar, maka penggabungan mitokondria dapat meningkatkan efisiensi bioenergi mereka (jumlah ATP yang dibuat per molekul nutrisi). Jika kelebihan nutrisi memasuki sel, maka mereka bisa 1) disimpan, atau 2) menghilangkan energi ini dalam bentuk panas. Tugas mitokondria dalam hal ini adalah untuk membuang lebih banyak energi dalam bentuk panas, menyimpan lebih sedikit dalam bentuk ATP (akumulasi NADH dan ROS akan menyebabkan stres oksidatif). Fragmentasi mitokondria memungkinkan mereka untuk mengurangi efisiensi bioenergi, mekanisme utama reduksi yang dianggap sebagai "kebocoran" proton.
Jadi, kita pergi bekerja, dan kehidupan mitokondria terus berlanjut dalam siklus pembagian dan fusi (Gbr. 3).
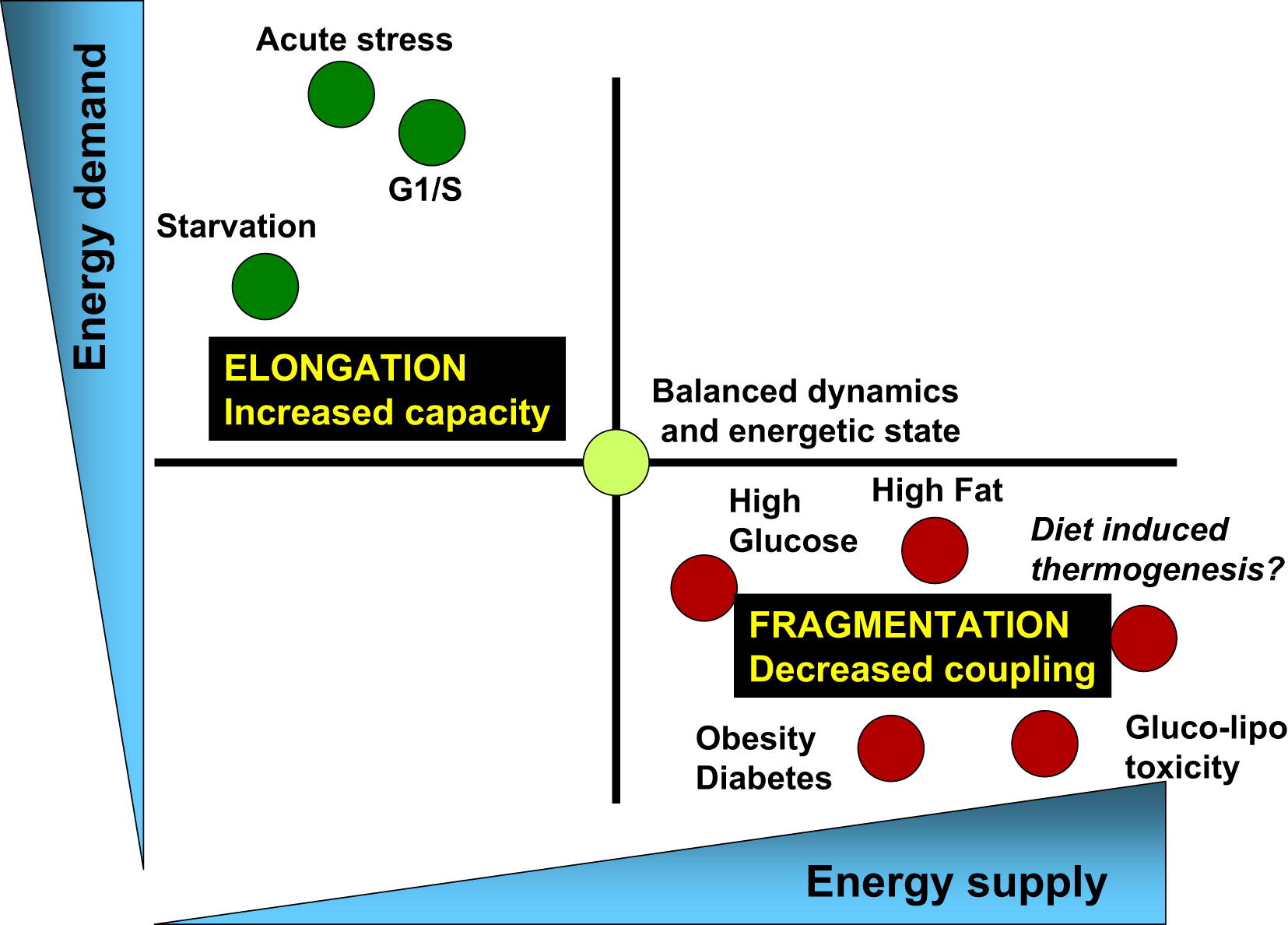 Gambar. 3 Keseimbangan konsumsi energi dan pasokan energi dikaitkan dengan perubahan yang sesuai dalam arsitektur mitokondria dan efisiensi bioenergi mereka [dari 3]
Gambar. 3 Keseimbangan konsumsi energi dan pasokan energi dikaitkan dengan perubahan yang sesuai dalam arsitektur mitokondria dan efisiensi bioenergi mereka [dari 3]
Proses fisiologis yang terkait dengan peningkatan permintaan energi dan penurunan pasokan energi (misalnya, stres akut, kelaparan dan fase G1 / S) ditandai oleh perpanjangan mitokondria dan respirasi yang terkait dengan sintesis ATP. Di sisi lain, proses fisiologis yang terkait dengan penurunan permintaan energi dan peningkatan pasokannya (tingkat nutrisi yang tinggi, obesitas dan diabetes tipe 2) terkait dengan fragmentasi mitokondria, produksi panas, atau penurunan fungsi mitokondria.Siklus fisi dan fusi yang sehat adalah kunci untuk kesehatan metabolisme sel
Siklus normal divisi mitokondria dan fusi adalah elemen kunci dalam kontrol kualitasnya. Mengapa Selama pembelahan mitokondria, dua anak perempuan terbentuk, salah satunya memiliki potensi membran yang lebih tinggi dan melangkah lebih jauh ke dalam siklus divisi fusi, dan yang lainnya, dengan membran yang lebih terdepolarisasi, tetap dipisahkan sampai potensi membran dipulihkan. Jika potensi dipulihkan, ia bersatu kembali dengan jaringan mitokondria. Jika tetap terdepolarisasi, maka dihilangkan dalam proses autophagy, yang merupakan kunci kualitas kualitas mitokondria (Gbr. 4).
Penghambatan jangka panjang dari pembelahan mitokondria (dengan kelaparan sel yang berkepanjangan) menyebabkan akumulasi mitokondria yang rusak, yang tidak dapat dipisahkan [3, 4].
Di sisi lain, kelebihan nutrisi menyebabkan penghambatan fusi mitokondria, yang mengarah pada gangguan siklus dinamika mitokondria, meningkatkan heterogenitas mitokondria mitokondria intraseluler. Ya, dengan kelebihan makanan, fragmentasi mitokondria adalah pelindung, tetapi fragmentasi yang berkepanjangan, seperti fusi yang berkepanjangan, berbahaya bagi kontrol kualitas mitokondria. Tidak ada pengangkatan selektif, massa mitokondria akan berkurang dan terdiri dari mitokondria kecil yang terdepolarisasi.
 Gambar. 4 Siklus hidup mitokondria dan regulasi ketersediaan nutrisi [3]
Gambar. 4 Siklus hidup mitokondria dan regulasi ketersediaan nutrisi [3]Mitofusin bukan sembarang protein
Pada tingkat molekuler, fusi mitokondria adalah proses dua tahap yang membutuhkan fusi terkoordinasi dari membran luar dan dalam selama peristiwa berurutan yang terpisah. Pada mamalia, proses ini diatur oleh tiga protein milik GTPases: Mfn1 dan Mfn2 diperlukan untuk fusi membran luar, dan OPA1 - untuk fusi membran dalam. Protein lain diperlukan untuk pembelahan, Fis1 dan Drp1.
Peran protein mitofusin telah dipelajari dalam studi fungsi kehilangan dan perolehan. Tikus mutan untuk protein mitofusin mati sedini pertengahan kehamilan, karena fusi mitokondria menjadi tidak mungkin bagi mereka. Mitofusin penting untuk proses autophagy dan mitophagy. Berkurangnya ekspresi Mfn2 dalam kardiomiosit menghambat dimulainya proses autofagi, karena fusi autofagosom dengan lisosom terhambat. Menipisnya Mfn2 menyebabkan penurunan potensi membran mitokondria, untuk mengimbangi, ada penurunan dalam pekerjaan rantai pernapasan, peningkatan penyerapan glukosa, dan penurunan sintesis glikogen. Sel beralih ke glikokisis anaerob, dan ini adalah jalan menuju degenerasi onkologis sel. Kekurangan Mfn2 menyebabkan perubahan neurodegeneratif. Peningkatan ekspresi Mfn2 pada otot rangka meningkatkan sensitivitasnya terhadap insulin.
Mfn1 melakukan fungsi yang serupa, tetapi mungkin di jaringan lain (ekspresi Mfn2 dan Mfn1 bervariasi di jaringan yang berbeda) - Mfn1 lebih banyak diekspresikan di jantung, hati, pankreas, testis, dan Mfn2 di jantung, otot rangka, otak, jaringan adiposa coklat .
Dengan demikian, mitofus adalah pengatur utama dinamika mitokondria. Ekspresi mitofusin berbeda di organ yang berbeda, mereka memberikan efisiensi bioenergi dan mekanisme adaptasi terhadap ketersediaan nutrisi, dan "nasib" sel tergantung pada mereka. Tidak mengherankan, protein fusi mitokondria adalah target potensial untuk intervensi farmakologis [2, 5].
Hipotalamus, mitokondria, disfungsi metabolisme, dan penuaan
Dinamika mitokondria penting di semua sel. Dalam sel beta pankreas, mitokondria adalah sensor nutrisi dan generator sinyal sintesis insulin, pada otot, dinamika mitokondria penting untuk pengaturan metabolisme glukosa, dll. Namun, seseorang bukan hanya kumpulan berbagai jenis sel, yang masing-masing membuat keputusan independen. Organisme adalah sistem yang memiliki tautan pengaturan pusat untuk mempertahankan energi dan homeostasis glukosa. Regulator utama ini adalah hipotalamus.
Hipotalamus terletak di diencephalon dan dialah yang menyediakan interkoneksi sistem regulasi saraf dan humoral. Neuron hipotalamik memahami, memproses, dan merespons sinyal dari jaringan adiposa (leptin), pankreas (insulin), dan rangsangan hormonal lainnya (ghrelin, kolesistokinin, polipeptida pankreas, dll.). Hipotalamus mengendalikan aktivitas sistem endokrin manusia karena fakta bahwa neuronnya mampu mensekresi pemancar neuroendokrin yang merangsang atau menghambat produksi hormon oleh kelenjar hipofisis. Dengan kata lain, hipotalamus, yang massanya tidak melebihi 5% dari otak, adalah pusat pengaturan fungsi endokrin dan pemeliharaan homeostasis seluruh organisme.
Bahkan Dilman (Dilman V. M "Jam biologis besar") menunjuk pada peran utama hipotalamus dalam pengembangan sistematis disfungsi metabolisme, yang mengarah pada obesitas, diabetes, kardiovaskular, penyakit onkologis, dan penuaan. Menurut teori hiperadaptosis yang dibentuk oleh Dilman, sensitivitas reseptor hipotalamus terhadap sinyal yang berasal dari jaringan tubuh (leptin, insulin, dll.) Secara bertahap berkurang secara sistematis seiring bertambahnya usia. Untuk memprovokasi "respons" -nya, semakin banyak hormon yang dibutuhkan - lebih banyak insulin, lebih banyak leptin. Mengembangkan resistensi insulin dan leptin, penyakit metabolik yang menyebabkan penuaan dan kematian.
Tergantung pada fungsi yang dilakukan, kelompok neuron digabungkan ke dalam inti hipotalamus. Salah satunya - inti arkuata (arkuata) adalah pengatur utama perilaku makan dan metabolisme. Neuropeptida Orexigenic (merangsang nafsu makan) dan anorexigenic (menekan nafsu makan), masing-masing sesuai dengan neuron AgRP dan POMC, dapat terbentuk di dalamnya. Sinyal perifer (insulin, ghrelin, leptin, dll.) Memengaruhi ekspresi peptida yang merangsang atau menekan nafsu makan, yang memastikan koherensi regulasi pusat (Gbr. 5).
 Fig. 5. Kontrol hipotalamik metabolisme energi. Otak mengintegrasikan sinyal metabolisme (leptin, insulin, ghrelin, PYY3-36) dari jaringan perifer seperti pankreas, jaringan adiposa, dan perut. Di otak, jaringan saraf khusus mengoordinasikan perubahan adaptif dalam penyerapan dan konsumsi makanan [dari 5].
Fig. 5. Kontrol hipotalamik metabolisme energi. Otak mengintegrasikan sinyal metabolisme (leptin, insulin, ghrelin, PYY3-36) dari jaringan perifer seperti pankreas, jaringan adiposa, dan perut. Di otak, jaringan saraf khusus mengoordinasikan perubahan adaptif dalam penyerapan dan konsumsi makanan [dari 5].Jadi siapa dan bagaimana mengatur sensitivitas neuron hipotalamus?
Sebuah studi tentang dinamika mitokondria di jaringan otak menunjukkan bahwa dinamika mitokondria memainkan peran penting dalam kemampuan neuron hipotalamus untuk mengontrol kadar glukosa dan homeostasis energi dalam tubuh [6,7,8].
Pada AgRP neuron (neuron AgRP yang mempromosikan rasa lapar), yang merangsang nafsu makan dan mengatur kenaikan berat badan, kelaparan menyebabkan pembelahan mitokondria, dan pemberian makanan berlemak tinggi menyebabkan fusi. Artinya, respons mitokondria berbeda dari yang ada di sebagian besar sel lain.
Fusi MX dalam neuron ini mengatur aktivitas listrik sebagai respons terhadap diet tinggi lemak, merangsang produksi peptida orexigenic (AgRP peptide), yang diperlukan untuk penambahan berat badan dan penumpukan lemak dengan kelebihan nutrisi. Penghapusan Mfn1 dan Mfn2 pada neuron-neuron ini menghasilkan penambahan berat badan yang lebih sedikit pada tikus karena tingkat leptin yang bersirkulasi lebih rendah.
Neuron POMC (menekan nafsu makan) memiliki fungsi yang berlawanan, dan dinamika mitokondria dalam menanggapi asupan nutrisi berbeda. Penurunan ekspresi mitofusin dalam neuron ini menyebabkan gangguan dalam hubungan mitokondria dengan EPS, dan sebagai hasilnya, hyperphagia, resistensi leptin, dan obesitas. Pada saat yang sama, konsumsi makanan meningkat, dan konsumsi energi menurun.
Dengan demikian, respons tubuh terhadap diet tinggi lemak tergantung pada pola dinamika mitokondria dalam neuron hipotalamus. Renovasi mitokondria dalam neuron memastikan respons mereka terhadap asupan nutrisi, merangsang produksi neuropeptida yang akan merangsang atau menekan nafsu makan, yang memengaruhi metabolisme di tingkat tubuh (Gbr. 6).
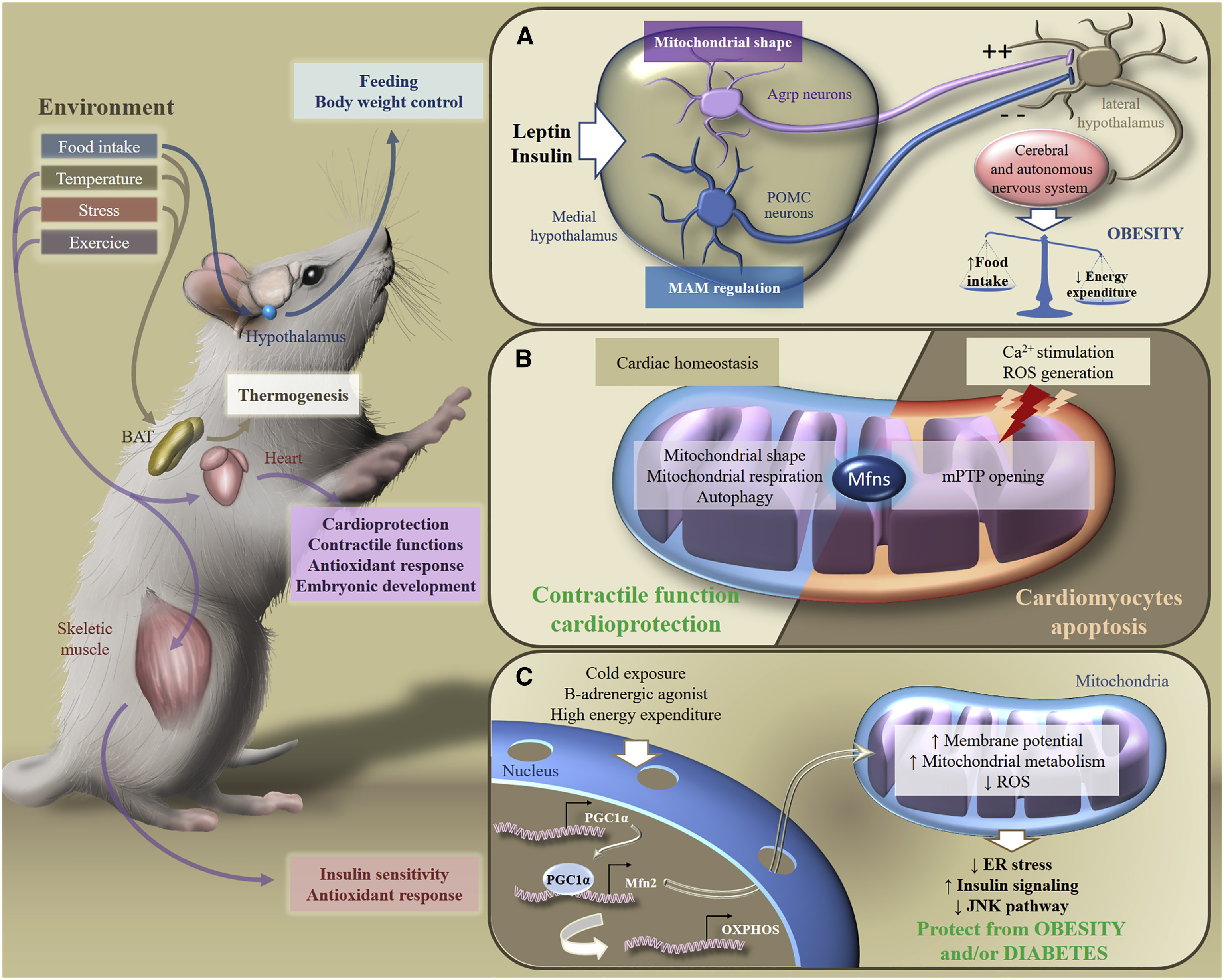 Fig. 6. Adaptasi metabolik dengan rangsangan lingkungan [dari 2]
Fig. 6. Adaptasi metabolik dengan rangsangan lingkungan [dari 2]Menanggapi rangsangan eksogen, Mfns terlibat dalam transduksi pensinyalan metabolik di berbagai organ, yang memastikan pemeliharaan homeostasis energi di seluruh tubuh. Secara khusus, sebagai respons terhadap asupan makanan, perubahan suhu, stres, atau olahraga, jaringan adiposa coklat, otak, jantung, atau otot rangka menyesuaikan metabolisme mereka untuk mengontrol nutrisi, berat badan, fungsi kontraktil, respons antioksidan, atau sensitivitas insulin.
Bagaimana cara mempengaruhi dinamika mitokondria?
1. Nutrisi dan olahragaSiklus Nutrisi Kelebihan makanan dan diet tinggi lemak (HFD) menghambat fusi mitokondria dalam sel (mekanismenya berbeda pada beberapa neuron otak). Siklus fisi-fusi mitokondria yang tidak lengkap mengganggu proses autophagy → heterogenitas mitokondria intraseluler meningkat → tidak ada penghapusan selektif mitokondria → mitokondria dengan disfungsi yang menumpuk.
Pembatasan kalori (siklus makan / puasa) merangsang adaptasi bioenergi, memberikan mekanisme kualitas mitokondria.
2. Membran sehat: asam stearat, kardiolipin, asam fosfatidatSemua proses utama bergantung pada “kesehatan” membran mitokondria - autofag, mitofag, apoptosis, hubungan mitokondria dengan retikulum endoplasma, dan dinamika mitokondria. Membran organel seluler tersusun atas lipid dan protein. Renovasi membran ini dikendalikan oleh interaksi antara lipid spesifik dan protein.
Asam lemak jenuh termasuk palmitat (C16) dan stearat (C18). Terlihat bahwa penggunaan asam stearat (C18: 0) merangsang proses fusi mitokondria. Aksinya dikaitkan dengan efek pada mitofusin. Pada tikus, suplemen makanan asam stearat dapat mengembalikan sebagian disfungsi mitokondria yang disebabkan oleh mutasi pada gen Pink1 atau parkin. Dalam neutrofil orang yang melakukan diet rendah C18: 0 selama 2 hari, mitokondria berada dalam keadaan terfragmentasi (50% sel memiliki fragmen MX, 10% terhubung dengan MX). Penggunaan asam stearat menyebabkan mereka menggabungkan mitokondria setelah 3 jam [8]. Dengan demikian, asam sterik penting untuk menjaga dinamika mitokondria. Sebagian besar asam stearat ditemukan dalam biji kakao (31-34%).
Fosfolipid adalah komponen utama membran organel. Mereka juga mengatur dinamika mitokondria, dan efeknya berbeda [9].
Cardiolipin (CL) merangsang pembelahan mitokondria dan fusi membran internal.
Cardiolipin diperlukan untuk operasi kompleks IV (citrochrome C oxidase) dari rantai transpor elektron. Cardiolipin terletak hampir secara eksklusif di membran dalam mitokondria. Seiring bertambahnya usia, ada penurunan jumlah kardiolipin. Ada teori bahwa hilangnya fungsi kardiolipin dikaitkan dengan penggantian asam lemak jenuh dalam molekulnya dengan asam lemak tak jenuh ganda. Untuk mengatasi masalah ini, perlu memasukkan lemak jenuh yang kaya akan asam lemak stearat ke dalam makanan.
Untuk meningkatkan efisiensi pengiriman asam lemak jenuh ke membran, transporter dapat digunakan. Misalnya, penggunaan fosfatidilkolin jenuh (dipalmitophosphatidylcholine dan dyseroylphosphatidylcholine), yang berpotensi memberikan FA jenuh langsung ke cardiolipin [10]. Kolin, sebagai pembawa, mudah melewati sitosol dan memasuki mitokondria.
Asam fosfatidat (RA) menghambat pembelahan mitokondria dan merangsang fusi membran eksternal (Gbr. 7).
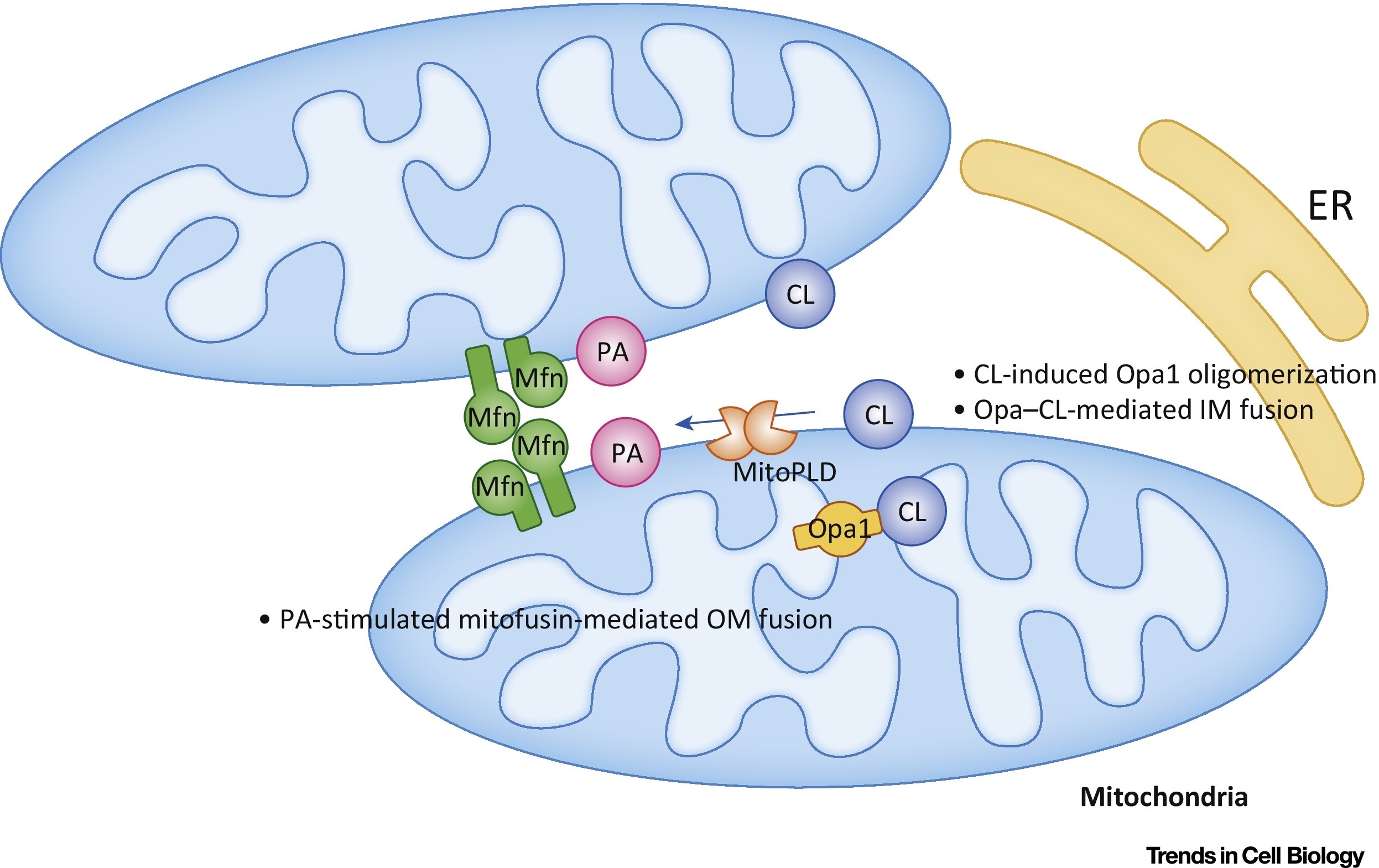 Gambar. 7 Regulasi fusi mitokondria dengan asam fosfatidat (PA) dan kardiolipin (CL) [dari 9].
Gambar. 7 Regulasi fusi mitokondria dengan asam fosfatidat (PA) dan kardiolipin (CL) [dari 9].Di membran luar (OM), RA menstimulasi fusi mitofusin-mediated (Mfn). Dalam membran bagian dalam (IM), CL merangsang fusi yang dimediasi Opa1. Singkatan: ER - retikulum endoplasma; MitoPLD, - fosfolipase terlokalisasi mitokondria D.
3. Regulasi ekspresi mitofusin (protein yang bertanggung jawab untuk dinamika mitokondria)Segala sesuatu yang kita bicarakan di atas (pembatasan kalori, asam stearat, fosfolipid) bertindak dengan memengaruhi ekspresi mitofusin.Selain itu, ada sejumlah obat yang secara tidak langsung dapat mempengaruhi dinamika mitokondria. Ini termasuk penggunaan metformin.Yang paling menarik adalah penggunaan zat yang secara langsung dapat mempengaruhi ekspresi mitofusin. Salah satu obat potensial yang disebut leflunomide (leflunomide), yang telah disetujui oleh FDA [5,11]. Ini adalah penginduksi dari ekspresi Mfn1 dan Mfn2, dan telah terdaftar sebagai obat untuk perawatan rheumatoid arthritis.Terapi gen mitokondria
Dinamika mitokondria yang terganggu dapat dikaitkan dengan gangguan ekspresi protein yang bertanggung jawab atas fusi dan pembelahan mitokondria. Selain itu, disfungsi protein ini dapat dikaitkan (dan ini paling sering terjadi) dengan mutasi mereka. Ada dua pendekatan untuk pertimbangan interaksi sebab-akibat dari disfungsi mitokondria.Sebelumnya diyakini bahwa gaya hidup, termasuk makan berlebihan, mengarah pada pembentukan radikal bebas, stres oksidatif, mutasi genom mitokondria dan, akibatnya, disfungsi mitokondria. Namun, baru-baru ini ada bukti yang meyakinkan bahwa mutasi DNA mitokondria tidak dapat dihindari, semua memiliki mutasi titik DNA heteroplasma dan dikaitkan dengan kesalahan replikasi, dan tidak dengan kerusakan oksidatif, yang DNA mitokondria cukup stabil [12]. Sudah pada tahap sel telur yang dibuahi, beberapa mitokondria kita membawa mutasi. Seiring waktu, mereka membelah, ada lebih banyak mitokondria mutan, mereka tidak dapat melakukan fungsinya secara normal.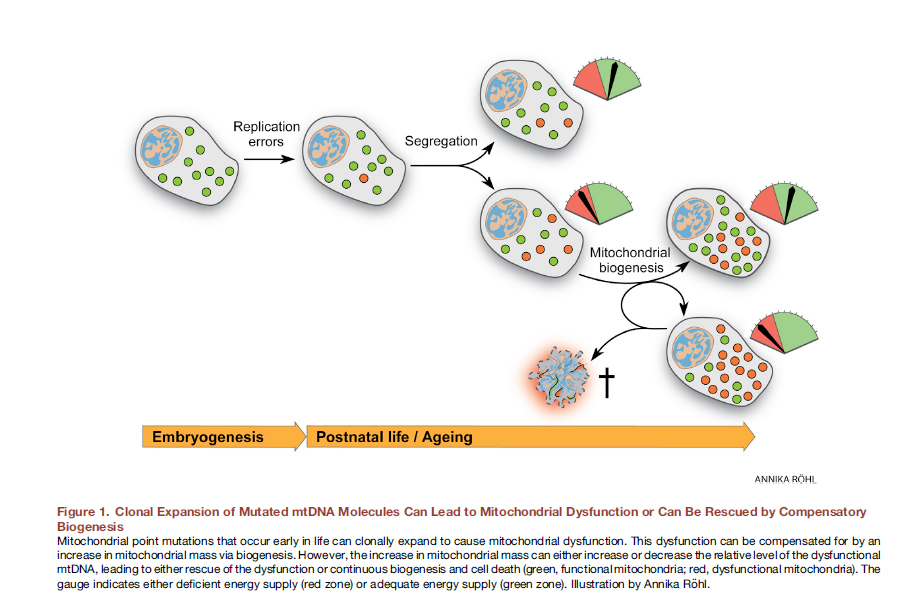 Fig. 8 Ekspansi klon molekul mtDNA yang termutasi dapat menyebabkan disfungsi mitokondria atau dapat "diselamatkan" dengan biogenesis kompensasi [dari 12].Di sini, secara in vivo, pengeditan genom mitokondria bisa sangat berguna. Telah ditunjukkan bahwa untuk mutasi titik DNA heteroplasma pada tikus, keberhasilan yang signifikan telah dicapai dengan nuklease seng-jari yang ditargetkan (mtZFN) dengan pengiriman menggunakan vektor adenoviral [13].
Fig. 8 Ekspansi klon molekul mtDNA yang termutasi dapat menyebabkan disfungsi mitokondria atau dapat "diselamatkan" dengan biogenesis kompensasi [dari 12].Di sini, secara in vivo, pengeditan genom mitokondria bisa sangat berguna. Telah ditunjukkan bahwa untuk mutasi titik DNA heteroplasma pada tikus, keberhasilan yang signifikan telah dicapai dengan nuklease seng-jari yang ditargetkan (mtZFN) dengan pengiriman menggunakan vektor adenoviral [13].Transfer mitokondria
Metode lain yang menjanjikan untuk menghilangkan disfungsi mitokondria adalah transplantasi mitokondria. Inti dari pendekatan ini adalah untuk "mengganti" mitokondria yang rusak dengan mitokondria eksogen yang sehat. Pendekatan ini pertama kali digunakan secara klinis pada anak-anak dengan iskemia miokard. Mitokondria terisolasi autologus digunakan untuk transplantasi, yang diisolasi dengan otot rectus abdominis (biopsi dilakukan, dan kemudian persiapan disiapkan), dan kemudian diberikan dengan injeksi langsung [14]. Berbagai pendekatan untuk memperkenalkan mitokondria sedang dikembangkan: injeksi langsung mitokondria terisolasi (injeksi lokal) dan injeksi sistemik ke dalam aliran darah, ketika mitokondria itu sendiri “mencari” sel mana yang akan dituju. Kelompok peneliti sedang mempelajari kemungkinan transplantasi mitokondria pada penyakit Parkinson, iskemia hati, stroke, penyakit mitokondria [15].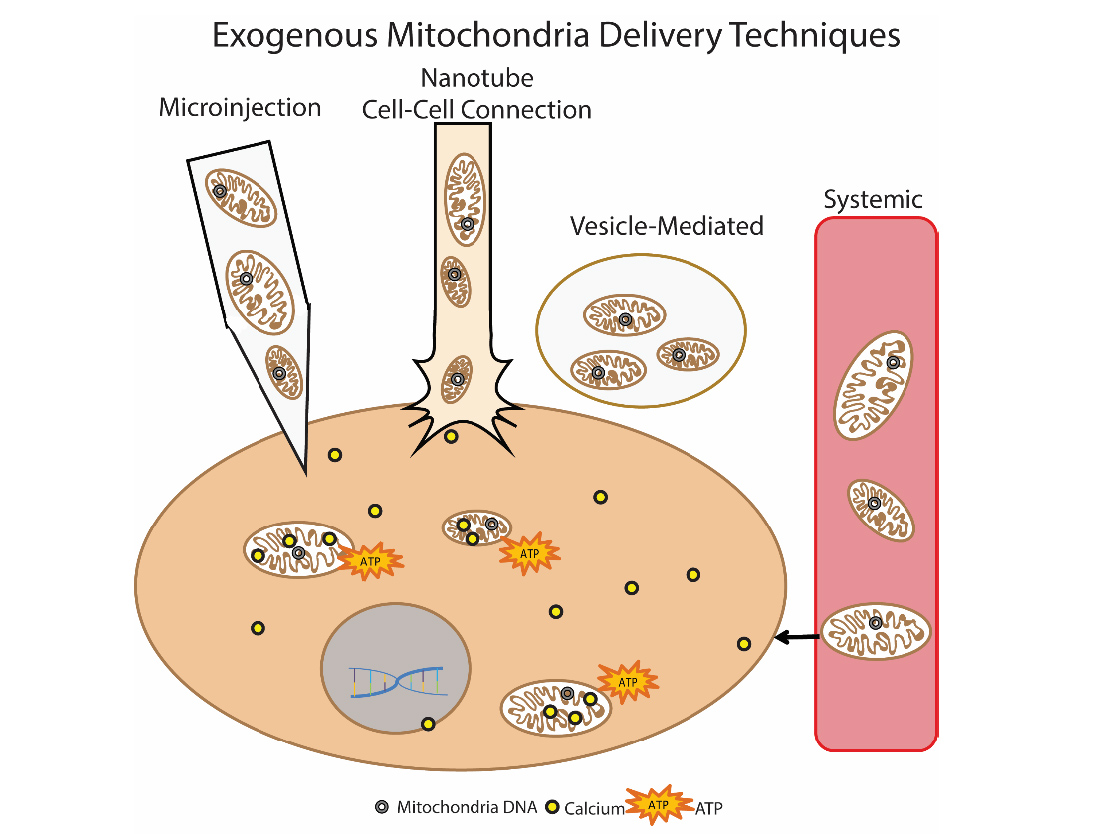 9 Metode untuk pengiriman mitokondria eksogen ke selPenulis Olga Borisova
9 Metode untuk pengiriman mitokondria eksogen ke selPenulis Olga BorisovaSastra1. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. «Mammalian mitochondria and aging: an update.» Cell metabolism 25.1 (2017): 57-71.
www.sciencedirect.com/science/article/pii/S15504131163050222. Schrepfer, Emilie, and Luca Scorrano. «Mitofusins, from mitochondria to metabolism.» Molecular cell 61.5 (2016): 683-694.
www.sciencedirect.com/science/article/pii/S1097276516001337#fig13. Marc Liesa, Orian Shirihai “Mitochondrial Dynamics in the Regulation of Nutrient Utilization and Energy Expenditure” Cell methabolism (2013): 491-506
www.sciencedirect.com/science/article/pii/S1550413113001046#fig34. Ramos, Eduardo Silva, Nils-Göran Larsson, and Arnaud Mourier. «Bioenergetic roles of mitochondrial fusion.» Biochimica et Biophysica Acta (BBA)-Bioenergetics 1857.8 (2016): 1277-1283.
www.sciencedirect.com/science/article/pii/S00052728163008585. Cunarro, Juan, et al. «Hypothalamic mitochondrial dysfunction as a target in obesity and metabolic disease.» Frontiers in endocrinology 9 (2018): 283.
www.frontiersin.org/articles/10.3389/fendo.2018.00283/full6. Marcelo O.Dietrich et al. «Mitochondrial Dynamics Controlled by Mitofusins Regulate Agrp Neuronal Activity and Diet-Induced Obesity”.
www.sciencedirect.com/science/article/pii/S0092867413010957#figs27. Steculorum, Sophie M., and Jens C. Brüning. „Sweet mitochondrial dynamics in VMH neurons.“ Cell metabolism 23.4 (2016): 577-579.
www.sciencedirect.com/science/article/pii/S15504131163011768. Senyilmaz-Tiebe, Deniz, et al. „Dietary stearic acid regulates mitochondria in vivo in humans.“ Nature communications 9.1 (2018): 3129.
www.nature.com/articles/s41467-018-05614-69. Kameoka, Shoichiro, et al. „Phosphatidic Acid and Cardiolipin Coordinate Mitochondrial Dynamics.“ Trends in cell biology (2017).
www.sciencedirect.com/science/article/pii/S096289241730158710.
raypeatforum.com/community/threads/mitolipin-liquid-saturated-phosphatidylcholine-pc-mix.1039811. Miret-Casals, Laia, et al. „Identification of new activators of mitochondrial fusion reveals a link between mitochondrial morphology and pyrimidine metabolism.“ Cell chemical biology25.3 (2018): 268-278.
12. Kauppila, Timo ES, Johanna HK Kauppila, and Nils-Göran Larsson. „Mammalian mitochondria and aging: an update.“ Cell metabolism 25.1 (2017): 57-71.
13. Gammage et al. “Genome editing in mitochondria corrects a pathogenic mtDNA mutation in vivo” Nature medicine, 2017
www.nature.com/articles/s41591-018-0165-914. Emani, Sitaram M., et al. „Autologous mitochondrial transplantation for dysfunction after ischemia-reperfusion injury.“ The Journal of thoracic and cardiovascular surgery 154.1 (2017): 286-289.
www.jtcvs.org/article/S0022-5223 (17)30258-1/fulltext
15. McCully, James D., et al. „Mitochondrial transplantation: From animal models to clinical use in humans.“ Mitochondrion 34 (2017): 127-134.
www.sciencedirect.com/science/article/pii/S1567724917300053