Mekanisme anti-penuaan dan umur yang lebih lama terkait dengan pembatasan kalori: data dari studi hewan yang dimodifikasi secara genetik.
Diketahui bahwa pembatasan kalori (CR) meningkatkan harapan hidup dan menghambat berbagai perubahan patofisiologis. CR menghambat pensinyalan hormon pertumbuhan / faktor pertumbuhan seperti insulin dan mTORC1, mengaktifkan sirtuin dan meningkatkan regulasi redoks mitokondria. Tetapi mekanisme yang tepat sedang dibahas. Dalam ulasan ini, kami membahas mekanisme CR menggunakan data penelitian hewan yang telah dimodifikasi secara genetik sesuai dengan kemajuan terbaru dalam teknologi molekuler dan genetik, dalam hal hipotesis respon adaptif yang diajukan oleh Holliday pada tahun 1989. Kami juga akan menjelaskan efek positif CR, diklasifikasikan menurut apakah mereka bekerja dalam kondisi gizi atau puasa.
Pada tahun 1935, CR dideskripsikan untuk meningkatkan umur panjang pada tikus [1]. CR, juga dikenal sebagai pembatasan diet atau pembatasan energi, banyak digunakan dalam penelitian penuaan sebagai manipulasi diet yang kuat dan mudah direproduksi untuk memperpanjang usia. CR telah diamati pada beberapa spesies, dari ragi dan nematoda hingga mamalia. Pada mamalia, ini terutama dipelajari menggunakan tikus di mana CR menekan berbagai perubahan patofisiologis terkait usia dan memperpanjang usia rata-rata dan maksimum. Namun, efek menguntungkan dari CR menghilang pada jenis dan / atau kondisi tertentu. Ulasan terbaru merinci batasan-batasan ini [2]. Sejauh mana CR memberikan efek menguntungkan tergantung pada faktor-faktor seperti spesies hewan pengerat, strain, dan waktu timbulnya CR. Secara umum, bagaimanapun, CR jangka panjang dimulai pada usia muda menekan perubahan patofisiologis terkait usia dan memperpanjang umur panjang pada tikus yang berbeda. Penting juga bahwa keterbatasan nutrisi individu (misalnya, glukosa, lipid, protein) tanpa pembatasan energi tidak menyebabkan efek menguntungkan seperti itu [3, 4].
Lebih dari 20 tahun yang lalu, tikus kerdil Ames yang memiliki mutasi gen Prop1 ditemukan hidup lebih lama daripada tikus tipe liar [5]. Ini adalah laporan pertama bahwa mutasi gen tunggal atau modifikasi genetik dapat memperpanjang umur panjang pada mamalia. Sepengetahuan kami, lebih dari 40 tikus dan tikus dengan mutasi gen tunggal atau modifikasi genetik hidup lebih lama daripada hewan tipe liar. Dari tikus dan tikus ini, sekitar sepertiga menunjukkan pensinyalan hormon pertumbuhan (GH) / insulin-like growth factor 1 (IGF1). Karena CR juga menekan pensinyalan GH / IGF1, efek menguntungkan dari CR dapat didasarkan pada hal ini. Mekanisme molekuler lain yang telah diusulkan untuk mengatur efek menguntungkan CR termasuk penghambatan aktivitas target mekanistik rapamycin complex 1 (mTORC1), aktivasi autophagy, aktivasi NAD + dan metabolisme sirtuin, dan peningkatan regulasi redoks mitokondria [6, 7]. Namun, mekanisme ini tidak sepenuhnya dipahami.
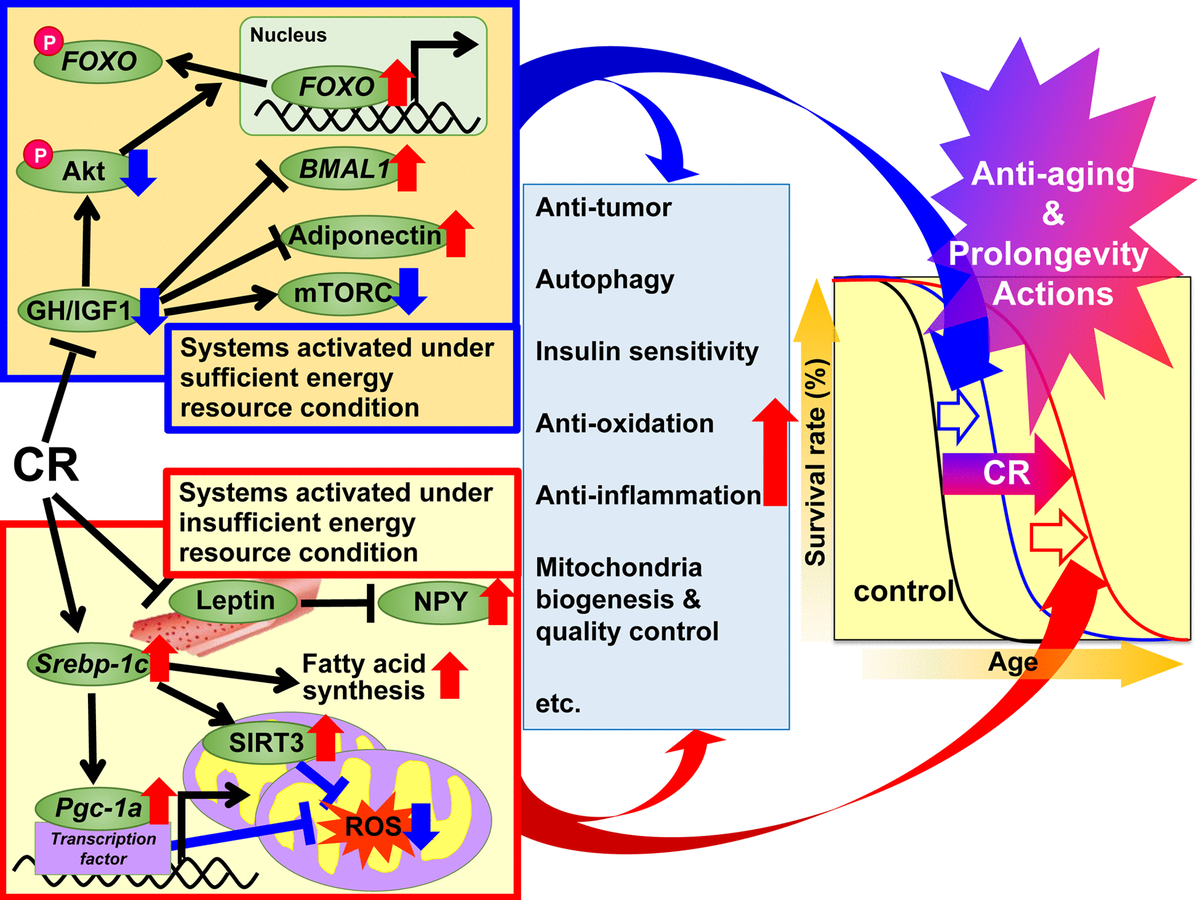 Fig. 1. Mekanisme tindakan pembatasan kalori yang diusulkan (CR) terhadap penuaan dan untuk meningkatkan umur berdasarkan pada hipotesis respon adaptif. Diusulkan agar mekanisme pengaturan CR dibagi menjadi dua sistem. Sistem pertama diaktifkan di bawah kondisi energi yang cukup, ketika dimungkinkan untuk menggunakan energi secara bebas, dan hewan tumbuh dengan baik, mereproduksi lebih banyak dan menyimpan energi berlebih dalam bentuk trigliserida (TG) dalam jaringan adiposa putih (WAT) untuk penggunaan selanjutnya. Sistem ini termasuk hormon pertumbuhan (GH) / insulin-like growth factor 1 (IGF1), Akt, FOXO, mTORC, adiponectin dan BMAL1. Sistem kedua diaktifkan dalam kondisi energi yang tidak mencukupi, ketika tidak ada manfaat dari penggunaan energi yang berlebihan, dan hewan menekan pertumbuhan dan reproduksi dan menggunakan energi yang disimpan untuk mempertahankan fungsi biologis. Sistem ini mencakup jalur pensinyalan seperti itu: protein SREBP-1c, sirtuin (SIRT), protein PGC-1α, spesies oksigen reaktif mitokondria (ROS), leptin dan neuropeptide Y (NPY). Pada hewan dengan CR, sinyal ini efektif untuk penggunaan energi. Selain itu, berbagai sinyal dan / atau faktor dapat berkontribusi pada efek menguntungkan yang terkait dengan CR, termasuk antioksidan, anti-inflamasi, antitumor dan efek CR lainnya pada berbagai tingkat di setiap jaringan atau organ, dan dengan demikian menyebabkan peremajaan dan perpanjangan hidup.
Fig. 1. Mekanisme tindakan pembatasan kalori yang diusulkan (CR) terhadap penuaan dan untuk meningkatkan umur berdasarkan pada hipotesis respon adaptif. Diusulkan agar mekanisme pengaturan CR dibagi menjadi dua sistem. Sistem pertama diaktifkan di bawah kondisi energi yang cukup, ketika dimungkinkan untuk menggunakan energi secara bebas, dan hewan tumbuh dengan baik, mereproduksi lebih banyak dan menyimpan energi berlebih dalam bentuk trigliserida (TG) dalam jaringan adiposa putih (WAT) untuk penggunaan selanjutnya. Sistem ini termasuk hormon pertumbuhan (GH) / insulin-like growth factor 1 (IGF1), Akt, FOXO, mTORC, adiponectin dan BMAL1. Sistem kedua diaktifkan dalam kondisi energi yang tidak mencukupi, ketika tidak ada manfaat dari penggunaan energi yang berlebihan, dan hewan menekan pertumbuhan dan reproduksi dan menggunakan energi yang disimpan untuk mempertahankan fungsi biologis. Sistem ini mencakup jalur pensinyalan seperti itu: protein SREBP-1c, sirtuin (SIRT), protein PGC-1α, spesies oksigen reaktif mitokondria (ROS), leptin dan neuropeptide Y (NPY). Pada hewan dengan CR, sinyal ini efektif untuk penggunaan energi. Selain itu, berbagai sinyal dan / atau faktor dapat berkontribusi pada efek menguntungkan yang terkait dengan CR, termasuk antioksidan, anti-inflamasi, antitumor dan efek CR lainnya pada berbagai tingkat di setiap jaringan atau organ, dan dengan demikian menyebabkan peremajaan dan perpanjangan hidup.Tujuan dan mekanisme molekuler CR
Pensinyalan GH, IGF1 dan FOXO1
GH meningkatkan produksi IGF1 terutama di hati melalui reseptor GH (GHR). IGF1 bekerja pada reseptor IGF1 dan kemudian memfosforilasi Akt, serin / treonin kinase dalam sel target. Bentuk Akt terfosforilasi kemudian memfosforilasi faktor transkripsi FOXO, memfasilitasi ekspor nuklir. Oleh karena itu, penekanan sinyal GH / IGF1 secara transkripsi meningkatkan ekspresi beberapa gen yang diaktifkan oleh faktor transkripsi FOXO.
Beberapa spesies tikus yang dimodifikasi, Ames dwarf, Snell dwarf, dan GHR KO (GHR KO), menunjukkan pensinyalan GH yang ditekan dan memiliki umur yang panjang. Tikus kerdil ini memiliki fenotipe yang mirip dengan tikus CR, termasuk pensinyalan GH / IGF1 yang ditekan, penurunan kadar hormon tiroid, insulin dan glukosa, suhu tubuh yang lebih rendah, dan penurunan obesitas. Namun, profil ekspresi gen hati berbeda secara signifikan antara tikus GHR KO dan tikus CR [8]. Kami juga melaporkan bahwa bagian dari profil ekspresi gen dalam jaringan adiposa putih (WAT) tikus CR secara signifikan berbeda dari tikus kurcaci seumur hidup yang membawa transgen antisense GH [9].
Bonkowski et al. melaporkan bahwa CR meningkatkan sensitivitas insulin dan meningkatkan harapan hidup pada tikus tipe liar, tetapi tidak pada tikus GHR KO [10]. Oleh karena itu, mereka menyarankan bahwa efek peningkatan umur CR tergantung pada penekanan sinyal GH / IGF1. Pada tikus kerdil dan tikus kerdil yang membawa antisense GH transgen, CR semakin meningkatkan harapan hidup [11, 12]. Data ini menunjukkan bahwa tindakan anti-penuaan dan meningkatnya usia harapan hidup CR dapat diatur baik secara independen dari sinyal GH / IGF1 maupun secara independen.
Faktor-faktor transkripsi FOXO pada mamalia terdiri dari empat isoform, yaitu, FOXO1, 3, 4, dan 6. Tikus FOXO1 KO (dengan knockout gen ini) memiliki umur CR yang diperpanjang, tetapi tidak ada efek antitumor yang terkait dengan CR [13]. Sebaliknya, pada tikus FOXO3 KO, penambahan CR menghambat tumorigenesis, tetapi tidak ada peningkatan rentang hidup yang diinduksi CR. Perbedaan-perbedaan ini dapat dikaitkan dengan pola aktivasi diferensial dalam jaringan dan / atau sel-sel dari empat isoform faktor transkripsi yang diinduksi CROX FOXO.
Protein BMAL1 adalah faktor transkripsi yang terlibat dalam pengaturan ritme sirkadian. Pada tikus BMAL1 KO (tersingkir dari gen ini), asupan makanan meningkat, berat badan menurun, dan fenotip penuaan bertambah cepat. Pada tikus yang sama, CR tidak menurunkan kadar insulin dan IGF1 dan tidak meningkatkan harapan hidup. Yang menunjukkan partisipasi BMAL1 dalam efek menguntungkan CR dan bahwa efek menguntungkan ini tergantung pada transmisi sinyal GH / IGF1 [15].
Alarm mTOR
mTOR kinase, serin / treonin kinase, telah diidentifikasi sebagai molekul target rapamycin. Ini membentuk dua kompleks multi-protein yang terpisah, yang dikenal sebagai mTORC1 dan mTORC2. MTORC1 diketahui diaktifkan oleh asam amino dan faktor pertumbuhan (mis., Insulin dan IGF1). Aktivasi mTORC1 mempromosikan sintesis protein melalui S6 1 ribosom protein kinase, sintesis asam lemak melalui steroid regulator binding protein (SREBP) 1, dan diferensiasi adiposit oleh peroxisome proliferator-activated reseptor (PPARγ). mTORC1 menghambat biosintesis autofag dan lisosom melalui faktor transkripsi EB (TFEB). Fungsi mTORC2 kurang dipahami, tetapi diyakini bahwa itu termasuk peningkatan aksi anabolik dan penekanan aksi katabolik, seperti untuk mTORC1 [16].
Tikus yang diberi regulasi negatif rapamycin mTORC1 untuk waktu yang lama setelah usia pertengahan mengalami peningkatan harapan hidup [17]. Sesuai dengan penemuan ini, tikus transgenik dengan ekspresi berlebih dari protein TSC1, yang secara negatif mengatur mTORC1, hidup lebih lama daripada tikus tipe liar [18]. Selain itu, tikus knockout dengan protein kinase ribosom S6 1 dan tikus mutan mTOR juga hidup lebih lama dari tikus tipe liar [19, 20].
Sejauh pengetahuan kami, efek menguntungkan CR belum diteliti pada tikus dengan fungsi mTORC1 yang rusak. Namun, dalam ragi dengan penghambatan genetik, mTOR CR tidak meningkatkan umur [21]. Autophagy ditingkatkan dengan menghambat mTORC1. Pada nematoda yang kekurangan gen yang berhubungan dengan autophagy, CR tidak meningkatkan rentang hidup [22]. Berdasarkan data ini, ada kemungkinan bahwa penurunan aktivitas mTOR dan aktivasi peralatan autophagic dikaitkan dengan efek positif CR.
Sirtuins
Sir2 ditemukan sebagai gen baru yang terlibat dalam penekanan transkripsi dalam ragi. Setelah itu, dilaporkan bahwa itu memainkan peran kunci dalam memperpanjang hidup di CR [23, 24]. Tujuh sirtuin gen ortolog, sirtuins Sirt1 - Sirt7, telah diidentifikasi pada mamalia. Protein SIRT1, 6 dan 7 terutama terlokalisasi di nukleus, SIRT2 di nukleus dan sitoplasma, dan SIRT 3, 4 dan 5 terutama di mitokondria. Sirtuins mengkatalisasi reaksi deasetilasi berbagai protein, termasuk histones, tergantung pada NAD [25].
Di antara tujuh sirtuin mamalia, SIRT1, 3, dan 6 dilaporkan terlibat dalam patofisiologi terkait usia dan regulasi rentang hidup [26]. Tikus transgenik di mana protein SIRT1 secara selektif diekspresikan dalam neuron hipotalamus memiliki umur yang lebih panjang daripada tikus tipe liar. [27] Tikus betina transgenik di mana protein SIRT6 diekspresikan berlebih memiliki umur yang lebih panjang daripada tikus tipe liar [28]. Pada tikus tua, CR meningkatkan ekspresi SIRT6 dan memperbaiki gagal ginjal selama 6 bulan. Selain itu, sementara overekspresi SIRT6 menekan penuaan sel dengan mengurangi aktivitas faktor transkripsi terkait peradangan NF-κB, KO SIKT6 mempercepat penuaan sel [29]. Pada tikus SIRT3 KO, berbagai patologi terkait usia sebelumnya diamati [30]. Meskipun CR mencegah gangguan pendengaran terkait usia pada tikus tipe liar, efek ini tidak diamati pada tikus SIRT3 KO [31].
Faktor transkripsi NRF2
NRF2 mengikat unsur respons antioksidan untuk menginduksi ekspresi gen target sebagai respons terhadap stres oksidatif dan meningkatkan ekspresi gen yang terlibat dalam respons antioksidan dan detoksifikasi. Dalam kondisi fisiologis, NRF2 berikatan dengan protein Keap1 di sitoplasma, di mana ia terdegradasi. Di bawah tekanan, termasuk stres oksidatif, setelah Keap1 ditangkap oleh p62 terfosforilasi, NRF2 mentranslokasi ke nukleus, mengikat elemen respons antioksidan, dan mengaktifkan transkripsi gen antioksidan [32].
Karena ekspresi NRF2 berkurang dengan penuaan pada tikus, diasumsikan bahwa tingkat spesies oksigen reaktif dan berbagai risiko kanker meningkat. Namun, CR menekan penurunan kemampuan antioksidan terkait usia dengan meningkatkan ekspresi gen yang terlibat dalam antioksidan dan detoksifikasi. Dalam nematoda, Skn-1, homolog NRF2, sangat diperlukan untuk tindakan CR untuk meningkatkan umurnya. Tikus knockout NRF2 menunjukkan penurunan ekspresi gen yang terlibat dalam respons antioksidan dan detoksifikasi, sehingga mempercepat onkogenesis. Peran NRF2 dalam efek menguntungkan CR telah diselidiki menggunakan tikus NRF2 KO. Hasil penelitian menunjukkan bahwa NRF2 penting untuk efek antitumor CR, tetapi tidak terlibat dalam efek yang terkait dengan harapan hidup dan peningkatan sensitivitas insulin CR [33].
Neuropeptide Y (NPY)
Pada mamalia, neuron dalam nukleus arkuata hipotalamus merasakan status energi dari tingkat sirkulasi hormon. Keseimbangan energi negatif terkait CR dan penurunan massa lemak selanjutnya meningkatkan sirkulasi tingkat ghrelin dan adiponektin dan mengurangi kadar leptin darah, insulin, dan IGF1. Perubahan hormon ini mengaktifkan neuron NPY dalam nukleus arkuata hipotalamus. Sebagian besar neuron ini mensintesis protein Agrp, melemahkan aktivitas neuron POMC dalam nukleus arkuata. Perubahan aktivitas neuron primer menghambat neuron hipotalamus sekunder yang mensekresi somatotropin, gonadotropin, dan hormon pelepas tirotropin, dan mengaktifkan neuron yang mengeluarkan hormon pelepas kortikotropin. Perubahan hipotalamus ini menekan pensinyalan GH / IGF1, fungsi tiroid, dan reproduksi dan mengaktifkan fungsi glukokortikoid adrenal. Sebagian besar profil sekresi neuron yang berubah ini diamati pada tikus dan tikus dengan CR [34].
Dalam NPY KO tikus yang tersingkir, penambahan CR tidak meningkatkan harapan hidup, menyebabkan toleransi terhadap stres oksidatif di hati, dan mengubah profil sekresi neuron. Namun, CR menurunkan kadar insulin dan IGF1 dalam darah, meningkatkan kadar adiponektin dan kortikosteron darah, dan menurunkan ekspresi gen yang terlibat dalam oksidasi beta di hati. Dengan demikian, NPY harus menjadi faktor kunci yang terkait dengan tindakan CR independen GF / IGF1 [35].
Mutasi DNA mitokondria (mtDNA)
Diyakini bahwa akumulasi mutasi mtDNA adalah salah satu faktor patogenesis kunci pada penyakit yang berkaitan dengan usia. Tikus PolgA D257A / D257A membawa mutasi pada gamma mtDNA polimerase dan menunjukkan perkembangan akumulasi mutasi mtDNA yang berkaitan dengan usia dan fenotipe usia terkait dalam berbagai jaringan [36]. Pada tikus PolgA, D257A / D257A CR tidak memperpanjang umur, tidak mempengaruhi akumulasi penghapusan mtDNA pada otot rangka, dan tidak meningkatkan fungsi jantung, dan ini berkontribusi pada sarkopenia. Data ini menunjukkan bahwa akumulasi mutasi mtDNA dapat menghambat efek menguntungkan dari CR [37].
Hasil baru kami: Renovasi CR jaringan adiposa
Obesitas visceral terkait dengan diabetes, hiperlipidemia, dan hipertensi, secara kolektif dikenal sebagai "sindrom metabolik", merupakan faktor risiko yang diketahui untuk perkembangan penyakit aterosklerotik yang mengancam jiwa, termasuk infark miokard dan infark serebral. Jaringan adiposa, awalnya dianggap hanya terkait dengan fungsi energi, baru-baru ini digambarkan sebagai organ endokrin yang mengeluarkan berbagai molekul aktif biologis yang disebut adipokine. Adiposit besar yang menumpuk trigliserida (TG) secara berlebihan meningkatkan sekresi adipokin inflamasi, termasuk tumor necrosis factor-α (TNF-α) dan interleukin-6 (IL-6), dan mengurangi sekresi adiponektin dibandingkan dengan adiposit kecil, yang menumpuk lebih sedikit TG. Profil sekresi adipokin ini terlibat langsung dalam patologi terkait usia, termasuk resistensi insulin, hipertensi, dan aterosklerosis [38]. Selain itu, jaringan adiposa dan adipokine baru-baru ini dilaporkan sebagai pemain kunci dalam mengatur umur. Sebagai contoh, tikus dengan KO reseptor insulin pada adiposit menunjukkan penurunan obesitas, peningkatan biogenesis mitokondria, dan rentang hidup yang lebih lama daripada tikus tipe liar [39]. Tikus transgenik dengan ekspresi berlebih dari adiponektin di hati menunjukkan kelangsungan hidup yang lebih besar daripada kontrol [40]. Faktor transkripsi PPARγ dan CCAAT / protein pengikat penambah α (C / EBPα) dan β (C / EBPβ) terlibat dalam diferensiasi adiposit. Tikus dengan dekomposisi gen C / EBPβ di lokus C / EBP menunjukkan biogenesis mitokondria yang ditingkatkan dan umur yang lebih lama [41]. Sebaliknya, PPARγ KO yang tersingkir memiliki masa hidup yang lebih pendek daripada yang kontrol [42].
CR telah dilaporkan meningkatkan bentuk aktif adiponectin pada tikus dari segala usia. Regulasi adiponektin terkait CR ini bergantung pada pensinyalan GH / IGF1 [43, 44]. Kami menganalisis perubahan terkait CR dalam urutan kronologis dan memperoleh hasil berikut. CR meningkatkan ekspresi gen dan / atau protein yang terlibat dalam biosintesis asam lemak dan biogenesis mitokondria dalam jaringan adiposa setelah fase CR awal. Perubahan terkait CR terjadi lebih dominan di jaringan adiposa daripada di jaringan atau organ lain. Setelah ini, perubahan morfologis terjadi, termasuk penurunan ukuran adiposit dan perubahan metabolisme di hati [45]. Untuk mengklarifikasi perubahan jaringan adiposa metabolik terkait CR yang terjadi secara independen dari sinyal GH / IGF1, kami kemudian membandingkan profil ekspresi gen CR dalam jaringan adiposa tikus tipe liar dengan tikus transgenik yang diberi ad libitum (AL). Hasil kami menunjukkan bahwa CR meningkatkan ekspresi gen yang terlibat dalam biosintesis asam lemak, khususnya, dalam faktor transkripsi utama biosintesis asam lemak, gen pengatur SREBP-1, secara independen dari GH / IGF1 [9].
CR , SREBP-1c KO . SREBP-1c KO , . CR , , . , . , CR- SREBP-1c KO. , PGC-1α CR- [ 46 ]. , SREBP-1c Pgc-1α, , SREBP-1c Pgc-1α [ 47 ]. , , CR / [ 48 ]. , , CR de novo , [ 45 ]. , SREBP-1c KO CR. , , SREBP-1c CR.
CR
1989 - R , , [ 49, 50 ]. CR ; «, » «, ». , . , , , , , . , - . , , . .
Berdasarkan hipotesis respons adaptif dan temuan terbaru yang disebutkan di atas, kami mengusulkan serangkaian mekanisme untuk efek menguntungkan CR.CR , , CR «, » «, » . GH / IGF1, FOXO, mTORC, BMAL1, CR, -, . SREBP-1c / , SIRT NPY, , , CR . , / CR , , .
CR, (IER) (TRF) [ 2 ]. IER 2-3 . TRF, , , , ( ) . , IER TRF, CR. , , , , . CR, IER TRF.
, CR , [ 51 ]. CR , CR, CR. , , CR CR. , , CR, . , . CR , / , , CR , . , , CR- , CR IER TRF, CR, , .
: .
:
Hoshino S, Kobayashi M, Higami Y. Mechanisms of the anti-aging and prolongevity effects of caloric restriction: evidence from studies of genetically modified animals. Aging (Albany NY). 2018 Sep 16.