Sel-sel tua (tua) sekarang disebut sel-sel di mana siklus sel dihentikan di bawah pengaruh berbagai faktor (stres atau kelelahan sumber daya divisi). Akibatnya, sel-sel tersebut tidak membelah dan tidak diperbarui.
Konferensi Senescence Cell in Cancer and Aging di University of Cambridge memberikan definisi penuaan sel sebagai berikut: “Penuaan sel
mengacu pada penghentian proliferasi yang disebabkan oleh berbagai pemicu molekuler, termasuk aktivasi onkogen, serta pembelahan sel yang berlebihan. Selain itu, sel-sel tua ditandai oleh sekresi sejumlah regulator stroma dan regulator inflamasi (yang disebut "terkait dengan penuaan fenotip serotore"), yang mempengaruhi fungsi sel-sel tetangga, termasuk yang imunokompeten. Sejumlah fakta yang meyakinkan menunjukkan bahwa penuaan sel adalah mekanisme yang efektif untuk menekan pertumbuhan tumor. Pada saat yang sama, penuaan sel dapat berkontribusi pada penuaan jaringan dan seluruh organisme . "
Karena berbagai mekanisme penyebab, tiga jenis penuaan sel dibedakan.
Yang paling awal di awal 60-an abad lalu ditemukan penuaan replikasi sel. Dalam karya yang sudah terkenal, gerontolog Amerika L. Hayflick dan P. Moorhead, dalam percobaan dengan fibroblast manusia yang dikultur, menetapkan bahwa sel tidak membelah tanpa batas waktu dan ada batas untuk pembelahan sel (kemudian disebut batas atau batas Hayflick) [1]. Setelah 10 tahun, ahli biologi Soviet Aleksey Olovnikov memberikan penjelasan logis untuk fenomena ini, menghubungkan batas pembelahan sel dengan pemendekan bertahap bagian terminal DNA, telomer. Ini disebabkan oleh fakta bahwa enzim telomerase, yang mampu meningkatkan telomer setelah pemendekannya, tidak aktif di sebagian besar sel somatik. Setelah telomer dipersingkat ke tingkat kritis, respons kerusakan DNA (DDR) terjadi, akibatnya siklus sel berhenti dan sel menjadi tua. Diketahui bahwa faktor eksternal yang secara negatif mempengaruhi kesehatan dan umur panjang (obesitas, kurang olahraga, stres) juga memiliki efek negatif pada pemendekan telomer [2]. Juga, percepatan pengurangan panjang telomer diamati pada pasien dengan penyakit neurodegeneratif, seperti penyakit Alzheimer [3].
Untuk sebagian besar sel, diyakini bahwa batas Hayflick adalah sekitar 50 divisi, setelah itu sel berhenti membelah. Untuk membedakan penuaan tubuh secara keseluruhan dari penuaan sel, Hayflick dan Moorhead memperkenalkan istilah khusus untuk revolusi ilmiah, yang mengacu pada penuaan sel - penuaan (berbeda dengan penuaan - penuaan).
Selain penuaan replikasi, penuaan sel juga dapat disebabkan oleh faktor-faktor lain yang secara prematur menginduksi penuaan sel terlepas dari panjang telomer. Faktor-faktor ini membentuk penuaan sel tipe kedua dan ketiga.
Dengan demikian, aktivasi onkogen seperti RAS dan RAF menyebabkan penuaan sel yang disebut oncogene-induced cell senescence (OIS). Bentuk penuaan sel ini dikaitkan dengan penekanan tumor. Studi perbandingan genom sel dengan replikasi dan penuaan OIS menunjukkan bahwa, meskipun ada beberapa perubahan umum dalam ekspresi gen antara kedua spesies dibandingkan dengan sel yang berkembang biak, ada juga perbedaan yang signifikan [4]. Diketahui bahwa kerusakan DNA yang terkait dengan spesies oksigen reaktif (ROS) memainkan peran penting dalam mekanisme penuaan OIS. ERK kinase juga secara aktif terlibat dalam terjadinya OIS, merangsang degradasi protein yang diperlukan untuk perkembangan siklus sel. Peran respon kerusakan DNA (DDR) dalam jenis penuaan sel ini belum diklarifikasi. Onkogen mutan, seperti H-Ras G12V, diketahui memiliki potensi untuk mengaktifkan jalur molekul penuaan sel yang terkait dengan p38 MAPK kinase dan faktor transkripsi NF-kB, terlepas dari kerusakan DNA. Gen Ras onkogenik juga dapat berkontribusi untuk meningkatkan regulasi p53 melalui p19ARF dan penuaan sel terlepas dari kerusakan DNA. [5]. Oleh karena itu, stimulasi penuaan OIS seluler tidak dikecualikan bahkan tanpa adanya kerusakan DNA.
Tipe ketiga dari penuaan sel, yang juga tidak tergantung pada panjang telomer, adalah stress premature induced senescence (SIPS). Ini muncul sebagai respons terhadap faktor stres dari berbagai alam: radiasi ionisasi dan ultraviolet, peningkatan tingkat ROS, obat kemoterapi. Berbeda dengan penuaan OIS, kejadian SIPS sepenuhnya tergantung pada respons terhadap kerusakan DNA (DDR). Secara fenotip, SIPS dan penuaan sel replikatif sebagian besar serupa, tetapi mungkin berbeda pada tingkat ekspresi protein. Peran SIPS dalam penuaan umum tubuh tetap tidak sepenuhnya jelas - peningkatan ekspresi antioksidan dan penekanan ROS, faktor utama dalam terjadinya SIPS, tidak mengarah pada peningkatan rentang hidup [6].
Mekanisme molekuler untuk menghentikan siklus sel dalam sel tua sedang dipelajari secara aktif hari ini. Diketahui bahwa tingkat kerusakan DNA mempengaruhi siklus sel dengan berbagai cara. Jadi, kerusakan DNA moderat dapat menginduksi penghentian pertumbuhan sementara, kerusakan DNA luas menyebabkan kematian sel terprogram, kerusakan DNA persisten menyebabkan penuaan sel. Penentu molekuler (faktor utama) yang mengatur transisi dari penangguhan sementara pertumbuhan untuk penangkapan siklus yang tidak dapat dibalikkan adalah rumit dan belum sepenuhnya dijelaskan. Diketahui bahwa kerusakan DNA pada awalnya mengaktifkan jalur p53-p21, yang menghentikan siklus sel. Kemudian, jika kerusakan DNA tidak diperbaiki, sel masuk ke apoptosis atau menjadi tua. Dalam kasus kedua, peran kunci dimainkan oleh protein INK4a p16, yang mengatur pelestarian jangka panjang dari penangkapan siklus sel melalui jalur pensinyalan pRb-E2F (protein retinoblastoma, protein pRb -transkripsi E2F) dan perubahan struktur kromatin [7].
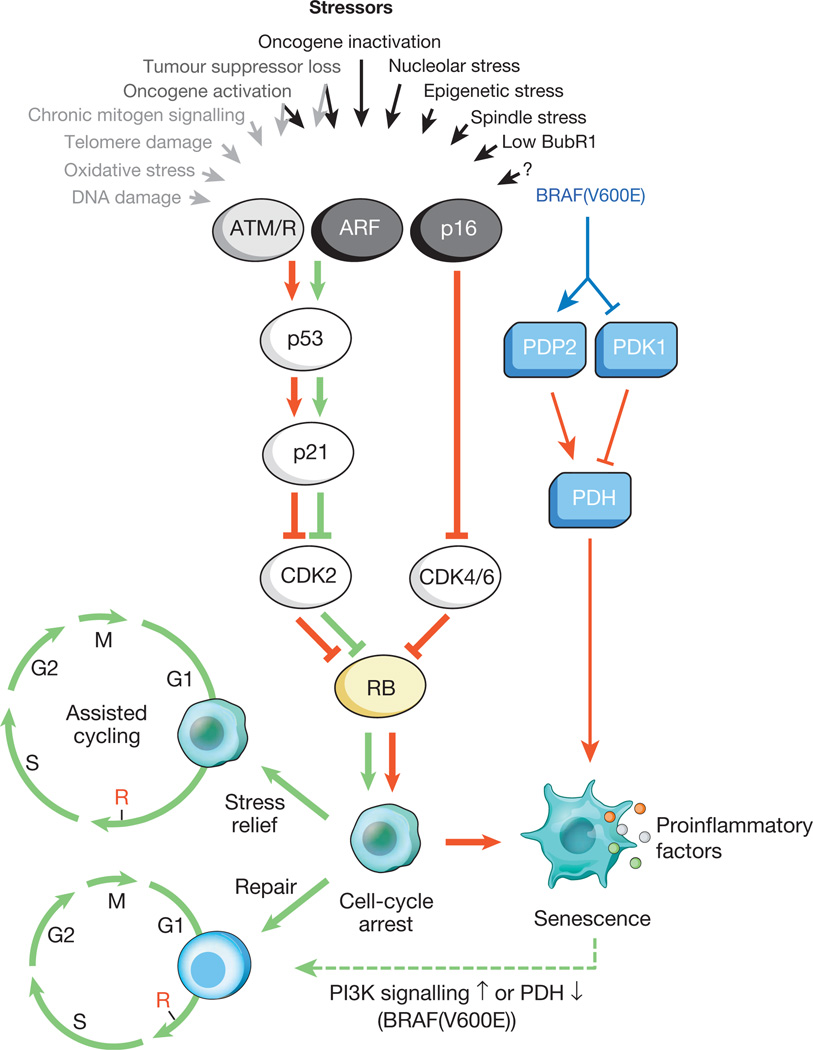
Fig. 1.
Stimuli menyebabkan penuaan sel dan jalur efektor utamaBerbagai tekanan intraseluler dan eksternal dapat mengaktifkan program penuaan sel. Stresor ini menangkap berbagai kaskade pensinyalan seluler, dan akhirnya mengaktifkan INK4a p53 dan p16. Jenis-jenis stres yang mengaktifkan pensinyalan p53 melalui DDR ditunjukkan oleh teks dan panah abu-abu (ROS (ROS) menyebabkan respons kerusakan DNA (DDR), mengganggu transkripsi gen dan replikasi DNA, serta memperpendek telomer). P53 aktif menginduksi p21, yang menyebabkan henti siklus sel sementara dengan menghambat cyclin E-Cdk2. p16 INK4a juga menghambat perkembangan siklus sel, tetapi melakukannya dengan menargetkan cyclin D-Cdk4 dan cyclin D-Cdk6 complexes. Baik INK4a p21 dan p16 bertindak untuk mencegah inaktivasi Rb, yang mengarah pada represi berkelanjutan dari gen target E2F yang diperlukan untuk permulaan fase S. Dengan stres berat (panah merah), sel-sel yang diblokir sementara masuk ke tahap penangkapan dari siklus sel. Sel yang rentan terhadap kerusakan ringan dapat berhasil dipulihkan dan melanjutkan siklus normal. Dengan demikian, jalur p53-p21 dapat memusuhi atau bersinergi dengan p16 INK4a di usia tua tergantung pada jenis dan tingkat stres. BRAF (V600E) dikaitkan dengan penuaan melalui jalur efektor metabolik. BRAF (V600E) mengaktifkan PDH dengan menginduksi PDP2 dan menghambat ekspresi PDK1, mempromosikan pergeseran dari glikolisis ke fosforilasi oksidatif, yang menyebabkan penuaan akibat stres redoks. Sel yang mengalami penuaan menginduksi transkrip inflamasi terlepas dari stres yang disebabkan oleh penuaan (titik-titik berwarna mewakili berbagai faktor SASP). Panah merah dan hijau, masing-masing, menunjukkan aktivitas yang mempromosikan penuaan dan "anti-penuaan." Panah hijau putus-putus menunjukkan mekanisme "perubahan penuaan".Diketahui bahwa sel-sel tua secara aktif memengaruhi lingkungan mikro mereka (jaringan di sekitarnya), mengeluarkan sejumlah molekul aktif: sitokin pro-inflamasi, kemokin, faktor pertumbuhan, protease (total sekitar 40 jenis molekul). Zat-zat ini digabungkan menjadi satu kelompok - penuaan terkait fenotip sekresi (SASP) yang terkait dengan penuaan sel. Diketahui bahwa faktor SASP secara aktif terlibat dalam remodeling jaringan dalam perkembangan embrionik. Selain itu, di bawah pengaruhnya, tubuh ibu dan embrio dibangun kembali. Sifat evolusioner dari SASP dianggap terkait dengan sejumlah mekanisme pertahanan: penekanan tumor, pemulihan dari trauma, dan regenerasi jaringan.
Efek fisiologis yang disederhanakan dari SASP dapat digambarkan sebagai berikut. Molekul pro-inflamasi yang disekresikan membentuk fokus peradangan di sekitar sel-sel tua yang akan diangkat. Apa yang menarik sel-sel sistem kekebalan tubuh ke tempat ini untuk menghilangkan sel-sel yang menua. Matriks matriks SASP metalloproteases (MMP-1, MMP-10, MMP-3) dan serin protease merombak matriks ekstraseluler untuk memfasilitasi penetrasi sel sistem kekebalan tubuh ke sel yang menua. Dan akhirnya, faktor pertumbuhan yang disekresikan merangsang proliferasi sel-sel tetangga untuk menggantikan sel-sel tua terpencil.
Dijelaskan bagaimana mekanisme SASP harus bekerja secara normal, dalam tubuh yang muda dan sehat. Tetapi dengan bertambahnya usia dan dengan penyimpangan, efektivitasnya dapat menurun secara signifikan, yang menyebabkan akumulasi sel-sel tua dalam jaringan dan, sebagai konsekuensinya, untuk sekresi SASP yang pro-inflamasi yang berkepanjangan. Yang disertai dengan terjadinya fokus peradangan kronis. Selain itu, diketahui bahwa aktivitas SASP yang berkepanjangan bertindak sebagai infeksi pada sel normal. Molekul-molekul aktif yang disekresikan oleh sel-sel tua memasuki ruang ekstraseluler dan, bekerja pada sel-sel normal yang berdekatan, memulai penangkapan siklus sel dan menghentikan proliferasi. Yang sangat mempercepat perkembangan penuaan sel dalam jaringan.
Selain itu, sekresi faktor SASP yang berkepanjangan oleh sel yang menua dikaitkan dengan perkembangan patologi terkait usia. Dengan demikian, peningkatan sekresi metaloprotease matriks oleh sel-sel tua merangsang perkembangan penyakit jantung koroner, osteoporosis dan osteoartritis. Sel-sel otot polos penuaan terlibat dalam pengembangan atherosclerosis, melalui sekresi sejumlah besar sitokin proinflamasi. Sekresi faktor pro-inflamasi TNF-α yang berkepanjangan oleh sel T tua terlibat dalam proses yang terkait dengan disfungsi tulang. Selain itu, diketahui bahwa peningkatan kadar IL-6 pro-inflamasi dikaitkan dengan resistensi insulin, diabetes, aterosklerosis, dan penyakit hati. Untuk merujuk pada semua proses yang terkait dengan peradangan kronis dan penuaan sistemik, di mana faktor SASP memainkan peran kunci, istilah khusus diperkenalkan - peradangan. Selain itu, peran ganda SASP dalam karsinogenesis telah dijelaskan - aktivitas penekan tumor dan aktivitas yang mempromosikan tumor [8].
Sehubungan dengan peran ganda dari penuaan sel yang dijelaskan di atas pada usia muda dan tua, beberapa ilmuwan menganggap penuaan sel sebagai contoh pleiotropi antagonis evolusioner, yang masih diracik dengan ungkapan “gunakan sekarang - bayar nanti”. Menurut teori ini, proses yang telah mengakar dalam evolusi untuk meningkatkan kelangsungan hidup organisme muda dapat memiliki efek berbahaya kumulatif pada individu yang lebih tua. Jadi, mekanisme yang terkait dengan sel tua pada usia muda terlibat dalam kehamilan, pemulihan dari cedera, dan perlindungan terhadap tumor. Pada usia lanjut, mekanisme yang sama menyebabkan peradangan sistemik, degenerasi jaringan dan perkembangan patologi [9].
Di antara kumpulan sel-sel tubuh yang menua, para penulis konsep SENS menyoroti dua jenis yang terkait dengan jaringan adiposa: preadipocytes dan sel-sel jaringan adiposa visceral. Dan ini bukan kebetulan, karena hari ini diketahui bahwa lemak visceral aktif secara metabolik dan melepaskan sejumlah molekul aktif - adipokin. Yang, pada gilirannya, dikaitkan dengan perkembangan sejumlah patologi terkait usia (resistensi insulin, diabetes, penyakit kardiovaskular). SENS penulis juga fokus pada kerusakan sistem kekebalan terkait usia. Menurut pendapat mereka, ini disebabkan oleh kelebihan tubuh oleh sel-sel yang menua dan, sebagai jawaban, untuk kelebihan produksi T-killers yang menghancurkan sel-sel tua yang merusak jenis sel kekebalan lainnya. Apa yang membuat tubuh menjadi tua rentan terhadap berbagai infeksi.
SENS penulis melihat solusi untuk masalah akumulasi sel tua di dua arah. Yang pertama adalah pengembangan obat-obatan yang beracun bagi sel-sel tua, atau menyebabkan apoptosis mereka, tetapi tidak berbahaya bagi sel-sel normal yang sehat. Dan arah kedua adalah mencari stimulan sistem kekebalan tubuh untuk mencari dan membunuh sel target penuaan secara selektif. Cara yang paling mungkin untuk menyerang sel-sel abnormal ini, menurut pengembang SENS, adalah dengan menggunakan molekul khas yang ditemukan pada permukaan mereka. Memang, berbagai jenis sel memiliki perbedaan pada permukaannya. Oleh karena itu, langkah pertama adalah identifikasi dan orientasi penanda permukaan sel yang khusus untuk sel tua yang akan dihapus. Strategi ini tidak abstrak, tetapi sudah membentuk dasar dari beberapa perawatan kanker yang menghambat pertumbuhan sel dan menarik sel-sel kekebalan untuk menghancurkannya [10].
Penelitian telah menunjukkan bahwa sel-sel tua sebenarnya menumpuk seiring bertambahnya usia di berbagai jaringan [11]. Itu juga menggambarkan bahwa penghapusan sel-sel tua yang menumpuk dalam model tikus yang cepat menua mencegah munculnya tiga fenotipe penuaan utama (katarak, sarkopenia, kehilangan lemak subkutan) [12]. Dalam hal ini, sangat jelas bahwa ada kebutuhan untuk mengidentifikasi biomarker penuaan sel yang dapat diandalkan dan efektif. Yang perlu di tempat pertama untuk melacak efek dari obat senolitik potensial.
Paling sering, beta-galactosidase terkait-penuaan, SA-β-Gal, digunakan sebagai biomarker sel-sel tua. Enzim β-galaktosidase adalah hidrolase lisosomal yang memecah terminal beta-galaktosa dari senyawa yang mengandungnya (laktosa, keratin sulfat, sphingolipid, dll.). Kembali pada tahun 1995, dijelaskan bahwa ekspresi SA-β-Gal meningkat secara signifikan dalam sel-sel tua. Metode imunohistokimia digunakan untuk menentukan kandungannya dalam jaringan penuaan. Sebagai metode alternatif untuk menentukan aktivitas SA-β-gal dalam sel, flow cytometry digunakan menggunakan 5-dodecanoylaminofluorescein di-β-D-galactopyranoside sebagai substrat.
Namun, penggunaan SA-β-Gal sebagai biomarker penuaan sel memiliki keterbatasannya sendiri, karena enzim ini dapat memberikan hasil positif palsu, meningkatkan ekspresi tidak hanya pada sel yang menua, tetapi juga pada sel "muda", yang karena berbagai alasan, proliferasi terbatas. Oleh karena itu, hari ini dianggap disarankan untuk menggunakan SA-β-Gal bersama dengan penanda penuaan sel lainnya.
Pada 2017, sitologi Israel mengembangkan teknologi baru yang lebih efisien berdasarkan flow cytometry menggunakan sitometer ImageStreamX. Metode ini memungkinkan deteksi SA-β-Gal dalam jaringan dengan efisiensi lebih dari 80%. Untuk meningkatkan efisiensi analisis, para ilmuwan, bersama dengan SA-β-Gal, menentukan beberapa biomarker penuaan sel lainnya - protein HMGB1 dan γH2AX. HMGB1 adalah protein dari kelompok protein non-histone nuklir HMG, dalam sel tua ia meninggalkan nukleus dan bergerak ke ruang ekstraseluler. γH2AX, bentuk histone H2AX terfosforilasi, merupakan penanda yang diakui untuk kerusakan DNA awal dan penuaan sel. Selain itu, metode baru oleh para ilmuwan Israel memungkinkan untuk menentukan sel-sel penuaan dengan ukurannya yang meningkat. Menurut para peneliti, teknologinya dapat digunakan dengan cepat dan menentukan efektivitas senyawa farmasi baru yang akan dirancang khusus untuk menghilangkan sel-sel penuaan dari jaringan. [13]
Heterochromatin foci (SAHF) yang terkait dengan penuaan sel juga bisa menjadi penanda penuaan lainnya. SAHF adalah struktur heterokromatin khusus yang terbentuk pada inti sel-sel yang menua. Pembentukannya dikaitkan dengan heterokromatinisasi ireversibel yang terkait dengan inaktivasi gen yang terlibat dalam siklus sel yang terletak di situs ini (MCM3, PCNA, Cyclin A). SAHF dapat dilihat di bawah mikroskop setelah pewarnaan dengan pewarna DAPI khusus. Selain itu, peningkatan ekspresi protein leukemia promyelocytic (PML) dalam sel-sel tua telah dijelaskan, yang juga dapat menjadi penanda tambahan penuaan sel [14].
Peneliti Amerika telah menggambarkan protein INK4a p16 dari sel T darah tepi manusia sebagai biomarker untuk penuaan sel. p16 INK4a, seperti dijelaskan di atas, mengambil bagian aktif dalam menghentikan siklus sel sel tua. Ekspresi p16 INK4a meningkat dalam sel-sel tua dan, ternyata, secara signifikan terkait dengan merokok dan aktivitas fisik. Selain itu, ekspresi p16 INK4a dikaitkan dengan konsentrasi plasma IL-6, penanda peradangan terkait usia. Menurut para ilmuwan, ekspresi INK4a p16 adalah biomarker darah perifer yang mudah diukur untuk menentukan penuaan sel [15].Lampiran 1.Biomarker penuaan sel.1. Terkait dengan penuaan sel β-galactosidase (beta-galactosidase terkait penuaan, SA-β-Gal).2. Protein HMGB1 (protein kelompok mobilitas tinggi B1).3. Honeaks berfosforilasi γH2AX.4. Terkait dengan fokus penuaan seluler heterochromatin (SAHF).5. Protein Promyelocytic Leukemia (PML).6. Protein p16 INK4a.Penulis: Alexey Rzheshevsky.Referensi1. L. Hayflick P. S. Moorhead. Budidaya serial strain sel diploid manusia. Res Sel Exp. 1961 Des; 25: 585-621.
2. Epel ES, Blackburn EH, Lin J, FS Dhabhar, Adler NE, Morrow JD, Cawthon RM. Pemendekan telomer dipercepat sebagai respons terhadap stres kehidupan. Proc Natl Acad Sci US A. 2004 7 Des; 101 (49): 17312-5.
3. Panossian LA, Porter VR, Valenzuela HF, Zhu X, Reback E, Masterman D, Cummings JL, Effros RB. Pemendekan telomer dalam sel T berkorelasi dengan status penyakit Alzheimer. Penuaan Neurobiol. 2003 Jan-Feb;24(1):77-84.
4. Nelson DM1, McBryan T, Jeyapalan JC, Sedivy JM, Adams PD. A comparison of oncogene-induced senescence and replicative senescence: implications for tumor suppression and aging. Age (Dordr). 2014 Jun;36(3):9637.
5. Palmero I, Pantoja C, Serrano M. p19ARF links the tumour suppressor p53 to Ras. Nature. 1998 Sep 10; 395(6698):125-6.
6. Pérez VI1, Van Remmen H, Bokov A, Epstein CJ, Vijg J, Richardson A. The overexpression of major antioxidant enzymes does not extend the lifespan of mice. Aging Cell. 2009 Feb;8(1):73-5.
7. Narita M, Nũnez S, Heard E, Narita M, Lin AW, Hearn SA, Spector DL, Hannon GJ, Lowe SW. Rb-mediated heterochromatin formation and silencing of E2F target genes during cellular senescence. Cell. 2003 Jun 13; 113(6):703-16.
8. .., .., .., .. « » : SASP ? Acta Naturae, 2018, 10(1). .4-15.
9. Shankar J. Chinta, Georgia Woods, Anand Rane, Marco Demaria, Judith Campisi, and Julie K Andersen. Cellular senescence and the aging brain. Exp Gerontol. 2015 Aug; 68: 3–7.
10. ApoptoSENS: Removing dysfunctional cells.
11. Jeyapalan JC, Ferreira M, Sedivy JM, Herbig U. Accumulation of senescent cells in mitotic tissue of aging primates. Mech Ageing Dev. 2007 Jan;128(1):36-44.
12. Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, Kirkland JL, van Deursen JM. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature. 2011 Nov 2;479(7372):232-6.
13. Anat Biran, Lior Zada, Paula Abou Karam, Ezra Vadai, Lior Roitman, Yossi Ovadya, Ziv Porat, and Valery Krizhanovsky. Quantitative identification of senescent cells in aging and disease. Aging Cell. 2017 Aug; 16(4): 661–671.
14. Bruno Bernardes de Jesus and Maria A. Blasco. Assessing Cell and Organ Senescence Biomarkers. Circ Res. 2012 Jun 22; 111(1): 97–109.
15. Yan Liu, Hanna K. Sanoff, Hyunsoon Cho, Christin E. Burd, Chad Torrice, Joseph G Ibrahim, Nancy E. Thomas, and Norman E. Sharpless. Expression of p16INK4a in peripheral blood T-cells is a biomarker of human aging. Aging Cell. 2009 Aug; 8(4): 439–448.