Kisah biomarker epigenetik dimulai pada 2013. Kemudian perintis ke arah ini, seorang spesialis di bidang genetika dan biostatistik, seorang karyawan Universitas California di Los Angeles, Steve Horvath, memperkenalkan metode revolusionernya yang baru untuk menentukan usia biologis, yang disebut "jam epigenetik". Seperti namanya, metode ini didasarkan pada perubahan epigenom, yaitu metilasi DNA.
Metilasi DNA adalah salah satu mekanisme epigenetik pengaturan ekspresi gen. Selama metilasi, gugus metil enzim khusus CH3 berikatan dengan salah satu basa DNA, sitosin. Akibatnya, 5-methylcytosine terbentuk dan ekspresi gen tidak aktif - proses transkripsi diblokir. Seperti yang Anda ketahui hari ini, metilasi DNA adalah proses yang dinamis. Ini dapat berubah di bawah pengaruh faktor-faktor eksternal, dikaitkan dengan pengembangan sejumlah patologi, dan dapat diwarisi oleh beberapa generasi berikutnya. Metilasi memainkan peran kunci dalam penonaktifan DNA asing, serta dalam proses perkembangan dan penuaan. Perubahan terkait usia dalam metilasi dijelaskan sebagai "pergeseran epigenetik" dijelaskan. Jadi, dengan bertambahnya usia, hipometilasi (demetilasi) dan ketidakstabilan kromosom yang terkait diamati. Selain itu, dengan penuaan, proses sebaliknya juga terjadi - hipermetilasi daerah promotor tertentu, termasuk gen penekan tumor tertentu, yang terkait dengan perkembangan patologi [1]. Secara umum, saat ini diyakini bahwa perubahan metilasi memainkan peran kunci dalam penuaan.
Berdasarkan fakta bahwa usia kronologis dikaitkan dengan perubahan yang dapat diprediksi dalam epigenom, hipo dan hipermetilasi di banyak daerah di seluruh genom, generasi pertama dari biomarker penuaan epigenetik berdasarkan metilasi DNA telah dikembangkan. Pada 2011, artikel pertama oleh para ilmuwan di University of California, Los Angeles, berjudul "Prediktor usia epigenetik," menunjukkan bahwa metilasi DNA memiliki hubungan yang jelas dengan usia. Pada 2013, Steve Horvat, menggunakan teknik pembelajaran mesin berbantuan komputer, mengidentifikasi 353 situs metilasi yang sangat berkorelasi dengan usia kronologis seseorang, yang membentuk dasar "jam epigenetik" pertama atau "jam Kroasia" [2].
Pentingnya penemuan ini sulit untuk ditaksir terlalu tinggi. Harus dikatakan bahwa kisah sukses S. Horvat penuh dengan drama yang tidak ditemukan. Menurut memoar Horvat sendiri, pada awalnya mereka tidak mau menerima artikelnya tentang metode epigenetik baru untuk mengukur usia di lebih dari satu majalah. Dia terus-menerus harus mendengar dari pengulas frase yang sama bahwa "itu terlalu bagus untuk menjadi kenyataan." Tetapi Horvath tidak menyerah dan mencurahkan seluruh waktunya untuk menyelesaikan metode baru: "Saya menulis di setiap waktu luang, seolah-olah ini adalah saat terakhir untuk menyelesaikan artikel saya." Tepat sebelum pekerjaan selesai di keluarga Kroasia, sebuah bencana terjadi - putrinya yang baru lahir meninggal. Tapi ini tidak meresahkan ilmuwan yang keras kepala itu. Edisi terakhir dari artikelnya kembali ditolak oleh Genome Biology. Dan setelah menerima komentar kritis lain dari pengulas, Horvath, dalam ingatannya, melakukan tiga hal yang tidak boleh dilakukan: “Setelah membaca komentar pengulas, saya menghabiskan 10 menit berikutnya melakukan tiga hal yang seharusnya tidak boleh dilakukan. Pertama, saya pergi ke lemari es dan minum tiga botol bir secepat mungkin. Kedua, saya kembali ke komputer dan menulis surat kepada editor. Ketiga, saya mengirimnya. " Dan kali ini, keberuntungan tersenyum padanya, artikelnya diterima.

Bagaimana "jam epigenetik" berguna? Menurut penulis penemuan ini, metode ini dapat memainkan peran besar dalam menilai efektivitas intervensi anti-penuaan, karena dapat secara signifikan mengurangi masa tunggu untuk hasil. Selain itu, diasumsikan bahwa situs metilasi yang diidentifikasi oleh Kroasia tidak hanya penanda, tetapi juga peserta aktif dalam penuaan (setidaknya beberapa). Apa yang memberi para peneliti target terapi potensial dalam memerangi penuaan dan patologi terkait usia. Juga, metode baru ini dapat berguna dalam prosedur kriminal, ketika sampel usia diperlukan dari sampel jaringan. Tapi, tentu saja, "jam epigenetik" memperoleh kepentingan terbesar selanjutnya dalam memprediksi penyakit dan meningkatkan risiko kematian.
Ternyata, "jam epigenetik" menunjukkan nilai "nol" pada batang embrionik dan menginduksi sel-sel pluripoten, spermatozoa, sel telur, dan sel plasenta. Dan selama 5 tahun pertama kehidupan - kursus dipercepat terkait dengan perkembangan tubuh. Pada usia 21, "jam epigenetik" secara bertahap melambat, dan kemudian bergerak dengan kecepatan yang kurang lebih seragam, mengubah kinerjanya di bawah pengaruh faktor-faktor eksternal. Selain itu, ternyata jaringan yang berbeda menua dengan kecepatan yang berbeda. Yang paling rentan terhadap proses penuaan adalah jaringan payudara pada wanita. Dari sudut pandang epigenetik, otak mengalami penuaan paling lambat, sementara sel darah dan tulang menunjukkan penuaan yang sedikit dipercepat [3].
Pada 2013 yang sama, sebuah artikel diterbitkan oleh para ilmuwan Cina dan Amerika yang menyajikan versi lain dari "jam epigenetik" - "jam Hannum". Gregory Hannum, seorang bioengineer University of California di University of California di San Diego, dan rekan-rekannya mempelajari profil metilasi DNA dari 450.000 CpG dinukleotida dari sel darah orang berusia 19 hingga 101 tahun, mengidentifikasi 71 situs metilasi yang paling berkorelasi dengan usia [4]. Perbedaan utama antara "jam Hannum" dan "jam Kroasia" adalah kekhususannya: sampel DNA diambil dari sel darah, dan bukan dari jaringan apa pun, seperti dalam metode Kroasia.
Cukup cepat, nilai utama "jam epigenetik" menjadi jelas. Perbandingan kemajuan mereka dengan usia kronologis adalah nilai prognostik yang sangat baik untuk menilai risiko kematian dari semua penyebab dan perkembangan banyak patologi. Jika "jam epigenetik" sedang terburu-buru - ada penyakit, penuaan yang dipercepat dan pemendekan hidup. Jika mereka lebih lambat dari usia kronologis, ada kemungkinan umur panjang. Studi telah menunjukkan bahwa "jam epigenetik" memiliki korelasi yang tinggi dengan kematian dari semua penyebab dan penyakit yang berkaitan dengan usia.Pada 2015, Horvat dan rekannya melakukan penelitian untuk menentukan hubungan antara kanker paru-paru dan usia epigenetik. Setelah menganalisis data 2.029 orang, ditemukan bahwa percepatan usia epigenetik dikaitkan dengan peningkatan risiko kanker paru-paru, dan hubungan ini lebih kuat pada perokok dan orang di atas 70: “Hasilnya menunjukkan bahwa indikator standar percepatan usia epigenetik (IEAA) adalah secara signifikan terkait dengan kejadian kanker paru-paru (HR: 1,50, P = 3,4 × 10 -3). Selain itu, kami telah menunjukkan bahwa hubungan tersebut mungkin lebih kuat di antara orang yang lebih tua (70 tahun atau lebih) atau mereka yang saat ini adalah perokok. Secara umum, hasil kami menunjukkan bahwa IEAA dapat menjadi biomarker yang berguna untuk menilai kerentanan terhadap kanker paru-paru dari sudut pandang penuaan biologis ”[5].
Pada tahun yang sama, kelompok peneliti lain membangun hubungan "usia epigenetik" dengan risiko kematian dari semua penyebab pada orang di atas 60 tahun. Untuk analisis, kami mengambil data dari empat studi (total 4658 orang), usia rata-rata peserta adalah 79,1, 69,5, 66,3 dan 72,9 tahun, masing-masing. Usia epigenetik ditentukan oleh dua metode: "Jam Kroasia" (berdasarkan 353 situs metilasi CpG) dan "Jam Hannum" (berdasarkan 71 situs metilasi CpG). Kedua metode menunjukkan korelasi yang kuat satu sama lain, meskipun set dasar hanya cocok di 6 situs CpGs. Hasil penelitian menunjukkan bahwa percepatan "usia epigenetik" dibandingkan dengan kronologis oleh 5 tahun meningkatkan risiko kematian pada orang sebesar 16%. Para penulis menyimpulkan: “Tingkat penuaan yang dipercepat berasal dari metilasi DNA adalah faktor bawaan yang memprediksi kematian, terlepas dari status kesehatan, faktor gaya hidup, atau faktor genetik yang diketahui. Oleh karena itu, dapat diasumsikan bahwa usia metilasi DNA yang diprediksi adalah “jam epigenetik” yang mengukur usia biologis yang berjalan bersama, tetapi tidak selalu sejalan dengan usia kronologis, dan dapat memberikan prediksi usia harapan hidup ”[6].
Pada 2016, ahli onkologi Jerman melakukan penelitian yang menggambarkan hubungan antara percepatan penuaan epigenetik dan kematian akibat kanker dan penyakit kardiovaskular dan semua penyebab lainnya. Untuk pekerjaan mereka, mereka menggunakan "jam epigenetik" dari Horvath dan Hannum. Usia metilasi DNA dievaluasi dalam kohort 1863 lansia yang berpartisipasi dalam studi ESTHER dengan usia rata-rata 62,5 tahun. Hasil penelitian menunjukkan bahwa usia epigenetik lebih besar dari kronologis dikaitkan dengan kematian yang lebih tinggi. Percepatan 5 tahun dari "usia epigenetik" yang ditentukan oleh metode Kroasia menghasilkan peningkatan angka kematian sebesar 22%, dan sebesar 16% menggunakan metode Hannum [7].
Pada tahun 2016, tim peneliti internasional besar yang dipimpin oleh Steve Horvath melakukan meta analisis skala besar di mana data dari 13.089 orang dari tiga kelompok ras / etnis diperiksa: berkulit putih, Hispanik, dan Afrika-Amerika. Zaman epigenetik di sini juga ditentukan oleh dua metode: "jam Kroasia" dan "jam Hannum". Karya ini menunjukkan bahwa percepatan "jam epigenetik" oleh 1 tahun (dibandingkan dengan usia kronologis) meningkatkan risiko kematian dari semua penyebab menjadi 4%. Selain itu, efek sebaliknya juga diamati: perlambatan "jam epigenetik" menyebabkan risiko kematian yang lebih rendah. Selain itu, para peneliti mencatat fenomena menarik: “Kami menemukan bahwa 5 persen orang memiliki usia biologis yang lebih cepat, yang mengarah ke rentang hidup yang lebih pendek. Penuaan yang dipercepat meningkatkan risiko kematian orang-orang ini hingga 50 persen pada usia dewasa. ”[8, 9].
Sejumlah faktor eksternal yang mempengaruhi jalannya "jam epigenetik" juga sudah diketahui. Pada 2017, Horvath dan rekannya menggambarkan hubungan diet, alkohol, pendidikan dan olahraga dengan perjalanan waktu epigenetik. Menurut penulis sendiri, pekerjaan mereka mengkonfirmasi kebenaran yang telah lama diketahui: diet dengan sayuran, ikan dan daging tanpa lemak, konsumsi alkohol moderat, aktivitas fisik dan pendidikan memperlambat perjalanan waktu epigenetik dan berkontribusi untuk memperpanjang hidup. Peningkatan kadar insulin dan glukosa, protein C-reaktif dan trigliserida, serta kelebihan berat badan dan tekanan darah tinggi mempercepat penuaan epigenom. Dalam studi yang sama, para ilmuwan tidak menemukan efek positif dari obat antidebasic metformin pada perjalanan waktu epigenetik [10]. Pada tahun yang sama, para peneliti Finlandia sekali lagi menunjukkan hubungan obesitas dengan percepatan penuaan epigenetik [11]
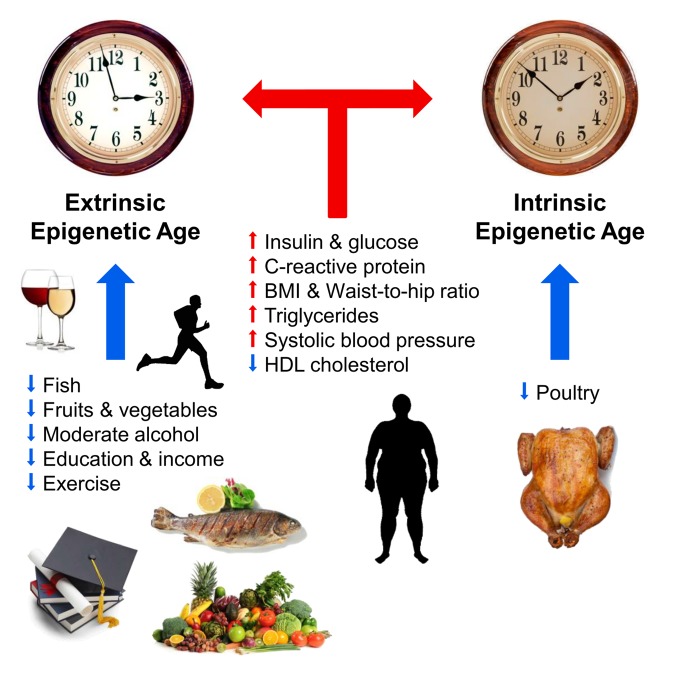
Fig. 1
Faktor yang mempengaruhi usia epigenetik (dari [10]).
Panah biru dan merah menunjukkan masing-masing faktor yang memperlambat dan mempercepat penuaan. Jam ini melambangkan jam epigenetik eksternal (jam epigenetik ekstrinsik, versi diperpanjang dari metode Hannum) dan jam epigenetik internal (jam epigenetik intrinsik, jam Kroasia). Efek positif pada perjalanan waktu epigenetik (melambat): ikan, unggas, sayuran dan buah-buahan, lipoprotein densitas tinggi, alkohol sedang, pembentukan dan aktivitas fisik. Secara negatif mempengaruhi perjalanan waktu epigenetik (mempercepat): peningkatan kadar insulin, glukosa, protein C-reaktif, trigliserida, tekanan darah tinggi, peningkatan berat badan dan perbandingan pinggang dan pinggul yang salah.Berbagai tim peneliti telah melakukan pekerjaan yang menggambarkan hubungan antara perjalanan waktu epigenetik dan fungsi fisik dan kognitif, sindrom Down and Werner, infeksi HIV, penyakit Alzheimer dan menopause [12-17]. Hubungan yang jelas antara umur panjang dan perlambatan "jam epigenetik" juga ditunjukkan dengan menggunakan contoh centenarian berusia 100 tahun Italia [18]. Untuk waktu yang lama, Steve Horvath tidak bisa menggunakan metodenya untuk memprediksi percepatan usia biologis selama progeria Hutchinson-Guildford. Tapi tahun ini masalah ini diselesaikan: dia dan rekan-rekannya menciptakan "jam epigenetik" khusus berdasarkan fibroblas, yang terdiri dari 391 situs CpG, yang disebut "jam kulit-darah" [19].
Langkah selanjutnya dalam pekerjaan S. Horvat adalah pengembangan biomarker penuaan yang lebih efektif, dengan peningkatan kemampuan diagnostik yang memprediksi risiko kematian dari berbagai penyebab dan perkembangan penyakit yang berkaitan dengan usia. Kelemahan dari "jam epigenetik" sebelumnya, menurut Horvath, adalah bahwa penggunaan usia kronologis sebagai standar untuk menentukan penyimpangan usia dapat mengecualikan situs CpG yang profil metilasi tidak menunjukkan perubahan yang kuat, tergantung waktu. Sebaliknya, mereka hanya menunjukkan perbedaan antara usia biologis dan kronologis. Dengan demikian, penting tidak hanya untuk menangkap CpG yang menampilkan perbedaan dengan waktu kronologis, tetapi juga mereka yang menunjukkan perbedaan dalam risiko dan status fisiologis di antara orang-orang dari usia kronologis yang sama. Pada tahun 2018, biomarker baru bernama DNAm PhenoAge, telah dibuat.
Pada tahap pertama, tim S. Horvath menganalisis pada sampel besar orang, 9926 orang, peserta dalam studi NHANES III, hubungan 42 biomarker klinis dan usia kronologis dengan risiko kematian. Sebagai hasilnya, 9 biomarker ditentukan untuk memprediksi usia fenotipik:
1. Albumin
2. Kreatinin
3. Glukosa
4. Protein C-reaktif
5. Persentase limfosit
6. Volume rata-rata sel darah merah
7. Lebar distribusi sel darah merah
8. Jumlah sel darah putih
9. Alkaline phosphatase.Kemudian mereka memvalidasi biomarker yang dipilih - memeriksa model usia fenotipik mereka dalam sampel orang lain (6209 orang). Pemeriksaan tersebut menunjukkan korelasi antara peningkatan usia fenotipik dan peningkatan risiko kematian dari semua penyebab: peningkatan satu tahun pada usia fenotipik dikaitkan dengan peningkatan 9% dalam risiko kematian dari semua penyebab, 9% peningkatan risiko kematian akibat penyakit yang berkaitan dengan penuaan, 10% peningkatan risiko kematian akibat penyakit jantung. penyakit pembuluh darah, peningkatan 7% dalam risiko kematian akibat kanker, peningkatan 20% dalam risiko kematian akibat diabetes, dan peningkatan 9% dalam risiko kematian akibat penyakit pernapasan.
Pada tahap kedua penelitian, penulis menghubungkan metilasi DNA dengan usia fenotipik. Para ilmuwan telah mengidentifikasi situs GpC termetilasi yang dikaitkan dengan 9 penanda klinis klinis yang memprediksi usia fenotipik. Mereka mengidentifikasi 513 CpGs dari situs tersebut yang memperkirakan usia fenotipik. Penanda epigenetik baru bernama DNAm PhenoAge. Tes menunjukkan akurasi tinggi biomarker baru: antara tahun 1998 dan 2007, perubahan rata-rata dalam DNAm PhenoAge adalah 8,51 tahun, sedangkan perubahan rata-rata usia fenotipik klinis adalah 8,88 tahun.
Setelah itu, para peneliti menguji penanda biomarker baru mereka menggunakan data dari 4 studi besar, Women's Health Initiative (n = 4207), Framingham Heart Study (n = 2553), Normative Aging Study (n = 657) dan Jackson Heart Study (n = 1747). Hasil penelitian menunjukkan bahwa DNAm PhenoAge secara signifikan terkait dengan risiko kematian berikutnya dalam semua penelitian (terlepas dari usia kronologis): peningkatan satu tahun dalam DNAm PhenoAge dikaitkan dengan peningkatan risiko kematian semua penyebab sebesar 4,5%.
Analisis genetik DNAm PhenoAge menunjukkan bahwa 513 situs CpG yang digunakan di dalamnya memiliki 41 CpG yang identik dengan jam Kroasia dan 6 CpG yang identik dengan jam Hannum. Lima CpG identik ditemukan dalam ketiga metode epigenetik. 149 CpG dari DNAm PhenoAge terletak di kelompok dinukleotida CpG (pulau CpG).
Semua data yang diperoleh selama studi oleh Steve Horvath dan timnya menunjukkan bahwa biomarker baru memiliki nilai prediksi yang besar dalam menentukan risiko penyakit yang berkaitan dengan usia dan risiko kematian. “
Dengan menggunakan proses dua langkah yang inovatif, kami telah mengembangkan biomarker epigenetik penuaan baru, DNAm PhenoAge, yang telah jauh melampaui biomarker sebelumnya dalam hal prediksi untuk berbagai faktor penuaan, termasuk kematian dari semua penyebab, kanker, kesehatan umum, fungsi fisik, dan penyakit Alzheimer. Meskipun biomarker ini dikembangkan menggunakan data darah lengkap, itu sangat berkorelasi dengan usia di setiap jaringan dan sel yang diuji. , , / , . , » [20].
: .
- Vayserman A.M., Voitenko V.P., Mekhova L.V. Epigenetik epidemiologi penyakit terkait usia. Ontogenesis 2011.42, 1–21;
- Horvath S. DNA usia metilasi jaringan manusia dan jenis sel. Genom Biol. 2013.14, R115.
- Josh Mitteldorf. Methylation Aging Clock: An Update. 14 Februari 2018.
- Hannum, G; Guinney, J; Zhao, L; Zhang, L; Hughes, G; Sadda, S; Klotzle, B; Bibikova, M; Fan, JB; Gao, y; Deconde, R; Chen, M; Rajapakse, I; Teman, S; Ideker, T; Zhang, K (2013). Profil metilasi genome mengungkapkan pandangan kuantitatif tingkat penuaan manusia. Sel Mol. 49: 359-367.
- Morgan E. Levine, H. Dean Hosgood, Brian Chen, Devin Absher, Themistocles Assimes and Steve Horvath. DNA methylation age of blood predicts future onset of lung cancer in the women's health initiative. Aging (Albany NY). 2015 Sep; 7(9): 690–700.
- Riccardo E Marioni, Sonia Shah, et al. DNA methylation age of blood predicts all-cause mortality in later life. Genome Biol. 2015; 16(1): 25.
- Laura Perna, Yan Zhang, Ute Mons, Bernd Holleczek, Kai-Uwe Saum, and Hermann Brenner. Epigenetic age acceleration predicts cancer, cardiovascular, and all-cause mortality in a German case cohort. Clin Epigenetics. 2016; 8: 64.
- Brian H. Chen, Riccardo E. Marioni et al. DNA methylation-based measures of biological age: meta-analysis predicting time to death Aging (Albany NY). 2016 Sep; 8(9): 1844–1859.
- Epigenetic clock predicts life expectancy. ScienceDaily. 28 September 2016.
- Quach A1, Levine ME1 et al. Epigenetic clock analysis of diet, exercise, education, and lifestyle factors. Aging (Albany NY). 2017 Feb 14;9(2):419-446.
- Nevalainen T, Kananen L, Marttila S, Jylhävä J, Mononen N, Kähönen M, Raitakari OT, Hervonen A, Jylhä M, Lehtimäki T, Hurme M. Obesity accelerates epigenetic aging in middle-aged but not in elderly individuals. Clin Epigenetics. 2017 Feb 14;9:20.
- Marioni RE, Shah S, McRae AF, Ritchie SJ, Muniz-Terrera G, Harris SE, Gibson J, Redmond P, Cox SR, Pattie A, Corley J, Taylor A, Murphy L, et al.. The epigenetic clock is correlated with physical and cognitive fitness in the Lothian Birth Cohort 1936. Int J Epidemiol. 2015; 44:1388–96.
- Horvath S, Garagnani P, Bacalini MG, Pirazzini C, Salvioli S, Gentilini D, Di Blasio AM, Giuliani C, Tung S, Vinters HV, Franceschi C. Accelerated epigenetic aging in Down syndrome. Aging Cell. 2015; 14:491–95.
- Horvath S, Levine AJ. HIV-1 Infection Accelerates Age According to the Epigenetic Clock. J Infect Dis. 2015; 212:1563–73.
- Maierhofer A, Flunkert J, Oshima J, Martin GM, Haaf T, Horvath S. Accelerated epigenetic aging in Werner syndrome. Aging (Albany NY). 2017; 9:1143–52.
- Levine ME, Lu AT, Bennett DA, Horvath S. Epigenetic age of the pre-frontal cortex is associated with neuritic plaques, amyloid load, and Alzheimer's disease related cognitive functioning. Aging (Albany NY). 2015; 7:1198–211
- Levine ME, Lu AT, Chen BH, Hernandez DG, Singleton AB, Ferrucci L, Bandinelli S, Salfati E, Manson JE, Quach A, Kusters CD, Kuh D, Wong A, et al.. Menopause accelerates biological aging. Proc Natl Acad Sci USA. 2016; 113:9327–32.
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, Mari D, Arosio B, Monti D, Passarino G, De Rango F, D'Aquila P, Giuliani C, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (Albany NY). 2015; 7:1159–70.
- Steve Horvath, Junko Oshima et al. Epigenetic clock for skin and blood cells applied to Hutchinson Gilford Progeria Syndrome and ex vivo studies. Aging. Volume 10, Issue 7, pp 1758—75.
- 20. Morgan E. Levine, Ake T. Lu, et al. An epigenetic biomarker of aging for lifespan and healthspan. Aging (Albany NY). 2018 Apr; 10(4): 573–591.