Pendahuluan
Tentang apakah teks ini
Jika seseorang mendengar tentang "simulasi realitas", maka kemungkinan besar ia akan datang dengan berbagai karya fiksi ilmiah (seperti Matrix, The Dark City, atau Zero Theorems), atau permainan komputer. Dalam kasus orang yang kepalanya tersumbat dengan gelar teknik, paket seperti
KOMPAS-3D AutoCAD, Solid Edge atau NX dapat muncul. Seseorang yang mendengarkan sains mungkin akan mengingat setiap
pemodelan berbagai alat luar angkasa .
Tetapi ada satu tingkat Realitas lagi, yang ternyata akan dilupakan dengan tidak patut: tingkat di mana semua kimia terjadi adalah tingkat atom dan molekul. Itu juga bisa cukup berhasil disimulasikan di komputer. Karena mekanika kuantum bertanggung jawab atas segala sesuatu di bagian Realitas ini, perhitungan seperti itu sering disebut kimia kuantum. Dan kita akan berbicara tentang hubungannya dengan Realita yang dipelajari oleh metode eksperimental.
Teks ini adalah tentang hal-hal yang paling mendasar. Tetapi, praktik membaca jurnal ilmiah dan mendengarkan berbagai laporan menunjukkan bahwa ini harus selalu diingatkan.
Teks ini dirancang untuk orang yang mengerti dan / atau tertarik pada bagaimana atom dan molekul hidup.Diambil dari xkcd.comLatar Belakang SingkatKebetulan, seorang rekan, sayangnya, bekerja dalam sains Rusia, mengundang saya untuk memberikan kuliah di kursus khusus untuk 2 orang di salah satu universitas fisik terkenal Rusia. Tetapi, karena kebetulan yang aneh, dia dipindahkan ke konferensi siswa yang diadakan secara paralel ... Di sana dia tidak membangkitkan minat banyak siswa, dan saya sangat, sangat menyesal dengan materi tersebut, jadi saya memutuskan untuk sedikit meng-spam Habr, mencoba mengubah kuliah pendidikan menjadi artikel sains populer.
Metode fisik untuk mempelajari kehidupan molekul
Kita tahu dari pelajaran kimia dan fisika di sekolah bahwa semua zat terdiri dari atom, molekul, ion, atau kombinasi keduanya. Dan kita tampaknya tahu kehidupan seperti apa yang mereka jalani. Tetapi informasi ini harus memiliki sumber yang dapat diandalkan sendiri (metode penelitian), dan memang demikian adanya.
Ada banyak, banyak cara untuk memata-matai kehidupan atom. Mereka yang ingin, misalnya, dapat membiasakan diri dengan beberapa dari mereka secara lebih rinci dalam buku teks klasik
- Pentin Yu.A., Vilkov L.V. Metode penelitian fisik dalam kimia. - M .: Mir, 2006,
- Drago R. Metode fisik dalam kimia. - M .: Mir, 1981.
Tetapi, secara kasar dan mudah, 3 kelompok utama metode menonjol:
- metode spektroskopi
- metode difraksi
- berbagai metode mikroskop (tidak masalah, tembus cahaya atau pemindaian, bagi kami ini tidak penting sekarang).
Tidak akan ada pembicaraan tentang yang terakhir, tetapi alat-alatnya tidak kalah pentingnya dari dua yang pertama.
Mengapa tidak akan ada pembicaraan tentang mikroskop(Saya hanya tidak menghindar dari kata sama sekali dalam mikroskop)
Metode spektroskopi untuk mempelajari materi
Kelompok metode yang kuat ini memberi kita banyak hal: mulai dari pencarian dan penentuan molekul dalam medium antarbintang dan planet lain hingga pemeriksaan dangkal untuk bahan peledak di bandara.
Prinsip umum metode spektral
Ketika berbicara tentang spektroskopi, biasanya mengacu pada prinsip umum operasi berikut.
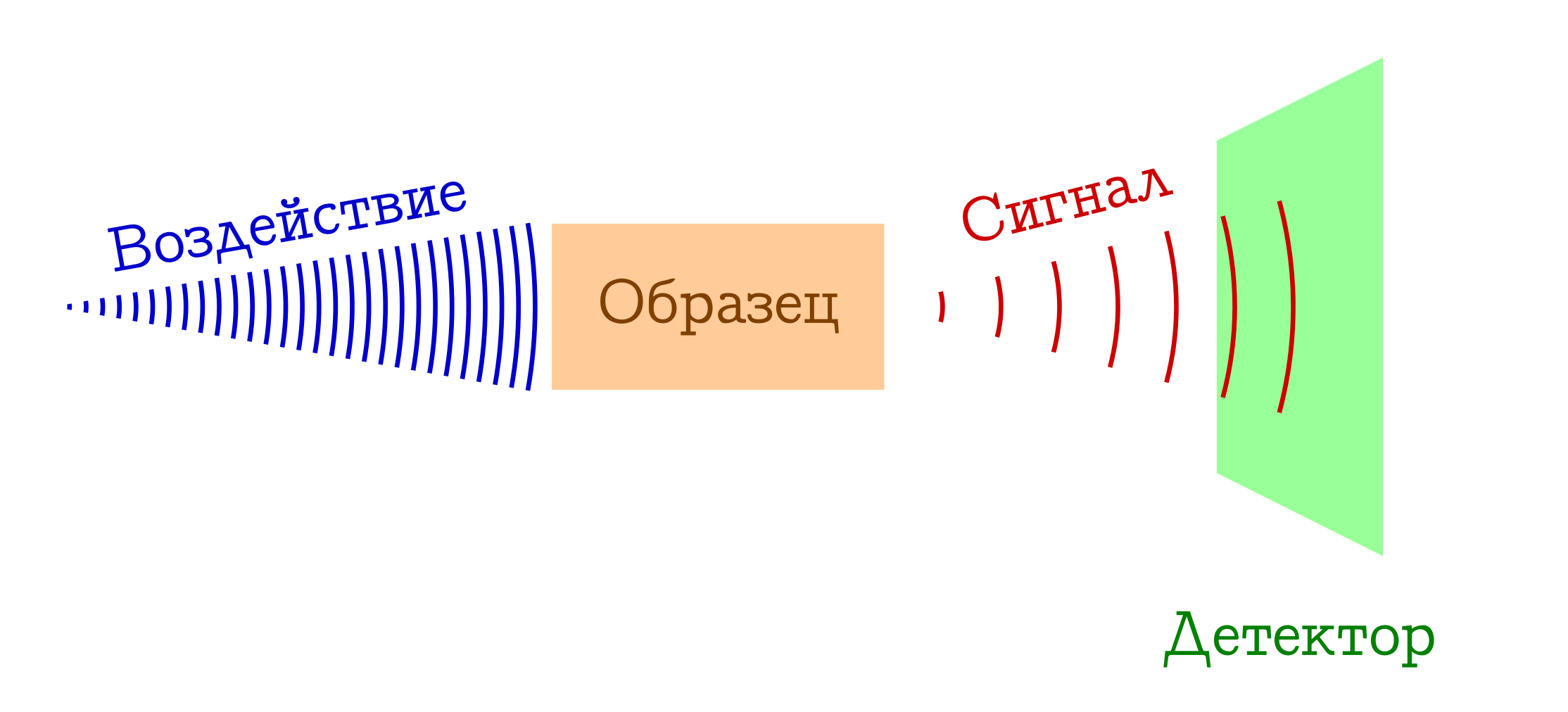
Skema umum metode spektral untuk mempelajari zat
- Kami memiliki sesuatu yang kami (misalnya, bola lampu / laser / sinar matahari) berikan pada sampel yang menarik bagi kami. Paling sering ini adalah studi elektromagnetik, tetapi bisa juga menjadi elektron (misalnya, dalam spektroskopi massa dengan ionisasi oleh dampak elektron) atau campuran segala sesuatu yang mungkin dan tidak mungkin dari plasma (misalnya, dalam spektroskopi nyala , sangat disukai oleh anak sekolah dan siswa junior fakultas kimia). Dengan satu atau lain cara, sesuatu harus bekerja pada sampel kami.
- Ketika terkena sampel, terjadi sesuatu yang mengubah statusnya. Ini dapat berupa transisi ke beberapa tingkat tereksitasi (dalam spektrofotometri atau spektroskopi Raman), atau bahkan keruntuhan sistem molekuler (seperti dalam spektra massa atau spektroskopi fotoelektron ). Tetapi entah bagaimana polanya di beberapa titik harus berbeda.
- ???
- KEUNTUNGAN !!! Kami mendaftarkan sinyal tertentu (dipancarkan atau diserap) dengan perubahan sampel pada tingkat molekuler ini. Ini dapat berupa kehilangan foton yang dihabiskan untuk mengubah sampel (maka kita memiliki spektroskopi serapan), atau sebaliknya, kelebihan foton yang dipancarkan setelah eksitasi awal bahan (spektroskopi emisi), perubahan dalam panjang gelombang foton awal sebagai akibat interaksi dengan substansi (spektroskopi Raman, lebih lanjut dikenal di luar negeri sebagai
Ramenovskaya Ramanova ), atau fragmen bodoh dari molekul asli (seperti dalam spektra massa atau spektroskopi fotoelektron ). Ada banyak pilihan - esensinya sama: ada sinyal!
Contoh metode tersebut adalah banyak huruf yang berbeda: NMR, ESR, MW, THz, IR, UV / Vis, XRF, MS, PES, EXAFS, XANES, dll. dll.
Semua (atau banyak dari mereka) akrab (atau seharusnya akrab) bagi setiap ahli kimia. Semua metode ini adalah gudang senjata standar (jauh dari tidak lengkap) dari seorang peneliti yang menghargai diri sendiri yang berurusan dengan zat.
Rentang spektral dan hubungannya dengan kehidupan molekul
 Diambil dari xkcd.com
Diambil dari xkcd.comKarena dalam sebagian besar kasus spektroskopi masih terikat dengan radiasi elektromagnetik, adalah logis untuk menghubungkan rentang spektrum elektromagnetik dengan berbagai aspek kehidupan atom-molekul. Lagi pula, frekuensi gelombang elektromagnetik yang digunakan dalam spektroskopi adalah semacam "jam" yang memungkinkan Anda mendeteksi berapa lama proses ini atau itu dalam sistem molekuler berlangsung. Jadi, dengan mengubah frekuensi ini, Anda dapat mempelajari (dan bahkan bertindak) pada berbagai proses molekuler.
Jadi
- Dari sudut pandang kimia, tidak ada yang menarik terjadi dalam rentang panjang gelombang super panjang, jadi Anda tidak dapat mengingatnya.
- Dengan frekuensi gelombang radio dan gelombang mikro (dan bahkan radiasi inframerah gelombang panjang, IR = IR), molekul yang berbeda berputar dalam fase gas: besar dan berat - di wilayah gelombang radio (frekuensi lebih rendah), dan kecil dan ringan - di IR (frekuensi lebih tinggi).
- Dalam IR, bagaimanapun, (terutama) berbagai getaran molekul terjadi: semua gerakan konformasi dan tidak jelas lainnya di dalam molekul berada dalam IR panjang gelombang panjang, dan getaran peregangan (peregangan - pemendekan panjang ikatan kimia) terjadi pada panjang gelombang pendek (hingga 4000 cm -1 ).
- Nah, kemudian datanglah tempat spektrum, di mana berbagai transisi elektronik hidup (hingga wilayah γ-quanta). Pada frekuensi yang lebih rendah (terlihat, UV = UV dan sinar-X lembut), terutama transisi yang terkait dengan elektron valensi hidup.
Kenapa kita melihat?By the way, justru karena transisi elektronik yang dapat kita lihat: di mata kita (dalam kerucut) ada struktur yang memiliki
retina dalam komposisi mereka. Ketika foton yang terlihat diserap oleh molekul ini, ikatan rangkap pecah di dalamnya, yang mengarah ke isomerisasi cis-trans. Dan perubahan inilah yang kita rasakan sebagai sinyal utama, yang kemudian ditransmisikan ke otak kita.
Tetapi dengan meningkatnya energi foton (mis., Dengan frekuensi yang meningkat, seperti yang kita ingat dari rumus Planck E = h n u ) kita sampai pada lapisan yang lebih dalam dan lebih dalam dari struktur elektronik, sampai kita beristirahat dalam kisaran x-ray ke kulit 1s-terakhir ( atau, sebagaimana mereka disebut X-ray, K ).
Jadi, memilih panjang gelombang yang tepat dari radiasi elektromagnetik, kita dapat melihat lebih detail pada proses tertentu dalam molekul.
Metode difraksi zat
Sekarang mari kita bicara sedikit tentang difraksi. Diagram skematik eksperimen semacam itu juga sederhana.
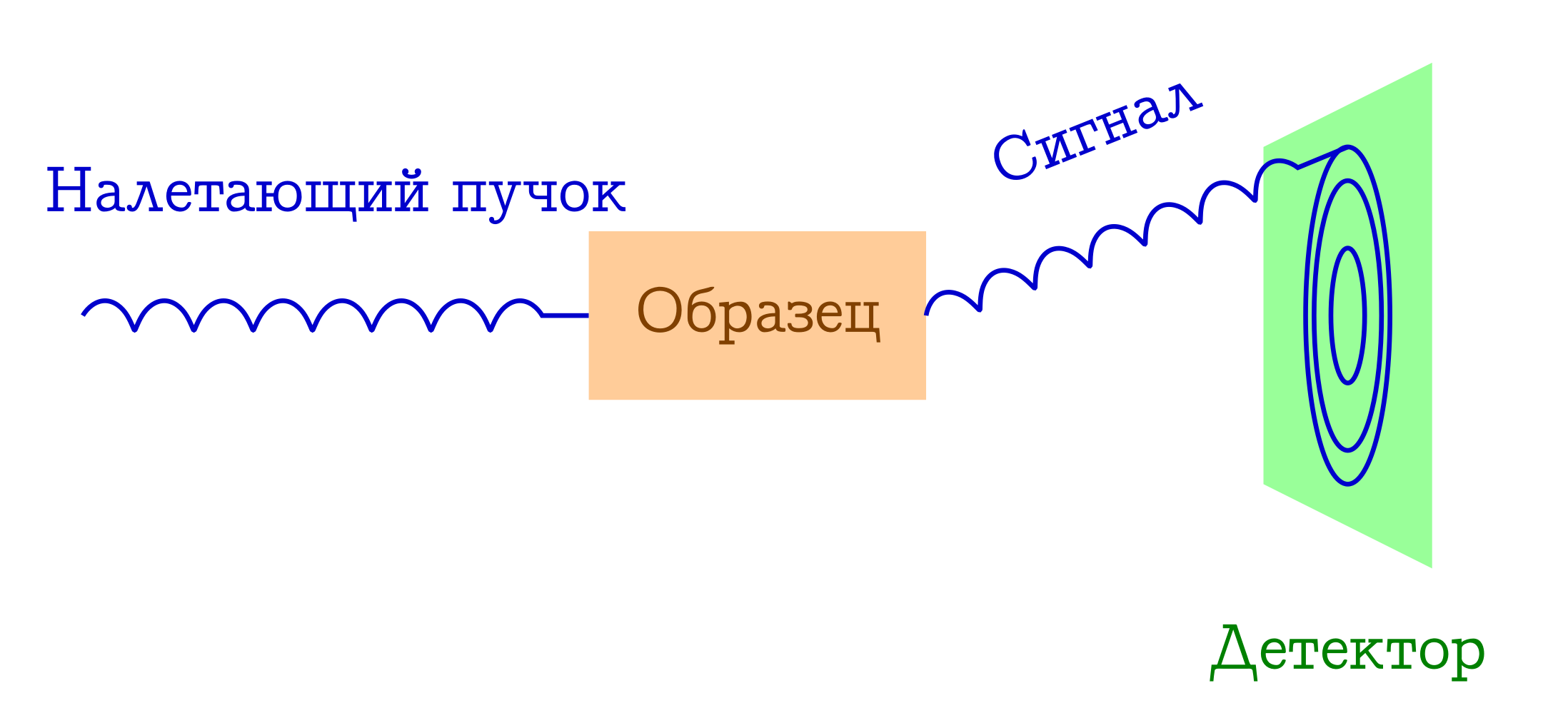
Skema umum metode difraksi untuk mempelajari zat
- Balok beberapa partikel terbang ke sampel. Paling sering itu adalah foton sinar-X, atau elektron, atau neutron.
- Partikel-partikel ini dengan mekanisme berbeda tersebar secara elastis pada atom dalam sampel yang menarik bagi kita (yaitu, tanpa mengubah panjang gelombang dan fase gelombang, mereka hanya mengubah arah penerbangan mereka). Tidak ada yang terjadi pada sampel dari partikel-partikel ini: ia tidak punya waktu untuk bereaksi.
- Jarak interatomik berfungsi sebagai kisi difraksi untuk sinar yang datang, oleh karena itu, sebagai hasilnya, kita akan melihat gambar difraksi yang indah pada detektor.
Dari paragraf terakhir, kondisi untuk panjang gelombang partikel datang (λ) muncul: harus dari urutan yang sama atau kurang dari urutan karakteristik jarak interatomik, sehingga λ khas untuk metode ini adalah 1 - 0,01 Å.
Jenis kesalahan utama saat membandingkan eksperimen dan perhitungan teoritis
Sebagai hasilnya, kami memiliki gambaran yang sangat menarik: dalam spektroskopi dan difraksi kami mengamati beberapa jenis sinyal kiri, yang entah bagaimana
secara tidak langsung menunjukkan apa yang sebenarnya terjadi dalam sistem molekuler.
Analogi dengan gua PlatonisLukisan ini mengingatkan
mitos tentang Gua Plato . Kami memiliki Dunia Nyata Molekul tertentu. Tetapi kita hanya melihat bayangan darinya di dinding gua (detektor), yang merupakan tampilan tidak lengkap dari semua hal menarik yang terjadi pada tingkat Realitas ini.
Tetapi, untungnya, kadang-kadang kita secara teoritis dapat menghitung sinyal yang menarik bagi kita (seperti, misalnya, dalam microwave, spektroskopi IR atau UV / Vis), dan kadang-kadang kita dapat mengekstrak dari sinyal yang diamati jumlah bunga yang tersedia untuk perhitungan kimia kuantum (misalnya, jarak antara atom dalam molekul, momen dipol, dll.). Dan di sini kita memiliki peluang bahwa percobaan numerik dan nyata dapat bersatu dalam tahap perbandingan yang bersemangat satu sama lain ... dan di sini 4 jenis kesalahan dapat terjadi sebagai standar.
Perhatian! Istilah "kesalahan" di sini tidak berarti bahwa hasil perbandingan jelas salah. Hanya saja tanah untuk perbandingan menjadi sangat goyah dan berawa, dan satu langkah ceroboh dapat dengan mudah mengacaukan seluruh pekerjaan.
- Kondisi percobaan dan / atau perhitungan yang berbeda (keadaan agregasi, suhu, tekanan, dll.). Kita tiba-tiba dapat mulai membandingkan sistem yang berbeda di antara mereka sendiri, untuk beberapa alasan menganggap mereka sama. Misalnya, jelas bahwa menambahkan satu atau lima sendok teh gula ke dalam secangkir teh akan mengarah pada sistem fisik yang sama yang disebut "teh dengan gula", tetapi sifat-sifat sistem ini akan sangat berbeda. Dan itu dapat dengan mudah diukur. Misalnya, dengan termometer (mengukur suhu teh segera setelah gula larut) atau dengan lidah (salah satu yang disebut metode analisis organoleptik). Jadi ketika membandingkan sistem yang dihasilkan satu sama lain (baik itu secangkir gula nyata dengan teh, atau model komputernya), kita tidak boleh lupa bahwa kesamaan memiliki batasnya, dan bahwa jika kita mengurangi margin kesalahan untuk "kesamaan", kita akhirnya akan menemukan perbedaannya.
- Makna fisik dan / atau matematika yang berbeda dari parameter (parameter makna fisik dalam arti biasa bahkan mungkin tidak ada). Di sini juga, semuanya sederhana: jika kita membandingkan 2 kuantitas dengan nama yang sama, ini tidak berarti bahwa kuantitas memiliki makna fisik yang sama. Misalnya, peringkat wakil di antara seluruh populasi kota vs. peringkat hanya di antara nenek. Baik ini dan itu peringkat (apa pun itu), angka-angka ini (atau apa pun itu) bahkan dapat sangat berkorelasi satu sama lain, tetapi arti dari parameter ini masih berbeda, dan perbedaan ini dapat dideteksi.
- Kesalahan "acak" . Ini termasuk beberapa kesalahan sistematis yang tidak diketahui oleh ahli teori eksperimen / simulator, atau kesalahan yang benar-benar acak dalam percobaan / perhitungan yang tidak dapat dikontrol dan / atau diprediksi. Pada prinsipnya, hal-hal seperti itu sendiri dapat menjadi subjek penyelidikan berbagai efek sistematis yang menarik.
atau hanya perkiraan rasio S / N ("sinyal terhadap noise") yang paling berguna. - Dan kesalahan standar terakhir adalah pertumbuhan tangan dari eksperimen / kalkulator dari tulang panggul , yaitu, kesalahan manusia biasa. Tidak perlu menyelidiki apa pun, cukup periksa pekerjaan atau ulangi percobaan untuk menemukan dan menghilangkan kusen yang sesuai.
Tidak ada yang lebih konkret dapat dikatakan tentang dua jenis kesalahan terakhir, tetapi tentang dua jenis kesalahan pertama, dan jika Anda menggunakan metode penelitian tertentu, Anda dapat mengatakan banyak hal. Karena itu, kami akan berkonsentrasi pada mereka. Penekanan utama dalam kasus ini adalah pada perbedaan struktural molekul.
Kesalahan # 1. Perbedaan dalam sifat molekul dalam kondisi yang berbeda
NaCl: ketika tidak ada kesalahan
Untuk beberapa alasan, tidak pernah terpikir oleh siapa pun untuk mengatakan bahwa kristal tunggal natrium klorida (NaCl), yang merupakan molekul besar ion Na
+ dan Cl
- , dan molekul NaCl diatomik yang diperoleh melalui penguapan kristal ini pada suhu gila memiliki satu dan sama katakanlah strukturnya.
Dan bahkan jika kita mengasumsikan bahwa setidaknya jarak antara klorin dan natrium (
r NaCl ) adalah sama di sana-sini, percobaan akan menempatkan kita di tempat:
Di mana kita melakukan kesalahanBahkan, dengan perbandingan seperti itu, kami memungkinkan kemungkinan Kesalahan # 2, tetapi semuanya baik-baik saja di sini, jika kami mengevaluasi kesalahan perbandingan seperti itu, mereka akan berada di urutan 0,01 Å, yang secara signifikan kurang dari perbedaan parameter yang dibandingkan. Yaitu ini bukan kesalahan, tetapi efek nyata.
Cara mendapatkan jarak antara kation natrium dan anion klorin dalam kristal garam sendiriMemperoleh jarak antar atom dalam molekul NaCl diatomik dari data eksperimen juga bukan prosedur yang rumit. Tetapi masalahnya adalah eksperimen semacam itu adalah hal yang rumit. Oleh karena itu, lebih mudah untuk menggunakan basis data di mana jarak yang diperlukan sudah diberikan.
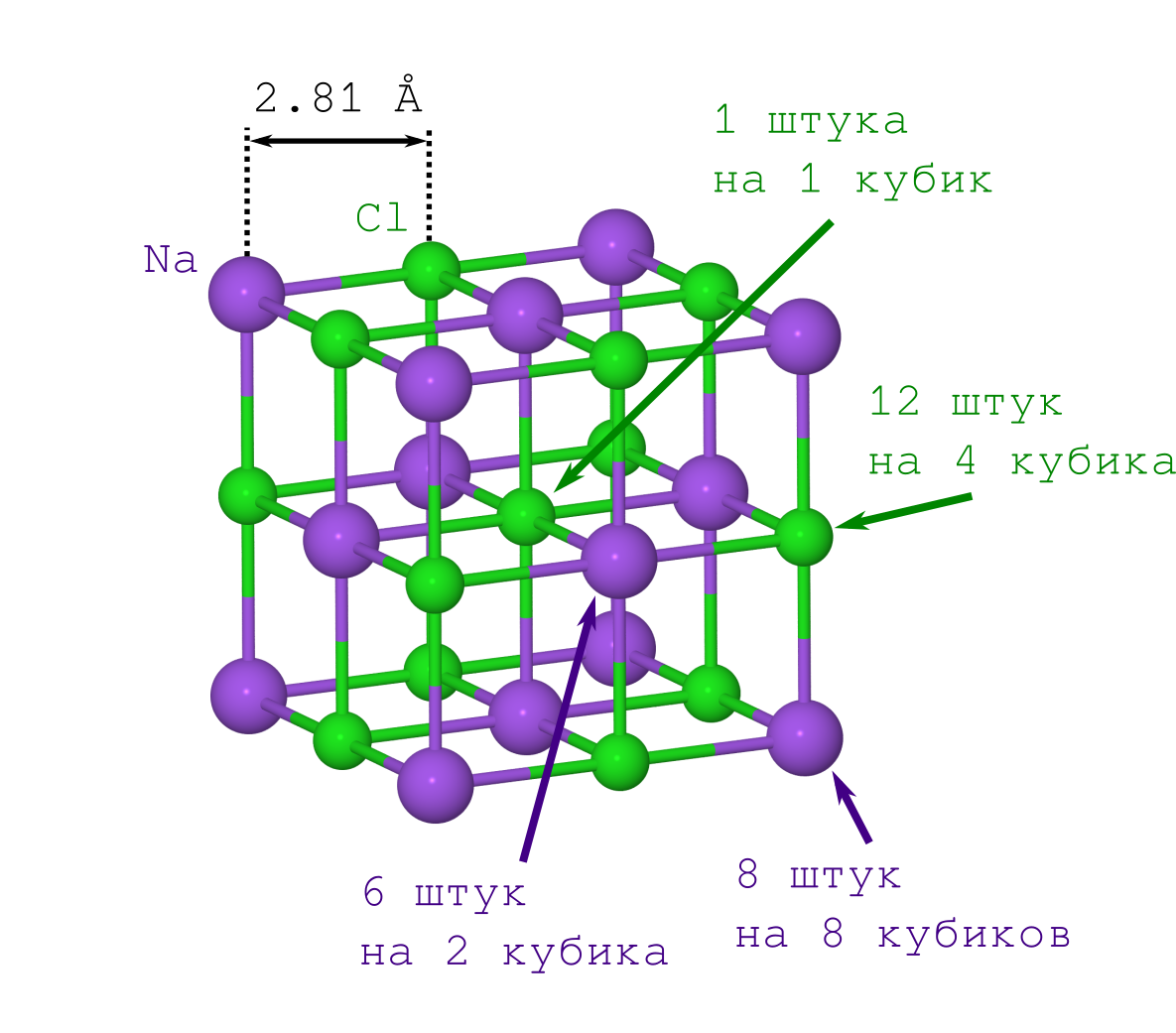
Tetapi untuk mendapatkan jarak antara atom dalam kristal, hanya kepadatan garam kristal dari tabel ρ = 2.165 g / cm
3 sudah cukup, yang dapat
dengan mudah diperoleh dari Wikipedia dan mengukur diri Anda di rumah.
Untuk menghitung jarak yang kita butuhkan:
- kerapatan kristal NaCl,
- pengetahuan tentang lokasi ion-ion kristal ini.
Jika Anda melakukan ini untuk pertama kalinya (katakanlah, pada awal abad ke-20), Anda harus menderita dengan poin kedua. Tapi ini sudah diketahui orang modern: kisi NaCl memiliki bentuk kubus di mana ion Na
+ dan Cl
- bergantian satu sama lain (lihat gambar di atas). Dengan mengalikan fragmen yang ditunjukkan dari kristal ("salin-tempel" potongan yang ditentukan dan menyesuaikannya dengan iterasi sebelumnya dengan bertatap muka), kami memperoleh kristal NaCl dari berbagai ukuran yang diinginkan dan bentuk (minecraft) yang diinginkan.
Jadi kepadatan kubus ini harus sama dengan seluruh kristal. Mengingat kepadatan itu
rho= fracmV (mis. massa per volume), ternyata mengetahui massa dan ekspresi geometrik volume, kita dapat menghitung jarak antara atom.
Volume kubus jelas: panjang tulang rusuk adalah dua kali jarak Na - Cl (
L=2r mathrmNaCl ), yang berarti volume yang diinginkan adalah
V=L3=8r mathrmNaCl3 .
Massa tidak begitu sederhana. Sebagian besar atom kami terletak pada simpul, tepi dan muka kubus, yang berarti bahwa mereka secara bersamaan menjadi bagian dari beberapa kubus ini. Ini harus diperhitungkan dalam perhitungan.
Mari kita mulai dengan ion Na
+ . Kami hanya memiliki 2 jenis (lihat pola kisi kristal):
- mereka yang berada di simpul kubus (ada sebanyak simpul kubus, yaitu 8, dan mereka secara bersamaan dalam 8 kubus, jadi Anda harus membagi angka ini dengan 8),
- mereka yang berbaring di wajah (ada 6 dari mereka, dan mereka secara bersamaan milik 2 kubus).
Akibatnya, kami mendapatkan bahwa kubus kami berisi
8 cdot frac18+6 cdot frac12=4 ion natrium.
Sekarang tentang Cl
- . Hanya ada 2 jenis saja (lihat pola kisi kristal):
- yang terletak di tepi kubus (ada 12 di antaranya, dan mereka secara bersama dimiliki oleh 4 kubus),
- bahwa Cl - yang ada di tengah-tengah kubus, itu adalah satu dan hanya milik kubus kita.
Oleh karena itu, kubus kami berisi
12 cdot frac14+1 cdot frac11=4 ion klorin.
Komposisi kristal, jelas, sesuai dengan rumus kimia NaCl, tetapi massa kubus kami sama (jangan lupa bahwa massa atom dalam tabel periodik diberikan dalam
satuan massa atom ):
m=4 cdot( underbraceM mathrmNa23 textam+ underbraceM mathrmCl35.5 textamu)=234 textamu=234 cdot1.66 cdot10−24 textr=3.88 cdot10−22 textg\.
Sekarang dari relasinya
rho= fracmV kita bisa membuat persamaan untuk panjangnya
r mathrmNaCl :
r mathrmNaCl3= kiri( fracm8 rho kanan) ,
yang mudah dipecahkan:
r mathrmNaCl= kiri( fracm8 rho kanan)1/3= kiri( frac3.88 cdot10−22 [ textg]8 cdot2.17 [ textg/ textcm3] kanan)1/3=2.82 cdot10−8 [ textcm]=2.82 [ textÅ] .
Dari data dari kristalografi x-ray 2,81 Å (misalnya, dari
Abrahams, SC; Bernstein, JL Akurasi difraktometer otomatis. Pengukuran faktor struktur natrium klorida // Acta Crystallographica (1965) 18, 926-932 ) kami hanya melewatkan 0,01 Å, yang cukup keren.
Seseorang mungkin berpikir bahwa perbedaan 0,45 Å tidak signifikan, tetapi ini hampir jari-jari Bohr (0,52 Å), yang sama dengan jarak elektron yang paling mungkin, dan menurut standar atom perbedaannya sangat besar.
Mengapa NaCl dalam bentuk molekul atom 2 berbeda dari kristalSemuanya sangat sederhana di sini. Kisi kristal tanpa batas menciptakan kemungkinan "lompatan" yang tidak dapat diubah untuk elektron natrium 3s
1 per atom klor, karena perbedaan muatan yang dihasilkan dikompensasi oleh interaksi dengan tetangga.
3s
1 ( ), ,
«» :
Na:Cl↔Na+Cl−
() (), .
,
±1 , , .
NaCl (2.36 Å),
d=q⋅rNaCl=9.0 [] dimana
q≥0 (
+q ,
−q )
, « » 0.21, ..
d=0.21⋅9.0=1.9 [qe⋅Å] , :
q=drNaCl=1.92.36=0.8 . «» 0.2 NaCl NaCl .
Ferrocene
Layak untuk dipindahkan dari kristal ionik ke kristal molekuler di mana molekul padat, sehingga tiba-tiba menjadi mungkin untuk membandingkan, dan tanpa keraguan.Tapi bedanya jangan dilupakan. Dan bahkan ada contoh klasik tentang hal ini: molekul ferrocene .Ini adalah koneksi sandwich yang paling sederhana. Di dalamnya, atom besi netral (seperti irisan daging) terjepit di antara dua cincin aromatik beranggota lima (roti).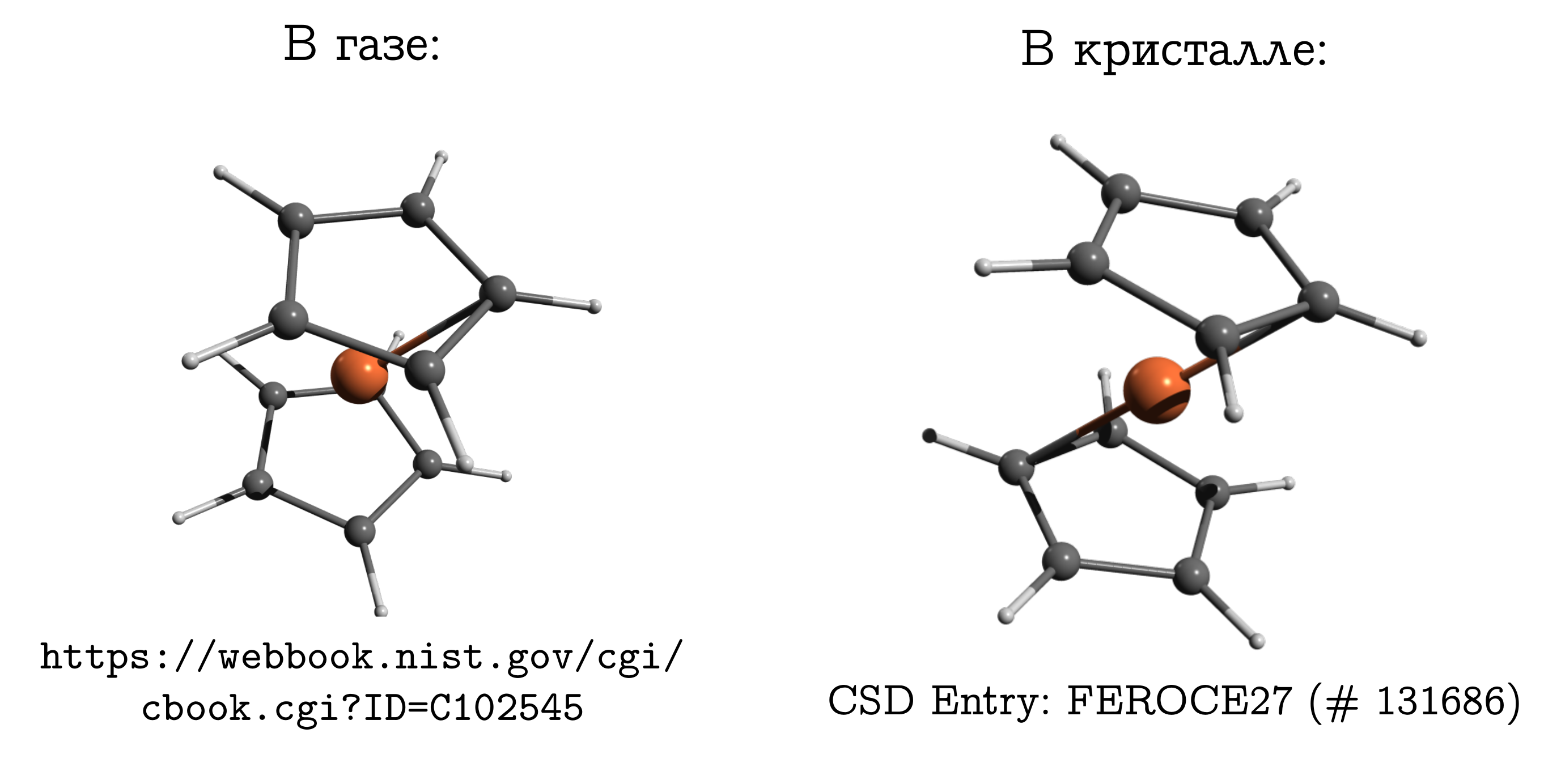 Molekul ini dapat diuapkan dengan cukup mudah, dan mengetahui bahwa apa yang disebut sebagai struktur paling stabil dalam fase gas adalah konformasi terhambat. Di dalamnya, karbon dan hidrogen dari cincin atas dan bawah saling berlawanan (lihat gambar di atas), karena dalam hal ini interaksi dispersi paling kuat. antara potongan-potongan molekul ini, dan dispersi selalu bermanfaat.Jika kita mengambil kristal ferrocene, maka ternyata molekul di sana memiliki konformasi stabil yang berbeda (yang disebut dihambat untuk hidrokarbon), di mana hidrogen dan karbon dari satu cincin berada di atas / di bawah ikatan C - C yang lain. Ada interaksi dispersi antara molekul, dan yang serupa, tampaknya tidak nyaman untuk struktur molekul muncul dari kenyataan bahwa molekul lebih mudah untuk menyatu hanya dalam bentuk yang tidak nyaman, dan ketidaknyamanan pribadi ini dikompensasi oleh interaksi satu sama lain.
Molekul ini dapat diuapkan dengan cukup mudah, dan mengetahui bahwa apa yang disebut sebagai struktur paling stabil dalam fase gas adalah konformasi terhambat. Di dalamnya, karbon dan hidrogen dari cincin atas dan bawah saling berlawanan (lihat gambar di atas), karena dalam hal ini interaksi dispersi paling kuat. antara potongan-potongan molekul ini, dan dispersi selalu bermanfaat.Jika kita mengambil kristal ferrocene, maka ternyata molekul di sana memiliki konformasi stabil yang berbeda (yang disebut dihambat untuk hidrokarbon), di mana hidrogen dan karbon dari satu cincin berada di atas / di bawah ikatan C - C yang lain. Ada interaksi dispersi antara molekul, dan yang serupa, tampaknya tidak nyaman untuk struktur molekul muncul dari kenyataan bahwa molekul lebih mudah untuk menyatu hanya dalam bentuk yang tidak nyaman, dan ketidaknyamanan pribadi ini dikompensasi oleh interaksi satu sama lain.Mengapa ferrocene sangat berbeda dari ethaneSeseorang yang akrab dengan kimia biasanya harus mengalahkan dirinya sendiri untuk mengingat struktur ferrocene dalam gas. Lagi pula, ia memiliki ingatan etana (C
2 H
6 ), di mana konformasi yang paling stabil dihambat (ketika hidrogen dari satu bagian CH
3 terletak "di antara" hidrogen dari CH
3 lainnya ), karena dalam posisi ini, tolakan antar atom antara kulit elektron hidrogen diminimalkan.

Diadaptasi dari
www.chem.msu.su/rus/teaching/stereoDan di sini perbedaannya terletak pada jarak. Bentuk standar dari potensi interaksi dispersi adalah potensi Lennard-Jones (ini, omong-omong, adalah satu, bukan dua orang):
V mathrmLJ(r)= fracAr12− fracBr6
Di dalamnya, istilah pertama diambil dari tolakan interatomik, dan yang kedua dari tarik interatomik yang timbul dari fluktuasi kepadatan elektron. Secara umum, potensi ini terlihat seperti ini:
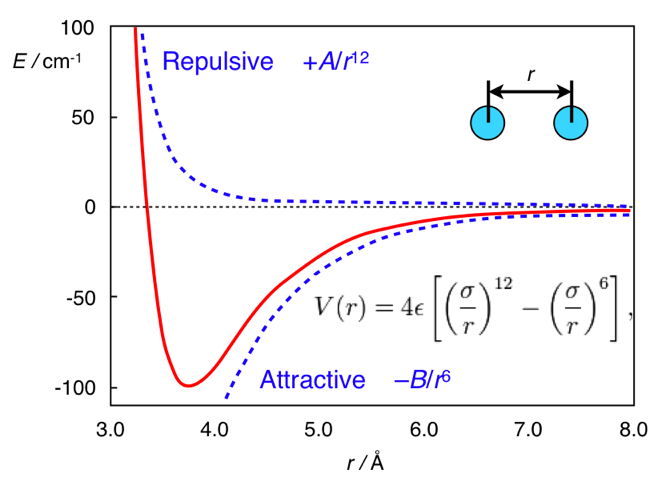
Potensi Lennard-Jones. Diadaptasi dari
chemistry.stackexchange.com/questions/34214/physical-significance-of-double-well-potential-in-quantum-bondingDan dalam kasus etana, atom hidrogen terlalu dekat satu sama lain, sehingga mereka (relatif terhadap minimum) di sisi kiri kurva, dan mereka dicirikan oleh tolakan. Dalam kasus ferrocene, di antara cincin-cincin ada lapisan yang tidak sakit-sakitan (atom besi), karena cincin-cincin itu cukup jauh untuk tidak merasakan tolakan interatomik. Dan mereka berada di bagian yang tepat (menarik) dari potensi.
Histamin
Dalam kasus ferrocene, kami melihat apa yang disebut perbedaan konformasi: molekulnya tetap sama (mis. tidak ada ikatan kimia yang putus atau terbentuk), dan bentuknya sedikit berubah.
Tetapi perbedaannya bisa lebih kuat, misalnya jika disebut demikian
transformasi tautomerik . Tautomerisasi adalah kelas reaksi kimia yang terjadi dengan begitu mudah dan cepat sehingga sebagai hasilnya, kita dapat secara bersamaan memiliki beberapa isomer dari satu molekul, dengan mudah saling melintas. Isomer ini disebut tautomer.
Contoh standar ini: tautomerisme keto-enol dalam keton:

Paling sering, seperti dalam contoh ini, tautomerisme dikaitkan dengan melompatnya proton dari satu tempat hangat ke tempat lain. Dan reaksi-reaksi ini terkait dengan
efek terowongan , di mana hidrogen, sebagai atom yang paling ringan, paling rentan.
Transformasi kimia semacam itu adalah karakteristik dari banyak molekul biologis, misalnya,
basa nitrogen yang membentuk DNA , atau
gula .
Tetapi ketika bergerak dari sistem ke sistem, konstanta kesetimbangan dari reaksi seperti itu sering berubah, sehingga dalam fase yang berbeda kita dapat mengamati komposisi tautomerik yang berbeda.
Contohnya adalah molekul histamin (lihat gambar di bawah).
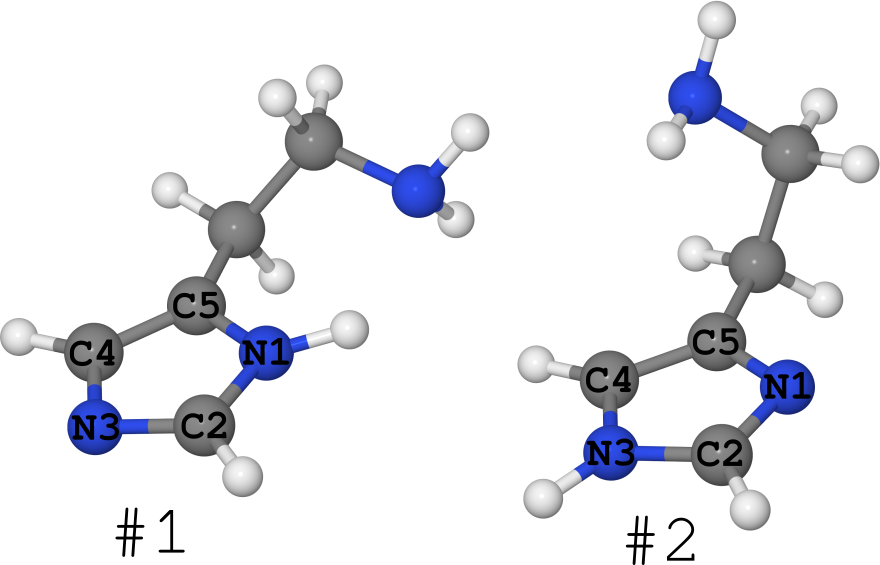
Itu ada dalam bentuk 2 tautomer (saya biasanya diam tentang jumlah konformer, ada banyak dari mereka):
- # 1, di mana hidrogen berada pada nitrogen N1,
- # 2, tempat hidrogen berada pada nitrogen N3.
Kebetulan bahwa untuk molekul ini strukturnya dalam fase yang berbeda diketahui.
- Dalam kristal, itu benar-benar "beku" dalam bentuk # 1. (lihat artikel DOI: 10.1021 / ja00796a011 dan struktur di Bank Struktural Cambridge dengan nama "HISTAN" dan / atau nomor 1176642)
- Dalam larutan air, molekul ini ada dalam kedua bentuk, dan tautomer # 2 secara nyata lebih besar ( DOI: 10.1021 / ja027103x ).
- Dalam gas, histamin ada sama dalam bentuk # 1 dan dalam bentuk # 2 ( DOI: 10.1021 / ja980560m ).
Yaitu fase yang berbeda mengandung jumlah molekul yang berbeda pula, yang berarti mereka adalah sistem yang berbeda.
Kesimpulan Kesalahan # 1

Kesimpulan utama yang bisa ditarik dari contoh di atas adalah sebagai berikut:
Ketika membandingkan perhitungan dalam satu fase dengan eksperimen dalam fase lain, seseorang harus siap untuk perbedaan sistematis.
Ini tidak berarti bahwa tidak perlu membandingkan: perlu membandingkan, tetapi hanya perlu untuk lebih kritis terhadap perbedaan dan / atau kebetulan yang ditemukan, dan untuk mengevaluasi efek seperti itu jika memungkinkan.
Kesalahan # 2. Parameter molekuler "Zoo".
Kesalahan kedua dijelaskan secara singkat sebagai berikut: jika parameter dipanggil dengan cara yang sama, tetapi tidak identik, ini adalah parameter yang berbeda.
Untuk memahami apa sumber perselisihan antara teori dan eksperimen ini, kita harus menganalisis secara lebih rinci metode eksperimen standar yang digunakan untuk mendapatkan parameter molekuler dan model yang menghitung jumlah yang sama murni dari teori.
Dan di sini kita akan berbicara lagi hanya tentang struktur.
Cara mendapatkan struktur molekul eksperimental
Untuk membatasi diri kita, kita hanya akan berbicara tentang metode untuk mempelajari struktur molekul tunggal, mis. tentang fase gas.
Kami memiliki dua sumber utama informasi tersebut:
- difraksi elektron gas,
- spektroskopi gelombang mikro.
Kami akan membahas masing-masing metode ini secara lebih rinci.
Difraksi elektron gas
Metodenya cukup tua, itu berasal pada 30-an abad XX, ketika para ilmuwan Jerman Mark dan Wirl melakukan percobaan pertama pada difraksi elektron oleh gas.
Hanya sedikit orang yang tahu, tetapi metode penelitian ini terlibat dalam menerima tiga Hadiah Nobel dalam bidang kimia.
3 bangsawan dengan input elektronografi- Peter Debye pada tahun 1936 menerima penghargaannya dengan kata-kata:
"[atas karyanya pada] struktur molekul melalui penyelidikannya pada momen dipol dan difraksi sinar-X dan elektron dalam gas "
Ini adalah satu-satunya penyebutan difraksi elektron gas secara eksplisit dalam manfaat penerima hadiah, dan bukan tanpa alasan. Persamaan difraksi elektron dasar untuk intensitas hamburan molekul bernama Debye.
sebenarnya, persamaan DebyeIij(s)=gij frac sin(srij)rij
Di sini
Iij menunjukkan intensitas hamburan elektron (atau sinar-x, atau partikel lain) oleh sepasang atom ke-i dan ke-
j di kejauhan
rij terpisah
s= frac2 pi lambda sin kiri( frac theta2 kanan) Apakah koordinat hamburan terkait dengan sudut hamburan
theta dan panjang gelombang partikel
lambda , dan
g - kemampuan pasangan atom ini untuk menyebarkan partikel difraksi.
Dan terlepas dari kenyataan bahwa apa pun diingat tentang fisika yang luar biasa ini ( model solusi ionik , modelnya untuk menghitung kapasitas panas kristal ), tetapi bukan difraksi elektron, ia menerima hadiah ilmiah utama (khususnya) untuk itu.
- Linus Pauling pada tahun 1954. Ya, orang yang menerima 2 Hadiah Nobel pribadi,
dan bahkan menempatkan seluruh dunia pada vitamin C , Great Pauling. Ketika dia berada di Kaltech, dia terutama terlibat dalam difraksi elektron gas (lihat, misalnya, DOI: 10.1021 / ja01873a047 ). Dan tentu saja, pengetahuan tentang struktur kimia molekul bebas membantunya menciptakan teori ikatan kimia yang terkenal (tapi jangan mengecilkan latar belakang kristalografi yang besar di sini). - Odd Hassel, 1969 Laureate. Dia menerima 1/2 Hadiah Nobelnya untuk penemuan keseimbangan konformasi. Dia melakukan ini berdasarkan studi difraksi elektron dari sikloheksana. Molekul ini ada dalam bentuk dua konformasi: kursi (kursi) dan kamar mandi (dalam tradisi Inggris - perahu, perahu).

Dari sini: www.shapeways.com/product/N5FE298DS/cyclohexane-2-molecules-boat-and-chair-form
Opsi-opsi untuk pengaturan atom ini dengan cepat berubah menjadi satu sama lain, tetapi pada saat itu mereka tidak mengetahuinya, dan percaya bahwa hanya satu dari struktur yang harus diwujudkan. Hanya sinyal difraksi elektron yang tidak ingin dijelaskan oleh salah satu dari struktur ini, dan hanya kombinasi sinyal dari kedua konformasi yang dapat menjelaskan pola difraksi yang diamati (lebih lanjut tentang ini dapat ditemukan dalam buku I. Khargittai "Ilmu Frank. Percakapan dengan Ahli Kimia Terkenal").
Skema metode itu sendiri sangat sederhana (lihat gambar di bawah).
Masalahnya terjadi dalam ruang hampa.
- Elektron yang cepat secara terus menerus dihilangkan dari katoda, yang dipercepat di bidang anoda menjadi energi 40-60 keV.
- Elektron yang tersebar (tetapi cepat) cukup terfokus oleh lensa magnetik, setelah itu mereka berubah menjadi berkas yang sempit.
- Ruang dengan zat dipasang tegak lurus dengan balok. Sampel dipanaskan sampai mendidih, dan uap yang dihasilkan bersentuhan dengan berkas elektron.
- Elektron berhasil disebarkan oleh molekul-molekul, dan diam-diam terbang jauh, di mana mereka jatuh pada film.
- Biasanya di depan film diletakkan yang disebut. perangkat sektor. Ini adalah layar yang berputar sangat cepat dari bentuk yang tidak biasa. Faktanya adalah bahwa elektron memiliki kemungkinan menyimpang dari arah aslinya (oleh sudut hamburan yang besar) t h e t a ), jatuh sangat cepat. Oleh karena itu, untuk memperlancar penurunan intensitas ini, sektor ini secara seragam membayangi bagian tengah film, membiarkan bagian yang jauh terbuka. Hasilnya adalah gambar yang diterangi lebih merata.
- Perangkap balok menangkap elektron-elektron yang tidak tersebar sama sekali (dan ada banyak dari mereka).
- Nah, agar molekul tidak terbang di seluruh perangkat, mengotori itu, mereka dibekukan dalam perangkap dingin yang didinginkan oleh nitrogen cair.
Hasilnya adalah pola difraksi yang sama dari cincin konsentris yang dijelaskan oleh persamaan Debye (ini adalah sinyal). Berbagai parameter molekuler kemudian dapat ditarik langsung darinya.
Di mana saya dapat menemukan laboratorium elektron gas?Tidak banyak yang tersisa.
Tetapi di Rusia ada dua di antaranya: Moskow (di Departemen Kimia Universitas Negeri Moskow), dan di Universitas Teknologi Kimia Ivanovo.
Spektroskopi gelombang mikro
Metode mempelajari molekul ini lebih dikenal, jadi saya akan membicarakannya sedikit lebih singkat, menggunakan modifikasi paling modern sebagai contoh: spektrometer transformasi Fourier (seperti dalam bahasa Rusia, dalam spektroskopi gelombang mikro Fourier-transformed).
Desain di sini sudah lebih rumit, karena memerlukan banyak elektronik yang berbeda (amplifier, modulator frekuensi, dll.). Kami akan menghilangkan semua ini dan hanya berbicara tentang apa yang terjadi di dalam ruang vakum.
- Berseberangan satu sama lain ada dua antena tanduk (seperti yang membuka studi relict ). Salah satunya berfungsi sebagai pemancar, dan yang kedua adalah penerima.
- Yang tegak lurus terhadap antena ini adalah katup yang meluncurkan sampel. Paling sering, diluncurkan dalam bentuk uap bersama dengan gas pembawa tertentu (biasanya gas inert) dalam mode ekspansi adiabatik. Dalam kondisi seperti itu, molekul-molekul dengan cepat mendingin hingga suhu mendekati 0 K, yang sangat menyederhanakan spektrum, membuatnya lebih rentan terhadap interpretasi.
- Ketika molekul mengisi seluruh ruangan, antena pemancar menyinari mereka dengan sinyal termodulasi frekuensi linier. Dalam representasi frekuensi, ini sesuai dengan jumlah semua frekuensi dalam rentang tertentu.
- Beberapa molekul menyerap radiasi ini pada frekuensi yang berbeda, dan masuk ke kondisi tereksitasi. Tetapi, setelah beberapa waktu, mereka jatuh kembali, mulai memancarkan apa yang mereka tangkap selama impuls dari antena pengirim. Kios ini terlihat seperti sinyal osilasi yang berkurang ( peluruhan induksi bebas ). Antena kedua juga mendaftarkannya. Kemudian, setelah transformasi Fourier merekam sinyal ini dalam waktu, spektrum frekuensi yang biasa diperoleh.
Berbeda dengan difraksi elektron, yang tidak penting jenis molekul apa yang perlu dipertimbangkan, dalam spektroskopi gelombang mikro sebuah molekul harus memiliki momen dipol konstan (dalam kasus yang jarang, momen dipol magnetik juga cocok, ini khas untuk radikal, seperti molekul O
2 ). Sinyal di sini adalah “intensitas emisi vs. frekuensi. " Konstanta rotasi diekstraksi dari spektrum ini melalui beberapa model, dari mana struktur molekul kemudian diekstraksi.
Selamat datang di Kebun Binatang Parameter Molekuler!
Sekarang saatnya untuk melihat parameter geometrik apa yang bisa kita dapatkan dari berbagai eksperimen. Bahkan, masing-masing jenis kuantitas menunjukkan model apa yang digunakan agar sesuai dengan sinyal eksperimental (paling sering dengan metode kuadrat terkecil). Sebagian besar parameter ini dapat ditemukan di ulasan Kuchitsu K., Cyvin SJ // In: Struktur Molekul dan Getaran / Cyvin SJ (Ed.) - Amsterdam: Elsevier, 1972.- Ch.12. - P.183-211.
Mari kita mulai lagi dengan elektronografi.
- rg= langler rangleT struktur. Ini hanya seperangkat nilai rata-rata jarak interatomik pada suhu tertentu.
- ra= langler−1 rangle−1T nilai ini serupa rg , tetapi agak lebih alami untuk menggambarkan pola difraksi.
- r alpha=rh,0=? . Nilai ini tidak memiliki makna fisik yang jelas dan sepenuhnya terkait dengan model interpretatif. Sebenarnya, inilah yang diamati dalam kristalografi.
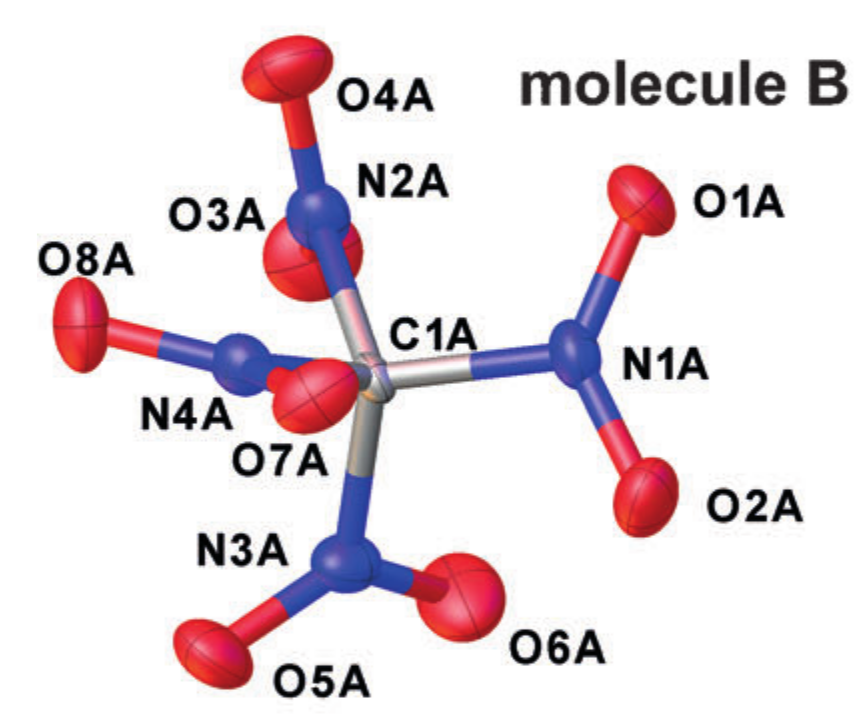
Contoh kristalografi r alpha struktur (tetranitromethane dalam kristal). Diadaptasi dari DOI: 10.1002 / anie.201704396
Setiap atom didekati dengan sebuah ellipsoid yang menggambarkan gerakan vibrasinya, dan jarak antara pusat-pusat elips yang dihasilkan diambil sebagai jarak interatomik. Tapi, penyederhanaan sifat gerak atom sesuai dengan pengenalan pendekatan osilator harmonik untuk osilasi, dan itu tidak selalu bekerja dengan baik.
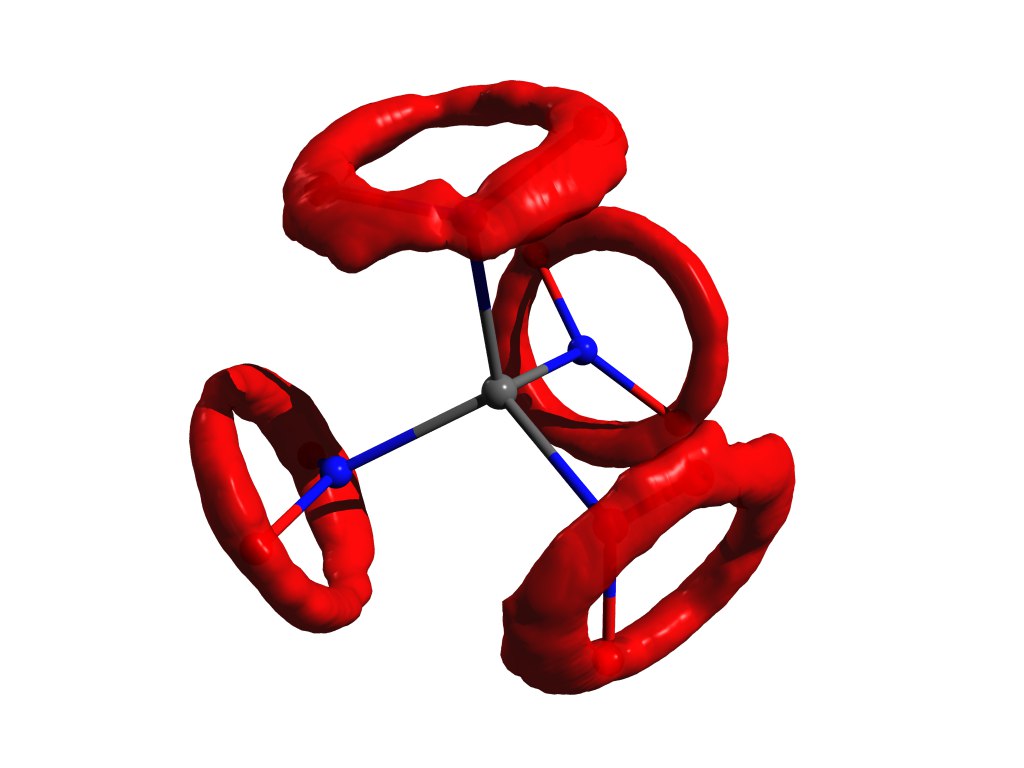
Contoh distribusi atom ketika pendekatan osilator harmonik tidak berfungsi. Tetranitromethane yang sama, tetapi dalam gas.
- rh1=??? . Ikan paus keajaiban-
judo HEX ini tidak dideskripsikan secara singkat, ia memiliki hubungan yang sangat lemah dengan kenyataan, tetapi ia memiliki sifat-sifat yang indah: ia harus konsisten secara geometris (lihat di bawah) dan dapat dengan mudah dihitung. Karena hal ini, ia memperoleh popularitas besar di komunitas elektronografi.
Dalam spektroskopi gelombang mikro, ada varian struktural yang sedikit lebih sedikit.
- Yang paling dimengerti secara fisik adalah rn= langlen| hatr|n rangle struktur. Faktanya, ini adalah rata-rata geometri pada keadaan getaran tertentu dari molekul ( |n rangle ) Karena mereka paling sering bekerja dengan molekul dingin, mereka biasanya mengamati satu struktur spesifik dari kelas ini: r0 , yaitu geometri molekul dalam keadaan getaran tanah, ketika atom membuat getaran nol di sekitar posisi mereka yang paling menguntungkan.
- Yang paling populer adalah rs struktur. Subskrip "s" berarti "substitusi". Mereka mendapatkannya dengan cara ini: diyakini bahwa ada beberapa koordinat atom yang tetap di ruang angkasa, kemudian mereka membuat substitusi atom tunggal dengan atom dalam molekul, dan mereka menentukan posisi atom ini dengan mengubah konstanta rotasi. Keuntungan utama dari teknologi ini adalah kesederhanaan. Minus: Anda hanya perlu monosubstitusi + tidak semua posisi atom dapat ditetapkan seperti ini + makna fisik model semacam itu tidak terlalu jelas.
- Pengembangan logis rs struktur rm -struktur yang diperoleh dari pemasangan dengan kuadrat terkecil tertimbang massa. Mereka juga membutuhkan molekul yang tersubstitusi secara isotop, tetapi salah satunya sudah sesuai.
Dan ini jauh dari semua jenis struktur yang mungkin ...
Tapi
Simulator Hebat Para pengguna beberapa paket kimia kuantum standar (seperti
Program Gaussian Evil Corporation ) ketika menggunakan mantra ajaib seperti "Opt" mendapatkan apa yang disebut "geometri keseimbangan", atau
re struktur. Ini adalah konfigurasi inti yang paling optimal, meminimalkan energi elektronik dari sistem. Dan struktur seperti itu juga dapat ditarik keluar dari difraksi elektron dan spektroskopi rotasi, tetapi hanya untuk molekul yang sangat kecil dan simetris, dan dalam kombinasi dengan metode penelitian lainnya. Sejauh ini tidak berhasil.
Maka timbul pertanyaan: apakah benar untuk membandingkan
re struktur dengan beberapa eksperimental, hanya melihat kesalahan eksperimental?
Jawabannya di sini sederhana:
tidak , perlu untuk membuat kesalahan tambahan tentang kemungkinan perbedaan sistematis. Dan contoh yang sangat mencolok dapat diberikan untuk ini: efek Bastiansen-Morino (lihat artikel
DOI: 10.1107 / S0365110060002557 dan
DOI: 10.1107 / S0365110060002545 ).
Misalkan kita memiliki molekul tipe CX
2 (mis., CO
2 , CS
2 , dll.). Seperti yang harus kita ketahui dari pelajaran kimia sekolah, molekul-molekul ini memiliki struktur linier (atom karbon dan dua kalkogen X terletak pada satu garis lurus).
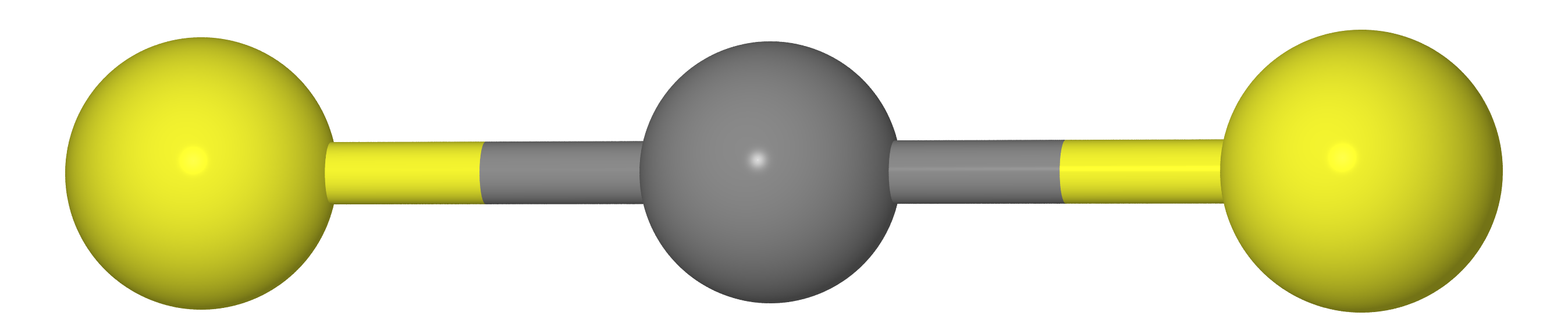
Ini berarti bahwa jarak antara atom X harus sama dengan dua kali panjang ikatan C - X (mis.
re( mathrmXX)=2re( mathrmCX) )

Lagi pula, jika kita mengukur jarak antara atom C dan X (
rg( mathrmCX) ) dan XX (
rg( mathrmXX) ) dengan difraksi elektron gas, kita dapatkan itu
rg( mathrmXX)<2rg( mathrmCX) , yaitu molekulnya ternyata melengkung. Alasannya terletak pada kenyataan bahwa molekul melakukan apa yang disebut
getaran gunting , karena atom X lebih dekat satu sama lain daripada di lokasi yang paling menguntungkan (lihat gambar di bawah).

Dari mana efek Bastansen-Morino berasal? Gambar dari artikel
DOI: 10.1039 / C6CP05849C .
Karena itu, jika kita menyamakan suhu rata-rata
rg -struktur ke keseimbangan (
re ), kita akan membuat kesimpulan yang salah bahwa molekul karbon dioksida dan karbon disulfida melengkung.
Itu sebabnya ketika membandingkan berbagai jenis parameter geometris, Anda harus selalu sangat berhati-hati. Ini berlaku baik untuk perbandingan data eksperimental di antara mereka sendiri, dan untuk perbandingan eksperimen dan teori.
Molekul Standar Model Molekul
Sekarang mari kita bayangkan bahwa kita dengan sepenuh hati ingin mensimulasikan hasil dari beberapa percobaan berdasarkan model teoretis kita untuk membandingkan simulasi dengan kenyataan dalam pertempuran yang adil.
Dan di sini juga perlu berhati-hati, karena model molekul yang berbeda juga memiliki batas penerapannya. Mari kita periksa ini menggunakan contoh Model Molekul Standar.
Pertama, Anda perlu memahami apa Model Molekul Standar itu. Fisikawan BAK memiliki
Model Standar mereka sendiri, para astronom memiliki
Model mereka sendiri , dan fisikawan memiliki desain dasar mereka sendiri, dari mana mereka kemudian menari. Namun tidak seperti model fisik, yang kami pertimbangkan adalah sekumpulan perkiraan yang memungkinkan pengguna untuk mendapatkan hasil yang relatif otomatis dan cepat.
Untuk Pengguna GaussianSekarang kita ingat apa yang ada di dasar mantra sihir Gaussian "Opt" dan "Freq".
Skema umum dari perkiraan yang diperkenalkan terlihat seperti ini:
Kualitas paling bawah adalah model standar kami. Secara singkat melewati semua tahap penerimaannya.
Model yang dihasilkan disebut RR-HO (@BO). Kita tidak akan menyentuh perkiraan Born-Oppenheimer (BO), tetapi kita harus membicarakan tentang rotator keras dan osilator harmonik dalam kerangka kimia struktural ...Dan masalah utama dengan perkiraan ini adalah bahwa molekulnya tidak kaku, dan getarannya benar-benar harmonis. Oleh karena itu, pada kenyataannya, kita memerlukan perkiraan rotator nonrigid dan osilator anharmonik. Dan kata kuncinya di sini adalah "anharmonic", mis. "Tidak harmonis."Mari kita bicara tentang molekul paling sederhana: diatomik. Ada banyak contoh di antaranya: HCl, HBr, HI, CO, O 2 , N 2 , dll. dll.
Mereka dibedakan dari semua molekul oleh fakta bahwa mereka hanya memiliki satu getaran: ketegangan / kompresi jarak interatomik.Dan ini adalah jarak antara atom-atom yang dapat kita ukur dalam difraksi elektron gas (dalam varian suhu rata-rata,r g ) dan dalam spektroskopi rotasi (dirata-ratakan, katakanlah, kondisi getaran dasar, mis.r 0 )
Dan sekarang pertanyaan utama muncul dari jagat raya kehidupan dan secara umum:apa yang akan terjadi r g dan r 0 dalam perkiraan osilator harmonik, dan bagaimana hal ini berkorelasi dengan jarak kesetimbanganr e ?
Untuk jawabannya, Anda harus melihat permukaan energi potensial untuk molekul diatomik:
- , : . , .
- , , 2 :
- ( r→0 ), - , « » ,
- ( r→+∞ )
Akibatnya, jika molekul tersebut memperpendek panjang ikatannya relatif terhadap posisi kesetimbangan, ia berbatasan dengan dinding, dan jika bertambah, ia jatuh di sofa yang lembut. Dan molekul itu bukan orang bodoh, ia akan lebih banyak berbaring di sofa daripada memukul di dinding. Oleh karena itu, getaran yang dirata-ratakan pada jarak akan lebih besar daripada keseimbangan (r e < r 0 , r g ), dan ini nyata: perpindahan seperti itu adalah urutan 0,01 Å, yang lebih tinggi dari kesalahan pengukuran.
Oleh karena itu, bahkan jika kita ingin menghitung sesuatu yang lebih seperti eksperimen, tetap dalam kerangka Model Molekul Standar (RR-HO @ BO), kita tidak akan mendapatkan sesuatu yang baru, oleh karena itu, geometri yang sangat seimbang akan berpartisipasi dalam perbandingan.Kesimpulan Kesalahan # 2
 Ilustrasi dari artikel DOI: 10.1002 / anie.201611308 .Dan kesimpulannya sangat sederhana dan terdiri dari 2 bagian.
Ilustrasi dari artikel DOI: 10.1002 / anie.201611308 .Dan kesimpulannya sangat sederhana dan terdiri dari 2 bagian.- Dengan perbandingan yang benar, semua nilai harus memiliki makna yang sama.
- Jika nilainya berbeda, maka ini tidak boleh dilupakan.
Contoh kesalahan dalam karya ilmiah
"Karya Hindu"
Sebenarnya, tempat utama di mana Anda dapat menemukan ini adalah majalah tingkat rendah. Mereka jarang berisi artikel dengan hasil yang keren, sehingga mereka dipilih oleh Peneliti Terkemuka dari negara-negara Dunia kedua dan lebih banyak (negara-negara BRICS dan pengikut mereka yang kurang berhasil). Dengan majalah "tingkat rendah" di sini tidak dimaksudkan yang menerbitkan artikel seperti "The Rooter: Algorithm untuk Unifikasi Khas Poin Akses dan Redundansi," melainkan publikasi ilmiah yang dihormati. Dalam bidang ilmiah saya, "setengah mencuci" yang paling terkenal adalah:(ada yang lain). Seperti yang dapat Anda lihat, menurut tanda-tanda formal, dalam sains Rusia mereka dianggap publikasi yang sangat baik. Tapi, datanglah begitu banyak konten ... kualitas meragukan yang masih banyak bocor.Sebagai ilustrasi, saya mengambil edisi terbaru Journal of Molecular Structure dan membaca daftar isi, dan voila:S. Sathiya, M. Senthilkumar, C. Ramachandra Raja, Pertumbuhan kristal, analisis permukaan Hirshfeld, studi DFT dan studi NLO urutan ketiga dari tiourea 4 dimethyl aminobenzaldehyde // J. Mol. Struct., V. 1180 (2019), PP. 81-88.
https://doi.org/10.1016/j.molstruc.2018.11.067
Struktur umum dari pekerjaan seperti itu sangat bersahaja.- Beberapa zat "direbus" (tetapi lebih sering dibeli dengan bodoh di Sigma ). Dalam pekerjaan ini, zat tersebut masih dimasak.
- (), . — , ( , ) , . , - Gaussian, « ». … 1 2 , .. - .
- , /Vis, .
- Dalam visualisator molekuler standar, seperti (indah) GaussView gambar-gambar indah digambar, tetapi selalu dalam kualitas buruk.
- Tidak ada kesimpulan substantif yang diambil: “kami banyak bereksperimen, menghitung banyak, membawa meja dan gambar ⇒ kami hebat, beri kami permen. ”
Tapi dari favorit saya: artikelM. Govindarajan, M. Karabacak, FT-IR, FT-Raman dan investigasi spektral UV; analisis estimasi frekuensi yang dikomputasi dan perhitungan struktur elektronik pada 1-nitronaphthalene // Spectrochimica Acta Bagian A: Spektroskopi Molekul dan Biomolekul, V. 85 (2012), PP. 251-260,
https://doi.org/10.1016/j.saa.2011.10.002.
Di dalamnya, spektrum dalam fase padat direkam dengan bodoh, dan kemudian ditafsirkan berdasarkan perhitungan biasa-biasa saja dalam model HO dalam fase gas. Tetapi triknya adalah bahwa mereka bahkan tidak dapat membuat perhitungan normal,
yang mereka tunjukkan dengan sopan di komentar pada artikel tersebut .
Namun, istilah "karya Hindu" (seperti istilah "
kode Hindu ") merujuk jauh dari hanya karya yang berasal dari anak benua misterius yang bersesuaian.
Jika Anda pergi ke situs indah
Cyberleninka , maka
Anda melihat Abyss, dan Abyss melihat Anda, Anda dapat menemukan banyak hal menarik. Dengan mencari "kuantum-kimia" (dengan / tanpa syarat tambahan "rsa"), adalah mungkin untuk menemukan banyak hal berguna. Karena sejumlah besar karya "kimia kuantum" dikhususkan untuk mempelajari kuda bulat dalam ruang hampa (yaitu, perhitungan tanpa mengacu pada kenyataan), mereka tidak terkait dengan teks ini. Namun di antara mereka, tiga karya ini hilang:
Saya sangat senang dengan yang terakhir, karena "penilaian kecukupan" adalah perbandingan struktur yang tidak memadai dalam fase yang berbeda (gas vs kristal) dan dengan makna yang berbeda (
r e vs.
r a l p h a ) - ini benar-benar ketinggian kecukupan.
Apakah itu terjadi di majalah yang bagus?
Ya, ada "kesalahan" di sana.
Jangan takut, semuanya berakhir dengan baik!Untungnya, dalam cerita yang sekarang akan kita bahas, sikap ceroboh terhadap nilai-nilai eksperimental / teoritis tidak mengarah pada konsekuensi serius dan mengerikan. Dan pekerjaan itu, meski dihilangkan, tidak kehilangan kesejukan dan signifikansinya.
Selain itu, pada akhirnya semuanya berakhir pada super umum: publikasi artikel yang luar biasa di mana keadilan menang.
Kita berbicara tentang salah satu molekul organik dengan ikatan C - C tunggal yang sangat panjang:
1,1'-bisdiadamantane :

Mengapa molekul ini keren?Jika Anda melihat buku teks sekolah atau
universitas tentang kimia, pada
Wiki (atau
bahkan hanya mengarahkannya ke Google ), kami akan menemukan bahwa panjang standar ikatan C - C tunggal adalah 1,54 Å.
Jadi, panjang eksperimental dari ikatan tunggal pusat di 1,1'-bisdiadamantane
re=1,630 pm0,005 Å, hampir 0,08 Å lebih lama (ini adalah dofiga)!
Perpanjangan ikatan C-C tunggal ini terjadi karena dua keping intan yang dimiliki ikatan ini sangat besar, sehingga saling tolak. Tetapi, seperti yang kita ingat dari contoh Ferrocene, kita juga memiliki daya tarik karena gaya dispersi (London). Dan karena ukuran molekulnya yang sakit, ada daya tarik dispersi yang besar di antara potongan-potongannya. Itu tidak memungkinkan ikatan pusat ini putus, sehingga molekul ini dapat (relatif mudah) menguap tanpa memutusnya di sepanjang jalan.
Koneksi unary sentral C - C sangat panjang, dan karena itu sangat menarik untuk membandingkan bagaimana metode teoritis mereproduksi kenyataan. Dan kenyataannya ada di artikel pertama, ini dia:
Sial!Artikel pertama adalah di Nature, majalah paling keren, dan yang kedua di JACS, majalah kimia murni yang paling dihormati !!! Hanya sedikit orang yang memimpikan hal ini, tetapi kolaborasi ilmiah Jerman-Ukraina ini sangat keren.
hanya diwakili oleh data kristalografi. Sebagai hasilnya, membandingkan hal-hal sulit yang dapat dibandingkan satu sama lain, tanpa membuat koreksi yang
tepat untuk perbedaan parameter, mereka akhirnya sampai pada kesimpulan bahwa panjang ikatan C-C pusat dalam gas adalah 1,655 Å, melampaui 0,02 Å. Dan ini secara signifikan lebih dari kesalahan eksperimental.
Untungnya, pada akhirnya, mereka bekerja sama dengan spesialis dalam masalah ini,
dan pada akhirnya menerima jawaban yang benar (
ringkasan populer singkat dari karya ini juga dapat ditemukan di N +1 ).
Apakah Anda perlu perbandingan?

Setelah semua yang saya tulis tentang kebenaran perbandingan, mungkin timbul pertanyaan yang masuk akal: apakah perlu membandingkan hasil perhitungan dan hasil eksperimen di antara mereka sendiri?
Itu perlu! Sama seperti yang Anda butuhkan!Ada pernyataan terkenal (yang saya tidak dapat menemukan penulis yang dapat diandalkan):
Tidak ada yang percaya perhitungan teoritis, kecuali orang yang melakukannya.
Semua orang percaya hasil eksperimen, kecuali yang mendapatkannya.
Diterjemahkan ke dalam bahasa Rusia, kedengarannya seperti: Tidak ada yang percaya perhitungan teoretis, kecuali orang yang membuatnya, tetapi semua orang percaya pada data eksperimen, kecuali orang yang menerimanya.
Tetapi dalam sains, semua orang perlu meyakini (baik, atau mayoritas), dan eksperimen adalah satu-satunya ukuran, karena ini menghubungkan apa yang telah kita hitung dengan Realitas.
Ada esai yang luar biasa (akses terbuka) dalam jurnal kimia terpenting kedua tentang topik tentang apa yang harus dilakukan oleh peneliti atau orang biasa yang membaca artikel ilmiah dan / atau berita:
Mata R., Suhm M. // Angew. Chem Int. Ed., 56 (2017), DOI: 10.1002 / anie.201611308(Ngomong-ngomong, saya sudah memberikan tautan ke sana, karena satu gambar, oleh Ricardo Mata, berasal dari artikel ini).
Kesimpulan dari esai ini memberikan rekomendasi untuk ahli teori simulasi dan eksperimen. Saya akan memberikannya di sini (dalam terjemahan dan sedikit revisi) sebagai kata terakhir untuk posting ini.
- Ahli teori harus:
- tidak hanya memberikan metode dan upaya yang berhasil, tetapi juga menggambarkan kegagalan metode (terutama jika metode ini populer),
- jelaskan metodologi Anda dengan baik dan sepenuhnya,
- di mana dimungkinkan untuk memberikan perkiraan (atau deskripsi) kesalahan, dan perkiraan dan penyederhanaan penting yang diterima.
- Para peneliti, pada gilirannya, harus:
- untuk menyodok teori data eksperimental mereka, yang dapat mereka gunakan sebagai tolok ukur (standar),
- untuk menunjukkan data eksperimen komunitas ilmiah yang tidak dapat dipahami, di mana teori (atau eksperimen tambahan) akan membantu dengan penjelasan,
- untuk berbicara di
wilayah asing konferensi teoritis dengan data mereka,
kisah pribadiNgomong-ngomong, saya baru saja bertemu penulis kedua artikel ini, yang merupakan seorang eksperimen, pada simposium teoretis.
- menarik keluar dari data eksperimental Anda hal-hal yang dapat diakses mungkin untuk dibandingkan dengan teori,
Semua perbandingan terbaik dan benar! Dan ingat: hanya dia yang tidak melakukan apa pun yang tidak salah.
PS
Sebagai kata penutup, saya ingin memberikan daftar kecil basis data di mana Anda dapat menggali berbagai data eksperimental untuk molekul.
Databanks Struktural
Kaleng kristalografi
Cara termudah untuk menentukan struktur molekul dalam kristal adalah karena PCA adalah rutin. Karenanya, jika Anda tidak tahu seperti apa bentuk molekulnya, silakan pergi ke bank data kristalografi (tempat di mana hampir semua struktur zat yang pernah dijejalkan ke goniometer dan diterangi oleh seberkas partikel gelombang pendek dikumpulkan). Karena ada banyak bank seperti itu, saya hanya akan memberikan yang paling terkenal (daftar yang lebih lengkap dapat ditemukan di
Wiki ).
- Database Struktur Kristal Anorganik ( ICSD ). Ini bukan sepenuhnya tentang molekul, di sana Anda terutama dapat menemukan struktur garam yang berbeda, logam, keramik, dll. Basis ini didukung oleh Universitas Teknologi Karlsruhev, oleh karena itu akses ke sana dibayar dan tidak murah. Tetapi jika itu, situsnya .
- Cambridge Structural Database ( CSD ). Mungkin basis kristalografi terbesar di dunia. Hampir sejuta struktur! Ini terutama kristal molekul organik dan organologam. Dan basis data ini gratis! Untuk menambahkan. biaya, tentu saja, Anda bisa mendapatkan opsi keren, seperti pencarian pada struktur molekul yang ditarik, tetapi ini sudah surplus. Situs
- Database Terbuka Kristalografi ( COD ). Nah, juga semacam database. Apa yang ada di sana, saya tidak benar-benar tahu, tetapi setidaknya itu ada. Situs
- Nah, bagi yang tertarik dengan biologi, ada Protein Data Bank ( PDB ). Basis data terbuka tempat Anda dapat mengunduh struktur protein besar dan menakutkan (tetapi dalam kristal). Situs
Struktur molekul dalam gas
Di sini segalanya agak lebih buruk, karena percobaan untuk mempelajari struktur molekul bebas jauh lebih rumit, baik untuk melakukan (paling tidak diperlukan ruang hampa tinggi) dan untuk interpretasi.
Oleh karena itu, ada jauh lebih sedikit basis data.
- Basis data terbesar untuk molekul bebas adalah DOKumentasi MOlecular GAsphase (atau MOGADOC ). Itu berbasis di Universitas Ulm, dan merupakan investasi yang sangat mahal. Tetapi, jika ada, situs itu ada di sini .
- Jika Anda ingin mengetahui 100% struktur kesetimbangan eksperimental molekul, maka ini adalah Komparasi Kimia Komputasi NIST dan Benchmark DataBase ( CCCBDB ). Hampir semuanya murni eksperimental r e -struktur dapat ditemukan di sana, tetapi ada cukup nishtyaks lain di sana. Situs
- Benteng terakhir adalah proyek MolWiki yang belum berkembang. Tetapi tidak ada banyak struktur yang dapat ditemukan di sana, hanya yang telah diterima di Universitas Bielefeld, Universitas Negeri Moskow dan ISTU baru-baru ini (dan bahkan kemudian tidak semua). Situs
Di mana menemukan karakteristik spektral molekul?
 Diambil dari xkcd.com
Diambil dari xkcd.comAda lebih banyak database di sini, karena menghapus spektrum tanpa interpretasi adalah tugas yang jauh lebih sederhana daripada mendapatkan struktur (tidak perlu membuat model dan membuktikan bahwa mereka benar). Dan di samping itu, spektra memiliki nilai terapan yang sangat bagus: spektra dapat digunakan untuk menentukan komposisi sampel, apakah itu air dari sungai tetangga, atau sinyal dari awan molekul (atau bahkan dari atmosfer planet ekstrasurya, lihat ilustrasi di atas).
Ya, omong-omong, semua tautan di bagian ini adalah untuk membebaskan basis data.
- NIST Chemistry WebBook . Mungkin buku terbaik di dunia. Dalam database ini, Anda dapat menemukan IR, UV / Vis, spektrum massa untuk sekelompok molekul. Dan juga, parameter termokimia dan bahkan terkadang kinetik! Secara umum, jika seorang ahli kimia tidak tahu tentang keberadaan situs ini, maka ia bukan seorang ahli kimia. Situs
- Database penyerapan molekul transmisi resolusi tinggi ( HITRAN ). Proyek Pusat Astrofisika Harvard-Smithsonian, dari situ jelaslah bahwa spektrum yang diperlihatkan di sana digunakan untuk mengidentifikasi molekul-molekul dalam ruang antarbintang dan antarbintang (misalnya, seperti ini ). Situs
- Mirip dengan yang sebelumnya, proyek Database Cologne untuk Spektroskopi Molekuler, dari bagian astrofisika Universitas Cologne. Situs
- Sebagai contoh terakhir, saya akan memberikan proyek ExoMol . Ini bukan sepenuhnya spektrum eksperimental murni, tetapi ini adalah contoh yang sangat baik dari interaksi teori dan eksperimen: berdasarkan pada data eksperimen presisi tinggi dan perhitungan tingkat yang sangat tinggi, spektrum molekul sederhana diprediksi dalam kondisi yang berbeda (termasuk ekstrim). Penekanan utama di sini adalah pada biomarker, jadi ketika para astronom melihat spektrum planet ekstrasurya, mereka dapat dengan mudah mengidentifikasi molekul yang sudah kita ketahui di dalamnya. Situs
PPS
Jika ada kesalahan / sesuatu tetap tidak bisa dipahami, tulis di komentar - Saya akan memperbaiki / mencoba menjelaskan dengan lebih baik.