Kami telah
memberi tahu Anda tentang mikroRNA yang bersirkulasi, tetapi ada hal lain yang sama-sama keren - DNA yang beredar di luar sel (DNA bebas sel, DNA yang beredar). Dibuka pada tahun 1948. Sekarang minat terhadapnya semakin meningkat, dan inilah faktanya.
DNA ekstraseluler (cfDNA) ditemukan dalam beberapa cairan tubuh: dalam plasma dan serum, urin, saliva, sinovial, cairan peritoneum, dan serebrospinal.
Kami akan mempertimbangkan fitur cfDNA dalam dua cairan: darah dan urin. Jelas bahwa lebih mudah untuk diagnosis.
Sumber cfDNA di dalam tubuh
Seperti diketahui, cfDNA beredar dalam darah sebagai bagian dari tubuh apoptosis, mikrovesikel, nukleosom, eksosom, nukleoprotein kompleks dengan protein darah dan, mungkin, dalam bentuk bebas.
Dipercayai bahwa penyebab cfDNA dalam darah adalah proses kematian sel, pematangan sel darah merah, sekresi DNA oleh sel, serta bakteri dan virus. Kami segera mencatat bahwa sumber terakhir, DNA bakteri dan virus, memberikan kontribusi yang sangat tidak signifikan terhadap kumpulan total DNA yang beredar, dan tingkat DNA eksogen selama infeksi tidak melebihi beberapa puluh pkg / ml. Padahal, menurut data modern, tingkat normal cfDNA dalam tubuh yang sehat adalah 3-44 ng / ml dalam plasma dan 50-100 ng / ml dalam serum darah.
Bagian penting dari cfDNA dalam tubuh kemungkinan hasil dari kematian sel selama apoptosis, nekrosis, dan netosis. Sekitar seratus miliar sel mati setiap hari pada orang dewasa melalui kematian sel terprogram (apoptosis), akibatnya sekitar 1 g DNA terdegradasi per hari.
Dalam proses apoptosis, DNA nuklir dibelah oleh enzim khusus, DNase. Setelah itu, fragmen DNA dengan panjang beberapa nukleosom muncul (180-200 bp, pasangan nukleotida), yang harus dibuang oleh makrofag sebagai bagian dari tubuh apoptosis (kemasan khusus setelah apoptosis). Semua orang tahu bahwa pasangan nukleotida (adenin-timin dan guanin-sitosin) dalam DNA kita diulang tiga miliar kali. Nukleosom adalah struktur khusus dalam kromatin, yang terdiri dari protein histon, di mana untai DNA terluka satu setengah putaran.
Kemudian hal aneh terjadi. Untuk alasan yang tidak diketahui, bagian dari DNA sel yang mati menghindari pertemuan dengan makrofag dan memasuki aliran darah. Pada waktu yang berbeda, percobaan dilakukan untuk mengkonfirmasi sifat apoptosis cfDNA [1,2].
Ketika cfDNA donor sehat dipisahkan dengan elektroforesis gel, pita yang sesuai dengan panjang fragmen 180-200 bp terdeteksi. dan panjang yang merupakan kelipatan dari angka ini, yang sesuai dengan pembelahan kromatin internucleosome selama apoptosis. Deteksi DNA janin dalam darah ibu juga berbicara mendukung apoptosis sebagai sumber cfDNA [3].
Biasanya, nekrosis membuat kontribusi yang kurang signifikan terhadap penampilan cfDNA, meningkatkan jumlahnya pada cedera parah. CfDNA nekrotik dalam plasma terdeteksi dalam bentuk fragmen yang lebih panjang - panjangnya lebih dari 10 ribu bp. Menggunakan PCR (reaksi berantai polimerase) adalah mungkin untuk membedakan antara fragmen panjang cfDNA yang dihasilkan dari nekrosis dan fragmen yang lebih pendek karena apoptosis.
Selain apoptosis dan nekrosis, ada jenis kematian sel lain yang tidak banyak diketahui, yang merupakan sumber cfDNA - netosis (NETosis).
Dengan netosis, sel-sel neutrofil mengeluarkan struktur mirip-jaringan khusus, perangkap neutrofil ekstraseluler (NET, Neutrophil Extracellular Trap), yang tugasnya untuk menonaktifkan patogen yang telah memasuki tubuh: virus, jamur dan bakteri. Dalam hal ini, neutrofil mati, melemparkan DNA, histones, berbagai protein dan enzim ke ruang ekstraseluler. Diketahui bahwa kadang-kadang proses NET bersifat patologis, berkontribusi pada pengembangan trombosis, penyakit kardiovaskular dan autoimun, serta kanker.
Baru-baru ini, pada tahun 2018, ditemukan bahwa dalam kasus infeksi HIV, neutrofil yang terlalu aktif, mekanisme NET, dan netosis terjadi. Akibatnya, ada kematian yang luas dari sel-sel kekebalan yang ditangkap oleh jaringan neutrofil, sel T CD4 + dan CD8 +, sel B dan monosit, dan pengembangan patologi kardiovaskular bersamaan [4].
Sumber potensial lain dari cfDNA adalah sekresi DNA oleh sel-sel normal dan tumor. Kembali pada tahun 1972, bukti diperoleh dari pelepasan aktif DNA oleh limfosit ke dalam media ekstraseluler [5].
Kehadiran fenomena seperti pelepasan DNA oleh sel ke dalam media ekstraseluler menunjukkan adanya mekanisme khusus untuk transfer DNA melalui membran sel. Dalam perjalanan studi, ditemukan bahwa pelepasan DNA dari limfosit terjadi dengan aksi aktif trypsin, pronase dan plasmin dengan latar belakang kekurangan ion Ca2 + dan Mg2 +. Kelebihan ion kalsium menghambat keluarnya DNA dari sel [6].
Menurut ahli biokimia Rusia dari Kazan State University, kemungkinan lain sumber cfDNA dalam darah mungkin merupakan bentuk DNA sitoplasma yang sama sekali tidak diketahui, berbeda dengan DNA nuklir dan mitokondria - DNA yang terkait dengan membran limfosit diploid manusia (Membrane-Associated DNA dalam Sitoplasma Limfosit Manusia Diploid. Limfosit Manusia) ) [7].
Terlepas dari kenyataan bahwa jenis DNA ini ditemukan pada tahun 1971, itu masih belum diselidiki, dan hanya ada beberapa karya oleh penulis yang sama di dalamnya, meskipun dalam PNAS dan Alam.
Menurut asumsi Abramova Z.I. et al., beberapa bagian cfDNA dapat dibentuk dari DNA sitoplasma ini, seperti yang ditunjukkan oleh fitur karakteristik dari beberapa fragmen cfDNA, berbeda dengan nuklir dan mitokondria [6].
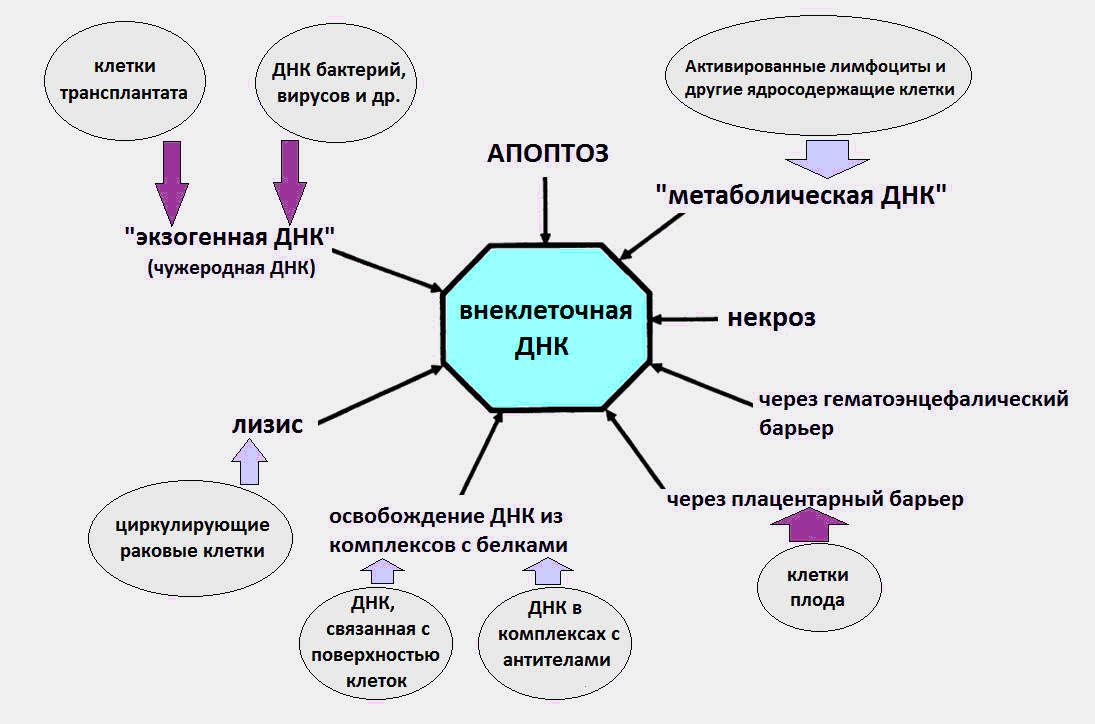 Gambar. 1 Berbagai cara cfDNA memasuki sirkulasi.
Gambar. 1 Berbagai cara cfDNA memasuki sirkulasi.Rincian lebih lanjut tentang semua aspek biologi cfDNA (efek imunomodulator, penerimaan cfDNA pada permukaan sel, dll.) Dapat ditemukan dalam ulasan terperinci oleh Profesor Kozlov V.A. (Research Institute of Clinical Immunology SB RAMS) [8].
DNA ekstraseluler sebagai biomarker untuk berbagai patologi
Logika menunjukkan bahwa kadar cfDNA harus berubah dengan patologi yang menyertai kematian sel massal. Sejumlah penelitian telah menunjukkan peningkatan kadar cfDNA yang signifikan dengan perkembangan penyakit autoimun (lupus erythematosus sistemik, skleroderma sistemik, rheumatoid arthritis, dll.) Dan bahwa ada fitur karakteristik cfDNA yang khas dari patologi autoimun tertentu [8-10].
Diketahui juga bahwa pada infark miokard akut, yang menyertai kematian sel-sel jantung dengan tipe nekrosis dan apoptosis, kadar cfDNA juga meningkat. Dan ini memiliki nilai diagnostik potensial, karena pasien yang mengalami komplikasi memiliki tingkat yang lebih tinggi daripada mereka yang pulih lebih baik [11].
Pada pasien yang mengalami stroke akut, konsentrasi cfDNA dalam plasma darah, diukur dalam 24 jam, berkorelasi dengan tingkat keparahan stroke dan dapat berfungsi sebagai prediktor mortalitas dan keparahan hasil bahkan pada pasien yang tidak memiliki perubahan yang terdeteksi terdeteksi oleh metode neuroimaging [12,13] .
Diketahui bahwa cfDNA ditandai oleh adanya sejumlah besar sekuens guanine-sitosin (GC), yang lebih tahan terhadap kerusakan oleh nuklease daripada fragmen DNA adenin-timin. Dengan demikian, isi urutan gen yang diperkaya GC spesifik - daerah yang ditranskripsi dari pengulangan ribosom - dalam cfDNA beberapa kali lebih tinggi dari isi pengulangan ini dalam DNA nuklir [14].
Dan dalam patologi kronis yang disertai dengan aktivasi kematian sel (penyakit jantung koroner, hipertensi arteri, patologi autoimun), isi urutan penanda kaya-GC dalam fcDNA darah meningkat 10 kali atau lebih [15]. Hal ini memungkinkan untuk menggunakan parameter DNA ribosom yang diperkaya GC sebagai bagian dari cfDNA sebagai biomarker dari proses patologis yang terjadi secara kronis.
Dalam perang melawan kanker, tugasnya adalah mendeteksi tumor sedini mungkin. Di sini, cfDNA sangat menarik sebagai biomarker tumorigenesis.
Mutasi titik pada tumor fcDNA terdeteksi dalam darah pasien jauh sebelum diagnosis dibuat [16].
Tentang tingkat cfDNA dalam onkologi, mencari mutasi spesifik karsinogenesis ccDNA, seperti oncogen KRAS, HER2, BRCA1, APC, PIK3CA, BRAF, dll., Menggunakan DNA mitokondria sebagai penanda dalam ccDNA, mempelajari perubahan genetik dan epigenetik yang khas cfDNA, seperti hipometilasi elemen motil Alu, dalam hal tumor, penggunaan "indeks integritas" cfDNA dan aspek lainnya dapat ditemukan dalam karya-karya Vasilyeva et al., Gonzalez-Masia et al. [17, 18].
Telah ditetapkan bahwa cfDNA ditandai oleh keadaan oksidasi yang jauh lebih kuat di bawah pengaruh spesies oksigen reaktif (ROS) daripada DNA nuklir.
Dengan demikian, kandungan penanda oksidasi DNA yang terkenal, 8-ohodG, dalam komposisi DNA nuklir secara normal dan untuk berbagai patologi bervariasi dari 1 hingga 10 per juta nukleotida, dan isi penanda ini dalam cfDNA adalah 300 atau lebih per juta nukleotida [19].
Peningkatan tajam dalam kandungan 8-oxodG dalam cfDNA didirikan pada onkologi dan penyakit kardiovaskular, yang disertai dengan stres oksidatif, dan dapat mencapai nilai 3000 8-oxodG per juta nukleotida [20].
Secara umum, diyakini bahwa kadar 8-ohdG dalam cfDNA adalah penanda sensitif dari stres oksidatif total dalam tubuh.
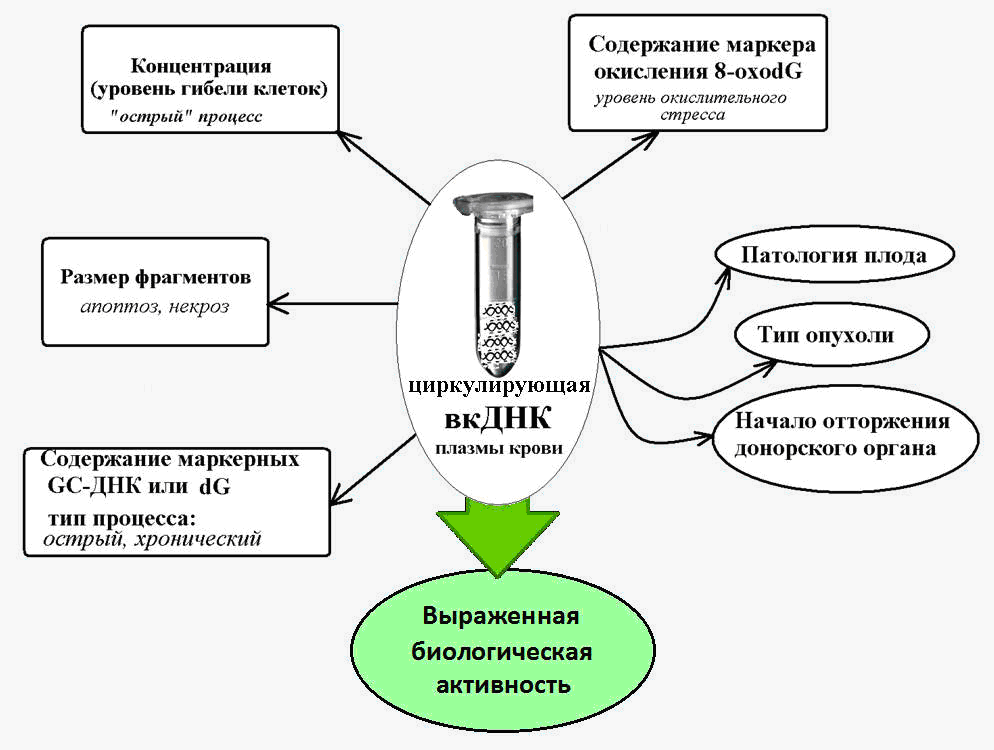 Fig. 2. Sirkulasi DNA ekstraseluler - penanda dalam berbagai kondisi patologis, disertai dengan peningkatan kematian sel.
Fig. 2. Sirkulasi DNA ekstraseluler - penanda dalam berbagai kondisi patologis, disertai dengan peningkatan kematian sel.DNA ekstraseluler sebagai elemen seluler
Terobosan utama dan sangat penting dalam studi tentang peran cfDNA dalam proses internal terjadi 3 tahun lalu. Pada 2015, sekelompok peneliti membuat penemuan menarik, yang menunjukkan bahwa cfDNA, seperti elemen genetik seluler, mampu menyerang DNA nuklir dan menyebabkan mutasi pada genom [21]. Semua ini sangat mengejutkan.
Dalam karya-karya sebelumnya, sudah ditunjukkan bahwa DNA tumor dari darah mungkin memiliki kemampuan untuk diintegrasikan ke dalam DNA nuklir. Fibroblas tikus ditempatkan dalam plasma yang diambil dari pasien dengan kanker usus besar, setelah itu onkogen K-ras dan gen protein p53 yang terlibat dalam apoptosis terdeteksi dalam DNA sel-sel tikus, dan sel-sel itu sendiri onkogen ditransformasikan (menyebabkan kanker pada tikus sehat) [22 ] Ini menunjukkan bahwa DNA dari plasma diserap dan diintegrasikan oleh sel-sel yang ditempatkan di dalamnya. Fenomena yang diduga ini - pengambilan oleh sel-sel onkogen sehat dari vcDNA yang beredar dalam darah - mungkin bertanggung jawab untuk proses metastasis dan disebut "genomeastasis".
Dalam karya lain, data diberikan pada penyerapan dan integrasi fragmen gen DYS14 spesifik untuk kromosom Y di otak seorang wanita yang mengandung janin laki-laki [23].
Dalam sebuah studi tahun 2015, para ilmuwan melacak bagaimana cfDNA berlabel fluoresensi yang diambil dari pasien kanker dan orang sehat dengan mudah dimasukkan ke dalam DNA inti dari fibroblast murine dalam percobaan in vitro (mis., Di luar organisme hidup, dalam kultur sel). Selain itu, cfDNA manusia terlokalisasi dalam inti sel tikus selama beberapa menit, dan hampir 100% inti sel tikus menunjukkan sinyal fluoresen selama 30 menit.
Sekuensing seluruh genom sel-sel tikus menunjukkan adanya fragmen DNA manusia di dalamnya, termasuk elemen seluler khas Alu. Selain itu, penulis menemukan induksi fokus γ-H2AX yang timbul dari kerusakan DNA, serta peningkatan aktivitas caspase-3 dan ekspresi ATM, p53, p21, GADD-34 dan gen ligase DNA. Yang semuanya bersama-sama menunjukkan peningkatan ketidakstabilan genom, aktivasi respon terhadap kerusakan DNA dan apoptosis.
Para penulis kemudian menguji efek vcDNA asing in vivo pada organisme hidup. Tikus diinjeksikan secara intravena dengan cfDNA manusia, fragmen yang kemudian ditemukan di jantung, paru-paru, hati, dan otak tikus yang dikorbankan 7 hari setelah injeksi.
Selain itu, partikel-partikel DNA manusia yang diberikan pada tikus mampu melewati sawar darah-otak dan menembus otak. Seperti dalam kasus sel dalam kultur, pemberian cfDNA intravena menyebabkan induksi γ-H2AX, proapoptotic caspase-3 dan aktivasi respon terhadap kerusakan DNA. Dan itu adalah respon terhadap kerusakan DNA, menurut para ilmuwan, yang memainkan peran sentral dalam integrasi cfDNA ke dalam nuklir.
DNA nuklir menganggap pengenalan ekstraseluler sebagai pemecahan untai ganda dan mulai "menambal" itu sendiri, menggabungkan DNA yang bersirkulasi ke dalam komposisinya: "Aktivasi respons terhadap kerusakan DNA menggabungkan beberapa cfDNA heterogen dan kromatin terfragmentasi ke dalam konateman panjang melalui koneksi non-homolog dari ujung sebagai bagian dari proses pemulihan."
Sebagai hasilnya, penulis sampai pada kesimpulan paradoks: “Menjadi di mana-mana dan terus-menerus terjadi, kerusakan pada DNA nuklir yang disebabkan oleh DNA yang bersirkulasi ekstraseluler dapat menjadi penyebab utama penuaan terkait dengan kelainan penuaan dan kematian akhir tubuh. Jadi, DNA, mungkin, memainkan peran paradoks sebagai penjaga fondasi kehidupan, dan perusak kehidupan itu sendiri. ”
Tak perlu dikatakan, kesimpulan ini sangat bertentangan dengan semua ide tentang penuaan hari ini.
Logika menunjukkan bahwa hipotesis ini akan sesuai dengan ketergantungan berikut: semakin lama kehidupan suatu spesies, semakin sedikit individu dari bentuk DNA ini dan / atau kurang berbahaya untuk spesies ini.
Tetapi sampai studi komparatif semacam itu telah selesai, masih harus diasumsikan bahwa dalam spesies berumur panjang (manusia) dan cfDNA yang berumur pendek diproduksi, mungkin, dalam jumlah yang relatif sebanding. Dan penemuan peningkatan konsentrasi molekul-molekul ini pada orang tua mungkin, sebaliknya, merupakan konsekuensi dari proses penuaan, dan bukan penyebabnya.
Meskipun ini adalah konsekuensi yang bisa memperkuat penyebabnya. Baca artikel Belikov.
Selain itu, penulis penemuan menyarankan menghubungkan cfDNA ke kelas lain dari elemen genetik seluler. Dan kemudian, mungkin, partisipasi luas dalam evolusi proses seperti transfer gen horizontal, baik invertebrata maupun vertebrata yang mewakili dunia hewan, akan mendapatkan penjelasannya. Berkat itulah, menurut salah satu data terbaru, genom manusia dapat meminjam beberapa puluh gen dari spesies lain [24]
Pertanyaan yang sangat penting tetap terbuka: bagaimana tepatnya cfDNA memasuki sel? Hipotesis yang ada termasuk saran bahwa partikel yang mengandung DNA dapat menembus sel melalui pori-pori di membran, serta melalui berbagai jenis endositosis, makropinositosis yang bergantung pada proteoglikan, atau ketika berinteraksi dengan protein membran.
DNA ekstraseluler untuk obesitas, radang, sinar-X, dan berbagai jenis stres
Penemuan lain yang menarik dibuat setahun kemudian oleh para peneliti Jepang. Mereka mampu menggambarkan partisipasi aktif cfDNA, yang muncul dalam darah sebagai akibat dari kematian adiposit pada orang gemuk, dalam pengembangan peradangan dan resistensi insulin. Faktor kunci yang berinteraksi dengan cfDNA dalam proses ini adalah molekul imunitas bawaan seperti reseptor 9 (TLR9) [25].
Bukan tanpa intrik ilmuwan Rusia dari Institut Teofisika dan Eksperimental Biofisika dari Akademi Ilmu Pengetahuan Rusia. Mereka menemukan bahwa iradiasi x-ray dan metformin obat antidiabetes menyebabkan peningkatan ekskresi cfDNA (nuklir dan mitokondria) urin pada tikus.
Data mereka menunjukkan bahwa sebelum percobaan, jumlah cfDNA nuklir 40% lebih tinggi, dan fcDNA mitokondria 50% lebih tinggi dalam urin tikus tua dibandingkan dengan tikus muda.
12 jam setelah iradiasi, kandungan i-fccDNA dan mt-fcDNA dalam urin tikus muda masing-masing meningkat 200% dan 460%, dibandingkan dengan kontrol, sedangkan pada urin tikus tua meningkat 250% dan 720%.
6 jam setelah pemberian metformin ke tikus lain, jumlah i-cfDNA dan mt-fcDNA dalam urin tikus muda meningkat sebesar 25% dan 55% dan sebesar 50% dan 160% dalam urin tikus tua.
Menurut penulis, data ini menunjukkan bahwa sinar-X dan metformin menyebabkan peningkatan cfDNA yang signifikan dalam urin tikus (terutama yang lama), yang disebabkan oleh kematian sel aktif dalam jaringan. Hasil ini juga menunjukkan bahwa metformin dapat bertindak sebagai senolitik, memulai kematian sel-sel tua yang mengandung gangguan struktural dan fungsional [26].
Pada Oktober tahun lalu, para ilmuwan melacak hubungan tingkat cfDNA dengan tekanan mental dan aktivitas fisik pada orang muda berusia 18-36 tahun.
Hasilnya menunjukkan peningkatan dua kali lipat dalam cfDNA setelah stres laboratorium psikososial akut (TSST) dan peningkatan lima kali lipat dalam cfDNA setelah berolahraga di treadmill (dengan pencapaian kelelahan treadmill).Peningkatan jumlah fragmen cfDNA yang lebih pendek, karakteristik apoptosis, dalam darah setelah kelelahan fisik juga dicatat.DNA mitokondria ekstraseluler menunjukkan peningkatan yang sama setelah kedua beban stres. Selain itu, profil metilasi cfDNA yang digunakan dalam pekerjaan ini sebagai penanda untuk asal seluler yang berbeda secara signifikan berbeda untuk tes stres yang berbeda.Untuk analisis metilasi, para ilmuwan memilih gen HOXA5 yang terlibat aktif dalam perkembangan embrionik karena kekhususan metilasi dalam berbagai jenis sel. Jadi, ini ditandai dengan hipermetilasi dalam sel otot, hipometilasi dalam sel otak, dari garis sel hippocampus dan neuron yang dikultur, dan metilasi diferensial dalam sel darah.Metilasi gen HOXA5 dalam cfDNA menurun segera setelah stres psikososial dan meningkat setelah stres fisik, yang, menurut penulis, menunjukkan berbagai sumber seluler pelepasan DNA nuklir aktif. [27]DNA dan Penuaan Ekstraseluler
Sekarang yang utama. Pertimbangkan hubungan antara level dan fitur spesifik cfDNA dengan penuaan.Karya-karya pertama yang menunjukkan hubungan ini diterbitkan pada 2011-13. Ahli mikrobiologi dan imunologi Finlandia dari University of Tampere mempelajari nilai-nilai cfDNA pada usia panjang lebih dari 90 tahun, peserta dalam studi Vitality 90+, dan orang muda (usia 22-37 tahun) sebagai kelompok kontrol.Hasil penelitian mereka menunjukkan bahwa konsentrasi cfDNA dalam hati jauh lebih tinggi secara signifikan daripada yang muda. Ada juga perbedaan karakteristik dalam cfDNA: pada orang tua itu lebih diwakili oleh fragmen dengan berat molekul rendah, pada orang muda itu diwakili oleh fragmen dengan berat molekul lebih tinggi, yaitu lebih lama.Dalam studi berikut, kelompok yang sama menunjukkan bahwa kadar cfDNA memiliki hubungan yang jelas dengan penanda peradangan (berkorelasi positif dengan kadar protein C-reaktif, serum amiloid A (SAA), dll.) Dan kematian pada orang di atas 90 tahun. Dan juga fakta bahwa level cfDNA total dan hypomethylated yang lebih tinggi dikaitkan dengan peradangan sistemik dan perkembangan asthenia pikun (kelemahan) [28-30].Dua dari penelitian terbaru tentang cfDNA dan penuaan menunjukkan perubahan epigenetik yang khas pada DNA ini.Di salah satu dari mereka, tim ilmuwan menganalisis bagaimana metilasi elemen genetik seluler LINE-1 dan Alu dalam cfDNA orang sehat berusia 23 hingga 61 berubah seiring bertambahnya usia.Elemen LINE-1 memiliki panjang sekitar 6 ribu bp, sedangkan fragmen cfDNA dengan berat molekul tinggi, sebagai perbandingan, memiliki ukuran lebih dari 10 ribu bpLINE-1 mengacu pada retroelements, mis. ke elemen seluler yang menggunakan transkripsi terbalik untuk reproduksi mereka, transfer informasi genetik dari RNA ke DNA. LINE-1 adalah satu-satunya elemen seluler dari genom yang dikenal saat ini yang mempertahankan kemampuan untuk mereproduksi dan memindahkan salinannya dalam genom. Juga, ini adalah struktur seluler manusia yang paling banyak: salinan LINE-1 menempati sebagian besar dalam DNA - seperlima dari seluruh genom.Elemen kedua, Alu, tidak dapat melipatgandakan dan membuat insersi baru ke dalam genom sendiri, dan dalam proses ini tergantung pada perangkat genetik elemen LINE-1 (untuk rincian lebih lanjut tentang elemen genom retro, lihat artikel di Mekanika Populer " Retrovirus:" kolom kelima DNA ").Hasil penelitian menunjukkan bahwa dengan penuaan, ada penurunan yang signifikan dalam metilasi retroelemen LINE-1 dan Alu, dan proses ini terasa lebih kuat pada perokok.Seperti yang ditemukan hari ini, aktivitas unsur-unsur LINE-1 dan Alu, yang mampu memasukkan salinannya ke dalam genom, berkontribusi pada sebagian besar penyakit genetik manusia dan kanker. Lebih dari 100 insersi yang dimediasi oleh LINE-1 (insersi) yang mengarah pada penyakit genetik manusia telah diketahui, dan beberapa insersi LINE-1 yang mengganggu gen penekan tumor dan memicu kanker telah ditemukan [31].Dalam studi kedua, para ilmuwan mengkonfirmasi penurunan metilasi elemen LINE-1 dan Alu pada cfDNA seiring bertambahnya usia. Selain itu, di antara 4 kelompok dalam penelitian ini (orang tua yang sehat lebih dari 100 orang, orang tua yang tidak sehat lebih dari 100 tahun, orang tua (71 tahun) dan orang muda (25 tahun)), orang tua sehat dengan orang muda dan orang tua dengan orang tua yang tidak sehat memiliki karakteristik yang sama:“Secara terus-menerus dalam penelitian kami, kami mencatat kesamaan yang lebih besar dalam profil cfDNA, baik secara global maupun lokal, antara orang muda dan orang tua yang sehat, tidak seperti orang tua dan orang yang tidak sehat. Oleh karena itu, penelitian kami menunjukkan bahwa profil fcDNA dapat digunakan tidak hanya sebagai biomarker usia, tetapi juga sebagai prediktor kesehatan secara keseluruhan. " [32]Jadi, sirkulasi DNA ekstraseluler ternyata terkait erat dengan keadaan kesehatan dan proses yang terjadi dalam tubuh selama penuaan: stres oksidatif, peradangan, dan patologi terkait usia.Metode penelitian modern, seperti PCR kuantitatif waktu nyata, memungkinkan penggunaan cfDNA sebagai biomarker yang sangat sensitif dari proses yang berkaitan dengan penuaan.Penelitian telah menunjukkan potensi besar nilai analisis cfDNA dalam diagnosis kanker, transplantasi, penyakit kardiovaskular dan ginjal, fibrosis, diagnostik prenatal (selama kehamilan), cedera dan sepsis, serta obat-obatan olahraga.Data yang diperoleh bahwa cfDNA dapat menunjukkan sifat-sifat elemen bergerak dan berintegrasi ke dalam DNA nuklir, sehingga mempengaruhi perkembangan patologi yang terkait dengan mutasi dan penuaan secara umum, juga merupakan hal yang tidak diragukan menarik.Semua ini membutuhkan penelitian dan penyempurnaan lebih lanjut.Ulasan ini disiapkan oleh: Alexey Rzheshevsky dan Mikhail Batin kecilReferensi- Jahr S, Hentze H, Englisch S, Hardt D, Fackelmayer FO, Hesch RD, Knippers R. DNA fragments in the blood plasma of cancer patients: quantitations and evidence for their origin from apoptotic and necrotic cells. Cancer Res. 2001 Feb 15;61(4):1659-65.
- Deligezer U1, Yaman F, Erten N, Dalay N. Frequent copresence of methylated DNA and fragmented nucleosomal DNA in plasma of lymphoma patients. Clin Chim Acta. 2003 Sep;335(1-2):89-94.
- Bishoff FZ, Dang D., Horne C., Marquez-Do D., Brincley WR, Levis DE Fetal DNA in maternal plasma circulates as apoptotic bodies: elucidations of structural nature of fetal DNA for non-invasive prenatal genetic diagnosis // Am. J. Hum. Genet. 2003. V. 73. P. 189.
- Sivanandham R, Brocca-Cofano E, Krampe N, Falwell E, Venkatraman SMK, Ribeiro RM, Apetrei C, Pandrea. Neutrophil extracellular trap production contributes to pathogenesis in SIV-infected nonhuman primates. J Clin Invest. 2018 Nov 1;128(11):5178-5183.
- Rogers JC, Boldt D., Kornfeld S. Excretion of deoxyribonuclein acid by lymphocytes stimulated with phytohemagglutinin or antigen // Proc. Nat. Acad. Sci. USA. 1972. V. 69, No 7. P. 1685–1689.
- ., .. . 2007. . .149, .23-32.
- Lerner RA, Meinke W., Goldstein DA Membrane-associated DNA in the cytoplasm of diploid human lymphocytes // Proc. Nat. Acad. Sci. USA. 1971. V. 68, No 6. P. 1212–1216.
- .. . . 2013;15(5):399-412.
- Galeazzi M, Morozzi G, Piccini M, Chen J, Bellisai F, Fineschi S, Marcolongo R. Dosage and characterization of circulating DNA: present usage and possible applications in systemic autoimmune disorders. Autoimmun Rev 2003;2:50-5.
- Leon SA, Revach M, Ehrlich GE, Adler R, Petersen V, Shapiro B. DNA in synovial fluid and the circulation of patients with arthritis. Arthritis Rheum 1981;24:1142-50.
- Destouni A, Vrettou C, Antonatos D, Chouliaras G, Traeger-Synodinos J, Patsilinakos S, et al. Cell-free DNA levels in acute myocardial infarction patients during hospitalization. Acta Cardiol 2009;64:51-7.
- Rainer TH, Wong LKS, Lam W, Yuen E, Lam NYL, Metreweli C, Lo YMD. Prognostic Use of Circulating Plasma Nucleic Acid Concentrations in Patients with Acute Stroke. Clin Chem 2003; 49:562-9.
- Lam NY, Rainer TH, Wong LK, Lam W, Lo YM. Plasma DNA as a prognostic marker for stroke patients with negative neuroimaging within the first 24 h of symptom onset. Resuscitation 2006; 68:71-8.
- .., .., .., .., .., .., .., .., .., .., — , , 2008, : 54(1), 78-93.
- Bulicheva, N. et al. Effect of cell-free DNA of patients with cardiomyopathy and rDNA on the frequency of contraction of electrically paced neonatal rat ventricular myocytes in culture. Ann NY Acad Sci. 2008. V. 1137. P. 273-277.
- Lecomte, T. Circulating free tumor DNA and colorectal cancer/ T. Lecomte, N. Ceze, E.
- Dorval, P. Laurent-Puig // Gastroenterol Clin Biol. 2010. V. 34. № 12. P. 662- 681.
- ., .. . . 2013.-N 6.-.673-681
- Gonzalez-Masia, JA et al. Circulating nucleic acids in plasma and serum (CNAPS): applications in oncology. Onco Targets Ther. 2013. V. 8. № 6. P. 819-32.
- Ermakov, AV et al. Oxidized extracellular DNA as a stress signal in human cells. Oxid Med Cell Longev. 2013. V. 2013. P. 649-747.
- Loseva, P. et al. Extracellular DNA oxidation stimulates activation of NRF2 and reduces the
- production of ROS in human mesenchymal stem cells. Expert Opin. Biol. Th. 2012. V.12. № 1. P. 85-97.
- Mittra I, Khare NK, Raghuram GV, et al. Circulating nucleic acids damage DNA of healthy cells by integrating into their genomes. J Biosci. 2015;40(1):91–111.
- Garcia‐Olmo DC, Dominguez C, Garcia‐Arranz M, Anker P, Stroun M, Garcia‐Verdugo JM, Garcia‐Olmo D (2010) Cell‐free nucleic acids circulating in the plasma of colorectal cancer patients induce the oncogenic transformation of susceptible cultured cells. Cancer Res. 70, 560–567
- Chan W, Gurnot C, Montine TJ, Sonnen JA, Guthrie KA, Lee Nelson J (2012) Male Microchimerism in the Human Female Brain. PLoS ONE 7, e45592.
- Crisp A, Boschetti C, Perry M, et al.: Expression of multiple horizontally acquired genes is a hallmark of both vertebrate and invertebrate genomes. Genome Biol. 2015;16:50. 10.1186/s13059-015-0607-3
- Sachiko Nishimoto, Daiju Fukuda et al. Obesity-induced DNA released from adipocytes stimulates chronic adipose tissue inflammation and insulin resistance. Sci Adv. 2016 Mar; 2(3): e1501332.
- Gaziev A, Abdullaev S, Minkabirova G, Kamenskikh K. X-rays and metformin cause increased urinary excretion of cell-free nuclear and mitochondrial DNA in aged rats. J Circ Biomark. 2016 Oct 25; 5:1849454416670782.
- Hummel EM, Hessas E, Müller S, Beiter T, Fisch M, Eibl A, Wolf OT, Giebel B, Platen P, Kumsta R, Moser DA Transl Psychiatry. 2018 Oct 29;8(1):236.
- Jylhävä J1, Kotipelto T, Raitala A, Jylhä M, Hervonen A, Hurme M. Aging is associated with quantitative and qualitative changes in circulating cell-free DNA: the Vitality 90+ study.
- Mech Ageing Dev. 2011 Jan-Feb;132(1-2):20-6.
- Jylhävä J1, Jylhä M, Lehtimäki T, Hervonen A, Hurme M. Circulating cell-free DNA is associated with mortality and inflammatory markers in nonagenarians: the Vitality 90+ Study. Exp Gerontol. 2012 May;47(5):372-8.
- Jylhävä J1, Nevalainen T, Marttila S, Jylhä M, Hervonen A, Hurme M. Characterization of the role of distinct plasma cell-free DNA species in age-associated inflammation and frailty. Aging Cell. 2013 Jun;12(3):388-97.
- Lars Erichsen,a Agnes Beermann et al. Genome-wide hypomethylation of LINE-1 and Alu retroelements in cell-free DNA of blood is an epigenetic biomarker of human aging. Saudi J Biol Sci. 2018 Sep; 25(6): 1220–1226.
- Teo YV, Capri M, Morsiani C, Pizza G, Faria AMC, Franceschi C, Neretti N. Cell-free DNA as a biomarker of aging. Aging Cell. 2019 Feb;18(1):e12890.