Monin Ilya Alekseevich, ctn
imoninpgd@gmail.com
Model atom dengan Nucleus besar sebanding dengan ukuran Atom secara keseluruhan.
Saat ini, dalam Fisika, model atom Rutherford-Bohr dianggap diakui secara universal, di mana nukleus kecil, berat, bermuatan positif dikelilingi oleh cangkang elektron yang hampir tidak berbobot, sedangkan ukuran cangkang elektron 1000 kali lebih besar dari ukuran nukleus.
Model atom Rutherford-Bohr memiliki banyak kekurangan inheren yang telah didiamkan selama 100 tahun sejak awal.
Satu-satunya hal yang menjelaskan model atom Rutherford-Bohr adalah pengalaman menaburkan fluks partikel alfa pada kertas emas tipis. Dari mana kesimpulan diambil tentang ukuran kecil dari inti positif yang semakin menghilang dalam komposisi atom besar yang diisi dengan kekosongan kulit elektron.
Dan bagaimana model Rutherford menjelaskan keberadaan padatan dengan kepadatan tetap?
Dan sama sekali tidak menjelaskan sifat-sifat zat nyata yang kita kenal dari kehidupan sehari-hari.
Karena alasan inilah saya harus menyusun model struktur atom saya sendiri.
Tak satu pun dari model yang ada dapat menjelaskan semuanya sekaligus.
Dalam model saya, saya tidak menjelaskan hamburan partikel alfa dalam percobaan Rutherford.
Nah, model Rutherford hanya menjelaskan satu pengalaman hamburan partikel alfa pada kertas emas, tetapi tidak dapat menjelaskan hal lain.
Tapi model saya menjelaskan keberadaan padatan, cairan, gas dan semua transisi fase di antara mereka.
Dalam model Rutherford-Bohr, benar-benar tidak dapat dipahami pada apa kekuatan zat padat yang ada, di mana semua benda di sekitar kita tersusun, transisi dari padat ke cair dan dari cair ke keadaan gas juga tidak bisa dipahami.
Inilah saatnya untuk mencoba memikirkan kembali model struktur Atom dan menciptakan konsep baru yang akan dapat menjelaskan Kekuatan dari padatan dan elastisitas dari gas yang dijernihkan.
Model Atom baru diusulkan untuk dipertimbangkan, fitur utama di antaranya adalah tesis berikut:
- Inti atom secara praktis bertepatan dalam ukuran dengan batas luar atom;
- Inti atom bukanlah sekelompok nukleon yang kacau (neutron dan proton), tetapi memiliki Struktur-Arsitektur yang sangat jelas, yang bertanggung jawab atas semua sifat fisik dan kimia dari zat sederhana tertentu dari tabel periodik;
- Atom dalam padatan bersentuhan langsung dengan inti padatnya;
- Transisi ke fase yang berbeda (gas padat-cair) dilakukan dengan perubahan posisi relatif nukleon individu (atau unsur-unsurnya) dalam struktur nukleus;
- Konsep "Electronic Atom Shell" dikecualikan dari Model Atom Baru, dan semua interaksi Atom dilakukan melalui kontak langsung nukleus nuklei dan melalui medan Elektrostatik dan Magnetik yang dikenal yang terikat pada nukleon spesifik dalam nukleus.
- Tidak ada partikel terpisah "Elektron" dalam model atom ini.
Inti atom secara praktis bertepatan dalam ukuran dengan batas luar atom. Kebetulan ukuran Nukleus dengan dimensi eksternal Atom memungkinkan seseorang untuk memberikan penjelasan kepada banyak keadaan fase yang sebelumnya tidak dapat dijelaskan, yaitu zat padat, cair, dan gas.
Zat padat dalam konsep baru dijelaskan oleh Atoms-Nuclei padat langsung dalam kontak satu sama lain. Selain itu, kekuatan tariknya ditentukan oleh tarikan atom-atom individu pada tingkat gaya magnet rentang-pendek dalam inti atom. Nah, kekuatan tekan ditentukan secara eksklusif oleh kekuatan inti atom padat itu sendiri. Kekuatan tekan cenderung tak terhingga, yang dimanifestasikan dalam kenyataan keberadaan benda-benda raksasa yang sangat terkompresi oleh gravitasi, seperti bintang dan planet.
Kasing tekanan satu sisi tidak menciptakan kondisi untuk kompresi komprehensif, dan oleh karena itu atom-atom mulai bergeser satu sama lain di bawah aksi gaya geser dalam arah tegak lurus dari gaya kompresi kerja. Justru kemungkinan pergeseran sedemikian rupa sehingga semua teknologi pembentukan logam (pengepresan, tempa, injakan) didasarkan pada, ketika dimungkinkan untuk menggulung logam kosong menjadi kertas yang sangat tipis di celah sempit di antara rol, atau dimungkinkan untuk meratakan sebuah blank antara cetakan dan tinju ke produk berbentuk seperti kaca. Ini persis bagaimana kaleng bir berdinding tipis dibuat dari pelet-aluminium kosong dengan stamping.
Inti atom memiliki Struktur-Arsitektur yang sangat jelas dan unik, yang bertanggung jawab atas semua sifat fisik dan kimia suatu zat sederhana tertentu dari tabel periodik.
Transisi ke pertimbangan rincian "kecil" dari struktur nukleus memungkinkan kita untuk beralih dari karakteristik Numerik yang tidak signifikan yang ada dari jumlah nukleon dan besarnya muatan menurut tabel periodik ke karakteristik kualitatif informatif Arsitektur Arsitektur Struktur Nukleus, yang harus membawa seluruh rangkaian kimia dan sifat fisik zat sederhana.
Transisi ke keadaan agregat yang berbeda (padat-cair-gas) terjadi ketika posisi relatif nukleon individu dalam struktur nukleus berubah atau nukleon itu sendiri berubah dalam nutria.
Dalam model Atom Rutherford-Bohr, nukleusnya ribuan kali lebih kecil dari ukuran Atom, dan karenanya efek nukleusnya yang kecil terhadap transformasi fasa eksternal sama sekali tidak dipertimbangkan. Dengan peningkatan ribuan kali lipat dalam ukuran nukleus, perannya meningkat tajam pada semua sifat fisik materi, termasuk transisi fase ke berbagai keadaan agregasi. Dalam kontak langsung Nuclei-Atom multi-nukleon besar, jenis interaksi baru muncul, berdasarkan gaya Magnetik dan Elektrostatik yang telah lama dikenal.
Dengan kontak dekat Nuclei, diperbesar ke batas luar Atom, fenomena yang sebelumnya diabaikan “Interaksi Elektrostatik dan Magnetik dari Urutan Jangka Pendek” mulai muncul, yaitu interaksi muatan Magnetik Kuat dan Listrik nukleon pada jarak dekat dengan ukuran Nukleus dan dengan ukuran nukleon individu.
Model sebelumnya menganggap atom netral secara listrik, dan pemisahan muatan negatif dari kulit elektron dan nukleus positif tidak diperhitungkan.
Dalam model baru, interaksi Atom-Nuklir dapat dipertimbangkan pada tingkat efek lokal konvergensi dekat kutub dengan nama yang sama dengan dipol inti-spasi internal. Pendekatan semacam itu memungkinkan untuk membuat model Solid pada gaya tarik magnet, serta model status Gas Statis pada gaya tolakan Elektrostatik. Keadaan menengah dalam model fase cair memiliki elemen model fase padat dan gas, yang saling bertentangan dalam celah sempit antara atom.
Gas ada pada gaya tolak dengan nama yang sama Muatan elektrostatik dalam dipol nukleon individu, ketika semua dipol listrik atom diputar ke luar dengan nama yang sama dengan kutub listrik. Dalam hal ini, semua atom gas tetangga dibalut dengan kutub yang sama dari dipol listrik (total atom tetap netral), yang menciptakan tolakan timbal balik elektrostatik lokal mereka. (Gbr. 1, Gbr. 2, Gbr. 3).
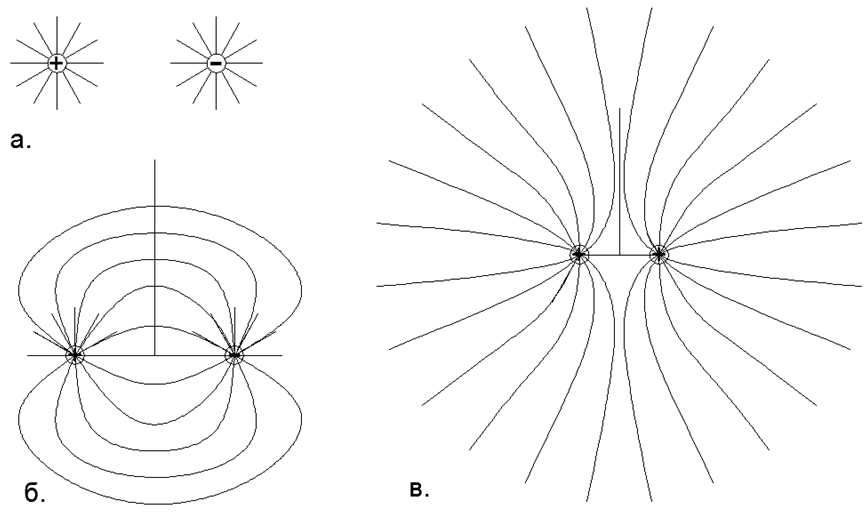 Fig. 1. Interaksi medan muatan titik menurut prinsip superposisi: a) Dua muatan yang terisolasi secara terpisah dengan medan listrik berarah (bola) beraturan, di mana garis-garis gaya terdistribusi secara merata dan meluas secara radial hingga tak terhingga, yaitu, dalam model abstrak bidang-bidangnya tidak berinteraksi; b) Bentuk nyata dari garis-garis gaya dari dua muatan berlawanan yang terletak berdekatan, di mana, sesuai dengan prinsip superposisi, garis-garis gaya dari muatan positif ditutup pada muatan negatif, dan pada tak terhingga muatan total sistem ini dianggap nol dan garis-garis gaya dari dipol tidak menjadi tak terhingga; c) Bentuk nyata dari garis-garis gaya dua muatan homonim tunggal dan satu-dimensi yang berjarak dekat, di mana menurut prinsip superposisi, garis-garis gaya dari muatan yang sama tidak berpotongan, tetapi dipindahkan ke dalam ruang-ruang terpisah, dan pada tak terhingga muatan total sistem ini dianggap sebagai muatan titik nilai ganda.
Fig. 1. Interaksi medan muatan titik menurut prinsip superposisi: a) Dua muatan yang terisolasi secara terpisah dengan medan listrik berarah (bola) beraturan, di mana garis-garis gaya terdistribusi secara merata dan meluas secara radial hingga tak terhingga, yaitu, dalam model abstrak bidang-bidangnya tidak berinteraksi; b) Bentuk nyata dari garis-garis gaya dari dua muatan berlawanan yang terletak berdekatan, di mana, sesuai dengan prinsip superposisi, garis-garis gaya dari muatan positif ditutup pada muatan negatif, dan pada tak terhingga muatan total sistem ini dianggap nol dan garis-garis gaya dari dipol tidak menjadi tak terhingga; c) Bentuk nyata dari garis-garis gaya dua muatan homonim tunggal dan satu-dimensi yang berjarak dekat, di mana menurut prinsip superposisi, garis-garis gaya dari muatan yang sama tidak berpotongan, tetapi dipindahkan ke dalam ruang-ruang terpisah, dan pada tak terhingga muatan total sistem ini dianggap sebagai muatan titik nilai ganda. Yaitu, dari lingkungan makro yang jauh, atom-atom netral nampak seragam netral, sementara dalam urutan jangka pendek dengan atom-atom tetangga, gas-gas tersebut disimpan dalam keadaan yang sama-sama stabil pada gaya-gaya repulsi elektrostatik dengan nama yang sama.
Dalam model “Interaksi Elektrostatik Urutan Jangka Pendek”, molekul gas berhenti bergerak dengan kecepatan yang luar biasa, tetap dalam keadaan istirahat yang kuat secara elektrik, dan suhunya ditentukan semata-mata oleh kekuatan medan elektrostatik dalam urutan interaksi jarak pendek. Perubahan halus dalam suhu gas diwujudkan dengan perubahan sinkron yang halus dalam panjang pundak Dipole-nukleon listrik dalam arah radial atom. Semakin pendek lengan dipol, semakin pendek panjang kelopak mahkota elektrostatik yang dapat dibuatnya.
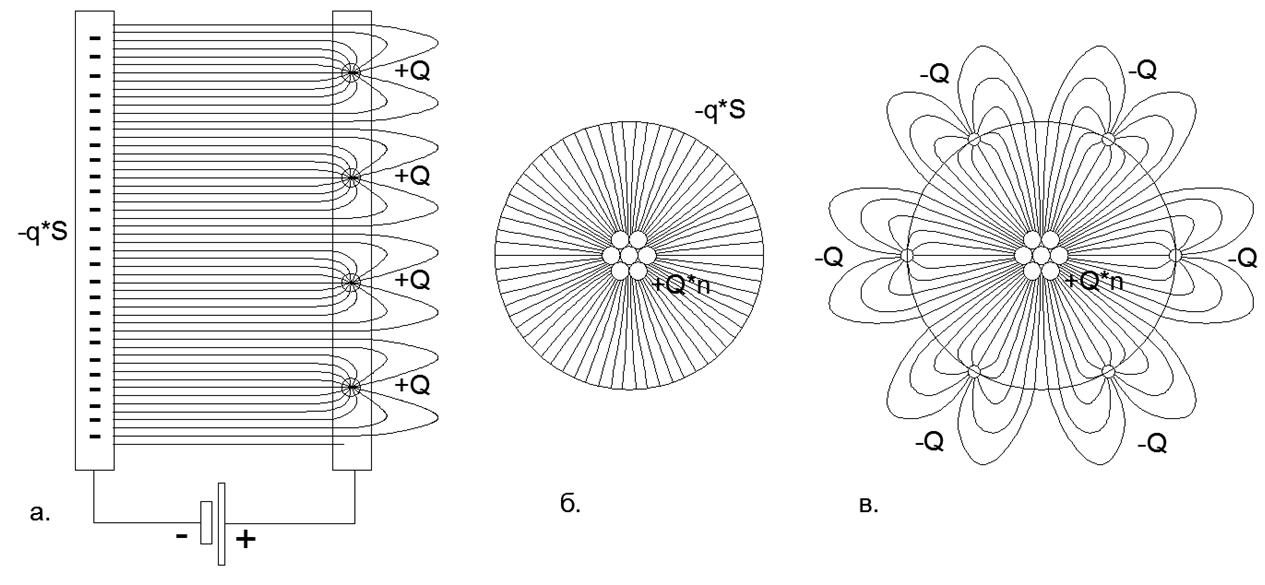 Gambar. 2 Distribusi garis medan listrik dari medan elektrostatik pada pelat kapasitor dengan muatan titik dan terdistribusi: a) Kapasitor datar dengan muatan terdistribusi dari pelat Minus (medan tidak melintasi bidang) dan muatan titik tunggal pada pelat Plus (medan menutup luar celah antara pelat) ; b) Kapasitor bola dengan muatan terdistribusi pada lapisan minus dan muatan titik tunggal pada lapisan plus; c) Kapasitor bola dengan muatan titik tunggal pada lapisan Plus dan muatan titik tunggal pada lapisan Minus (penutupan medan pada muatan eksternal menciptakan kelopak garis medan panjang yang memanjang jauh ke luar angkasa di luar lapisan bola kapas eksternal yang solid dari kapasitor).
Gambar. 2 Distribusi garis medan listrik dari medan elektrostatik pada pelat kapasitor dengan muatan titik dan terdistribusi: a) Kapasitor datar dengan muatan terdistribusi dari pelat Minus (medan tidak melintasi bidang) dan muatan titik tunggal pada pelat Plus (medan menutup luar celah antara pelat) ; b) Kapasitor bola dengan muatan terdistribusi pada lapisan minus dan muatan titik tunggal pada lapisan plus; c) Kapasitor bola dengan muatan titik tunggal pada lapisan Plus dan muatan titik tunggal pada lapisan Minus (penutupan medan pada muatan eksternal menciptakan kelopak garis medan panjang yang memanjang jauh ke luar angkasa di luar lapisan bola kapas eksternal yang solid dari kapasitor).
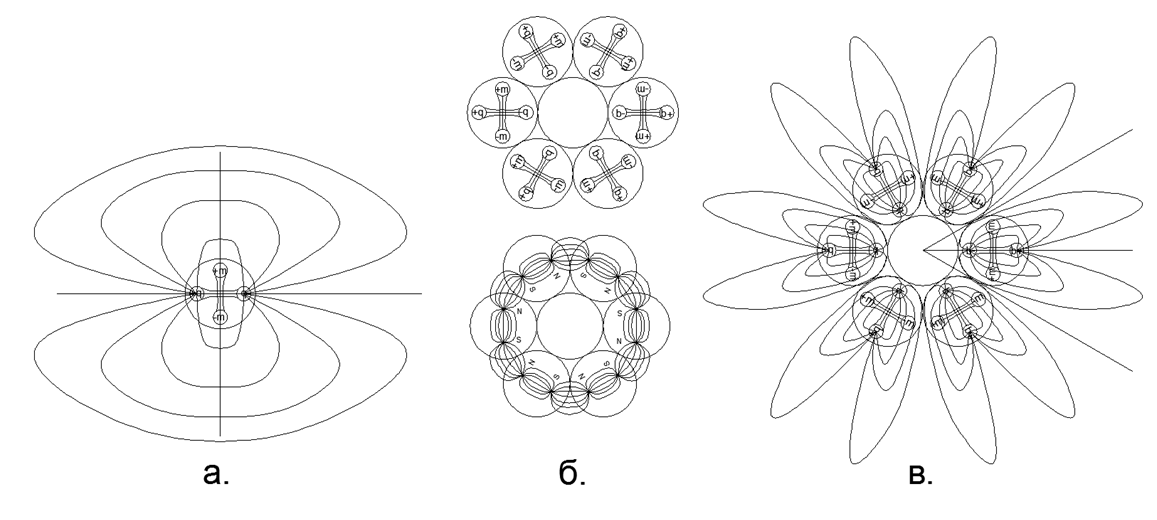 Fig. 3. a) Pemandangan medan listrik dipol dalam komposisi nukleon bebas; b) retensi pada gaya magnet rantai 6 nukleon yang ditutup dalam cincin, sementara garis gaya magnetik sepenuhnya tertutup di dalam cincin dan tidak masuk ke luar angkasa; c) Medan listrik dipol cincin nukleon, membentuk "Mahkota" elektrostatik (dalam hal ini, kelopak garis kekuatan "korona" listrik jauh melampaui batas dimensi atom).
Fig. 3. a) Pemandangan medan listrik dipol dalam komposisi nukleon bebas; b) retensi pada gaya magnet rantai 6 nukleon yang ditutup dalam cincin, sementara garis gaya magnetik sepenuhnya tertutup di dalam cincin dan tidak masuk ke luar angkasa; c) Medan listrik dipol cincin nukleon, membentuk "Mahkota" elektrostatik (dalam hal ini, kelopak garis kekuatan "korona" listrik jauh melampaui batas dimensi atom).Efek tolakan jarak pendek elektrostatik dalam gas dan tarikan magnetik inti dalam fase cair (padatan) dengan baik menjelaskan proses penguapan selama pemanasan bertahap dan kondisi kritis uap oleh saturasi. Jadi, penguapan (keluar dari fase padat atau cair ke keadaan gas) terjadi ketika, ketika atom dipanaskan, dipol elektrostatik nukleon berbalik dengan kutub yang sama sejauh bahwa pada suatu titik tolakan elektrostatik menjadi lebih besar daripada gaya tarik magnet dari atom-atom tetangga. Kondensasi terjadi dalam urutan terbalik: pendinginan atom menyebabkan penurunan intensitas tolakan elektrostatik ketika dipol listrik diputar ke posisi netral.
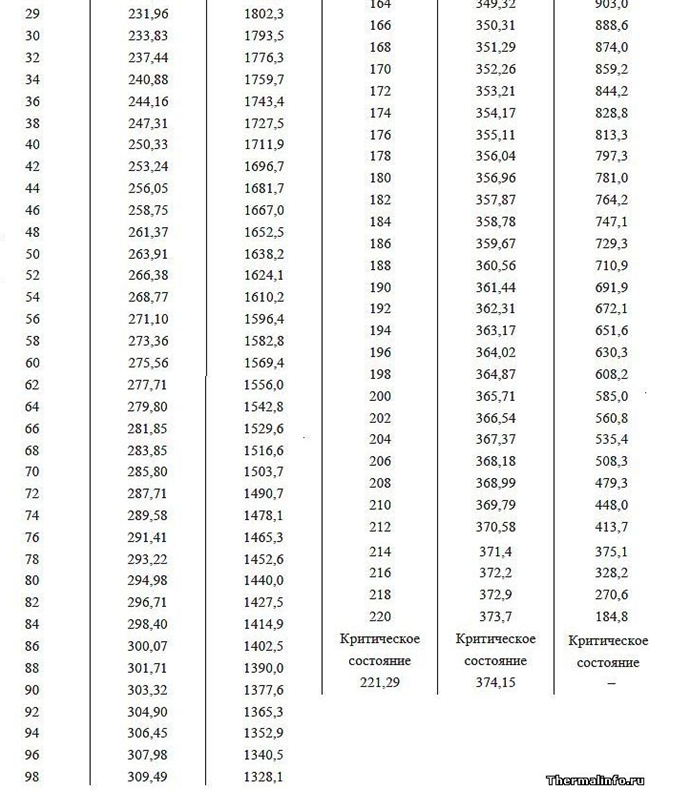
Fungsi kerja (energi penguapan) adalah energi medan tambahan yang dikeluarkan oleh atom selama ekspansi Corona elektrostatik dalam ruang gas kosong. Energi keluaran (panas penguapan) dengan tekanan gas yang meningkat harus turun pada suhu yang sama dari cairan dan gas di atasnya, yang dikonfirmasi oleh contoh ketergantungan nilai panas penguapan pada tekanan udara yang berbeda di sekitarnya (lihat data tabel untuk tekanan di bawah 1 atm di pegunungan tinggi). Juga, dengan meningkatnya tekanan dan titik didih air (data tabular titik didih Air pada tekanan berbeda di atas 1 atm.), Fungsi kerja menurun, yang dijelaskan oleh pengurangan perbedaan ukuran jarak antar molekul dalam fase cair dan gas, sehingga mengurangi volume medan listrik Corona, yang juga menyerap volume medan listrik Corona energi ketika terbuka setelah meninggalkan air padat dalam fase gas yang langka.
Transisi dari keadaan uap ke keadaan es pada suhu negatif harus melewati fase air cair. Pada saat yang sama, lapisan tertipis dari fase cair air dengan suhu di atas Nol Celcius terbentuk di permukaan es yang sudah mengeras, di mana fluks panas dari lipatan bidang molekul air kondensasi didistribusikan. Semakin besar perbedaan dalam suhu es relatif terhadap 0,, semakin tipis lapisan air pada permukaan, karena perbedaan suhu yang besar meningkatkan laju perpindahan panas dalam lapisan es cair, dengan penurunan proporsional dalam ketebalan lapisan air untuk melakukan fluks panas yang diinginkan dari molekul air yang terkondensasi.
Lapisan air tertipis pada permukaan es ketika berinteraksi dengan dukungan dari beban eksternal (sol boot atau runner sled) menciptakan kondisi untuk penampilan "hidroklin" bahkan pada hampir nol kecepatan relatif beban relatif terhadap es. Lapisan air tertipis dengan ketebalan beberapa baris molekuler tidak punya waktu untuk keluar dari celah tipis, sementara viskositas air cair sangat rendah, yang menciptakan kemungkinan tergelincirnya sol di atas es di atas lapisan air "hidroklin".
Jika ketebalan hidroklin dikaitkan dengan penurunan suhu relatif terhadap 0C, maka es yang licin akan berkurang dengan meningkatnya es. Inilah perilaku es yang dapat dilacak dalam praktiknya, ketika luncuran terbesar di jalan terlihat pada suhu mendekati nol Celcius. Pada embun beku yang parah, ketika bergerak di atas es, kontak langsung terbuat dari padat-keras, praktis tanpa pembentukan hidroklin, seolah-olah ada pengaturan molekul instan es dengan sol (ban) dengan pembekuan dukungan ke es.
Menurut beberapa laporan, ketebalan lapisan air pada permukaan es, sama dengan -5 derajat 100 nm, berkurang sepuluh kali pada -35 derajat hingga 10 nm, dan pada -170 derajat umumnya terdiri dari satu lapisan molekul. Jadi, penduduk Kutub Utara mengatakan bahwa menyeret kereta luncur di atas es pada suhu yang sangat rendah sama dengan menyeretnya ke atas pasir (toh, tidak ada cukup pelumasan dalam kasus ini).
 Gbr. 4 Representasi skematis dari zona batas kontak dari berbagai fase Gas-Cair (Air-Udara) dalam kasus Teori Elektro-Statis Gas: a) Gas pada tekanan 1 atm. di atas air cair (jarak antara pusat-pusat molekul sekitar 10 kali lebih besar dari pada fase cair); b) Gas yang sama di atas air pada suhu yang sama, tetapi pada tekanan 10 atm, sedangkan jarak antara pusat-pusat molekul gas berkurang sebesar 10 ^ 1/3 = 2,15 kali. Seseorang dapat dengan jelas melihat deformasi korona elektrik yang berhubungan dengan atom-atom gas ketika molekul-molekul saling mendekati. Garis-garis kekuatan tidak dapat berpotongan, dan karena itu dipaksa untuk berubah bentuk, mengambil volume yang lebih kecil, yang mengarah pada peningkatan kekuatan tolakan timbal balik (peningkatan tekanan gas).Tab. 1. Panas penguapan untuk air, tergantung pada tekanan dan suhu.
Gbr. 4 Representasi skematis dari zona batas kontak dari berbagai fase Gas-Cair (Air-Udara) dalam kasus Teori Elektro-Statis Gas: a) Gas pada tekanan 1 atm. di atas air cair (jarak antara pusat-pusat molekul sekitar 10 kali lebih besar dari pada fase cair); b) Gas yang sama di atas air pada suhu yang sama, tetapi pada tekanan 10 atm, sedangkan jarak antara pusat-pusat molekul gas berkurang sebesar 10 ^ 1/3 = 2,15 kali. Seseorang dapat dengan jelas melihat deformasi korona elektrik yang berhubungan dengan atom-atom gas ketika molekul-molekul saling mendekati. Garis-garis kekuatan tidak dapat berpotongan, dan karena itu dipaksa untuk berubah bentuk, mengambil volume yang lebih kecil, yang mengarah pada peningkatan kekuatan tolakan timbal balik (peningkatan tekanan gas).Tab. 1. Panas penguapan untuk air, tergantung pada tekanan dan suhu.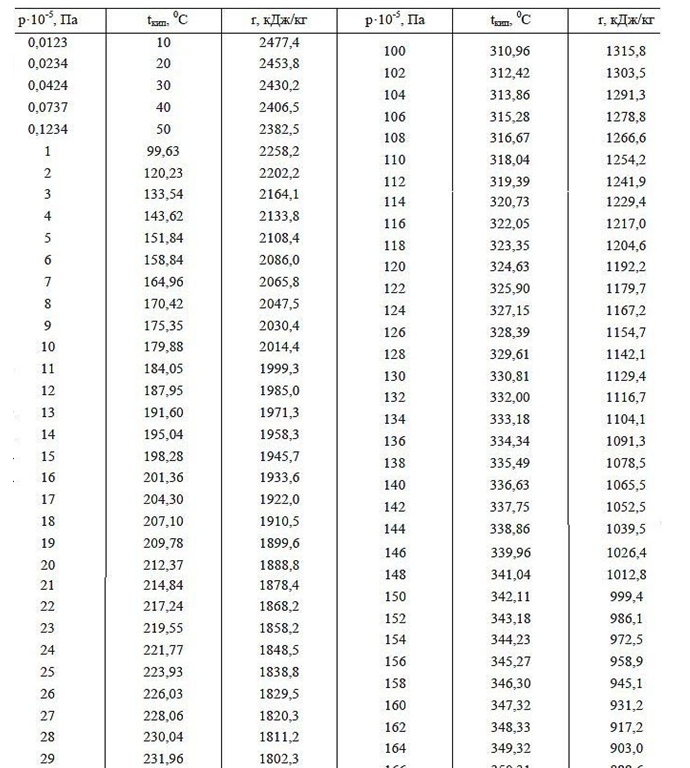
Persamaan yang ada dari keadaan gas ideal (hukum Boyle-Marriott) menggambarkan gas dengan tekanan rendah (kondisi normal) dan suhu tinggi. Tetapi pada tekanan tinggi, hukum ideal ini tidak memungkinkan kita untuk menggambarkan transisi ke cairan, atau bahkan ke keadaan padat.
Hukum Van der Waltz berupaya untuk memperbaiki ketidakkonsistenan dengan memperkenalkan faktor-faktor tambahan, menyesuaikan kurva teoretis dengan ketergantungan yang diperoleh secara eksperimen. Dalam hal ini, penolakan tersembunyi terhadap model atom Rutherford-Bohr terjadi, karena dalam persamaan van der Wals atom diwakili oleh bola padat yang mengisi seluruh volume pada batas luarnya.
Pada saat yang sama, sifat interaksi bola atom tidak dijelaskan secara kualitatif, meninggalkan penjelasan pada tingkat cangkang elektron statistik tanpa bobot di atas nukleolus kecil, sebagaimana seharusnya sesuai dengan model Rutherford-Bohr.
Dalam kasus model yang diusulkan, di mana tolakan permukaan bermuatan serupa terjadi, menjadi mungkin untuk mempertimbangkan Model Statis Pemahaman, di mana setiap elemen model memiliki perwujudan fisik yang dapat dipahami dan makna fisik.
Jadi interaksi dipol diekspresikan oleh rumus paling sederhana interaksi berpasangan langsung untuk muatan empat titik yang dikumpulkan berpasangan dalam dipol kuat mekanis dengan bahu L dan jarak R antara ujung dekat dipol:
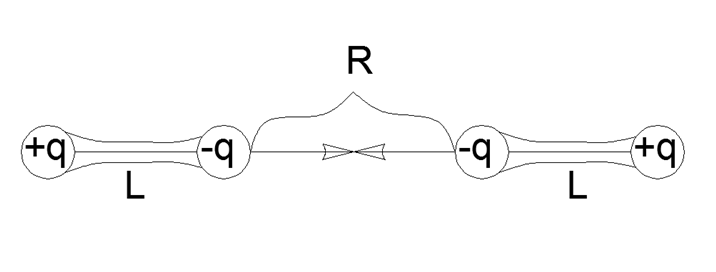
F = K q2 (1 / R2 - 2 / (R + L) 2 + 1 / (R + 2L) 2)
Menuju ke penyebut umum dan membuka tanda kurung dalam pembilang, kita mendapatkan ekspresi yang lebih rumit:
F = K q2 (2R2L2 + 12RL3 + 4L4) / (R2 (R + L) 2 (R + 2L) 2)
Fitur dari model perhitungan untuk dipol adalah bahwa fungsi tolakan dari dipol cenderung tidak jauh dari pusat atom, atau lebih tepatnya, di tepi luarnya, di mana kontak langsung atom dimungkinkan di bawah pengaruh kekuatan yang paling kuat dari tarikan atom magnetik. Ini adalah kontak dari dua perubahan tajam dalam nilai dan berlawanan dalam kekuatan tanda pada batas atom yang memungkinkan kita untuk membuat model Balancing-Attraction atom yang seimbang di antara mereka sendiri.
Ketika R >> L, fungsi tolakan elektrostatik dari dipol disederhanakan menjadi bentuk:
F = K q2 2L2 / R4
Tarikan magnetik memiliki sifat saturasi dan grafik fungsi tidak menuju tak terhingga bahkan dengan kontak langsung atom, oleh karena itu tarikan magnetik akan selalu menemukan titik kesetimbangan dengan tolakan Elektrostatik pada kemiringan hiperbolik curam dari karakteristik Elektrostatik.Tentu saja, jelas bahwa dalam kenyataannya tidak ada gaya yang tak terhingga besar, tetapi ada batas tertentu dari nilai maksimum (misalnya, gaya tarik atom dapat diperkirakan dengan pengukuran langsung dari kekuatan tarik dalam kristal tunggal suatu bahan, dan keterbatasan gaya interaksi elektrostatik ditentukan oleh energi tetap selama pemusnahan Elektron dan Positron). Ketika dua atom bersatu, gaya tolak di beberapa titik juga berhenti tumbuh dengan cepat dan mencapai nilai terbatas tetap tertentu. Dengan demikian, dua nilai tarik-menarik dan keseimbangan tolakan yang tidak terhingga besar pada titik kesetimbangan bersama tertentu, yang dapat ditemukan di persimpangan grafik kedua fungsi ini, ketika memplot grafik dalam satu sistem koordinat. (lihat Grafik 1)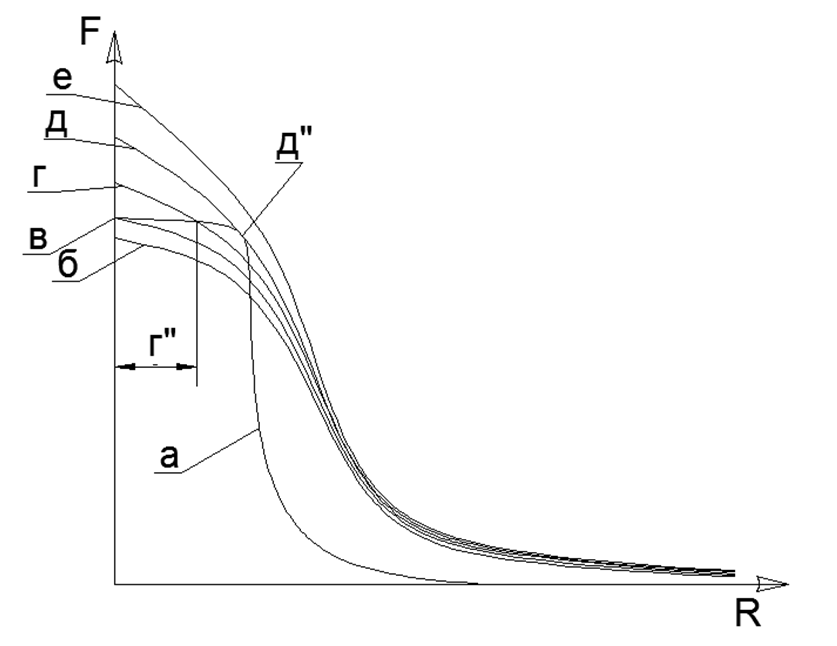 .1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). Persamaan Van der Waltz menarik gambaran yang sangat mirip, tetapi tidak menjelaskan makna fisik dari gaya tarik dan tolakan, sementara secara halus memindahkan zona pertumbuhan asimptotik tak terbatas dari fungsi ke dalam zona tak terjangkau dari pusat atom.Keadaan cair suatu zat adalah saat ketika, pada pemanasan, dipol elektrostatik sudah mulai menolak, tetapi tolakan ini belum mampu memutus ikatan tarikan magnetis atom. Akibatnya, celah kecil muncul antara atom (g "dalam grafik Grafik 1), yang mengarah ke peningkatan tajam dalam mobilitas atom timbal balik pada lapisan" pelumas "elektromagnetik.Lapisan batas Gas Padat terbentuk atas kontak bahan padat berpasangan magnetis dengan atom gas yang tertekan secara elektrostatis. Atom gas tidak dapat mendorong keluar dari padatan dengan korona elektrostatik atom yang dirahasiakan dan ditekan ke permukaan padat. Dengan demikian, lapisan batas atom gas terbentuk, ditekan ke permukaan zat padat. Dalam hal ini, lapisan gas batas masih mampu memukul mundur atom gas lain dari dirinya sendiri, karena lapisan gas batas tetap ditekan secara elektrostatis hingga tingkat yang diperlukan. Kompresi lapisan batas gas (udara) menjadi logam padat menjelaskan penampilan oksida logam yang hampir seketika di permukaan. Kontak lebih lanjut dari lapisan batas gas sudah dilakukan dengan film pelindung oksida pada permukaan logam,melindungi lapisan yang mendasari logam murni dari oksidasi lebih lanjut.Pemodelan dugaan Arsitektur Struktural elemen kimia. Di masa depan, kami mempertimbangkan dugaan model struktur inti atom berbagai zat, di mana bola logam dengan sifat magnetik yang kuat akan menjadi nukleon (nukleon, proton). Interaksi magnetik nukleon memenuhi kriteria noncentralitas dari interaksi gaya nukleon dalam nukleus dan saturasi gaya-gaya ini ketika nukleon saling mendekati, yang telah lama diasumsikan dalam fisika nuklir untuk interaksi nuklir yang kuat.Magnet rare-earth modern memiliki gaya magnet yang sangat tinggi, yang memungkinkan untuk membangun model struktur atom yang masuk akal, hanya mengandalkan kekuatan magnet dari Sharikov-Nuklonov yang memegang sebagai bagian dari inti tunggal dengan Arsitektur yang unik. Dalam hal ini, gaya magnet itu sendiri bertindak sebagai Pengendali Kritis untuk setiap model inti seperti itu, karena jauh dari semua kombinasi spasial bola dapat dirakit dalam bentuk yang stabil karena saling tarik-tolakan bola terpolarisasi.Model masing-masing atom dirakit dari jumlah nukleon yang ditentukan oleh tabel periodik (termasuk semua isotop stabil). Rekonstruksi model dibuat dari bola magnet neodymium dengan diameter 5 mm. Saat ini, bola magnet tersebut dijual sebagai mainan puzzle yang disebut Neocub, yang mencakup 216 bola magnet dengan ukuran yang sama (potongan kubus 6x6x6).Berdasarkan fitur geometris yang diperoleh dari model atom setiap zat sederhana, kami akan mencoba untuk menemukan hubungan logis antara bentuk model atom dan sifat-sifat materi nyata di tingkat makro.Pada tahap awal pemodelan struktur nuklir, beberapa keteraturan terungkap. Jadi bola magnetik cenderung berbaris dalam rantai, dan rantai yang cukup panjang dengan mudah mengunci cincin. Struktur magnetik cincin berubah menjadi sangat kuat dan stabil, sementara medan magnet luar cincin ini menurun tajam, karena hampir semua garis magnetik fluks magnetnya, bola-magnet yang terpisah ditutup melalui bola-bola tetangga dari cincin nukleon-magnetiknya (lihat Gambar 5). Cincin dengan ukuran yang sama (jumlah bola nukleon yang sama) dapat dengan mudah terhubung satu sama lain, membentuk struktur berbentuk pilar yang sangat stabil yang dapat diperluas hampir tanpa batas sepanjang dengan cincin sepadan baru (Gbr. 6).Rantai bola nukleon dapat dihubungkan secara paralel satu sama lain dalam dua versi:
.1. () : (); (), () (''); - () (''); (). R- . (-) () , - , ( ) ( ) (R max - ). Persamaan Van der Waltz menarik gambaran yang sangat mirip, tetapi tidak menjelaskan makna fisik dari gaya tarik dan tolakan, sementara secara halus memindahkan zona pertumbuhan asimptotik tak terbatas dari fungsi ke dalam zona tak terjangkau dari pusat atom.Keadaan cair suatu zat adalah saat ketika, pada pemanasan, dipol elektrostatik sudah mulai menolak, tetapi tolakan ini belum mampu memutus ikatan tarikan magnetis atom. Akibatnya, celah kecil muncul antara atom (g "dalam grafik Grafik 1), yang mengarah ke peningkatan tajam dalam mobilitas atom timbal balik pada lapisan" pelumas "elektromagnetik.Lapisan batas Gas Padat terbentuk atas kontak bahan padat berpasangan magnetis dengan atom gas yang tertekan secara elektrostatis. Atom gas tidak dapat mendorong keluar dari padatan dengan korona elektrostatik atom yang dirahasiakan dan ditekan ke permukaan padat. Dengan demikian, lapisan batas atom gas terbentuk, ditekan ke permukaan zat padat. Dalam hal ini, lapisan gas batas masih mampu memukul mundur atom gas lain dari dirinya sendiri, karena lapisan gas batas tetap ditekan secara elektrostatis hingga tingkat yang diperlukan. Kompresi lapisan batas gas (udara) menjadi logam padat menjelaskan penampilan oksida logam yang hampir seketika di permukaan. Kontak lebih lanjut dari lapisan batas gas sudah dilakukan dengan film pelindung oksida pada permukaan logam,melindungi lapisan yang mendasari logam murni dari oksidasi lebih lanjut.Pemodelan dugaan Arsitektur Struktural elemen kimia. Di masa depan, kami mempertimbangkan dugaan model struktur inti atom berbagai zat, di mana bola logam dengan sifat magnetik yang kuat akan menjadi nukleon (nukleon, proton). Interaksi magnetik nukleon memenuhi kriteria noncentralitas dari interaksi gaya nukleon dalam nukleus dan saturasi gaya-gaya ini ketika nukleon saling mendekati, yang telah lama diasumsikan dalam fisika nuklir untuk interaksi nuklir yang kuat.Magnet rare-earth modern memiliki gaya magnet yang sangat tinggi, yang memungkinkan untuk membangun model struktur atom yang masuk akal, hanya mengandalkan kekuatan magnet dari Sharikov-Nuklonov yang memegang sebagai bagian dari inti tunggal dengan Arsitektur yang unik. Dalam hal ini, gaya magnet itu sendiri bertindak sebagai Pengendali Kritis untuk setiap model inti seperti itu, karena jauh dari semua kombinasi spasial bola dapat dirakit dalam bentuk yang stabil karena saling tarik-tolakan bola terpolarisasi.Model masing-masing atom dirakit dari jumlah nukleon yang ditentukan oleh tabel periodik (termasuk semua isotop stabil). Rekonstruksi model dibuat dari bola magnet neodymium dengan diameter 5 mm. Saat ini, bola magnet tersebut dijual sebagai mainan puzzle yang disebut Neocub, yang mencakup 216 bola magnet dengan ukuran yang sama (potongan kubus 6x6x6).Berdasarkan fitur geometris yang diperoleh dari model atom setiap zat sederhana, kami akan mencoba untuk menemukan hubungan logis antara bentuk model atom dan sifat-sifat materi nyata di tingkat makro.Pada tahap awal pemodelan struktur nuklir, beberapa keteraturan terungkap. Jadi bola magnetik cenderung berbaris dalam rantai, dan rantai yang cukup panjang dengan mudah mengunci cincin. Struktur magnetik cincin berubah menjadi sangat kuat dan stabil, sementara medan magnet luar cincin ini menurun tajam, karena hampir semua garis magnetik fluks magnetnya, bola-magnet yang terpisah ditutup melalui bola-bola tetangga dari cincin nukleon-magnetiknya (lihat Gambar 5). Cincin dengan ukuran yang sama (jumlah bola nukleon yang sama) dapat dengan mudah terhubung satu sama lain, membentuk struktur berbentuk pilar yang sangat stabil yang dapat diperluas hampir tanpa batas sepanjang dengan cincin sepadan baru (Gbr. 6).Rantai bola nukleon dapat dihubungkan secara paralel satu sama lain dalam dua versi:- arah terkait fluks magnet
- arah berlawanan dari fluks magnet
Arah bersamaan dari fluks magnetik memberikan koneksi yang lebih tahan lama dan kompak dari rantai bola (bola terletak di simpul segitiga sama kaki). Fluks magnet yang berlawanan menyebabkan bola berada di bagian atas kotak, yang memberikan pengemasan bola nukleon yang kurang padat dan kurang tahan lama.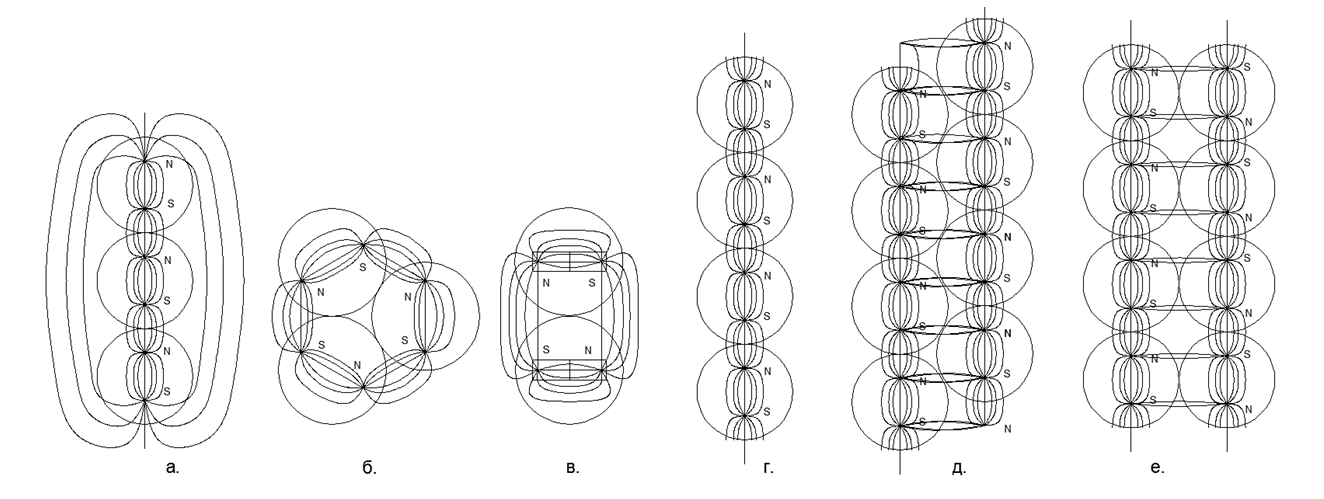 .5. :
.5. :
. 3- ();
. 3- ();
. 2- (), (.);
. - ;
. - , , ;
. - , , . .
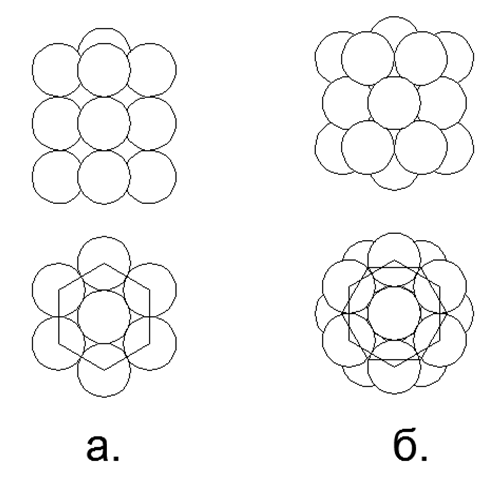 .6. 6- :
.6. 6- :
. ;
. .
- . 6- , .
.
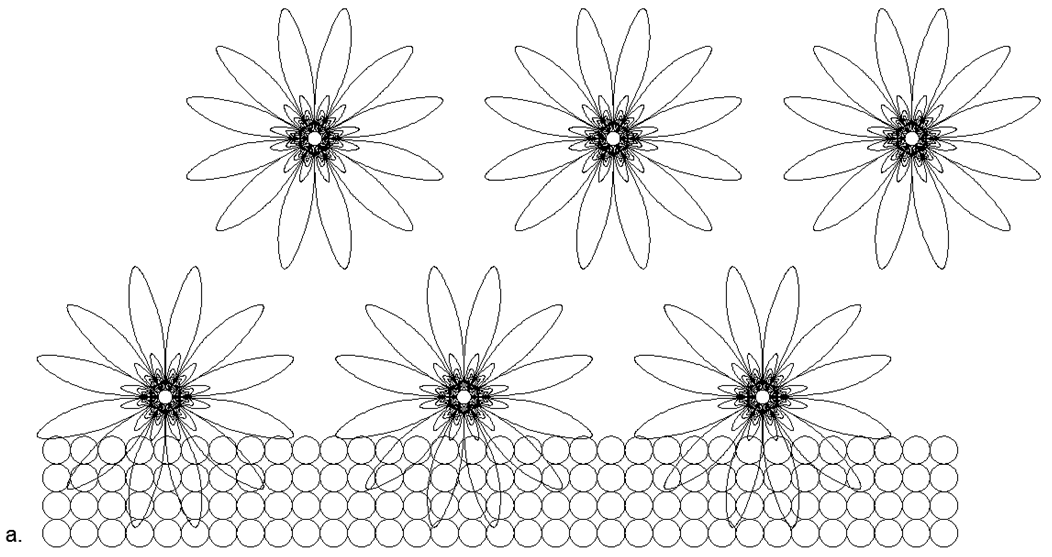
Selain menghubungkan cincin satu dimensi, dimungkinkan untuk menghubungkan cincin berukuran berbeda dalam berbagai kombinasi, memberikan berbagai bentuk spasial. Beragam bentuk koneksi struktur magnetik cincin dan bola magnet individual inilah yang memungkinkan Anda membuat banyak model Arsitektur nuklei dengan jumlah nukleon yang serupa, tetapi terkait dengan berbagai zat dengan sifat kimia dan fisik yang sangat berbeda.Seperti yang Anda ketahui, unsur kimia tunggal dapat berhubungan dengan banyak isotop dengan jumlah neutron yang berbeda dalam komposisi. Jadi, struktur atom seperti pilar dari cincin dengan enam atau lebih nukleon memiliki celah di tengahnya, yang memungkinkan nukleon tambahan ditempatkan di dalam kolom tanpa mengubah tampilan inti atom. (Gbr.6.b).Berdasarkan versi yang diusulkan dari tarik magnetis dan tolakan elektrostatik, dapat diasumsikan bahwa logam mencakup struktur nuklir yang memiliki cincin luar tambahan dari nukleon yang digabungkan secara magnetis di atas kolom pusat cincin nukleon satu dimensi (Gambar 7 - baris bawah). Asumsi ini didasarkan pada kenyataan bahwa cincin magnetik eksternal tidak bermuatan, sehingga meningkatkan celah antara kolom bermuatan listrik internal ketika mendekati atom lain dari jenis yang sama. Celah seperti itu meningkatkan titik didih dan titik lebur logam, dan juga menciptakan area yang lebih luas untuk zona keadaan cair.Zat yang merupakan gas dalam kondisi normal, sebaliknya, harus memiliki cincin nukleon yang bermuatan di sirkuit eksternal, memberikan tolakan elektrostatik dari jenis atom gas yang sama, sementara sejumlah besar nukleon dapat ditempatkan di dalam cincin yang diisi, menciptakan serangkaian isotop luas dari elemen ini.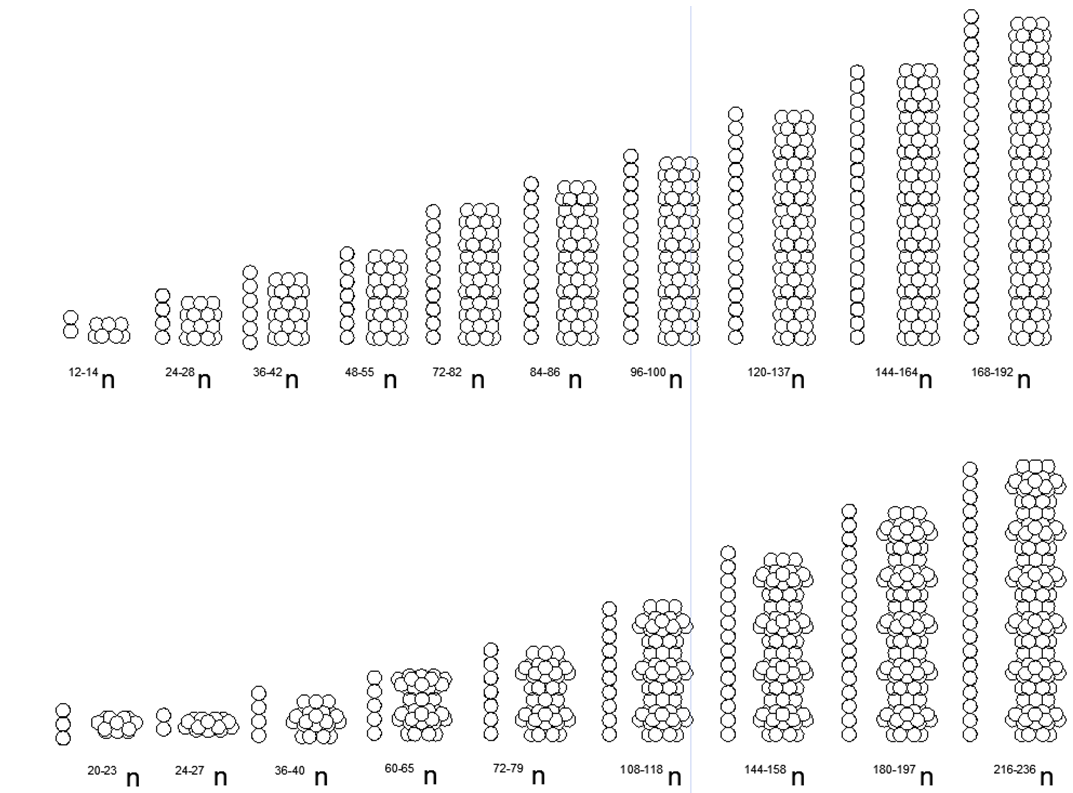 .7. - ( — ) ( - ) . , , . , , .
.7. - ( — ) ( - ) . , , . , , . 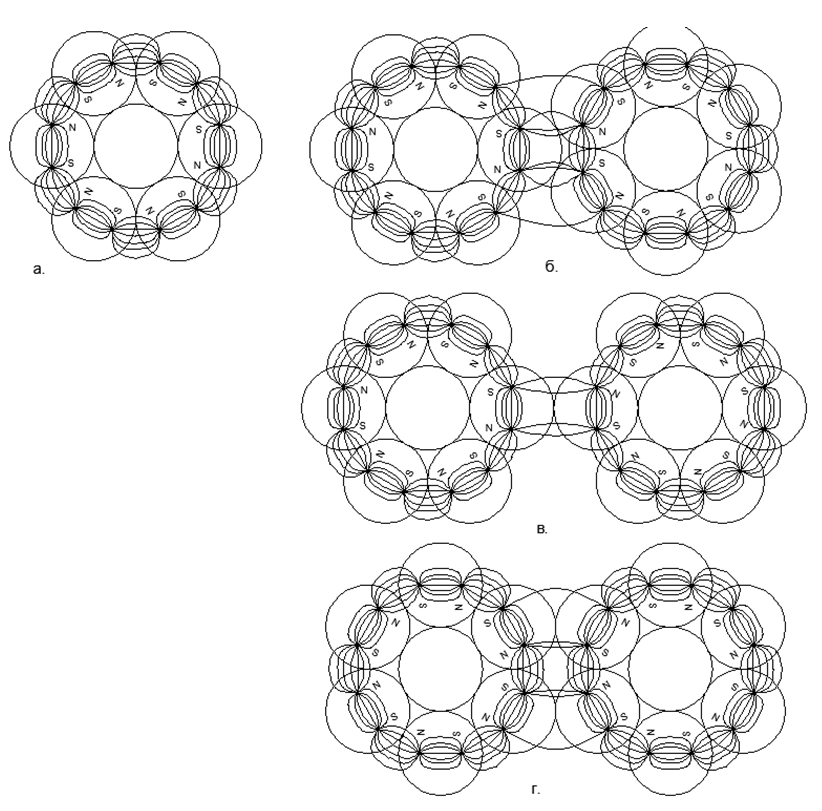 .8. «» :
.8. «» :
. 6- ;
. 6- , , ;
. 6- . , , , (.).
. 6- . , . 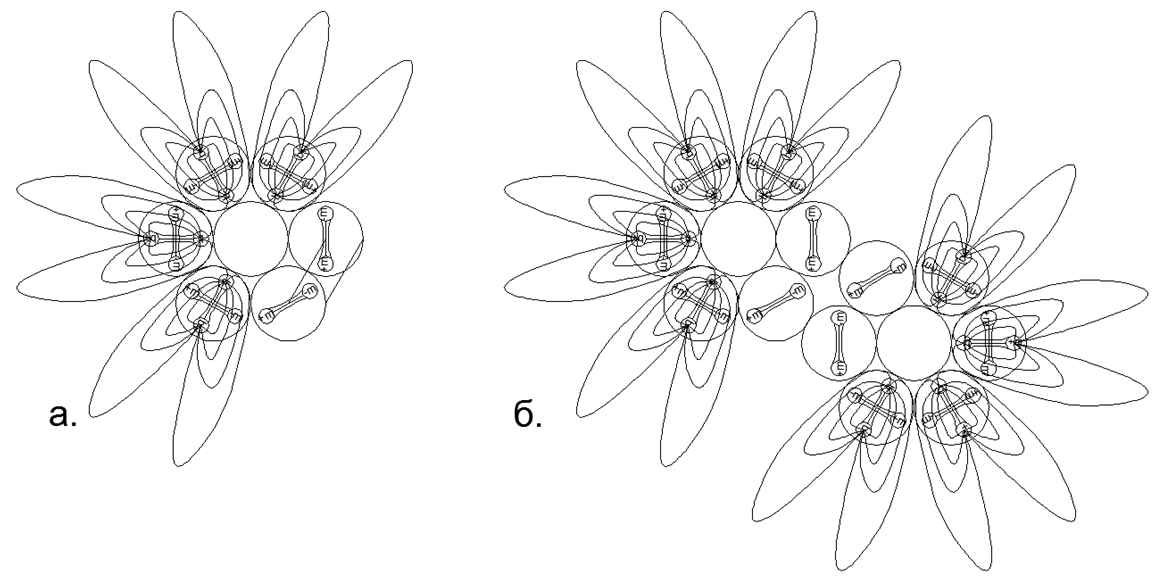 .9. ) , ( N2, 2 ..),; ) , .
.9. ) , ( N2, 2 ..),; ) , . -
Di masa depan, kami akan mempertimbangkan secara terperinci Struktur-Arsitektur Atom yang paling mungkin dari unsur-unsur individu dengan mengacu pada kekhasan komposisi nukleonnya dan sifat fisik yang diketahui (kepadatan, kekuatan, Tplav, TPK, dll.).Berikut ini adalah tabel 1-2-3 periode (pendek) dari tabel periodik, di mana bukan berat atom fraksional, bobot bilangan bulat dari isotop stabil individu yang ditemukan di alam ditunjukkan (Tabel 2).Tab 2. Berat atom isotop stabil dari unsur kimia periode 1-2-3 dari tabel periodik.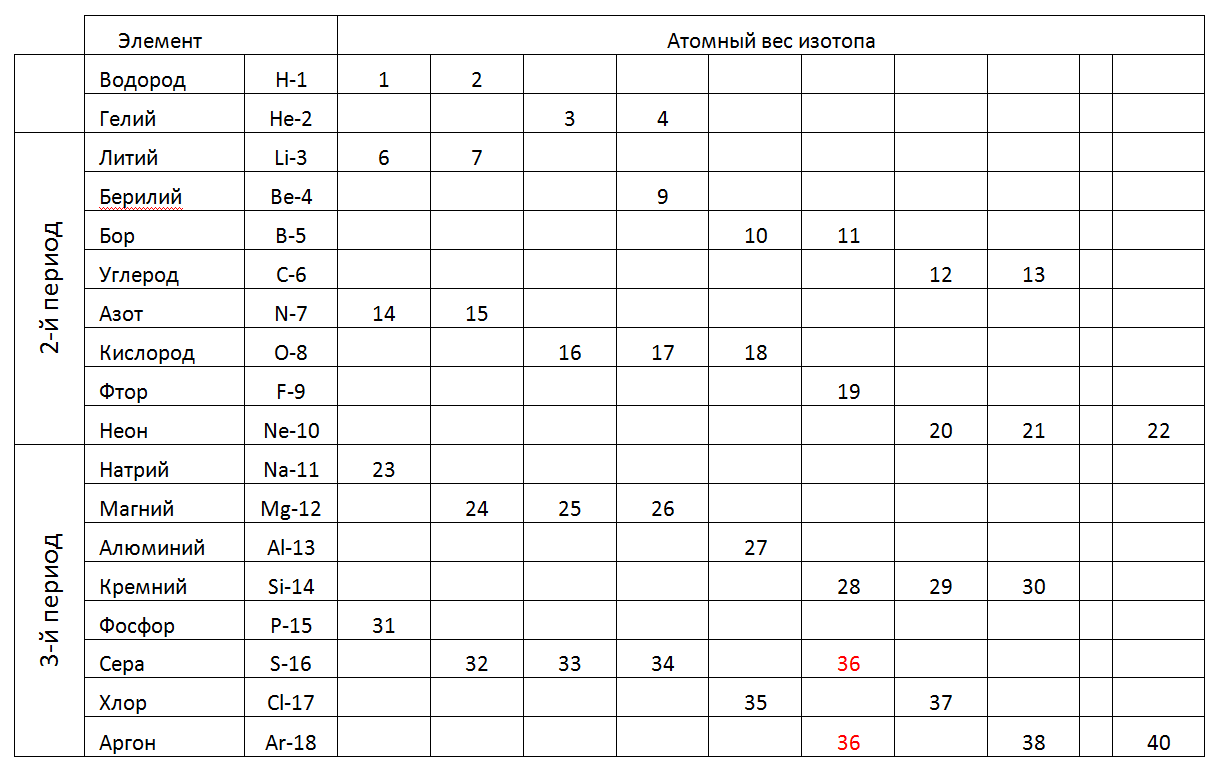 Dalam periode 1 dan periode 2 (baris lengkap pertama tabel) tabel periodik berisi elemen dengan sejumlah kecil nukleon. Atom berukuran kecil dari periode ini memungkinkan kita untuk mempertimbangkan model spasial seperti itu yang sesuai dengan bentuk unik yang dapat mengatur arah pembangunan model atom untuk semua periode berikutnya (lihat Gambar 7). Selain itu, opsi simulasi yang paling masuk akal dapat dianggap sebagai peningkatan bertahap dalam panjang cincin Atom utama yang diisi, melengkapi dengan komposisi nukleon maksimum dari nukleon eksternal (logam) dan intra-cincin (non-logam) sesuai dengan status kimianya, dan kemudian mencari analog dari tabel korespondensi nukleon unsur-unsur kimia. .
Dalam periode 1 dan periode 2 (baris lengkap pertama tabel) tabel periodik berisi elemen dengan sejumlah kecil nukleon. Atom berukuran kecil dari periode ini memungkinkan kita untuk mempertimbangkan model spasial seperti itu yang sesuai dengan bentuk unik yang dapat mengatur arah pembangunan model atom untuk semua periode berikutnya (lihat Gambar 7). Selain itu, opsi simulasi yang paling masuk akal dapat dianggap sebagai peningkatan bertahap dalam panjang cincin Atom utama yang diisi, melengkapi dengan komposisi nukleon maksimum dari nukleon eksternal (logam) dan intra-cincin (non-logam) sesuai dengan status kimianya, dan kemudian mencari analog dari tabel korespondensi nukleon unsur-unsur kimia. .1. Hidrogen (11H) 1proton (1p). Zat bebas memiliki bentuk H2.
Membangun atom hidrogen tidak memerlukan upaya apa pun, karena hanya terdiri dari satu bola proton. Karena fluks magnet terbuka, hidrogen monatomik sangat aktif, yang menyebabkannya bereaksi dengan zat bebas terdekat atau untuk menghubungi atom hidrogen lainnya dengan keadaan cincin tertutup yang stabil.
Deuterium (21D) 1 proton + 1 neutron (1p + 1n) - bentuknya juga tidak ambigu dalam bentuk dua bola yang saling menempel.
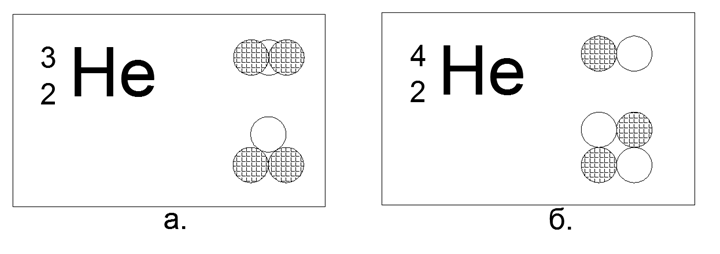
2. Helium (42He) 2 proton + 2 neutron (2p + 2n)
Untuk Helium, sudah dimungkinkan untuk membangun beberapa opsi untuk model struktur inti:
- Linear - empat nukleon berturut-turut,
- Flat (Square) - empat nukleon di sudut-sudut persegi datar,
- Spasial (Tetrahedral) - empat nukleon di sudut-sudut polihedron-Tetrahedron volumetrik.
Dalam hal ini, dari 4 bola magnet, adalah mungkin untuk membuat hanya bentuk inti yang datar. Bentuk tetrahedral pada gaya magnet tidak berlaku, langsung berubah menjadi persegi.
Di masa depan, kita akan fokus hanya pada bentuk spasial atom, karena varian linear dalam atom yang lebih masif tidak akan mampu memberikan perwujudan yang berarti.
Isotop helium langka (32) 2 proton + 1 neutron (2p + n)
Dalam konfigurasi ini, hanya segitiga datar yang dimungkinkan.
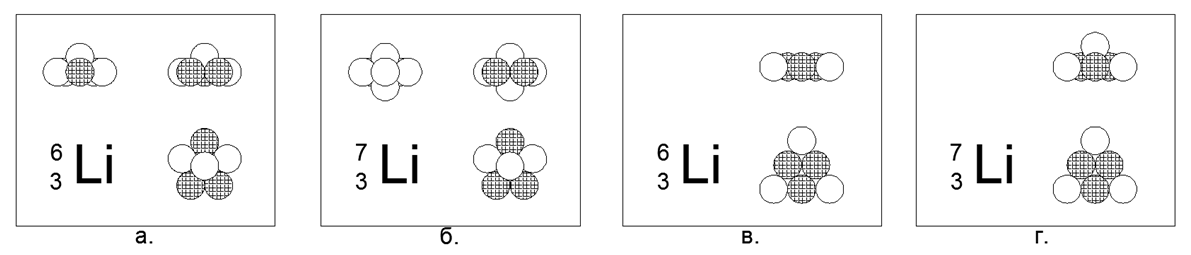
3. Lithium (73Li) -7 nukleon (3p + 4n)
Untuk Lithium, dimungkinkan untuk membuat model atom yang datar dan tiga dimensi.
Model datar adalah segi enam dengan satu nukleon di tengah. Model volume adalah segi lima datar dengan dua bola di kutub (Polandia adalah titik di ujung sumbu rotasi bagian sumbu-simetris utama model inti atom). Kedua model telah diucapkan simetri berbentuk bintang. Logam lithium, sangat ringan (0,534g / cm3), relatif rendah lelehnya (Tm = 454K). Nukleus isotop stabil Lithium (63Li) -6 (3p + 3n) yang langka dapat dimodelkan dalam kedua bentuk, sehingga pilihan yang mendukung model apa pun tidak dapat dibuat.
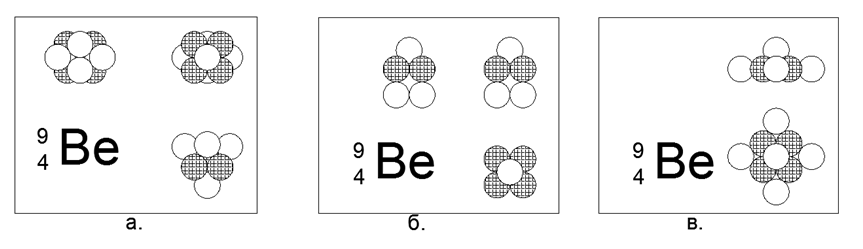
4. Berilium (94Be) - 9 nukleon (4p + 5n).
Satu-satunya isotop stabil berumur panjang. Ada isotop Beryllium (104Be) yang relatif berumur panjang - 10 nukleon (4p + 6n) dengan paruh 1,4 miliar tahun. Banyak implementasi yang dimungkinkan. Bentuk sensasi yang paling stabil dan kompak terlihat seperti bentuk dua segitiga berbentuk bintang yang dihubungkan oleh pesawat menjadi sebuah prisma, di mana satu bola merapat ke sisi-sisi sisi prisma segitiga. Berilium adalah logam, ringan (1,848 g / cm3), relatif tahan api (Tm = 1551K). Di masa depan, bentuk STAR akan dilacak di sebagian besar logam. Ketika bola ke-10 ditambahkan ke struktur yang dihasilkan, bentuk itu sendiri dimodifikasi menjadi bentuk lain berbentuk bintang, tetapi asimetris pada bidangnya. Bentuk baru dapat digambarkan sebagai bintang berujung enam dengan pusat terisi, ke bidang lateral di mana segitiga bola nukleon merapat. Ketika melihat sepanjang sumbu "bintang" pada kedua bentuk isotop Berilium, bintang berujung tiga satu tipe terlihat jelas, yang menentukan sifat-sifat eksternal dasar dari materi sederhana.
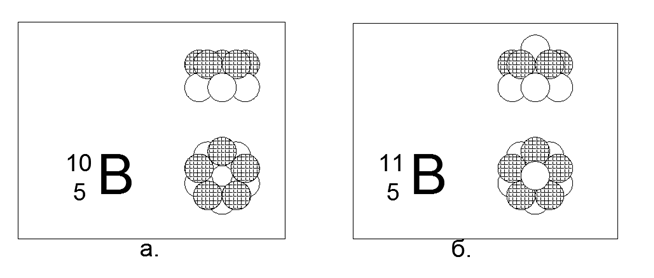
5. Boron (115Be) - 11 nukleon (5p + 6n).
Isotop stabil berumur panjang 10B dan 11B. Konfigurasi spasial 10B terdiri dari dua cincin pentagonal yang terhubung secara paralel dalam arah yang bersamaan atau berlawanan dari fluks magnet. Konfigurasi spasial 11B mengikuti struktur 10B, hanya satu neutron yang ditambahkan di sepanjang sumbu cincin.
Dengan demikian, dapat diasumsikan bahwa non-logam berbeda dari logam dalam bentuk eksternal utamanya: non-logam adalah sebuah silinder cincin dari jenis yang sama, logam adalah bentuk berbentuk bintang (bentuk cakram) tertentu.
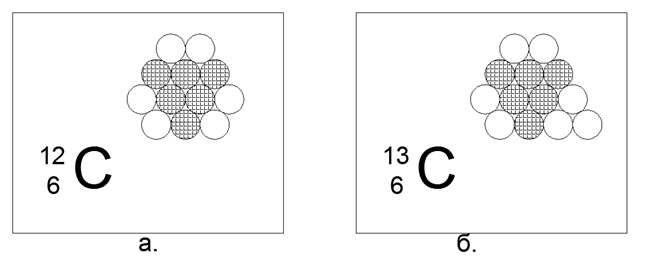
6. Karbon (126) - 12 nukleon (6p + 6n).
Isotop stabil berumur panjang 12 12 (98,93%) dan 13 and (1,07%), serta radioaktif 14. Unsur yang sangat menarik, yang sangat luas dan memiliki beragam bentuk struktural tak terbatas di alam (Grafit, berlian, batu bara, jelaga, struktur nano-fullerene, dll.) Bentuk-konten ini memerlukan struktur 12 bola dari beberapa sifat khusus yang menakjubkan. Struktur seperti itu dapat berubah menjadi segi enam datar non-sama sisi dengan tiga bola di tengah.
Nukleon yang bermuatan diatur dalam segitiga, di sisi mana tiga pasang neutron terpasang. Hasilnya adalah simetri tiga balok, di mana pada sumbu simetri terdapat neutron eksternal, siap untuk koneksi magnetik atom lainnya. Lapisan Grafit, atau permukaan tabung nano dan struktur curah dari struktur tertutup Fullerene, mudah ditata dari segi enam seperti itu.
 Fig. Tampilan lapisan graphene (grafit) tersusun dari atom karbon planar heksagonal C12.
Fig. Tampilan lapisan graphene (grafit) tersusun dari atom karbon planar heksagonal C12.Di antara non-logam, zat-zat yang merupakan gas dalam kondisi normal terutama dibedakan. Ini adalah gas inert (mulia) monoatomik, Nitrogen dan Oksigen atmosferik diatomik, dan Fluorin halogen diatomik aktif.
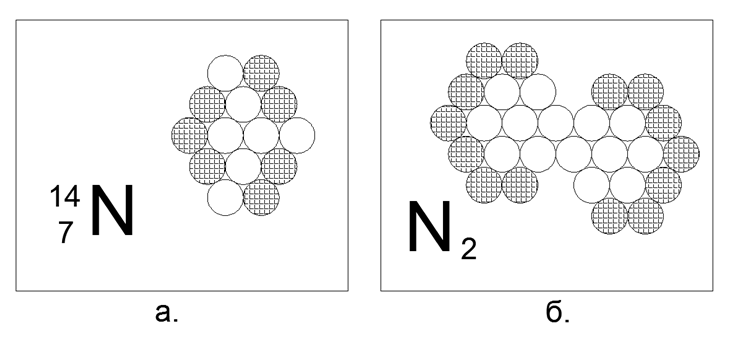
7. Nitrogen (147N) - 14 nukleon (7p + 7n).
Isotop berumur panjang yang stabil, 14N dan 15N. Dalam keadaan bebas dalam kondisi normal, Nitrogen adalah gas diatomik, dengan aktivitas yang sangat sedikit. Atmosfer planet kita adalah 78% nitrogen. Untuk memiliki properti gas di bawah N.u. atom membutuhkan keberadaan nukleon yang terisi pada perimeter luar, tanpa jeda pada pasangan elektron. Tetapi karena gas hanya merupakan molekul diatomik, itu berarti bahwa dalam struktur atom terdapat daerah yang aktif secara magnetis dari dua atau tiga neutron secara berturut-turut di batas luar, di mana atom nitrogen dihubungkan ke molekul N2. Bentuk 14 atom ini mudah dirakit dalam bentuk hexagon non-sama sisi, mirip dengan belah ketupat, di mana plot dengan tiga neutron berturut-turut pada perimeter luar atom benar-benar alami. Ikatan dalam molekul N2 begitu kuat sehingga gas tetap dalam keadaan molekul bahkan pada 5.000 derajat C.
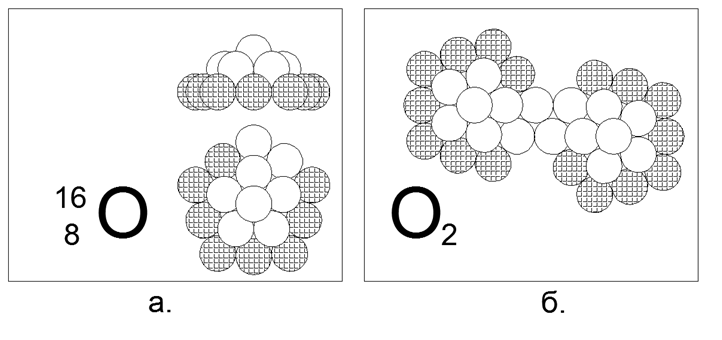
8. Oksigen (168) - 16 nukleon (8p + 8n).
Isotop berumur panjang yang stabil 17 dan 18. Bentuk diasumsikan dari isotop 16 yang paling umum (99,7%) adalah 5-gon dari sepuluh nukleon (8 bermuatan, 2 netral), dengan celah kontak magnetik-magnetik yang jelas di cincin sepuluh-atom terluar. Lapisan dalam terdiri dari cincin 5-nukleon dengan nukleon tambahan keenam belas di tengah. Cincin nukleon 10 dan 5 tidak dapat disatukan di dalam bidang, dan karenanya membuat bentuk kubah spasial. Isotop dibuat dengan menangkap neutron tambahan di tengah di bawah "kubah". Kehadiran celah dua nukleon eksternal di dalam cincin memastikan terciptanya molekul O2 diatomik. Kekuatan ikatan di dalam molekul O2 jauh lebih lemah daripada Nitrogen, dan karena itu oksigen jauh lebih aktif dan memasuki reaksi oksidasi (pembakaran) pada suhu yang cukup rendah.
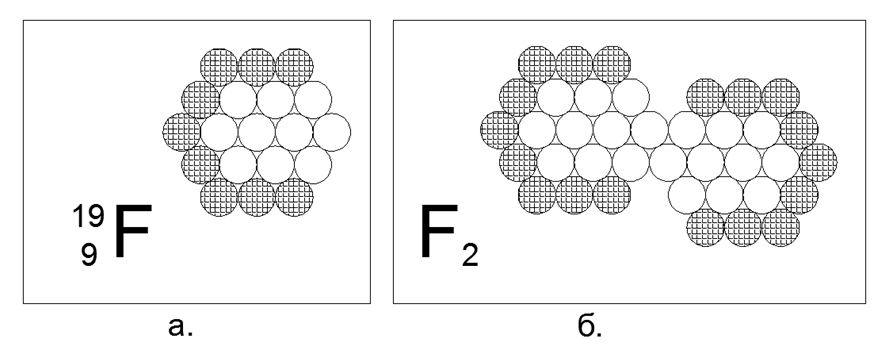
9. Fluor (199F) - 19 nukleon (9p + 10n).
Hanya ada satu isotop stabil, yang tidak stabil hidup dari pecahan detik hingga satuan jam. Bentuk struktur yang diasumsikan: segi enam datar dari cincin nukleon 12 dan 6 bersarang dan nukleon ke-19 di tengah. Kurangnya nukleon yang bermuatan di cincin luar menciptakan daerah tarikan magnetis dari tiga nukleon netral, yang memungkinkan untuk membuat molekul F2 diatomik, setelah itu zat tersebut menunjukkan sifat gas dalam kondisi normal. Gas kriogenik Fluorin-2, yaitu menjadi cair hanya pada suhu yang sangat rendah (85K atau -188C), yang membuatnya mirip dengan sifat dari dua gas diatomik sebelumnya.
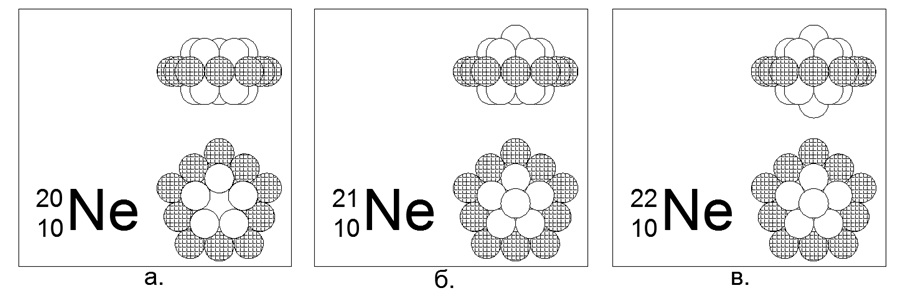
10. Kandungan Neon (2010He) - 20 nukleon (10p + 10n) sebesar 90,47%.
Isotop berumur panjang yang stabil, 21He (9,25%) dan 22He (0,27%). Perkiraan struktur inti: cincin terluar bermuatan 10 nukleon ditambah dua cincin 5-nukleon bersarang bagian dalam.
Isotop 21 dan 22 dibuat dengan menambahkan satu nukleon ke pusat salah satu dari 5 cincin nukleon di sepanjang sumbu.
Dalam Tabel 1, zat dengan isotop stabil tunggal adalah yang paling menarik, karena struktur uniknya tidak memungkinkan inti tambahan untuk diserap tanpa memasukkan distorsi ke dalam bentuk eksternal. Zat-zat tersebut termasuk Berilium-9 Logam (Gbr. 7) dan Sodium-23 (Gbr. 6), Aluminium-27, serta Fluorin-19 non-logam, Fosfor-31.
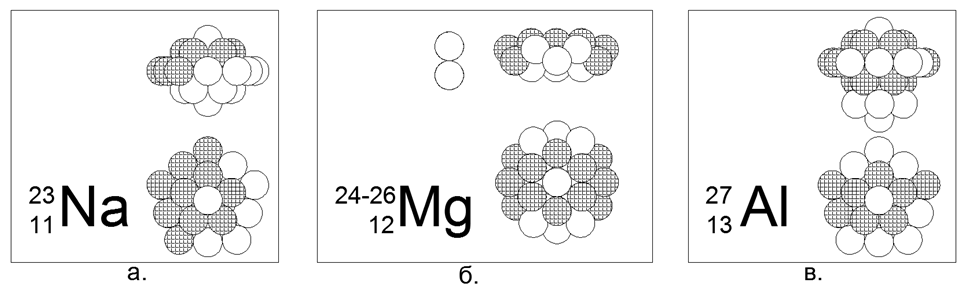
11. Sodium (2311Na) - 23 nukleon (11p + 12n) - Ini adalah satu-satunya isotop stabil di alam, yang memungkinkan kita untuk memilih konfigurasi nukleon unik untuk itu.
Dari 23 bola, dimungkinkan untuk membuat hanya satu versi dari struktur stabil magnetis simetris padat dari bentuk bintang-disk. Cincin 10 nukleon dililit di sekitar bagian tengah dua cincin 5 nukleon yang disatukan oleh pesawat. Di dalam bagian tengah antara dua cincin 5-nukleon, sebuah nukleon pusat ke-21 didorong. Satu lagi nukleon (22 dan 23) terhubung ke sisi-sisi dari bagian tengah sepanjang sumbu pusat. Secara umum, nukleus menyerupai yule dalam bentuk lentil cembung. Karena kenyataan bahwa cincin 5-nukleon dan 10-nukleon tidak dapat berbaris dalam bidang, bentuk cincin 10-nukleon mengambil bentuk zigzag, sedangkan cincin 5-nukleon dalam sedikit terpisah, yang memungkinkan 21- nukleon.
12. Magnesium (12Mg) - 24, 25, 26 nukleon.
Isotop memiliki prevalensi masing-masing 78,6% - 10,1% -11,3%. Dengan demikian, jelas bahwa bentuk utama adalah struktur seperti cakram dari dua cincin 6-nukleon di bagian tengah dan sebuah cincin 12-nukleon yang melilit. Isotop dibuat dengan mengarahkan satu atau dua neutron ke dalam tabung pusat cakram, yang pada cincin 6-nukleon sesuai persis dengan ukuran bola nukleon.
13. Aluminium (2713Al) - 27 nukleon (13p + 14n) - Ini adalah satu-satunya isotop stabil di alam, yang memungkinkan Anda memilih konfigurasi nukleon unik untuknya.
Dari 27 bola, versi axisymmetric dari struktur stabil magnetis padat dari bentuk bintang-disk dengan multiplisitas cincin dari 5 nukleon telah dibuat: pilar pusat dari tiga cincin 5 nukleon dan cincin 10 nukleon eksternal, dan dua nukleon di ujung tabung pusat melengkapi gambar. Isotop 28 dan 29 memiliki paruh masing-masing 2 menit dan 6 menit. Isotop 26 - memiliki T1 / 2 = 717 ribu tahun., Dan secara alami meluruh menjadi Magnesium-26 yang stabil oleh penangkapan elektron (tangkapan beta). Sintesis berkelanjutan dari Al-26 terjadi di atmosfer selama tumbukan proton cepat kosmik dengan atom Argon.

14. Silikon (14Si) - 28, 29, 30 nukleon.
Isotop memiliki prevalensi masing-masing 92,2% - 4,7% -3,1%. Silikon adalah non-logam. Dalam kondisi normal, silikon ada dalam berbagai bentuk, dan semuanya merupakan padatan. Dalam bentuk kristal, Silikon adalah semikonduktor, yang membuatnya mirip dengan Karbon dari periode sebelumnya.
Untuk 28 nukleon, tidak ada bentuk reguler dari barisan silinder, yang memungkinkan untuk mencari kemungkinan model atom dalam serangkaian pelat polihedral, seperti Karbon dan Nitrogen. Jadi 28 nukleon diperoleh dari dua atom nitrogen heksagonal planar yang dihubungkan oleh bidang.
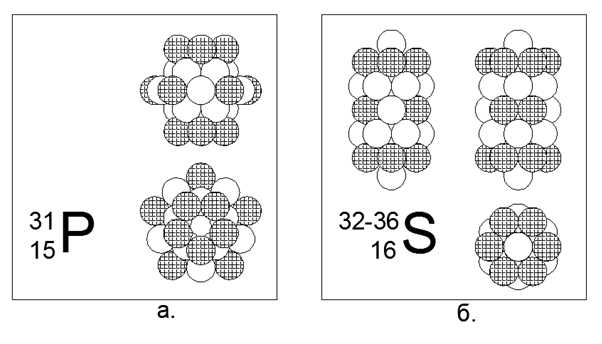
15. Fosfor (3115P) - 31 nukleon.
Satu-satunya isotop stabil. Non-logam. Diperkirakan struktur: Empat cincin 5-nukleon dalam tabung pusat dan cincin luar 10-nukleon di tengah tabung pusat, yang menghasilkan 30 nukleon, dan 31 nukleon digerakkan ke pusat cincin 10-nukleon, di mana rongga muncul karena docking non-planar 10 5 dan 5 cincin nukleon. Muatan terletak pada 5 buah di ujung tabung pusat dan lima lebih merata di sekitar cincin luar 10-nukleon.
16. Sulphur (16S) - memiliki empat isotop stabil 32, 33, 34 dan 36 nukleon.
Isotop memiliki prevalensi masing-masing 95,013% - 0,75% -4,215% -0,017%. Belerang adalah non-logam. Kami berasumsi bahwa bentuk utama adalah struktur silindris dari lima buah 6 cincin nukleon, di dalam terowongan pusat di mana nukleon isotop tambahan ditempatkan. Untuk isotop langka Sulphur-36, struktur menjadi tidak jelas, karena dua nukleon tambahan bahkan tidak muat di dalam tabung pusat. Sulfur-36 tidak hanya sepenuhnya mengisi tabung bagian dalam silinder, tetapi juga menonjol dengan nukleon di luar batas bagian luar silinder. Konfigurasi ini memberikan sifat non-logam dari zat, yaitu, dengan titik leleh dan titik didih yang relatif sedang mendekati kondisi normal.
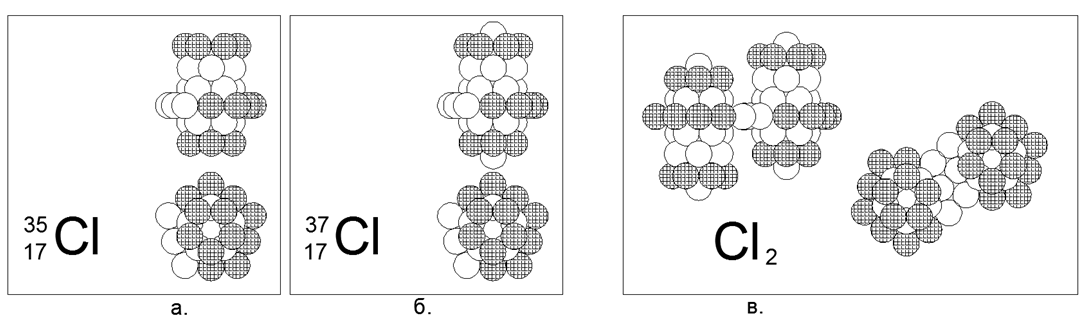
17. Klorin (17Cl) - memiliki dua isotop stabil dari 35 dan 37 nukleon.
Isotop memiliki prevalensi masing-masing 75% dan 25%. Klor adalah gas non-logam dan diatomik dalam kondisi normal. Kami berasumsi bahwa bentuk utama untuk gas adalah cincin 10-nukleon lebar yang tidak diisi penuh dengan struktur silinder bersarang dari tiga cincin 5-nukleon di sepanjang sumbu di mana cincin ujung pipa terisi penuh. Untuk isotop berat Chlor-37, satu nukleon ditambahkan ke ujung silinder utama. Klorin-36 bersifat radioaktif dengan T1 / 2 = 301 ribu tahun. Klorin-36 yang tidak stabil dimungkinkan baik dalam versi dengan nukleon di ujung terbuka pipa pusat, dan dengan cincin 10-nukleon didorong ke tengah. Dengan kedekatan jumlah massa Klor dan Sulfur, yang bahkan ada persimpangan timbal balik dari jumlah isotop (isobar), struktur inti ternyata berbeda secara fundamental. Perbedaan dalam struktur nukleus juga tercermin dalam perbedaan kuat dalam sifat kimia dan fisik.
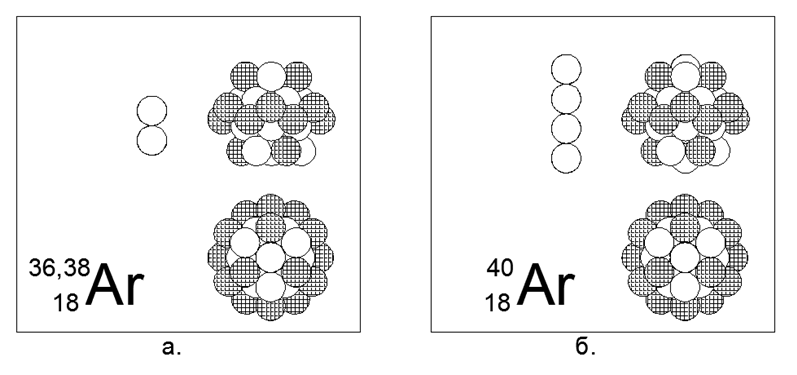
18. Argon (18Ar) - memiliki tiga isotop stabil 36, 38, dan 40 nukleon.
Isotop di Bumi memiliki prevalensi masing-masing 0,337% - 0,063% -99,6%, meskipun distribusi di ruang angkasa sangat berbeda. Di Bumi, semua Argon-40 berasal dari radioaktif Kalium-40 yang membusuk. Argon adalah gas inert. Dapat diasumsikan bahwa bentuk utama adalah struktur silindris dari empat buah 6 cincin nukleon, di terowongan pusat tempat 2 atau 4 nukleon tambahan isotop masif ditempatkan, dan sebuah cincin bermuatan 12 nukleon diletakkan di atas tabung pusat. Cincin luar Fully Charged serupa adalah fitur karakteristik gas Inert, menurut model teoritis yang dikembangkan dari Atom-Nucleus.
Argon-36 adalah isobar untuk Sulphur-36 (pasangan kedua dalam tabel periodik), tetapi struktur bentuk utama sangat berbeda. Dapat diasumsikan bahwa salah satu logam alkali berikut ini, yaitu Kalium atau Kalsium, akan berubah menjadi dekat dengan Argon dalam struktur inti.
Total.
Peningkatan bertahap dalam massa atom dengan peningkatan linear dalam jumlah nukleon bermuatan sesuai dengan tabel periodik memungkinkan untuk membangun serangkaian solusi struktural yang konsisten dari Struktur Atom-Arsitektur elemen kimia yang terkait dengan sifat fisik dan kimianya. Model unsur-unsur Nuklir-Atom sebagai persyaratan wajib mencakup kemampuan untuk membangun semua isotop stabil tanpa perubahan radikal dalam bentuk Atom.
Kesimpulan utama yang diperoleh pada tahap ini adalah ide berikut:
Meskipun terdapat perbedaan dalam sifat-sifat kimiawi dari zat-zat yang terletak dekat dalam tabel (Sebagai contoh: Gas inert dan logam alkali yang mengikutinya), mereka secara struktural akan berbeda hanya di lokasi nukleon yang bermuatan pada perimeter luar atom atau di baris dalam. Dengan demikian, perubahan sifat secara berkala dikaitkan dengan transisi mulus konsentrasi nukleon bermuatan dari zona dalam nukleus ke luar.