
Dari kantor apa di rumah sakit mana anak-anak dan kadang-kadang orang dewasa berteriak dari waktu ke waktu? Apa yang orang tua, dengan berani menipu kita di masa kecil, dibandingkan dengan gigitan nyamuk? Saya pikir Anda sudah menebak bahwa ini adalah tes darah. Sekarang prosedur ini menjadi lebih cepat dan tidak terlalu menyakitkan. Satu hal belum berubah - kepentingannya. Diagnosis dalam kedokteran memainkan peran paling penting pada tahap awal perang melawan suatu penyakit. Lagi pula, untuk mengalahkan penyakit, pertama-tama harus ditemukan. Setelah selamat dari prosedur pengambilan sampel darah untuk dianalisis, Anda dengan tenang berangkat untuk menunggu hasilnya. Pada saat ini di laboratorium, orang yang menggunakan perangkat yang kompleks, besar dan sangat mahal menganalisis darah Anda, mencari tahu apa yang ada di dalamnya dan dalam jumlah berapa. Adalah baik untuk memiliki laboratorium seperti itu di rumah sakit lokal Anda, tetapi ini tidak selalu terjadi. Tetapi bagaimana jika ada laboratorium saku, kecil dan murah, tetapi pada saat yang sama menganalisis sampel dengan akurasi dan efisiensi yang sama dengan yang biasa? Kedengarannya seperti fiksi ilmiah, bukan? Ungkapan "penganalisis gula darah saku" pada masanya juga terdengar futuristik. Hari ini kita akan mengetahui penelitian dan implementasi teknologi untuk analisis kuantitatif protein dan asam amino melalui perangkat kompak jenis baru. Terdiri dari apa mukjizat ini, bagaimana cara kerjanya dan seberapa efektif? Kami akan menerima jawaban untuk ini dan pertanyaan lain dalam laporan para ilmuwan. Ayo pergi.
Dasar studi
Kita hidup di era teknologi digital, yang berhasil diimplementasikan di berbagai bidang kehidupan kita. Studi laboratorium (diagnostik) tidak terkecuali. Para ilmuwan mencatat bahwa analisis tetesan digital 1000 kali lebih akurat daripada tradisional dan memungkinkan jutaan analisis dilakukan secara paralel dalam setetes sampel dengan volume yang diukur dalam femtoliter (fl, 1 fl = 10
-15 l).
Menggunakan analisis digital sangat berguna untuk mendeteksi asam nukleat dan protein, menganalisis sel-sel individual, dan bahkan eksosom.
Eksosom * - vesikel ekstraseluler (diameter: 30-100 nm), yang disekresikan oleh sel ke dalam ruang antar sel. Eksosom terlibat dalam kerja imunitas, sekresi protein, dll.
Saat ini, metode analisis digital yang paling terkenal adalah dELISA (DIA) dan qPCR (reaksi berantai polimerase digital). Teknik-teknik ini memungkinkan Anda untuk bekerja dengan sel-sel individual, sambil memperoleh hasil yang sangat akurat yang tidak memerlukan koreksi. Jadi baru-baru ini, dengan menggunakan metode ini, analisis kuantitatif protein dan mRNA yang berhasil dalam satu sel dilakukan bersamaan.
Teknik serupa dan demonstrasi bakat mereka sekali lagi menunjukkan bahwa implementasi analisis paralel dalam lingkungan yang sangat kecil (sampel) sangat mungkin. Namun, seperti teknologi lainnya, metode ini juga memiliki kelemahan. Mereka cukup sepele - dimensi, harga, dan kompleksitas manufaktur. Para peneliti mengingatkan kita bahwa satu instalasi untuk penguat digital (Quanterix's Simoa) berharga sekitar $ 100.000. Dan tidak semua klinik swasta mampu membayar jumlah seperti itu, saya sudah diam tentang klinik negara.
Tentu saja, Simoa "binatang" Quanterix ini sangat kuat, jika dibesar-besarkan. Menggunakan tablet dengan sel mikro dengan 200.000 sel masing-masing 40 fl.
 Simo Quanterix
Simo QuanterixPada saat yang sama, perangkat ini dapat memproses secara paralel hingga 4 tablet ELISA masing-masing 96 sel. Dengan demikian, satu perangkat mampu menghasilkan hasil dari 66 sampel dalam satu jam, yang masing-masing dapat dikenakan analisis 10-plex (mis. 1 sampel dianalisis untuk 10 indikator pada suatu waktu). Jumlahnya sungguh luar biasa. Tetapi sekali lagi, muncul pertanyaan tentang harga dan dimensi dari mesin ajaib semacam itu.
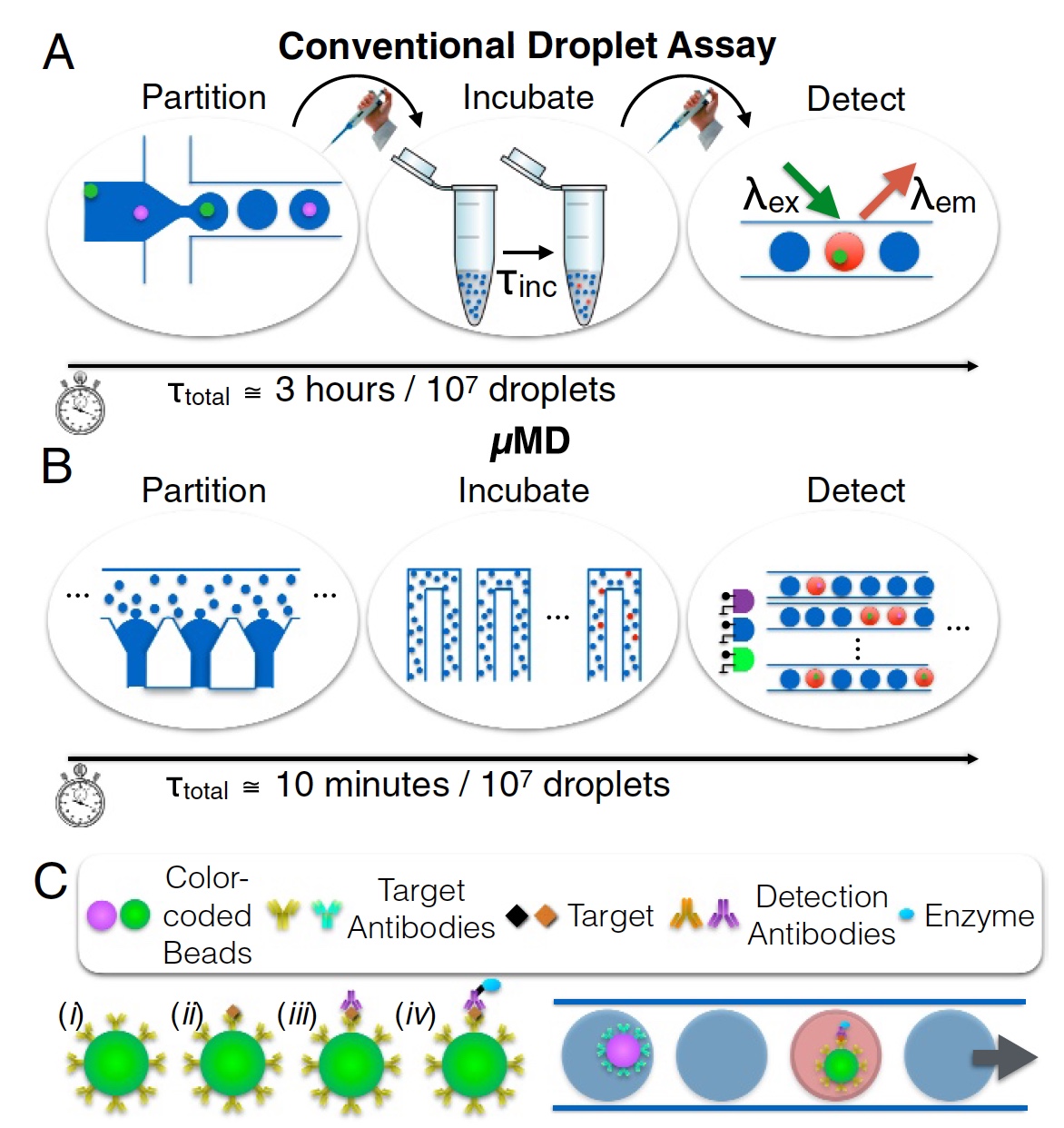 Gambar No. 1
Gambar No. 1Dan di sini, para ilmuwan mengusulkan untuk mengalihkan pandangan mereka ke sistem tetesan mikrofluida. Sistem klasik semacam ini tidak dapat membanggakan kinerja kolosal Simoa Quanterix, namun, mereka dapat berfungsi sebagai dasar untuk perangkat baru. Teknik tetesan mikrofluida aliran kontinu secara teoritis dapat menganalisis hingga 1 juta sel. Namun, dalam praktiknya, indikator tersebut belum tercapai karena beberapa alasan. Pertama, throughput (kurang dari 104 tetes per detik), ketika tetes dihasilkan secara berurutan (tidak paralel) dan bersifat monodisperse. Kedua, deteksi fluoresensi dari setiap tetes dilakukan dengan melewatkannya satu per satu melalui titik laser. Dengan kata lain, semuanya sejalan, satu per satu. Proses ini ditunjukkan pada gambar
1a (pemisahan, inkubasi, dan penentuan; 3 jam untuk analisis 10
7 tetes).
Masalah utama dalam mengubah metode ini ke format yang ringkas adalah sulitnya memaralelkan optik untuk pendeteksian multi warna fluoresensi, kompleksitas pengintegrasian proses persiapan sampel, dan kebutuhan akan alat-alat tertentu untuk menghasilkan aliran tetesan yang terkontrol secara ketat. Namun, para ilmuwan tidak terbiasa menyerah dalam menghadapi kesulitan, betapapun mengesankannya mereka.
Micro-drop Megascale Detector (MD, macro detector) adalah ciptaan para pahlawan kita hari ini. Perangkat ini tidak hanya dapat diterapkan di perangkat seluler (saku) apa pun, tetapi juga memenuhi standar analisis kuantitatif laboratorium ukuran penuh biasa. Proses ditunjukkan pada gambar
1b (pemisahan, inkubasi, dan penentuan; 10 menit untuk analisis 10
7 tetes).
Untuk mencapai ini, menurut para peneliti, tiga tugas utama dilaksanakan:
- Alih-alih menghasilkan 1 tetes masing-masing, generasi paralel tetesan mikrofluida digunakan, bekerja 100 kali lebih cepat. Dan prestasi rekan-rekan ilmuwan di bidang produksi tetes monodispersi ( tautan ke penelitian ini ) memungkinkan untuk menghilangkan ketergantungan monodispersitas tetes pada laju aliran. Hal ini memungkinkan penggunaan pompa peristaltik yang sangat murah yang dapat diintegrasikan ke dalam perangkat seluler (genggam).
- Pembacaan cepat fluoresensi tetesan pada kecepatan lebih dari 105 per detik (ingat batas 104, yang saya sebutkan di atas) tercapai berkat visualisasi yang didasarkan pada ponsel, yang 100 kali lebih cepat dari pembacaan konvensional (ketika tetes dibaca pada gilirannya). Dalam hal ini, tidak perlu optik mahal, dan penerapannya di perangkat seluler sudah jelas. Fitur pembeda utama dari inovasi ini adalah kemampuan untuk mengatasi keterbatasan frame rate rendah dari gambar digital dan memberikan deteksi fluoresensi multi-warna dengan memodulasi beberapa sumber eksitasi LED atau dioda laser warna berbeda dengan sinyal non-periodik yang unik. Video dapat didekodekan untuk mendapatkan data fluoresensi tetesan, mengatasi batas laju bingkai kamera. Dengan demikian, adalah mungkin untuk mencapai yang sangat (disebutkan sebelumnya) dari 1 juta tetes per detik.
- Dan akhirnya, integrasi unit pemrosesan microgranule (atau microbeads, objek bola mikroskopis), generator tetesan, jalur penundaan sinyal untuk inkubasi tetesan, dan detektor fluoresensi. Secara keseluruhan, ini menyediakan perangkat yang murah, ringkas, dan efisien untuk memasukkan serum (sampel) yang tidak diobati dan mengeluarkan data molekuler (hasil).
Sebagai demonstrasi penemuan mereka, para ilmuwan menerapkan DIGA multiplex menggunakan mikrogranul warna berbeda yang diperoleh dari pewarna fluorescent. Setiap warna adalah warna "kode" protein yang dituju oleh antibodi mikrobead (
1c ).
Analisis multipleks sitokin GM-CSF dan IL6 serum dilakukan dengan menggunakan butiran ultraviolet dan fluoresens hijau, ketika tetes mengandung mikrogranule dengan immunocomplex merah neon. Serum sapi digunakan sebagai media untuk analisis kuantitatif, dan batasan penentuan adalah 0,004 pg / ml (pikogram per mililiter, 1 pg = 10
−12 g). Ini 1000 kali lebih akurat daripada ELISA standar, dan sesuai dengan tingkat akurasi ELISA digital.
Hanya perlu 10 menit untuk memproses 10 juta tetes. Dalam hal ini, proses itu sendiri mencakup pembuatan dan inkubasi tetes, serta deteksi tetes fluoresens untuk setiap sampel.
Struktur perangkat dan proses analisis
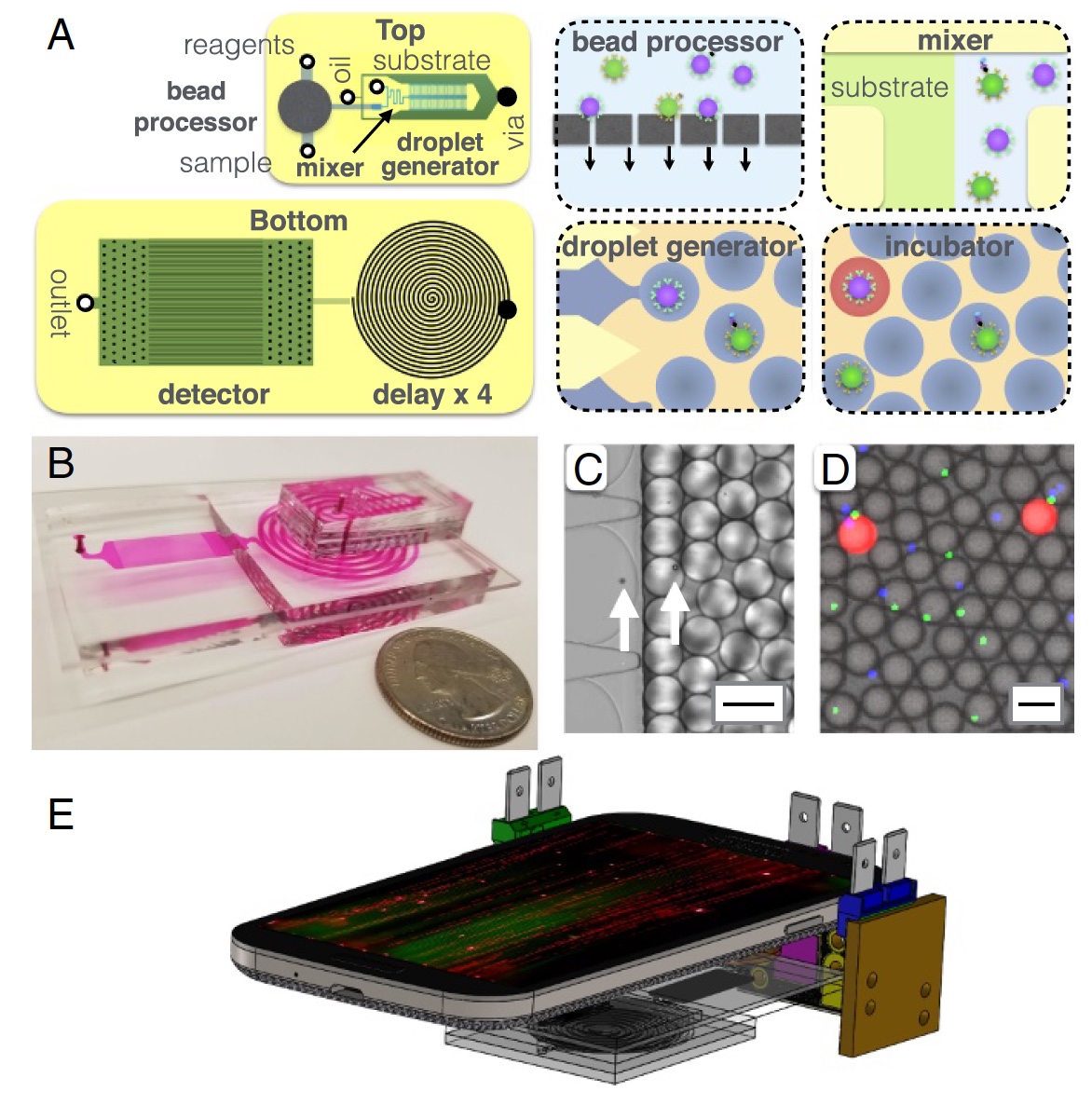 Gambar # 2: Struktur perangkat MD.
Gambar # 2: Struktur perangkat MD.Sedikit lagi tentang gambar di atas: diagram
2a - chip, tampilan atas dan bawah;
2b adalah foto chip MD di mana semua saluran optofluid terlihat;
2c adalah mikrograf dari proses enkapsulasi microbeads ke dalam tetesan dengan diameter 40 μm;
2d adalah mikrograf fluoresensi tetes setelah garis penundaan;
2e adalah representasi skematis platform MD (ponsel, 3 sumber cahaya, dan chip MD itu sendiri).
Komponen utama MD dapat disebut prosesor microgranule, di mana yang terakhir menangkap protein target dari serum. Setelah ini, butiran diberi label dengan immunocomplexes untuk amplifikasi selanjutnya di dalam tetesan. Di antara setiap proses tersebut, pembersihan berulang (beberapa kali) terjadi. Generator tetesan juga hadir, di mana mikrogranula dicampur dengan substrat enzim dan dienkapsulasi dalam tetesan air-minyak.
Berikutnya adalah saluran mikrofluida yang dilewati tetesan selama 3,2 menit. Saluran ini diperlukan sebagai penundaan / perlambatan proses, yang memungkinkan penguatan sinyal fluoresens secara enzimatis. Bagian terakhir adalah detektor (atau pemindai) berdasarkan pada ponsel (kamera), di mana fluoresensi tetesan terdeteksi.
Prosesor microgranule terdiri dari membran semipermeabel untuk melumpuhkan butiran. Beberapa reagen dan buffer pencuci dikirim ke butiran yang tidak bergerak. Setelah ini, butiran dilepaskan untuk analisis lebih lanjut.
Membran itu sendiri terbuat dari polycarbonate. Track terukir 300 mm
2 dengan pori-pori berdiameter 3 μm terukir pada membran.
Dalam percobaan ini, ada dua kelompok mikrogranul: (d = 5,4 μm, ex / em = 470/490 nm, CFH-5052-2) difungsikan dengan antibodi anti-GM-CSF (MAB2172) dan (d = 4,5 μm, ex / em = 370/410 nm, CFP-4041-2) difungsikan dengan antibodi anti-IL6 (MAB206).
Pertama-tama, mikrogranula melewati proses inkubasi bersama dengan sampel selama 1 jam, dan hanya setelah itu mereka ditangkap pada membran yang disebutkan di atas.
Pada tahap ini (di dalam membran), butiran dicuci dengan 1 ml buffer T20 pada laju aliran 10 ml / jam, diinkubasi dengan 0,1 ml antibodi deteksi 0,7 nM dalam buffer T20 selama 0,5 jam, dicuci lagi dengan 1 ml buffer T20 pada 10 ml / jam, dan setelah itu mereka dilepaskan dari membran dengan mengubah laju aliran menjadi 6 ml / jam.
Setelah itu, microbeads yang dirilis dicampur dengan substrat ELISA dan dienkapsulasi dalam tetesan dengan diameter 40 μm. Untuk memastikan pencampuran granula dan substrat yang akurat dan untuk meminimalkan sinyal latar belakang dari enzim yang menghasilkan sinyal fluoresens, saluran khusus dengan panjang 14 mm digunakan.
Generator tetesan dirancang sedemikian rupa sehingga diameter tetesan tidak tergantung pada laju aliran. Perangkat ini hanya memiliki 100 generator ini, yang pada outputnya memberikan throughput 100.000 tetes per detik.
Setiap tetes dienkapsulasi dengan 1 butiran atau tidak tersentuh. Pada saat yang sama, konsentrasi tertentu dicapai - 10 tetes lebih banyak dari mikrogranula (misalnya, 20 tetes - 10 dengan butiran dan 10 tanpa). Ini mengurangi kemungkinan bahwa dalam satu tetes akan ada dua butiran hingga 0,5%.
Mengikuti generator tetesan, ada garis penundaan yang mirip dengan spiral dengan lebar saluran 1,8 mm dan tinggi 1,5 mm. Garis penundaan harus cukup panjang, tetapi Anda tidak dapat menambah ukuran perangkat. Oleh karena itu, 4 spiral dibuat satu lawan satu, untuk sepenuhnya lulus yang pada laju aliran 67 ml / jam, tetes akan memakan waktu 3,2 menit.
Untuk memperkenalkan perangkat semacam itu ke dalam platform seluler, penting untuk menyelesaikan tugas-tugas tertentu yang terkait dengan kamera ponsel. Penggunaan eksitasi cahaya konstan waktu yang biasa mengarah pada fakta bahwa tetesan bergerak di bidang penglihatan kamera divisualisasikan sebagai garis-garis. Panjang strip ini menentukan jarak minimum antara tetesan dan, karenanya, secara serius membatasi throughput.
Jika kita menggunakan eksitasi ringan dengan urutan pseudo-acak (dalam waktu), ini akan memungkinkan kita untuk "melihat" setiap tetes. Kecepatan modulasi cahaya adalah 10 kali waktu pencahayaan kamera. Karena perbedaan ini, droplet membentuk strip, jarak antara (tiga diameter droplet) cukup untuk penentuan masing-masing. Dalam hal ini, Anda dapat melewati 120 saluran tetesan paralel di depan kamera.
Poin penting lainnya dalam mendeteksi dan memindai adalah fluoresensi. Untuk melakukan ELISA multiplex, diperlukan beberapa sinyal fluoresens yang berbeda. Untuk ini, 3 sumber cahaya digunakan sekaligus, masing-masing memiliki panjang gelombang yang diperlukan untuk mengeluarkan zat warna fluoresen tertentu. Sistem tripel ini terdiri dari dua laser dioda (biru, hijau) dan satu LED (UV).
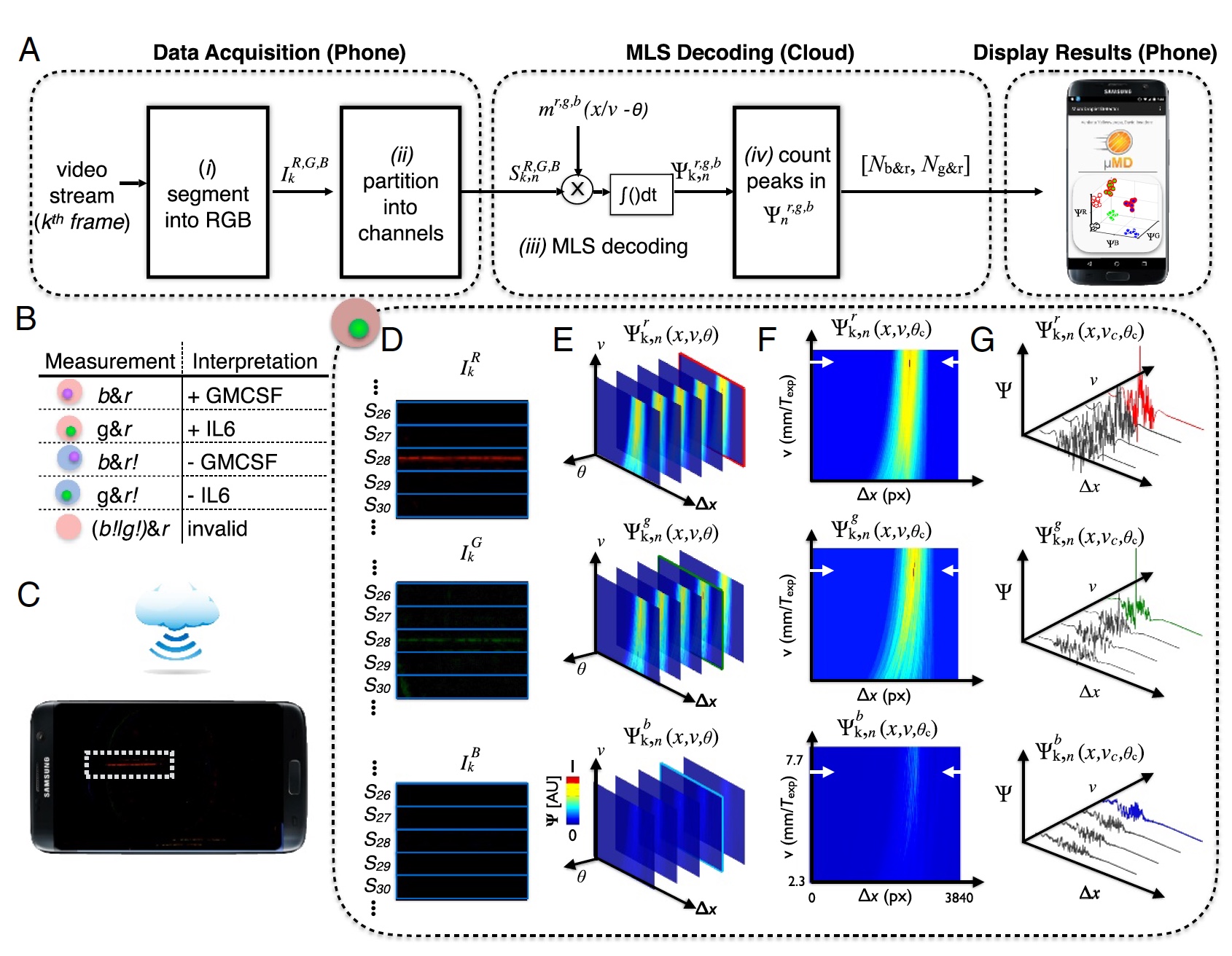 Gambar No. 3: proses "sampel-hasil" (decoding data dari kamera ponsel).
Gambar No. 3: proses "sampel-hasil" (decoding data dari kamera ponsel).Untuk decoding video yang akurat dari kamera ponsel, perlu dilakukan deteksi korelasi untuk tiga pola modulasi yang diharapkan (
m ), yang sesuai dengan masing-masing dari tiga sumber cahaya.
Hasilnya adalah vektor korelasi (
3a ), di mana:
k - frame;
n = 1: 120 saluran di perangkat;
R ,
G ,
B - saluran warna kamera digital;
r ,
g ,
b - eksitasi warna.
Pola tetesan diciptakan melalui urutan panjang maksimum (MLS) dengan | m | = 63 bit. Selain itu, setiap bit adalah 10 piksel dalam gambar digital, yaitu, total 63 bit adalah 630 piksel (1/3 dari lebar bingkai pada tahun 1920).
Pemindaian fluoresensi diperlukan untuk menentukan apakah setetes mengandung mikrogranule, jika demikian, untuk menentukan warna (UV atau protein hijau, molekul target merah). Setelah menerima data ini, mereka harus diekstraksi. Untuk melakukan ini, bingkai video dibagi menjadi komponen merah, hijau dan biru sesuai dengan sensor kamera (
3d ).
Perangkat ini menggunakan teknologi cloud. Ini dilakukan untuk mengurangi beban pada setrika (yaitu, pada ponsel itu sendiri). Alih-alih mengendalikan kecepatan atau fase tetesan, komputasi awan dilakukan untuk menentukan tetesan dengan fase atau kecepatan yang tidak diketahui (
3s ). Setelah menentukan fase optimal dan kecepatan tetesan, seseorang dapat dengan tepat menentukan puncak dalam ruang korelasi Ψ
r, g, b k, n (x, υ
c , θ
c ) (
3f dan
3g ).
Data yang dikumpulkan diunggah ke aplikasi khusus (sejauh ini hanya pada OS Android), yang mengirimkannya ke cloud untuk diproses menggunakan MATLAB pada server jarak jauh. Setelah itu, data yang sudah diproses dikembalikan ke smartphone dan ditampilkan di layar.
Setelah semua pekerjaan persiapan dan pengujian, para ilmuwan memutuskan untuk melakukan "perdebatan" dengan partisipasi penciptaan mereka dan perangkat Simoa ukuran penuh komersial yang ada.
Dalam duel uji, tiga versi media kerja digunakan: PBS - buffer natrium fosfat, FBS - serum sapi janin dan serum darah manusia. Indikator yang paling penting adalah batas deteksi (LOD), yaitu, konten minimum analit dalam sampel.
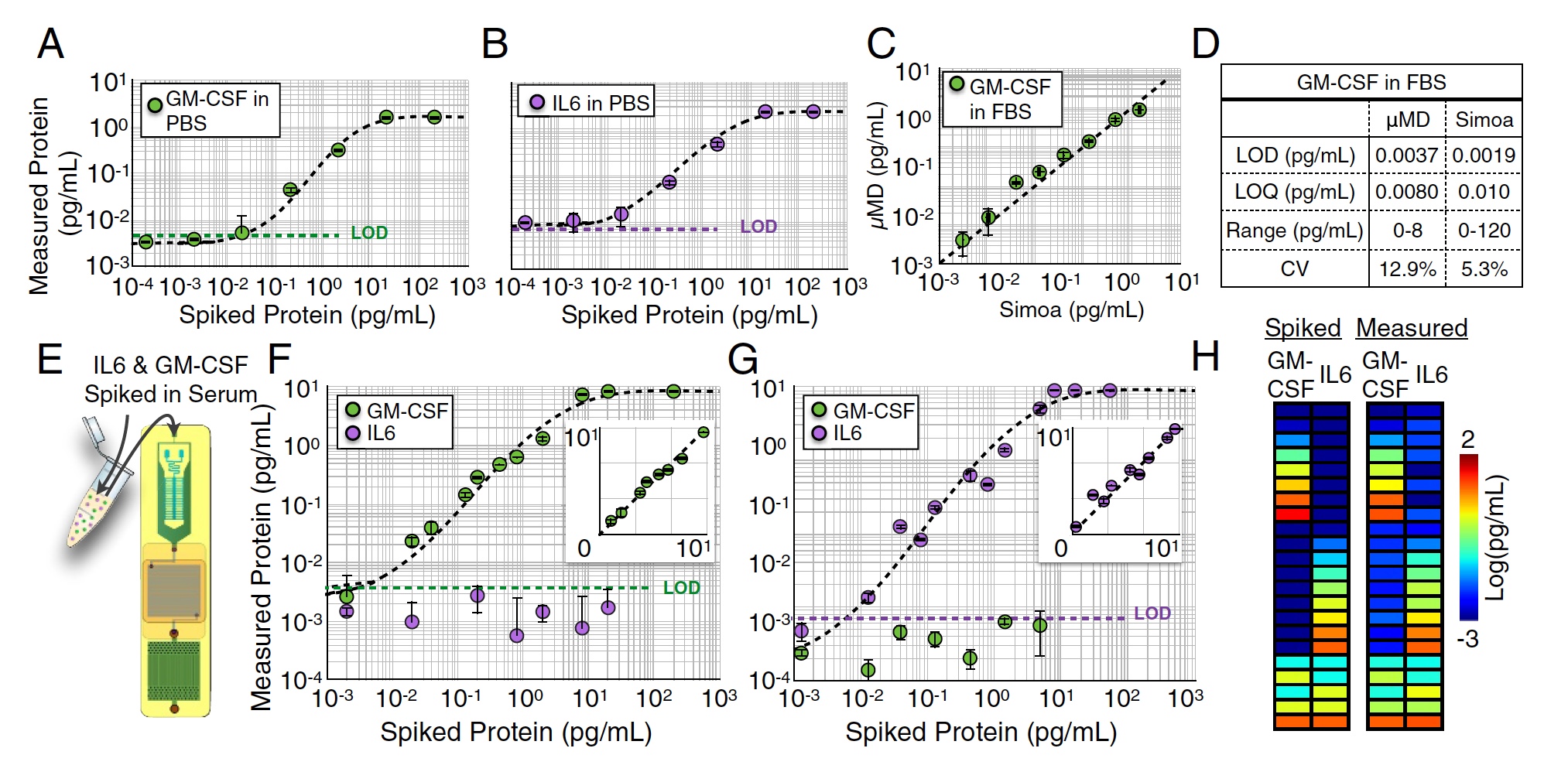
Hasil tes chip MD.
Beberapa pengukuran tunggal-kompleks M-CSF (Gambar
A di atas) dan IL6 (Gambar
B ) dilakukan dalam media PBS dengan mengukur pengenceran serial dari 104 hingga 102 pg / ml. Dalam tes ini, batas deteksi yang sangat baik diperoleh: LOD = 0,0045 pg / ml untuk GM-CSF dan LOD = 0,0070 pg / ml untuk IL6.
Pengukuran serupa juga dilakukan dalam larutan FBS (1: 4). Pada tahap ini, sampel untuk analisis dibagi dua antara perangkat yang diteliti dan Simoa "kelas berat" komersial. Akibatnya, penciptaan ilmuwan menunjukkan hasil yang sangat baik, yang praktis tidak kalah dengan Simoa (R2 = 0,95, gambar
C di atas).
Tetapi itu adalah analisis satu-pleks, yaitu, analisis satu indikator. Sekarang perlu untuk memeriksa bagaimana chip MD akan mengatasi analisis paralel dari beberapa protein, yaitu, dengan analisis dupleks GM-CSF dan IL6 secara bersamaan. Untuk mulai dengan, sejumlah GM-CSF ditambahkan ke FBS, dan konsentrasi IL6 adalah nol (gambar
F dan
G ). Kemudian yang sebaliknya dilakukan: konsentrasi nol GM-CSF dan beberapa IL6.
Dalam kedua kasus, batas deteksi tidak berbeda jauh dari hasil analisis satu-plex yang dilakukan sebelumnya (p> 0,88 untuk GM-CSF dan p> 0,90 untuk IL6).
Setelah itu, sejumlah GM-CSF dan IL6 (gambar h) ditambahkan ke sampel. Akurasi deteksi sangat baik - R2> 0:99 untuk GM-CSF dan R2> 0:99 untuk IL6.
Tes yang paling signifikan adalah analisis serum manusia. Sampel darah diambil dari 14 subyek. Para peneliti mengukur GM-CSF dan IL6 dari sampel ini menggunakan chip MD dan Simoa.
 Hasil kuantitatif serum manusia GM-CSF dan IL6 menggunakan MD dan Simoa.
Hasil kuantitatif serum manusia GM-CSF dan IL6 menggunakan MD dan Simoa.Hasil analisis menggunakan chip MD ternyata sangat dekat dengan hasil Simoa (R2 = 0: 96), yang saat ini merupakan penganalisa yang paling akurat.
Demonstrasi perangkat.Untuk seorang kenalan yang lebih terperinci dengan nuansa dan perincian studi ini, saya sarankan Anda melihat
laporan kelompok riset dan
bahan -
bahan tambahan untuknya.
Epilog
Kecepatan memainkan peran besar dalam kedokteran. Semakin cepat diagnosis akurat dibuat, semakin cepat Anda dapat memulai perawatan. Terkadang bahkan bukan tentang hari, tetapi menit yang tidak bisa disia-siakan. , - . , , .
, MD, , . , , , . 500 . - 5.
Setiap orang memiliki hak untuk berobat, tetapi karena berbagai alasan hak ini jauh dari selalu dan tidak di mana-mana sebanding dengan kenyataan. Penelitian serupa dan perangkat serupa akan membantu mengubahnya.Terima kasih atas perhatian Anda, tetap ingin tahu dan selamat bekerja, kawan.Terima kasih telah tinggal bersama kami. Apakah Anda suka artikel kami? Ingin melihat materi yang lebih menarik? Dukung kami dengan melakukan pemesanan atau merekomendasikannya kepada teman-teman Anda,
diskon 30% untuk pengguna Habr pada analog unik dari server entry-level yang kami buat untuk Anda: Seluruh kebenaran tentang VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps dari $ 20 atau bagaimana membagi server? (opsi tersedia dengan RAID1 dan RAID10, hingga 24 core dan hingga 40GB DDR4).
VPS (KVM) E5-2650 v4 (6 Cores) 10GB DDR4 240GB SSD 1Gbps hingga musim panas gratis ketika membayar untuk jangka waktu enam bulan, Anda dapat memesan di
sini .
Dell R730xd 2 kali lebih murah?Hanya kami yang memiliki 2 x Intel Dodeca-Core Xeon E5-2650v4 128GB DDR4 6x480GB SSD 1Gbps 100 TV dari $ 249 di Belanda dan Amerika Serikat! Baca tentang
Cara Membangun Infrastruktur Bldg. kelas menggunakan server Dell R730xd E5-2650 v4 seharga 9.000 euro untuk satu sen?