Publikasi sebelumnya menerima penilaian negatif dengan kata-kata "mengapa memposting hal-hal mendasar di sini". Karena itu, saya segera memperingatkan bahwa materi ini ditujukan terutama untuk anak sekolah yang mulai belajar kimia. Dan juga bagi mereka yang tidak memahami subjek ini di tahun-tahun sekolah mereka. Saya akan memposting artikel tentang sumber daya khusus yang populer untuk anak sekolah jika ada.
Dan ya, saya sadar akan keberadaan model atom di mana elektron merupakan gelombang probabilitas yang terletak di dekat nukleus. Tetapi, sebagai suatu peraturan, sulit bagi siswa untuk membayangkan bagaimana probabilitas dapat menggabungkan atom menjadi molekul. Karena itu, saya nyatakan "dengan jari."
Koneksi atom ke dalam molekulDunia kita tidak ada dalam bentuk atom yang terpisah, mereka entah bagaimana terhubung satu sama lain. Yang mana
Ambil dua atom hidrogen. Masing-masing mengandung satu proton dan satu elektron, sehingga muatan total masing-masing atom adalah nol.
Hukum liontin
F = k * q1 * q2 / r ^ 2memberitahu kita bahwa benda-benda netral tidak boleh saling tertarik
(q1 = 0, q2 = 0) .
Jadi, hidrogen (dan elemen kimia lainnya) harus ada hanya dalam bentuk atom, dan tidak pernah bergabung menjadi molekul. Faktanya, atom hidrogen selalu bergabung berpasangan. Mengapa
Mari kita ambil dua keping logam, dan susun secara paralel dengan jarak kecil satu sama lain.

Kedua segmen mengandung jumlah proton dan elektron yang sama, oleh karena itu, muatan total masing-masing sama dengan nol. Jadi, mereka tidak punya alasan untuk saling tertarik.
Kita tahu bahwa dalam logam, sebagian elektron eksternal meninggalkan atomnya dan dengan bebas berjalan di antara ion (atom terlantar) dari kisi kristal logam. Dan elektron-elektron ini didistribusikan rata-rata secara merata.
Bayangkan kita berhasil memindahkan sebagian elektron bebas ini ke sisi kiri segmen logam yang lebih rendah. Terlebih lagi, di sisi kanannya akan ada defisit elektron.

Kami mendapat apa yang disebut dipol: sisi kiri segmen bermuatan negatif, kanan adalah positif. Bagus Dan apa yang akan terjadi di segmen atas? Kita tahu bahwa tuduhan yang sama saling tolak, sedangkan yang sebaliknya menarik. Akibatnya, elektron dari segmen atas, mulai dari medan listrik elektron dari segmen bawah, akan pergi ke sisi kanan. Artinya, gambar distribusi elektron dalam dua segmen logam ini akan menjadi cermin:
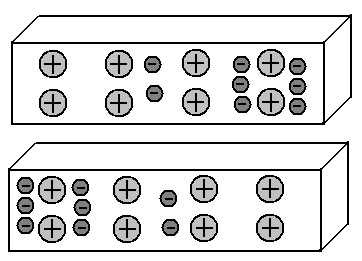
Efek objek bermuatan pada objek tetangga, yang mengarah ke redistribusi muatan di dalamnya, disebut induksi elektrostatik.
Sekarang hal yang paling menarik: inti atom bermuatan positif di sisi kiri segmen atas adalah elektron berlawanan yang dikumpulkan di sisi kiri segmen bawah. Dan tuduhan sebaliknya ditarik. Jadi, bagian kiri dari segmen akan mulai menarik satu sama lain!
Hal yang sama akan terjadi di sisi kanan segmen - hanya dicerminkan. Dan ujung kanan segmen juga akan tertarik satu sama lain. Luar biasa, bukan? Redistribusi biaya di dalam salah satu segmen konduktor telah menyebabkan ketertarikan timbal balik dari kedua segmen ini!
Tetapi apa yang terjadi jika kita sekarang memindahkan elektron bebas dari segmen bawah ke ujung kanan? Kemudian elektron bebas dari segmen atas akan bergerak ke ujung kiri. Artinya, memindahkan elektron bolak-balik di salah satu segmen, kami membuat elektron dari segmen tetangga bergerak, yang tidak terhubung dengan cara apa pun dengan yang pertama! Efek seperti pergerakan elektron dalam satu konduktor pada pergerakan elektron dalam konduktor yang berdekatan disebut induksi elektrodinamik.
Meskipun ini tidak berlaku untuk topik kami, kami mencatat bahwa kami telah mempelajari dalam bentuk yang agak disederhanakan bagaimana antena dan penerima bekerja selama transmisi radio.
Kita dapat mengatur dua keping logam ini secara berbeda - dengan ujung saling berhadapan:

Jika kita dapat memindahkan elektron, misalnya, ke sisi kanan segmen kiri, elektron segmen kanan, mulai dari mereka, juga akan pindah ke sisi kanan segmen kanan:

Dan dalam hal ini, kedua keping logam ini akan mulai saling menarik, karena ujung proksimalnya memiliki muatan yang berlawanan. Perlu diperhatikan secara khusus bahwa pada varian kedua dari susunan segmen, gaya tarik timbal balik mereka akan lebih lemah, karena hanya ujung yang berlawanan yang tertarik, sedangkan pada varian pertama dari susunan segmen, baik kiri dan kanan tertarik satu sama lain. ujungnya.
Tapi bagaimana hubungannya dengan ikatan atom? Mari kita lihat atom hidrogen. Ia memiliki elektron yang bergerak di sekitar nukleus. Dan jika atom hidrogen kedua ada di dekatnya, elektron ini akan menyebabkan elektron tetangga bergerak dengan cara yang sama ketika mereka bergerak di segmen logam kita - sementara elektron salah satu atom berada di satu sisi inti atomnya, tetangga yang berdekatan akan dipaksa berada di sisi berlawanan dari atomnya.
Di sini, tentu saja, pengaruhnya tidak sepihak, tetapi saling menguntungkan - kedua elektron pertama memengaruhi yang kedua, dan yang kedua memengaruhi yang pertama. Tetapi yang paling penting adalah bahwa kedua atom ini akan tertarik dengan cara yang sama seperti dua keping logam tertarik pada varian kedua dari pengaturan timbal balik mereka (dengan ujung saling berhadapan).
Esensinya sama: elektron-elektron dijauhkan dari satu sama lain, memungkinkan muatan yang berlawanan saling tertarik. Bayangkan bahwa elektron dari salah satu atom berada di antara inti dua atom yang berdekatan, sedangkan elektron atom yang berdekatan berada di titik orbit yang jauh:

Sekarang kita memiliki elektron bermuatan negatif yang terletak di antara dua inti atom yang bermuatan positif. Inti kedua atom tertarik pada elektron ini. Jadi, sebuah elektron saat ini mengikat dua atom.
Jarak antara inti atom lebih besar dari jarak dari masing-masing inti ke elektron yang terletak di antara mereka. Dan kita ingat bahwa kekuatan interaksi muatan berbanding terbalik dengan kuadrat jarak di antara keduanya. Oleh karena itu, pada saat ini, gaya tarik nuklei ke elektron lebih besar daripada saling tolak nukleus.
Tetapi elektron terus bergerak, dan karena itu setelah beberapa saat elektron pertama meninggalkan ruang antara nuklei, tetapi elektron kedua bergerak di sana. Pada saat ini, peran pengikat beralih ke elektron dari atom kedua (momen 3 pada gambar di bawah).

Perhatikan bahwa pada titik waktu yang ditunjukkan pada Gambar 2 dan 4, tidak ada elektron di antara inti atom. Pada saat-saat ini, inti saling tolak. Karena alasan ini, jarak antar atom bervariasi - ia terus berubah selama rotasi elektron di sekitar inti atom, tetapi panjang rata-ratanya, yang disebut panjang ikatan, dipertahankan. Panjang ikatan - jarak antara inti atom - adalah individu untuk setiap pasangan jenis atom yang digabungkan menjadi molekul.
Elektron dari dua atom ini dalam molekul hidrogen yang terbentuk mencoba untuk berjauhan sejauh mungkin, seperti yang mereka lakukan pada segmen logam. Karena ini, sinkronisasi mereka terjadi - lokasi mereka relatif satu sama lain pada setiap revolusi di sekitar inti kira-kira sama.
Ini agak mengingatkan pada kinerja kolektif sebuah waltz, ketika pasangan berputar dengan kecepatan yang sama sehingga baik wanita maupun pria tidak akan pernah bersebelahan, tetapi selalu bergantian:

Artikel ini adalah kutipan dari buku
"Clear Chemistry .
"Ketidakpastian Suci dan Probabilitas SuciTeori kuantum menyatakan bahwa mustahil untuk secara simultan menentukan tempat yang tepat dari elektron dalam ruang dan momentumnya (arah dan kecepatan gerakannya). Oleh karena itu, diyakini bahwa di sekitar nukleus suatu atom terdapat tempat-tempat tertentu (daerah-daerah) di mana kemungkinan mendeteksi suatu elektron adalah tinggi. Daerah-daerah ini disebut orbital elektron.
Teori ini tidak sulit untuk dijelaskan pada contoh rumah tangga. Misalkan Anda tinggal di sebuah apartemen di mana ada kamar tidur, dapur, dan kamar mandi. Jika Anda menghabiskan 90% dari waktu di kamar tidur, 8% dari waktu di dapur, dan 2% dari waktu di kamar mandi, maka orbital Anda dapat dianggap sebagai kamar tidur dan dapur, karena kemungkinan menemukan Anda di kamar mandi sangat rendah. Setelah 100 pengamatan Anda pada titik waktu yang berbeda, pengamat cenderung menemukan Anda di 90 kotak di kamar tidur, dan di 8 kotak di dapur. Dan dengan angka-angka ini akan sampai pada kesimpulan tentang area habitat Anda.
Sekarang tentang mengapa mustahil untuk secara simultan menentukan tempat elektron dalam ruang dan kecepatannya, dan arah geraknya. Itu bahkan lebih mudah. Faktanya adalah bahwa kecepatan hanya dapat diukur pada
segmen tertentu
dari jarak yang ditempuh. Membagi panjang segmen ini dengan waktu yang telah berlalu, kita bisa mengetahui kecepatan gerakan. Tetapi kita tidak dapat menganggap segmen ruang sebagai lokasi tubuh. Lokasi adalah koordinat tubuh yang tepat.
Bayangkan seekor lalat terbang di ruangan gelap. Dengan menerangi ruangan dengan kilatan cahaya yang sangat singkat, kita dapat melihat tempat di mana lalat saat ini berada. Tetapi untuk memahami di mana dan pada kecepatan apa ia terbang, kita harus menyalakan lampu untuk waktu yang lebih lama. Kemudian kita akan melihat perubahan posisi lalat dari waktu ke waktu dan akan dapat memperkirakan kecepatan perubahan ini. Tetapi dalam kasus ini, kita tidak dapat lagi menunjukkan tempat yang tepat di mana lalat berada selama pengukuran kecepatannya, karena selama waktu ini ia bergerak pada jarak tertentu. Itulah inti dari prinsip ketidakpastian.
Elektron yang bergerak di sekitar inti atom dengan sangat cepat mengubah kecepatan dan arah gerak, sehingga tidak mungkin untuk mengatakan dengan tepat di mana mereka berada pada waktu tertentu dan di mana mereka bergerak.
Dan dalam model yang dibahas di atas, elektron bergerak seperti panah dalam sebuah jam. Dan ini tidak bisa tidak menyebabkan kemarahan yang benar dari para penganut Ketidakpastian Suci dan Probabilitas Suci.
Namun, fakta bahwa kita tidak dapat mengatakan dengan tepat di mana elektron ini atau itu berada, dan ke atom mana yang "dimiliki" sama sekali tidak mengubah mekanisme elektrostatik dari ikatan atom. Tidak mungkin mengikat dua proton selain dari menempatkan elektron di antara mereka. Tidak ada probabilitas atau ketidakpastian yang dapat menghubungkan atom ke dalam molekul. Dan itu menunjukkan dengan sempurna ion hidrogen molekul H2 +. Dalam ion ini tidak ada keraguan elektron, tidak ada kompensasi dari spin elektron berpasangan, atau tumpang tindih awan elektron, namun ion ini ada dan stabil.
Selain itu, jangan lupa bahwa ini hanyalah sebuah model, dan kemampuan "penjelas" -nya terbatas, seperti juga kemampuan model lainnya. Sebagai contoh, itu (tampaknya) tidak menjelaskan mengapa atom hidrogen tidak dapat bergabung menjadi rantai panjang seperti H3, H4, dll.
Namun, kita dapat mengasumsikan bahwa karena fakta bahwa orbital elektronik dalam molekul hidrogen dipindahkan ke pusat molekul, mereka tidak "menonjol" dari ujungnya, dan karena itu molekul hidrogen yang berdekatan tidak dapat saling menempel menggunakan mekanisme sinkronisasi elektron.