Penuaan manusia saat ini didefinisikan sebagai penurunan fisiologis fungsi biologis dalam tubuh dengan adaptasi konstan terhadap kerusakan internal dan eksternal. Sistem endokrin memainkan peran penting dalam organisasi interaksi seluler, metabolisme, pertumbuhan dan penuaan. Beberapa studi, dari cacing hingga misha, telah menunjukkan bahwa menekan jalur pertumbuhan hormon / insulin-like factor-1 / insulin (GH / IGF-1 / insulin) aktivitas jalur mungkin berguna untuk memperpanjang umur manusia, sementara hasil pada manusia saling bertentangan. Dalam ulasan ini, kami membahas peran potensial sistem IGF-1 dalam memodulasi umur panjang, berhipotesis bahwa adaptasi endokrin dan metabolisme yang diamati pada centenarian dan mamalia dengan pembatasan kalori mungkin merupakan strategi fisiologis untuk meningkatkan harapan hidup karena pertumbuhan sel yang lebih lambat. Metabolisme, penggunaan cadangan fisiologis yang lebih baik, pergeseran metabolisme seluler dari proliferasi sel menjadi aksi regeneratif dan penurunan akumulasi sel-sel yang menua.
Entri.Penuaan didefinisikan sebagai penurunan fisiologis fungsi biologis dalam tubuh dengan penurunan progresif atau hilangnya adaptasi terhadap kerusakan internal dan eksternal. Pada manusia, fenotipe penuaan sangat heterogen dan dapat digambarkan sebagai mosaik kompleks yang dihasilkan dari interaksi beberapa peristiwa acak dan lingkungan, perubahan genetik dan epigenetik yang terakumulasi sepanjang hidup. Meskipun kompleksitasnya sangat besar, dasar penuaan molekul dibatasi oleh beberapa mekanisme biologis konservatif evolusioner yang bertanggung jawab untuk memelihara dan memulihkan tubuh (1).
Selama 3 dekade terakhir, salah satu topik yang paling banyak dibahas dalam gerontologi adalah peran hormon pertumbuhan (GH) / insulin-like growth factor-1 (IGF-1) / sistem insulin dalam regulasi umur panjang. Akumulasi data menunjukkan bahwa jalur ini memainkan peran penting dalam patogenesis sejumlah penyakit yang berkaitan dengan usia, termasuk kanker, demensia, penyakit kardiovaskular dan metabolisme (2 - 4).
Pada model hewan, penghambatan sistem GH / IGF-1 / insulin telah terbukti secara signifikan meningkatkan rentang hidup. Namun, pada manusia data tersebut saling bertentangan (5, 6).
Ulasan ini menggambarkan kemajuan terbaru dalam studi sistem IGF-1 dan modulasi umur panjang, dan berhipotesis bahwa adaptasi endokrin dan metabolisme yang diamati pada centenarian dan mamalia selama pembatasan kalori mungkin merupakan strategi fisiologis untuk meningkatkan harapan hidup karena lebih lambat pertumbuhan / metabolisme sel, kontrol yang lebih baik dalam transmisi sinyal dan kapasitas cadangan fisiologis, dan mengurangi akumulasi sel-sel yang menua.
Sistem IGF-1 dan daya tahan pada model hewan
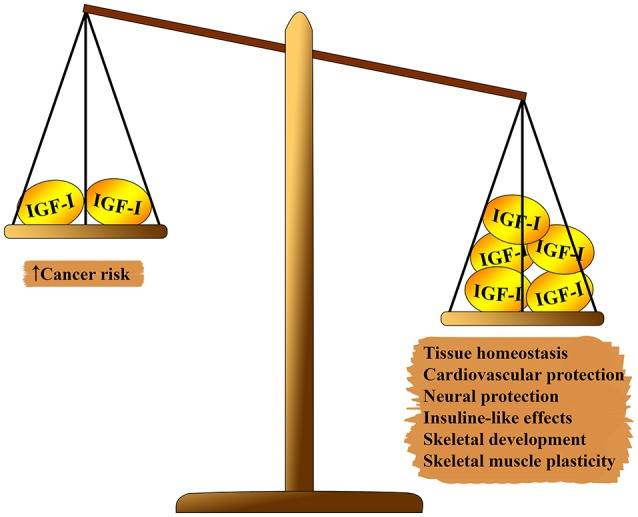 1 Efek pleiotropik IGF-1 pada tubuh. Di satu sisi skala, yang melebihi: homeostasis jaringan, efek kardioprotektif dan neuroprotektif, efek seperti insulin, partisipasi dalam pembentukan kerangka dan regenerasi otot. Di sisi kedua keseimbangan: risiko karsinogenesis.
1 Efek pleiotropik IGF-1 pada tubuh. Di satu sisi skala, yang melebihi: homeostasis jaringan, efek kardioprotektif dan neuroprotektif, efek seperti insulin, partisipasi dalam pembentukan kerangka dan regenerasi otot. Di sisi kedua keseimbangan: risiko karsinogenesis.Sistem IGF-1 memiliki beberapa efek pleiotropik pada penuaan biologis (lihat gambar 1). IGF-1 memainkan peran penting dalam perkembangan janin, pertumbuhannya pada masa kanak-kanak dan remaja, dan homeostasis jaringan dewasa. Selain itu, IGF-1, tampaknya, memiliki efek atheroprotektif, efek perlindungan saraf dan seperti insulin (dalam konsentrasi tinggi), dan mengatur metabolisme tulang dan regenerasi otot. Namun, IGF-1 adalah faktor risiko utama dalam pengembangan beberapa jenis tumor karena aktivitas proliferasi yang kuat, terutama karena modulasi siklus sel, apoptosis dan kelangsungan hidup sel (7 - 9). Sebagian besar efek ini dimediasi oleh interaksi dengan substrat reseptor insulin (IRS) -1 dan-2 dan modulasi jalur target rapamycin PI3K / AKT / mamalia (mTOR) (lihat Gambar 2)
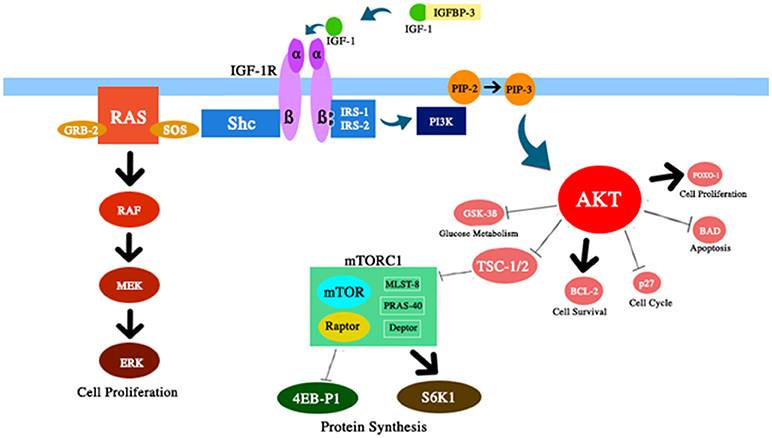 Gambar 2 Representasi skematis dari beberapa komponen jalur IGF-1 / PI3K / AKT / mTOR yang dibahas dalam ulasan ini. IGF-1 meningkatkan aktivitas AKT dengan efek yang sesuai pada kelangsungan hidup dan proliferasi sel, metabolisme glukosa, dan sintesis protein.
Gambar 2 Representasi skematis dari beberapa komponen jalur IGF-1 / PI3K / AKT / mTOR yang dibahas dalam ulasan ini. IGF-1 meningkatkan aktivitas AKT dengan efek yang sesuai pada kelangsungan hidup dan proliferasi sel, metabolisme glukosa, dan sintesis protein.
Beberapa studi praklinis telah melaporkan bahwa mutasi pada gen yang mengontrol jalur pensinyalan GH / IGF-1 / insulin dapat secara signifikan meningkatkan umur pada model hewan invertebrata dan vertebrata (5, 6).
Model Avertebrata.Pada invertebrata, kaskade insulin / IGF diatur oleh beberapa peptida yang mampu berinteraksi dengan satu reseptor insulin / IGF-1 yang umum.
Dalam elegans Caenorhabditis nematoda, jalur insulin / seperti IGF terdiri dari beberapa protein yang dikodekan oleh gen daf-2, usia-1 (mengkode subunit PI3K katalitik), akt-1, akt-2, pdk-1, sgk-1 (serine-threonine kinases ), daf-16, skn-1 dan daf-18 (PTEN, fosfatase terlibat dalam penghambatan jalur pensinyalan AKT). Telah ditunjukkan bahwa berkurangnya aktivitas gen daf-2, usia-1, akt-1, akt-2, pdk-1, sgk-1 menekan jalur ini, dan hewan dengan mutasi ini telah dilaporkan menua lebih lambat dan memiliki rentang hidup lebih lama hingga 300%. Sebaliknya, stimulasi jalur insulin / IGF-seperti mengurangi umur nematoda (10, 11).
Pada lalat buah Drosophila melanogaster, pensinyalan seperti insulin / IGF terdiri dari dINR (protein seperti reseptor insulin / IGF-1), substrat reseptor insulin CHICO, PI3K Dp110 / p60, dan target PK3 PI3K. Dilaporkan bahwa lalat dengan mutasi pada gen-gen ini secara signifikan meningkatkan harapan hidup (12, 13).
Yang mengejutkan, mekanisme molekuler yang sama pada jaringan yang berbeda tidak mempengaruhi penuaan dengan cara yang sama. Beberapa penelitian tentang nematoda dan lalat buah telah menunjukkan bahwa penurunan sinyal insulin / seperti IGF di saraf dan jaringan adiposa memainkan peran utama dalam mengatur umur panjang (14, 15). Meskipun telah ditunjukkan dalam model invertebrata bahwa kaskade ini penting untuk memodulasi umur, efek pensinyalan seperti insulin / IGF pada umur jauh lebih kompleks pada vertebrata karena mereka memiliki insulin spesifik spesifik dan molekul IGF, protein pengikat IGF, protein pengikat IGF (IGFBPs) ), IGFBP, protease GH, beberapa reseptor, dan beberapa mekanisme transmisi sinyal intraseluler dengan ekspresi spesifik jaringan yang berbeda (16).
Model VertebrataBeberapa tikus GH / IGF-1 mutan dirancang dengan target berbeda. Model terbaru dijelaskan di bawah ini.
Tikus Snell dan Ames.Tikus Snell dan Ames adalah dua galur tikus dengan mutasi pada gen PIT-1 dan PROP-1, masing-masing (17, 18). Karena kedua protein PIT-1 dan PROP-1 diperlukan untuk diferensiasi sel-sel hipofisis yang menghasilkan GH, prolaktin, dan hormon perangsang tiroid, kedua jenis tikus mutan homozigot kekurangan ketiga hormon (18). Model-model ini menunjukkan peningkatan yang signifikan dalam harapan hidup (42-70% lebih dari pada tikus tipe liar), peningkatan sensitivitas insulin dan frekuensi tumor yang lebih rendah (19, 20). Ketika tikus Ames dibatasi kalori, masa hidup mereka meningkat lebih banyak lagi (21). Meskipun hewan-hewan ini kekurangan tiga hormon, telah ditunjukkan bahwa peningkatan umur panjang terutama tergantung pada defisiensi GH (22).
Menyalakan / menyalakan mouseTikus lit / lit memiliki kekurangan GH dan mutasi pada gen yang mengkode reseptor hormon pelepas GH (GHRHR). Hewan-hewan ini kerdil, mengalami peningkatan jaringan adiposa, tingkat tumor yang lebih rendah, dan harapan hidup meningkat 23-25% (19).
GH-Releasing Hormone-Knockout (GHRH-KO) mouse.Tikus knockout Hormon pelepas GH (GHRH-KO) hidup 43% (pada wanita) dan 51% (pada pria) lebih lama dari hewan tipe liar dan memiliki banyak karakteristik fenotipik dari tikus Ames, seperti peningkatan sensitivitas terhadap insulin, penurunan trigliserida plasma dan kadar kolesterol, peningkatan jaringan adiposa, peningkatan kadar leptin plasma dan kadar adiponektin (23).
GH-Receptor-Knockout Tikus (GHR-KO)Tikus KO reseptor GH (GHR-KO) telah meningkatkan kadar GH serum dan kadar IGF-1 yang sangat rendah. Dilaporkan juga bahwa strain tikus ini hidup 38-55% lebih lama dari tipe liar (24) dan menunjukkan pengurangan stres oksidatif, serta onset tumor fatal yang lebih rendah dan tertunda (25). Hasil serupa diamati pada tikus df / KO, melintasi dua untaian misha, GHR-KO dan Ames dwarf, yang tidak memiliki reseptor GH dan GH dan terus meningkatkan harapan hidup (26). Tidak seperti saudara Ames liar dan tikus kerdil, pembatasan kalori tidak meningkatkan masa hidup tikus GHR-KO, menunjukkan bahwa sumbu GH / IGF-1 dan pembatasan kalori mungkin memiliki mekanisme yang serupa atau sebagian tumpang tindih untuk memperpanjang umur (27) .
Antagonisme Reseptor GH (GH)Tidak semua model hewan dengan penekanan sistem GH / IGF-1 menunjukkan peningkatan harapan hidup. Jenis GHA tikus adalah salah satu contohnya. GHA, yang dihasilkan dengan mengganti satu asam amino, mampu mengikat reseptor GH dengan afinitas yang sama dengan GH, tetapi tidak menyebabkan pensinyalan intraseluler. Harapan hidup tikus GHA tidak meningkat secara signifikan (28).
IGF-1R +/– TikusSementara sebagian besar tikus dengan reseptor IGF-1 tidak aktif (IGF-1R - / -) mati saat lahir, hewan heterozigot untuk alel mutan dari reseptor IGF-1 (IGF-1R ±) menunjukkan tingkat serum IGF-1 yang sangat rendah. , sekitar 10% lebih kecil dan harapan hidup 33% lebih lama pada wanita dan 16% pada pria. Namun, dalam penelitian ini, kontrol tipe liar bertahan hingga 19 bulan, yang membahayakan interpretasi hasil (29). Studi yang lebih baru mengevaluasi harapan hidup pada garis IGF-1R ± lain menunjukkan sedikit peningkatan harapan hidup sebesar 5-10%, tetapi hanya pada wanita (30, 31). Selain itu, strain latar belakang utama tampaknya memengaruhi derajat perpanjangan masa pakai pada beberapa model mouse (32).
IGF1-R +/− Khusus OtakTikus mutan IGF1-R +/− yang Khusus untuk Otak hidup 9% lebih lama dari tipe liar, yang menekankan peran yang sesuai dari sistem saraf dalam modulasi umur panjang (33).
Tikus-tikus yang terganggu-IGF-1 khusus-hati (LI-IGF-1 - / -).Tikus dengan gangguan produksi IGF-1 (LI-IGF-1 - / -) memiliki kadar serum IGF-1 yang sangat rendah dan kadar GH serum yang tinggi karena inaktivasi gen IGF-1. LI-IGF-1 - / - tikus telah secara nyata mengurangi obesitas dan, sebagai hasilnya, beratnya 25% lebih rendah daripada tikus tipe liar. Hanya tikus betina LI-IGF-1 - / - yang menunjukkan peningkatan harapan hidup 16% dibandingkan dengan tikus kontrol (34).
Pappa - / - tikus.Tikus Pappa - / - memiliki sistem gen untuk protein plasma terkait kehamilan, PAPP-A, PAPPA, protease spesifik untuk protein pengikat IGF. Umur rata-rata strain tikus ini adalah 38% lebih lama dibandingkan dengan kontrol tipe liar. Tikus Pappa - / - adalah kerdil, tetapi kadar glukosa serum, insulin, IGF-1, dan GH mereka tidak berbeda dari kontrol tipe liar, menunjukkan bahwa PAPPA bertindak terutama pada tingkat otokrin atau paracrine. Selain meningkatkan harapan hidup, tikus Pappa - / - menunjukkan insiden tumor yang lebih rendah, serta lesi degeneratif terkait usia (35, 36).
Mouse IRS Disrupted (IRS1 - / -).IRS-1 dan -2 adalah mediator penting untuk insulin serta pensinyalan IGF-1. Tikus IRS1 - / - yang resisten insulin, dengan cacat dalam transmisi sinyal insulin terutama di jaringan otot, sekitar 30% lebih pendek dari tipe liar, dan hanya betina yang memiliki harapan hidup 18% lebih lama dibandingkan dengan hewan tipe liar (37 ) )
Tikus IRS2 - / - juga resisten insulin, tetapi tidak seperti tikus IRS1 - / -, mereka menunjukkan cacat pensinyalan insulin pada lebih banyak jaringan, termasuk hati, jaringan adiposa, dan otot rangka. Tikus-tikus ini mengembangkan diabetes, dan umur mereka jauh lebih pendek daripada tikus tipe liar dan tikus IRS2 ±. Tikus IRS2 +/− telah meningkatkan sensitivitas insulin dan meningkatkan harapan hidup (+ 18%) dibandingkan dengan tikus tipe liar. Selain itu, tikus spesifik otak IRS2 ± dan IRS2 - / - dilaporkan resisten insulin dan hidup 18% dan 14% lebih lama dari kontrol tipe liar, masing-masing (38).
KLOTHO Modified Mice.Protein KLOTHO menghambat insulin dan pensinyalan IGF-1, mungkin dengan mengganggu interaksi reseptor / ligan. Dilaporkan bahwa tikus dengan ekspresi berlebih KLOTHO berukuran normal, dan resistensi insulin berkembang pada laki-laki, dan harapan hidup pada laki-laki dan perempuan meningkat secara signifikan (+18 dan + 30%, masing-masing) (39, 40).
P66shc Mouse Terganggu (P66shc - / -).P66shc adalah protein yang memediasi pensinyalan IGF-1 setelah reseptor dengan mengaktifkan jalur MAPK. Tikus P66shc - / - memiliki fenotipe normal, tetapi hidup 28% lebih lama dari kontrol tipe liar (41). Namun, data ini tidak dikonfirmasi dalam penelitian terbaru (42).
Peran pensinyalan GH / IGF-1 / insulin dalam penuaan dan umur panjang telah dipelajari dalam semua model hewan ini. Sementara invertebrata, efek penindasan jalur IGF-1 / insulin pada harapan hidup jelas dan signifikan, dalam model tikus efek ini melemah dan tidak dapat direproduksi dalam beberapa kasus, seperti dalam garis IGF-1R ± dan P66shc - / - tikus Namun, sebagian besar model ini menunjukkan beberapa fitur umum di antara tikus yang berumur panjang, seperti penurunan kadar IGF-1 dan insulin yang beredar dan peningkatan sensitivitas insulin, yang cenderung mengurangi kejadian kanker, meningkatkan ketahanan terhadap stres dan memperpanjang hidup. . Perubahan genetik yang dapat mengganggu sistem IGF-1 dapat membuat hewan tetap sehat untuk jangka waktu yang lebih lama dan dapat menunda atau mengurangi beberapa penyakit yang berkaitan dengan usia. Dalam proses ini, jaringan saraf dan lemak memainkan peran penting.
Selain itu, data tambahan diperlukan untuk menentukan titik waktu terbaik selama rentang hidup untuk melakukan intervensi dalam penekanan sistem IGF-1 untuk mendapatkan efek positif pada rentang hidup. Pada igf f / f C57B l / 6 tikus, defisiensi IGF-1 yang bersirkulasi, mulai dari usia 5 bulan atau lebih awal, meningkatkan harapan hidup sebesar 15% hanya pada wanita dengan penurunan jumlah organ dengan patologi pada akhir kehidupan dibandingkan dengan kelompok kontrol. . Selain itu, defisiensi IGF-1 akhir (15 bulan) mengurangi risiko kanker, tetapi tidak memiliki efek positif pada harapan hidup (43). Data ini menggarisbawahi pentingnya kekurangan IGF-1 pada usia dini untuk meningkatkan harapan hidup. Di sisi lain, Mao et al. (44) baru-baru ini melaporkan bahwa pemberian antibodi monoklonal yang terlambat terhadap reseptor IGF-1 pada tikus CB6F1 yang berusia 18 bulan memperpanjang harapan hidup wanita sebesar 9% dan meningkatkan beberapa aspek kesehatan.
Sistem IGF-1 pada orang berumur panjang
Centenarian Centenarian dianggap sebagai model manusia terbaik untuk mempelajari faktor-faktor penentu biologis umur panjang, yang telah mencapai nilai paling ekstrem dari harapan hidup manusia (45).
Beberapa studi membandingkan insulin yang bersirkulasi dan level IGF-1 pada usia panjang dengan mereka yang berada dalam kontrol yang lebih muda (46).
Renovasi metabolik terkait usia adalah proses fisiologis yang terjadi pada seluruh populasi. Penuaan sering dikaitkan dengan penurunan toleransi glukosa, yang dikaitkan dengan peningkatan resistensi insulin (47), tetapi orang yang berumur panjang memiliki pengecualian. Ditemukan (48) bahwa resistensi insulin meningkat dengan bertambahnya usia dan menurun pada orang yang lebih tua dari 90 tahun yang tinggal di Italia selatan. Memang, subjek berumur panjang menunjukkan sensitivitas insulin yang lebih tinggi dan fungsi sel beta yang lebih baik daripada subyek yang lebih muda. Perbedaan ini juga tidak tergantung pada faktor antropometrik dan metabolisme utama. Pada pasien berusia 100 tahun, konsentrasi glukosa plasma selama 2 jam lebih rendah daripada pada orang tua (usia rata-rata 78 tahun). Pada jangka panjang, konsumsi glukosa yang dimediasi insulin lebih tinggi daripada pada kontrol lansia selama pengambilan glukosa euglikemik, yang mempertahankan toleransi glukosa dan aksi insulin yang diawetkan dalam kelompok yang berumur panjang ini (49, 50). Hasil serupa mengkonfirmasi sensitivitas terbaik terhadap insulin yang diamati pada populasi lain dari long-liver (51, 52).
Selain itu, hati yang lama menunjukkan efek insulin yang dipertahankan tidak hanya pada metabolisme glukosa, tetapi juga pada jaringan adiposa. Bahkan, infus insulin biasanya dikaitkan dengan penghambatan lipolisis dan, dengan demikian, dengan penurunan yang signifikan dalam konsentrasi asam lemak bebas dan trigliserida dalam plasma. Pada jangka panjang, aktivitas penghambatan insulin selama lipolisis lebih tinggi daripada peserta kontrol (usia rata-rata 78 tahun) (50).
Perlu dicatat bahwa centenarian juga memiliki nada simpatik yang lebih rendah dibandingkan dengan kontrol orang dewasa, yang mungkin terkait dengan aksi insulin yang lebih baik dan, oleh karena itu, dengan tingkat rendah insulin plasma puasa (53, 54).Data pada sistem IGF-1 mengenai harapan hidup masih kontradiktif dalam mata pelajaran yang berumur panjang (46). Paolisso et al. (55) menggambarkan peningkatan rasio IGF-1 / IGFBP-3 plasma dalam hati yang sehat dibandingkan dengan orang tua. Mereka menyarankan bahwa peningkatan rasio ini menunjukkan bioavailabilitas IGF-1 yang lebih tinggi, yang berkontribusi pada peningkatan aksi insulin pada usia panjang. Bonafè et al. (56) melaporkan bahwa subyek dengan setidaknya alel A dari gen reseptor IGF-1 (G / A, kodon 1013) memiliki kadar plasma IGF-1 bebas plasma dan lebih umum di antara orang yang berumur panjang. Arai et al. (57) menggambarkan kadar IGF-1 serum yang relatif rendah pada populasi orang Jepang. Dalam populasi ini, tingkat terendah baik IGF-1 dan IGFBP-3 dikaitkan dengan peningkatan mortalitas (58).Hasil yang bertentangan ini mungkin mencerminkan kompleksitas sistem IGF dan perbedaan etnis dalam populasi terdaftar. Selain itu, centenarian sering dibandingkan dengan kelompok kontrol dari subjek yang lebih muda. Dengan demikian, dalam sebagian besar studi ini, tidak mungkin untuk menyimpulkan apakah perbedaan antara IGF-1 pada kedua kelompok dikaitkan dengan harapan hidup yang berbeda atau mencerminkan penurunan usia IGF-1 yang tergantung secara fisiologis. Memang, ada beberapa batasan untuk studi hati yang lama: (1) prevalensi rendah (1 centenary per 5-10.000 penduduk), (2) kelemahan karena usia yang ekstrem (hampir 95% dari hati yang lama memiliki setidaknya 1 kriteria asthenia), (3 ) tidak adanya kelompok kontrol pada usia yang sama (45, 59). Karena keterbatasan ini, model manusia ini tidak cocok untuk mempelajari variabel terkait usia,yang mungkin terlibat dalam memodulasi harapan hidup.Keturunan centenarian adalah model lain yang menarik untuk menentukan faktor-faktor terkait yang terkait dengan umur panjang manusia dan penuaan yang sehat. Serangkaian pengamatan yang konsisten di negara-negara yang berbeda menunjukkan bahwa keturunan penderita lama lebih sehat daripada perwakilan dari kelompok demografis yang sama (51, 60, 61) dan secara biologis (secara epigenetik) lebih muda dari usia kronologis mereka (62). Secara umum, studi ini menunjukkan bahwa kerabat centenarian lebih cenderung hidup lebih lama dan memiliki kesehatan yang baik (60, 63). Selain itu, studi tentang keturunan penderita lama memiliki keuntungan memiliki kelompok kontrol yang dipilih secara demografis yang terdiri dari keturunan yang sebanding usia, di mana kedua orang tua lahir dalam kelompok yang sama dari centenarians, tetapi meninggal sebelum usia ambang.setelah itu orang diklasifikasikan sebagai "centenarians." Strategi ini sangat penting untuk mencegah efek kohort. Dengan demikian, model keturunan long-liver dapat mengatasi beberapa keterbatasan yang ditemukan dalam studi long-liver (kelangkaan, kelemahan, dan kurangnya kontrol yang tepat) (60).Dalam beberapa penelitian, sistem IGF-1 / insulin dikarakteristikan sebagai turunan dari hati lama dan pada kelompok kontrol yang sesuai.Kami mengevaluasi bioaktivitas yang beredar dari IGF-1, diukur dengan menggunakan uji aktivasi reseptor kinase inovatif (KIRA) yang dilakukan pada umur panjang, keturunan lama, dan keturunan kontrol yang sebanding. Keturunan dari hati panjang dan hati panjang memiliki aktivitas biologis IGF-1 yang relatif lebih rendah dibandingkan dengan kelompok kontrol. Menariknya, aktivitas biologis IGF-1 pada keturunan penderita lama berbanding terbalik dengan sensitivitas insulin (51).Suh et al. (64) mengevaluasi kadar serum IGF-1 dalam keturunan centenarian Yahudi Ashkenazi dan kontrol yang sebanding dengan usia. Pada anak perempuan yang berumur panjang, serum IGF-1 35% lebih tinggi daripada peserta kontrol. Perbedaan ini dapat mewakili respons kompensasi terhadap penurunan pensinyalan reseptor IGF-1. Selain itu, keberadaan Yahudi dari para centenarian Ashkenazi menggambarkan adanya mutasi heterozigot yang berlebihan dalam gen reseptor IGF-1 bersamaan dengan level IGF-1 serum yang relatif tinggi dan penurunan aktivitas reseptor IGF-1 dibandingkan dengan kelompok kontrol tanpa umur panjang keluarga.Untuk mempelajari umur panjang, penulis lain memeriksa saudara dan saudari yang berusia sembilan puluh tahun dan keturunan mereka. Dalam studi umur panjang Leyden, 421 keluarga dipilih, yang terdiri dari setidaknya dua reporter, saudara dan saudari, keturunan dan pasangan keturunan mereka sebagai kontrol. Dalam populasi ini, glukosa serum, insulin, dan trigliserida adalah biomarker terbaik untuk penuaan yang sehat (kadar glukosa dan insulin yang rendah dianggap sehat) (65). Centenarian berusia sembilan tahun dalam rasio IGF-1 / IGFBP-3 terendah dalam aliran darah dikaitkan dengan kelangsungan hidup yang lebih baik (66). Keturunan anak berusia sembilan tahun menunjukkan sensitivitas insulin yang lebih baik dibandingkan dengan pasangannya, sementara kadar serum puasa IGF-1 dan IGFBP-3 yang sama diamati pada kedua kelompok puasa (67). Menarikbahwa total sekresi GH 24 jam adalah 28% lebih rendah pada keturunan dibandingkan dengan kontrol (68).Pendekatan lain yang diambil untuk mempelajari umur panjang pada manusia adalah memilih komponen keluarga untuk umur panjang yang luar biasa dan penuaan yang sehat berdasarkan kriteria yang ketat, seperti Long Life Family Study, ukuran rentang hidup keluarga. Keluarga-keluarga ini, dipilih untuk harapan hidup yang luar biasa, dibandingkan dengan kelompok kontrol tanpa riwayat keluarga yang panjang umur (69). Dalam populasi ini, tingkat sirkulasi IGF-1 terbukti menjadi biomarker terkait usia yang dapat diandalkan (70).Untuk mendukung peran potensial sistem GH / IGF-1 / insulin dalam umur panjang manusia, ada banyak studi genetik. Memang, telah ditemukan bahwa beberapa lokus genetik dikaitkan dengan tingkat sirkulasi IGF-1 dan IGFBP-3 dan berpotensi mampu mempengaruhi penuaan (71). Analisis genom yang luas pada asosiasi yang dilakukan pada usia sembilan puluh tahun dan populasi pasien berusia <60 tahun menunjukkan hubungan yang jelas antara variasi genetik gen yang terlibat dalam jalur insulin / IGF-1 dan umur manusia (72). Dalam sebuah studi prospektif pada orang tua, wanita dengan profil genetik, menunjukkan penurunan aktivitas pensinyalan insulin / IGF-1, menunjukkan masa hidup yang lebih lama (73).Dalam empat kohort independen dari individu yang berumur panjang, peningkatan linear dalam prevalensi homozigositas reseptor GH 3 eksogen (G3R) dengan usia baru-baru ini telah dijelaskan. Kehadiran genotipe d3 / d3 meningkatkan harapan hidup sekitar 10 tahun (74).IGF-1
Salah satu pengamatan paling meyakinkan dalam biologi penuaan adalah kemampuan untuk membatasi kalori untuk mencegah atau menunda beberapa penyakit yang berkaitan dengan usia dan meningkatkan harapan hidup mamalia (75-78). Mekanisme biologis dari fenomena ini tidak sepenuhnya jelas, tetapi saran dibuat tentang keterlibatan potensial dari perubahan terkait dalam metabolisme energi, sistem endokrin dan kerusakan oksidatif.
Pembatasan kalori menyebabkan banyak perubahan hormon. Pada tikus, pembatasan kalori tanpa kelaparan menekan tingkat sirkulasi IGF-1 dan insulin secara proporsional dengan tingkat pembatasan, meningkatkan sensitivitas insulin dan ketahanan terhadap stres dan toksisitas, dan mengurangi risiko kanker (79, 80). Menariknya, sebagian besar karakteristik ini diamati pada tikus tipe liar selama pembatasan kalori mirip dengan yang dilaporkan pada tikus yang berumur panjang karena kerusakan genetik sinyal GH / IGF-1 / insulin, seperti dijelaskan sebelumnya.
Uji klinis acak pada manusia menunjukkan bahwa pembatasan kalori tidak mengurangi IGF-1 serum kecuali asupan protein berkurang (81, 82). Namun, meta-analisis baru-baru ini mengevaluasi efek pembatasan nutrisi pada biomarker penuaan sehat yang diakui telah menunjukkan penurunan kadar IGF-1 manusia dalam darah (83).
Perubahan hormon lain, seperti penurunan kadar insulin, hormon tiroid dan kadar leptin, serta peningkatan adiponektin dan sensitivitas insulin, diamati selama pembatasan diet (85, 86).
Adaptasi hormon ini dapat memainkan peran penting dalam memperpanjang hidup melalui beberapa mekanisme:
1) Penurunan laju metabolisme, proliferasi sel, dan stres oksidatif. Faktanya, IGF-1 adalah faktor pertumbuhan yang kuat, dan hormon tiroid adalah stimulan kuat dari laju metabolisme dasar dan metabolisme oksidatif. Selain itu, pola transkripsi menunjukkan bahwa pembatasan kalori moderat kronis pada orang dewasa memperlambat proses penuaan, mengubah metabolisme sel dari pertumbuhan ke pemeliharaan dan pemulihan (84).
2) Mengurangi akumulasi sel-sel penuaan. Penuaan sel telah terbukti menjadi mediator utama penuaan (87). Seiring waktu, homeostasis protein berkurang dan kerusakan menumpuk. Menariknya, beberapa penyakit yang berkaitan dengan usia dapat ditunda dengan melemahkan akumulasi sel-sel penuaan (88, 89). Biasanya, jalur mTOR diaktifkan oleh beberapa sinyal, termasuk nutrisi, IGF-1, dan insulin (Gbr. 2). Deregulasi jalur ini, yang dilaporkan setelah pembatasan kalori, meningkatkan umur beberapa organisme. Efek ini, tampaknya, adalah sekunder dari peningkatan autophagy, proses pencernaan sitoprotektif. Sebenarnya, autophagy adalah proses pemrosesan sel yang dapat menghilangkan komponen seluler yang lama atau rusak, mencegah akumulasi sel-sel yang menua (90, 91).
3) Menangkal peradangan. Intervensi diet pada hewan dan manusia dapat memperlambat proses penuaan, melemahkan status inflamasi pada tingkat yang lemah (83, 92). Mekanisme yang mendasari aktivitas anti-inflamasi dari pembatasan nutrisi tidak didefinisikan secara jelas. Dipercayai bahwa efek ini disebabkan oleh penurunan massa lemak dan adipokin proinflamasi, serta peningkatan integritas penghalang usus yang diamati selama intervensi makanan (93, 94).
Sangat menarik untuk dicatat bahwa profil biokimia endokrin yang diamati pada subjek selama pembatasan kalori sebanding dengan pada centenarian, yang mengkonfirmasi peran potensial sistem endokrin dalam memodulasi harapan hidup. Selain meningkatkan sensitivitas insulin dan menurunkan kadar IGF-1 plasma / serum, beberapa penelitian telah menunjukkan peningkatan kadar adiponektin yang bersirkulasi dan penurunan kadar hormon leptin dan tiroid yang bersirkulasi pada orang yang berumur panjang dibandingkan dengan orang yang lebih muda.
Jaringan adiposa adalah organ endokrin yang menghasilkan beberapa sitokin yang terlibat dalam proses yang relevan, seperti metabolisme energi, homeostasis lipid dan glukosa, dan modulasi respon inflamasi. Jaringan adiposa visceral memainkan peran utama dalam perkembangan penyakit metabolik (95). Penuaan dikaitkan dengan peningkatan massa lemak dan redistribusi jaringan adiposa, ditandai dengan hilangnya lemak subkutan perifer dan akumulasi lemak visceral. Pada orang tua, perubahan sekresi, sintesis dan fungsi adipokine telah dijelaskan, mungkin karena ketidakseimbangan dalam fungsi, proliferasi, ukuran dan jumlah sel lemak (86). Adiponectin adalah sitokin yang peka terhadap insulin, antiinflamasi, dan anti aterogenik. Adiponektin bersirkulasi dalam darah dalam beberapa bentuk: trimer, hexamer, multimer dengan berat molekul tinggi (HMW) dan globular adiponectin (bentuk terpecah secara proteolitik). Multimer HMW diyakini sebagai bentuk adiponektin yang lebih aktif untuk perlindungan terhadap resistensi insulin dan diabetes (96). Adiponektin yang bersirkulasi secara independen dan negatif dikaitkan dengan aspek-aspek sindrom metabolik, termasuk resistensi insulin, berat badan, tekanan darah, dan lipid serum. Leptin terutama diproduksi di subkutan dan sedikit di jaringan adiposa putih visceral. Sitokin ini mengatur asupan makanan, pengeluaran energi, dan atherogenesis. Leptin meningkatkan penurunan berat badan dengan mengurangi nafsu makan dan merangsang metabolisme dan memiliki sifat proinflamasi (97).
Beberapa penelitian telah melaporkan bahwa hati yang lama memiliki kadar adiponektin plasma yang lebih tinggi dan konsentrasi leptin yang lebih rendah daripada kontrol yang lebih muda (53, 98 - 102). Semua bentuk adiponektin meningkat secara signifikan pada hati panjang, tetapi multimer HMW secara signifikan lebih tinggi (99). Pada jangka panjang, konsentrasi adiponektin yang tinggi ternyata tidak tergantung pada BMI, fungsi ginjal atau kardiovaskular dan dikaitkan dengan fenotip metabolik yang menguntungkan (kadar HDL-C yang lebih tinggi, hemoglobin yang terglikasi rendah, insulin, HOMA-IR dan trigliserida) (98, 99). Peningkatan kadar adiponektin juga ditemukan pada keturunan subjek yang berumur panjang (lebih dari 95 tahun) (103).
Penurunan kadar hormon tiroid tampaknya merupakan karakteristik dari hati yang lama. Mariotti et al. (104) melaporkan bahwa centenarian sehat memiliki kadar TSH dan FT3 serum yang lebih rendah dan kadar rT3 serum yang lebih tinggi dibandingkan dengan yang diamati pada kelompok kontrol lainnya. Dalam populasi Italia lain dari long-liver, total nilai T4 berada di bawah kisaran normal pada 60% dari yang diperiksa (105). Baranovskaya et al. melaporkan bahwa kadar T3 serum pada centenarian lebih rendah daripada pada wanita usia lanjut dan wanita muda awal (52). Kami baru-baru ini mengkarakterisasi profil fungsi tiroid dalam kohort Italia yang terdiri dari 672 pasien (berusia 52-113 tahun). Penurunan yang terkait usia dalam tingkat FT3 dan rasio FT3 / FT4 dicatat, sementara FT4 dan TSH meningkat dengan usia (106). Dalam keluarga centenarians Cina, penurunan fungsi tiroid (TSH tinggi dan konsentrasi FT3 rendah) tampaknya terkait dengan usia, dan fenotipe ini adalah keturunan (107).
Corsonello et al. (108) menemukan kerabat bersamaan (keturunan atau keponakan) memiliki penyakit penyerta yang lebih rendah, tingkat FT3, FT4, dan TSH dibandingkan dengan kontrol yang cocok dengan usia yang bukan kerabat orang yang hidup lama. Pada populasi Italia lainnya, level FT4 plasma yang lebih rendah diamati pada keturunan yang berumur panjang dibandingkan dengan kelompok kontrol pada usia yang sama (60).
Secara umum, liver panjang tipis (109) dan mematuhi kebiasaan makan sehat (110). Mirip dengan subyek selama pembatasan kalori, hati yang lama mengamati pertumbuhan / metabolisme sel yang lebih lambat, kontrol transmisi sinyal yang lebih baik dan peningkatan autophagy. Melalui analisis metilasi DNA di seluruh genom pada centenarian dan turunannya, kami telah mengidentifikasi gen dan jalur yang dimodulasi secara epigenetik yang berpotensi terlibat dalam penuaan dan umur panjang. Hasil kami menunjukkan bahwa populasi ini ditandai oleh konservasi status metilasi DNA yang lebih baik, pertumbuhan / metabolisme sel yang lebih lambat dan kontrol transmisi sinyal yang lebih baik melalui mekanisme epigenetik (111). Long-hati mempertahankan fungsi bioenergi mereka karena hipertrofi mitokondria, yang dapat mengkompensasi cacat fungsional (112). Selain itu, liver panjang yang sehat memiliki tingkat autophagy yang tinggi, yang dibuktikan dengan tingkat serum beclin-1 yang lebih tinggi dibandingkan dengan kedua pasien muda dengan infark miokard dan kontrol yang sehat (113). Peningkatan aktivitas autophagic juga diamati pada subjek yang termasuk keluarga dengan umur panjang yang luar biasa (114).
Fenomena yang sesuai muncul dalam kaitannya dengan status inflamasi, yang melemah pada subjek setelah pembatasan kalori (115, 116) dan tinggi dalam hati yang lama (117 - 119). Dengan penuaan, ada keadaan patologi peradangan ringan dan kronis (peradangan terkait usia) dan peningkatan prevalensi sejumlah penyakit, seperti penyakit kardiovaskular, aterosklerosis, tumor, gangguan kognitif, osteoartritis dan diabetes (120, 121). Karena itu, melemahnya status inflamasi kronis setelah pembatasan kalori adalah efek yang menguntungkan. Centenarian Centenarians menunjukkan tanda-tanda peradangan, tetapi pada saat yang sama, tampaknya, terhindar dari efek berbahaya. Paradoks yang jelas ini dapat dijelaskan oleh fakta bahwa hati yang lama memiliki keseimbangan yang kompleks dan khas antara faktor pro-inflamasi dan anti-inflamasi, yang mengarah pada perkembangan peradangan yang lebih lambat, lebih terbatas dan seimbang dibandingkan dengan orang tua, yang ditandai dengan respon yang tidak efektif untuk menangkal peradangan kronis (120). , 121).
Data ini menyarankan mekanisme umum untuk meningkatkan umur panjang dan menunda penyakit terkait usia yang ditemukan pada usia panjang dan mamalia selama diet terbatas kalori.
Opini penulis.Model praklinis telah memberikan wawasan yang lebih dalam tentang proses penuaan dengan menggunakan data yang konsisten yang memperhitungkan peran sistem GH / IGF-1 / insulin dalam memodulasi harapan hidup. Meskipun diketahui bahwa peningkatan sensitivitas insulin dan kadar insulin yang rendah dikaitkan dengan peningkatan kelangsungan hidup, ada beberapa bukti yang menunjukkan bahwa melemahnya poros GH / IGF-1 dapat memiliki efek menguntungkan pada peningkatan harapan hidup pada manusia. Namun, masih belum diketahui apa level optimal IGF-1 sepanjang hidup untuk hidup lebih lama dan lebih sehat. Selain itu, sensitivitas reseptor IGF-1 dan aktivasi jalur post-reseptor belum dievaluasi dalam sebagian besar studi yang melibatkan subyek berumur panjang. Oleh karena itu, tidak mungkin untuk menentukan keadaan aktual dari aktivasi pensinyalan reseptor IGF-1 dengan dosis sederhana dari level IGF-1 yang beredar. Ini membuatnya sulit untuk mengidentifikasi strategi farmakologis atau lingkungan yang menargetkan sistem ini untuk meningkatkan umur panjang dan mempromosikan penuaan yang sehat. Pemahaman yang komprehensif tentang aspek-aspek ini tetap menjadi masalah utama untuk mengidentifikasi intervensi yang bertujuan memperlambat penuaan manusia dan untuk digunakan dalam pengobatan rehabilitasi. Penelitian di masa depan harus mengevaluasi keadaan fungsional pensinyalan reseptor IGF-1, termasuk melalui profil transkripsi dan analisis jaringan fungsional mengenai gen yang diatur IGF-1 pada subjek yang berumur panjang.
KesimpulanKesamaan yang mencolok telah dijelaskan sehubungan dengan profil endokrin antara penderita lama dan subyek setelah diet terbatas kalori. Adaptasi endokrin dan metabolisme yang diamati pada kedua model dapat menjadi strategi fisiologis untuk meningkatkan harapan hidup karena pertumbuhan sel yang lebih lambat / metabolisme, hilangnya cadangan fisiologis alami yang lebih lambat, transisi metabolisme seluler dari proliferasi sel ke aktivitas regeneratif, dan mengurangi akumulasi sel penuaan. Rupanya, mekanisme ini, setidaknya sebagian, dimediasi oleh modulasi sistem GH / IGF-1 / insulin.
Referensi- Franceschi C, Valensin S, Bonafè M, Paolisso G, Yashin AI, Monti D, dkk. Jaringan dan teori renovasi penuaan: latar belakang sejarah dan perspektif baru. Exp Gerontol. (2000) 35: 879-96. 10.1016 / S0531-5565 (00) 00172-8.
- Bartke A, Darcy J. GH dan penuaan: Jebakan dan wawasan baru. Klinik Praktik Terbaik Endocrinol Metab. (2017) 31: 113–25. 10.1016 / j.beem.2017.02.005
- Vitale G, Salvioli S, Franceschi C. Stres oksidatif dan sistem endokrin yang menua. Nat Rev Endocrinol. (2013) 9: 228–40. 10.1038 / nrendo.2013.29
- Vitale G, Cesari M, Mari D. Penuaan sistem endokrin dan dampak potensial pada sarkopenia. Eur J Intern Med. (2016) 35: 10-15. 10.1016 / j.ejim.2016.07.017
- Reddy SSK, Chaiban JT. The Endocrinology of aging: kunci menuju umur panjang "Great Expectations". Praktik Endokrasi. (2017) 23: 1107–16. 10.4158 / EP171793.RA
- Junnila RK, Daftar EO, Berryman DE, Murrey JW, Kopchick JJ. Sumbu GH / IGF-1 dalam penuaan dan umur panjang. Nat Rev Endocrinol. (2013) 9: 366-76. 10.1038 / nrendo.2013.67
- Yakar S, Adamo ML. Fisiologi faktor pertumbuhan seperti insulin: pelajaran dari model tikus. Endocrinol Metab Clin North Am. (2012) 41: 231-47. 10.1016 / j.ecl.2012.04.008 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Higashi Y, Sukhanov S, Anwar A, Shai SY, Delafontaine P. IGF-1, stres oksidatif dan atheroprotection. Tren Endocrinol Metab. (2010) 21: 245-54. 10.1016 / j.tem.2009.12.005 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Belfiore A, Malaguarnera R, Vella V, Lawrence MC, Sciacca L, Frasca F, dkk. Isoform reseptor insulin dalam fisiologi dan penyakit: pandangan terbaru. Rev endokrat. (2017) 38: 379-431. 10.1210 / er.2017-00073 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Kenyon C, Chang J, Gensch E, Rudner A, Tabtiang RAC ... mutan yang hidup dua kali lebih lama dari tipe liar. Nature (1993) 366: 461-4. 10.1038 / 366461a0 [PubMed] [CrossRef] [Google Cendekia]
- Kimura KD, Tissenbaum HA, Liu Y, Ruvkun G. Daf-2, sebuah gen seperti reseptor insulin yang mengatur umur panjang dan diapause pada elegans Caenorhabditis. Sains (1997) 277: 942-6. 10.1126 / science.277.5328.942 [PubMed] [CrossRef] [Google Cendekia]
- Tatar M, Kopelman A, Epstein D, Tu MP, Yin CM, Garofalo RS, dkk. Homolog reseptor insulin Drosophila mutan yang memperpanjang masa hidup dan merusak fungsi neuroendokrin. Sains (2001) 292: 107-10. 10.1126 / science.1057987 [PubMed] [CrossRef] [Google Cendekia]
- Clancy DJ, Permata D, Harshman LG, Oldham S, Stocker H, Hafen E, dkk. Perpanjangan masa hidup dengan hilangnya CHICO, protein substrat reseptor insulin Drosophila. Sains (2001) 292: 104-6. 10.1126 / science.1057991 [PubMed] [CrossRef] [Google Cendekia]
- Libina N, Berman JR, Kenyon C. Kegiatan spesifik jaringan C. elegans DAF-16 dalam pengaturan umur. Cell (2003) 115: 489-502. 10.1016 / S0092-8674 (03) 00889-4 [PubMed] [CrossRef] [Google Cendekia]
- Broughton S, Partridge L. Insulin / pensinyalan seperti IGF, sistem saraf pusat dan penuaan. Biochem J. (2009) 418: 1-12. 10.1042 / BJ20082102 [PubMed] [CrossRef] [Google Cendekia]
- Reindl KM, Sheridan MA. Regulasi perifer dari sistem faktor pertumbuhan hormon mirip insulin pada ikan dan vertebrata lainnya. Comp Biochem Physiol A Mol Integr Physiol. (2012) 163: 231–45. 10.1016 / j.cbpa.2012 / 08 / 08.003 [PubMed] [CrossRef] [Google Cendekia]
- Snell GD. Dwarf, karakter resesif mendelian baru dari tikus rumah. Proc Natl Acad Sci USA. (1929) 15: 733–4. 10.1073 / pnas.15.9.733 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Berryman D, Christiansen JS, Johannsson G, Thorner MO, Kopchick JJ. Peran poros GH / IGF-1 dalam rentang hidup dan kesehatan: pelajaran dari model hewan. Horm Pertumbuhan IGF Res. (2008) 18: 455–71. 10.1016 / j.ghir.2008.05.005 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Flurkey K, Papaconstantinou J, Miller RA, Harrison DE. Perpanjangan umur dan penundaan penuaan kekebalan dan kolagen pada tikus mutan dengan cacat dalam produksi hormon pertumbuhan. Proc Natl Acad Sci USA. (2001) 98: 6736-41. 10.1073 / pnas.111158898 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Brown-Borg HM, Borg KE, Meliska CJ, tikus Bartke A. Dwarf dan proses penuaan. Nature (1996) 384: 33. 10.1038 / 384033a0 [PubMed] [CrossRef] [Google Cendekia]
- Bartke A, Wright JC, Mattison JA, Ingram DK, Miller RA, Roth GS. Memperpanjang umur tikus berumur panjang. Nature (2001) 414: 412. 10.1038 / 35106646 [PubMed] [CrossRef] [Google Cendekia]
- Panici JA, Harper JM, Miller RA, Bartke A, Spong A, Masternak MM. Pengobatan hormon pertumbuhan awal kehidupan memperpendek umur panjang dan mengurangi resistensi stres seluler pada tikus mutan yang berumur panjang. FASEB J. (2010) 24: 5073–9. 10.1096 / fj.10-163253 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Sun LY, Spong A, Swindell WR, Fang Y, Hill C, Huber JA, dkk. Gangguan hormon pelepas hormon pertumbuhan memperpanjang umur dan mengatur respons terhadap pembatasan kalori pada tikus. Elife (2013) 2: e01098. 10.7554 / eLife.01098 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Coschigano KT, Clemmons D, Bellush LL, Kopchick JJ. Penilaian parameter pertumbuhan dan masa hidup tikus-tikus yang terganggu gen GHR / BP. Endokrinologi (2000) 141: 2608-13. 10.1210 / endo.141.7.7586 [PubMed] [CrossRef] [Google Cendekia]
- Ikeno Y, Hubbard GB, Lee S, Cortez LA, Lew CM, Webb CR, dkk. Mengurangi kejadian dan menunda terjadinya penyakit neoplastik yang fatal pada reseptor hormon pertumbuhan / mengikat tikus knockout protein. J Gerontol A Biol Sci Med Sci. (2009) 64: 522-9. 10.1093 / gerona / glp017 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Gesing A, D Wiesenborn, Do A, Menon V, Schneider A, Victoria B, dkk. Seekor tikus berumur panjang yang tidak memiliki hormon pertumbuhan dan reseptor hormon pertumbuhan: model hewan baru untuk penelitian penuaan. J Gerontol A Biol Sci Med Sci. (2017) 72: 1054–61. 10.1093 / gerona / glw193 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Bonkowski MS, Rocha JS, Masternak MM, KA Al Regaiey, Bartke A. Gangguan yang ditargetkan pada reseptor hormon pertumbuhan mengganggu tindakan menguntungkan pembatasan kalori. Proc Natl Acad Sci USA. (2006) 103: 7901-5. 10.1073 / pnas.0600161103 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Coschigano KT, Holland AN, Penunggang ME, Daftar EO, Flyvbjerg A, Kopchick JJ. Penghapusan, tetapi bukan antagonisme, dari reseptor hormon pertumbuhan tikus menghasilkan penurunan berat badan, insulin, dan tingkat faktor pertumbuhan I yang seperti insulin dan peningkatan masa hidup. Endokrinologi (2003) 144: 3799-810. 10.1210 / en.2003-0374 [PubMed] [CrossRef] [Google Cendekia]
- Holzenberger M, Dupont J, Ducos B, Leneuve P, Géloën A, Even PC, dkk. Reseptor IGF-1 mengatur umur dan ketahanan terhadap stres oksidatif pada tikus. Nature (2003) 421: 182–7. 10.1038 / nature01298 [PubMed] [CrossRef] [Google Cendekia]
- Bokov AF, Garg N, Ikeno Y, S Thakur, Musi N, DeFronzo RA, dkk. Apakah pengurangan sinyal IGF-1R pada Igf1r +/− tikus mengubah penuaan? Plos ONE (2011) 6: e26891. 10.1371 / journal.pone.0026891 [Artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Xu J, Gontier G, Chaker Z, Lacube P, Dupont J, Holzenberger M. Efek umur panjang dari mutasi IGF-1R +/− tergantung pada aktivasi reseptor spesifik latar belakang genetik. Aging Cell (2014) 13: 19–28. 10.1111 / acel.12145 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Mulvey L, Sinclair A, modulasi Selman C. Umur pada tikus dan efek pengganggu dari latar belakang genetik. J Genet Genomics (2014) 41: 497-503. 10.1016 / j.jgg.2014.06.002 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Kappeler L, De Magalhaes Filho C, Dupont J, Leneuve P, Cervera P, Périn L, dkk. Otak reseptor IGF-1 mengendalikan pertumbuhan dan masa hidup mamalia melalui mekanisme neuroendokrin. PLOS Biol. (2008) 6: e254. 10.1371 / journal.pbio.0060254tt [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Svensson J, Sjögren K, Fäldt J, Andersson N, Isaksson O, Jansson JO, dkk. IGF-1 yang diturunkan dari hati mengatur masa hidup rata-rata pada tikus. PLoS ONE (2011) 6: e22640 10.1371 / journal.pone.0022640 [artikel gratis PMC] [PubMed] [CrossRef] [Google Cendekia]
- Conover CA, Bale LK. Loss of pregnancy-associated plasma protein A extends lifespan in mice. Aging Cell (2007) 6:727–9. 10.1111/j.1474-9726.2007.00328.x [PubMed] [CrossRef] [Google Scholar]
- Conover CA. Role of PAPP-A in aging and age-related disease. Exp Gerontol. (2013) 48:612–3. 10.1016/j.exger.2012.06.017 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Selman C, Lingard S, Choudhury AI, Batterham RL, Claret M, Clements M, et al.. Evidence for lifespan extension and delayed age-related biomarkers in insulin receptor substrate 1 null mice. FASEB J. (2008) 22:807–18. 10.1096/fj.07-9261com [PubMed] [CrossRef] [Google Scholar]
- Taguchi A, Wartschow LM, White MF. Brain IRS2 signaling coordinates life span and nutrient homeostasis. Science (2000) 317:369–72. 10.1126/science.1142179 [PubMed] [CrossRef] [Google Scholar]
- Kuro M, Matsumura Y, Aizawa H, Kawaguchi H, Suga T, Utsugu T, et al. Mutation of the mouse Klotho gene leads to a syndrome resembling ageing. Nature (1997) 390:45–51. 10.1038/36285 [PubMed] [CrossRef] [Google Scholar]
- Kurosu H, Yamamoto M, Clark JD, Pastor JV, Nandi A, Gurnani P, et al.. Suppression of aging in mice by the hormone Klotho. Science (2005) 309:1829–33. 10.1126/science.1112766 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Migliaccio E, Giorgio M, Mele S, Pelicci G, Reboldi P, Pandolfi PP, et al. The p66 Shc adaptor protein controls oxidative stress response and life span in mammals. Nature (1999) 402:309–13. 10.1038/46311 [PubMed] [CrossRef] [Google Scholar]
- Ramsey JJ, Tran D, Giorgio M, Griffey SM, Koehne A, Laing ST, et al.. The influence of Shc proteins on life span in mice. J Gerontol A Biol Sci Med Sci. (2014) 69:1177–85. 10.1093/gerona/glt198 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ashpole NM, Logan S, Yabluchanskiy A, Mitschelen MC, Yan H, Farley JA, et al.. IGF-1 has sexually dimorphic, pleiotropic, and time-dependent effects on healthspan, pathology, and lifespan. Geroscience (2017) 39:129–45. 10.1007/s11357-017-9971-0 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mao K, Quipildor GF, Tabrizian T, Novaj A, Guan F, Walters RO, et al.. Late-life targeting of the IGF-1 receptor improves healthspan and lifespan in female mice. Nat Commun. (2018) 9:2394. 10.1038/s41467-018-04805-5 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Passarino G, Mari D, Monti D. Centenarians as a 21st century healthy aging model: a legacy of humanity and the need for a world-wide consortium (WWC100+). Mech Ageing Dev. (2017) 165(Pt. B):55–8. 10.1016/j.mad.2017.06.002 [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Barbieri M, Kamenetskaya M, Paolisso G. GH/IGF-I/insulin system in centenarians. Mech Ageing Dev. (2017) 165:107–114. 10.1016/j.mad.2016.12.001 [PubMed] [CrossRef] [Google Scholar]
- Ferrannini E, Vichi S, Beck-Nielsen H, Laasko M, Paolisso G, Smith U. For European Group for the Study of Insulin Resistance (EGIR). Insulin action and age. Diabetes (1996) 45:947–53. 10.2337/diab.45.7.947 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Barbieri M, Rizzo MR, Carella C, Rotondi M, Bonafè M, et al. Low insulin resistance and preserved beta-cell function contribute to human longevity but are not associated with TH-INS genes. Exp Gerontol. (2001) 37:149–56. 10.1016/S0531-5565(01)00148-6 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, D'Amore A, Balbi V, Varricchio M, et al.. Glucose tolerance and insulin action in healty centenarians. Am J Physiol. (1996) 270:E890–4. 10.1152/ajpendo.1996.270.5.E890 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Gambardella A, Ammendola S, Tagliamonte MR, Rizzo MR, Capurso A, et al.. Preserved antilipolytic insulin action is associated with a less atherogenic plasma lipid profile in healthy centenarians. J Am Geriatr Soc. (1997) 45:1504–9. 10.1111/j.1532-5415.1997.tb03203.x [PubMed] [CrossRef] [Google Scholar]
- Vitale G, Brugts M, Ogliari G, Castaldi D, Fatti L, Varewijck A, et al.. Low circulating IGF-I bioactivity is associated with human longevity: findings in centenarians' offspring. Aging (2012) 4:580–89. 10.18632/aging.100484 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Wolinska-Witort E, Bik W, Baranowska-Bik A, Martynska L, Broczek K, et al.. Evaluation of neuroendocrine status in longevity. Neurobiol Aging (2007) 28:774–83. 10.1016/j.neurobiolaging.2006.03.014 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Manzella D, Barbieri M, Rizzo MR, Gambardella A, Varricchio M. Baseline heart rate variability in healthy centenarians: differences vs. aged subject. Clin. Sci. (1999) 97:579–84. 10.1042/cs0970579 [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Tagliamonte MR, Rizzo MR, Carella C, Gambardella A, Barbieri M, et al. Low plasma Insulin like growth factor-1 concentrations predict worsening of insulin mediated glucose uptake in the elderly. J. Am. Geriatr. Soc. (1999) 47:1312–8. 10.1111/j.1532-5415.1999.tb07431.x [PubMed] [CrossRef] [Google Scholar]
- Paolisso G, Ammendola S, Del Buono A, Gambardella A, Riondino M, Tagliamonte MR, et al.. Serum levels of insulin-like growth factor-I (IGF-I) and IGF-binding protein-3 in healthy centenarians: relationship with plasma leptin and lipid concentrations, insulin action, and cognitive function. J Clin Endocrinol Metab. (1997) 82:2204–9. 10.1210/jcem.82.7.4087 [PubMed] [CrossRef] [Google Scholar]
- Bonafè M, Barbieri M, Marchegiani F, Olivieri F, Ragno E, Giampieri C, et al.. Polymorphic variants of insulin-like growth factor I (IGF-I) receptor and phosphoinositide 3-kinase genes affect IGF-I plasma levels and human longevity: cues for an evolutionarily conserved mechanism of life span control. J Clin Endocrinol Metab. (2003) 88:3299–304. 10.1210/jc.2002-021810 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Hirose N, Yamamura K, Shimizu K, Takayama M, Ebihara Y, et al.. Serum insulin-like growth factor-1 in centenarians: implications of IGF-1 as a rapid turnover protein. J Gerontol A Biol Sci Med Sci. (2001) 56:M79–82. 10.1093/gerona/56.2.M79 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Takayama M, Gondo Y, Inagaki H, Yamamura K, Nakazawa S, et al.. Adipose endocrine function, insulin-like growth factor-1 axis, and exceptional survival beyond 100 years of age. J Gerontol A Biol Sci Med Sci. (2008) 63:1209–18. 10.1093/gerona/63.11.1209 [PubMed] [CrossRef] [Google Scholar]
- Herr M, Jeune B, Fors S, Andersen-Ranberg K, Ankri J, Arai Y, et al.. Frailty and associated factors among centenarians in the 5-COOP countries. Gerontology (2018) 64:521–31. 10.1159/000489955 [PubMed] [CrossRef] [Google Scholar]
- Bucci L, Ostan R, Cevenini E, Pini E, Scurti M, Vitale G, et al.. Centenarians' offspring as a model of healthy aging: a reappraisal of the data on Italian subjects and a comprehensive overview. Aging (Albany. NY). (2016) 8:1–11. 10.18632/aging.100912 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Gueresi P, Miglio R, Monti D, Mari D, Sansoni P, Caruso C, et al.. Does the longevity of one or both parents influence the health status of their offspring? Exp Gerontol. (2013) 48:395–400. 10.1016/j.exger.2013.02.004 [PubMed] [CrossRef] [Google Scholar]
- Horvath S, Pirazzini C, Bacalini MG, Gentilini D, Di Blasio AM, Delledonne M, et al.. Decreased epigenetic age of PBMCs from Italian semi-supercentenarians and their offspring. Aging (2015) 7:1159–70. 10.18632/aging.100861 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Caselli G, Pozzi L, Vaupel JW, Deiana L, Pes G, Carru C, et al.. Family clustering in Sardinian longevity: a genealogical approach. Exp Gerontol. (2006) 41:727–36. 10.1016/j.exger.2006.05.009 [PubMed] [CrossRef] [Google Scholar]
- Suh Y, Atzmon G, Cho MO, Hwang D, Liu B, Leahy DJ, et al.. Functionally significant insulin-like growth factor I receptor mutations in centenarians. Proc Natl Acad Sci USA. (2008) 105:3438–42. 10.1073/pnas.0705467105 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, van den Akker EB, Trompet S, van Heemst D, Mooijaart SP, Slagboom PE, Beekman M. Employing biomarkers of healthy ageing for leveraging genetic studies into human longevity. Exp Gerontol. (2016) 82:166–74. 10.1016/j.exger.2016.06.013 [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Rozing MP, Houwing-Duistermaat JJ, Slagboom PE, Beekman M, de Craen AJ, et al.. Association analysis of insulin-like growth factor-1 axis parameters with survival and functional status in nonagenarians of the Leiden Longevity Study. Aging (2015) 7:956–63. 10.18632/aging.100841 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Rozing MP, Westendorp RG, Frölich M, de Craen AJ, Beekman M, Heijmans BT, et al.. Human insulin/IGF-1 and familial longevity at middle age. Aging (2009) 1:714–22. 10.18632/aging.100071 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van der Spoel E, Jansen SW, Akintola AA, Ballieux BE, Cobbaert CM, Slagboom PE, et al.. Growth hormone secretion is diminished and tightly controlled in humans enriched for familial longevity. Aging Cell (2016) 15:1126–31. 10.1111/acel.12519 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Sun FX, Andersen SL, Lee JH, Wojczynski MK, Sanders JL, et al.. Families enriched for exceptional longevity also have increased health-span: findings from the long life family study. Front Public Health (2013) 1:38. 10.3389/fpubh.2013.00038 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sebastiani P, Thyagarajan B, Sun F, Honig LS, Schupf N, Cosentino S, et al.. Age and sex distributions of age-related biomarker values in healthy older adults from the long life family study. J Am Geriatr Soc. (2016) 64:e189–94. 10.1111/jgs.14522 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Teumer A, Qi Q, Nethander M, Aschard H, Bandinelli S, Beekman M, et al.. Genomewide meta-analysis identifies loci associated with IGF-I and IGFBP-3 levels with impact on age-related traits. Aging Cell (2016) 15:811–24. 10.1111/acel.12490 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Deelen J, Uh HW, Monajemi R, van Heemst D, Thijssen PE, Böhringer S, et al.. Gene set analysis of GWAS data for human longevity highlights the relevance of the insulin/IGF-1 signaling and telomere maintenance pathways. Age (2013) 35:235–49. 10.1007/s11357-011-9340-3 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- van Heemst D, Beekman M, Mooijaart SP, Heijmans BT, Brandt BW, Zwaan BJ, et al.. Reduced insulin/IGF-1 signalling and human longevity. Aging Cell (2005) 4:79–85. 10.1111/j.1474-9728.2005.00148.x [PubMed] [CrossRef] [Google Scholar]
- Ben-Avraham D, Govindaraju DR, Budagov T, Fradin D, Durda P, Liu B, et al.. The GH receptor exon 3 deletion is a marker of male-specific exceptional longevity associated with increased GH sensitivity and taller stature. Sci Adv. (2017) 3:e1602025. 10.1126/sciadv.1602025 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- McKiernan SH, Colman RJ, Lopez M, Beasley TM, Aiken JM, Anderson RM, et al.. Caloric restriction delays aging-induced cellular phenotypes in rhesus monkey skeletal muscle. Exp Gerontol. (2011) 46:23–9. 10.1016/j.exger.2010.09.011 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Colman RJ, Anderson RM, Johnson SC, Kastman EK, Kosmatka KJ, Beasley TM, et al. Calorie restriction delays disease onset and mortality in rhesus monkeys. Science (2009) 325:201–4. 10.1126/science.1173635 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Willcox DC, Willcox BJ, Todoriki H, Curb JD, Suzuki M. Caloric restriction and human longevity: what can we learn from the Okinawans? Biogerontology (2006) 7:173–7. 10.1007/s10522-006-9008-z [PubMed] [CrossRef] [Google Scholar]
- Mattison JA, Roth GS, Beasley TM, Tilmont EM, Handy AM, Herbert RL, et al.. Impact of caloric restriction on health and survival in rhesus monkeys from the NIA study. Nature (2012) 489:318–21. 10.1038/nature11432 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Dunn SE, Kari FW, French J, Leininger JR, Travlos G, Wilson R, et al.. Dietary restriction reduces insulin-like growth factor I levels, which modulates apoptosis, cell proliferation, and tumor progression in p53-deficient mice. Cancer Res. (1997) 57:4667–72. [PubMed] [Google Scholar]
- Berrigan D, Perkins SN, Haines DC, Hursting SD. Adult-onset calorie restriction and fasting delay spontaneous tumorigenesis in p53-deficient mice. Carcinogenesis (2002) 23:817–22. 10.1093/carcin/23.5.817 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Veldhuis JD, Rood J, Smith SR, Williamson D, Ravussin E, et al.. The effect of caloric restriction interventions on growth hormone secretion in nonobese men and women. Aging Cell (2010) 9:32–9. 10.1111/j.1474-9726.2009.00530.x [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Das SK, Smith SR, Meydani SN, Pittas AG, et al.. Effects of 2-year calorie restriction on circulating levels of IGF-1, IGF-binding proteins and cortisol in nonobese men and women: a randomized clinical trial. Aging Cell (2016) 15:22–7. 10.1111/acel.12400 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Lettieri-Barbato D, Giovannetti E, Aquilano K. Effects of dietary restriction on adipose mass and biomarkers of healthy aging in human. Aging (2016) 8:3341–55. 10.18632/aging.101122 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mercken EM, Crosby SD, Lamming DW, JeBailey L, Krzysik-Walker S, Villareal DT, et al.. Calorie restriction in humans inhibits the PI3K/AKT pathway and induces a younger transcription profile. Aging Cell (2013) 12:645–51. 10.1111/acel.12088 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Kojima T, Takayama M, Hirose N. The metabolic syndrome, IGF-1, and insulin action. Mol Cell Endocrinol. (2009) 299:124–8. 10.1016/j.mce.2008.07.002 [PubMed] [CrossRef] [Google Scholar]
- Redman LM, Ravussin E. Endocrine alterations in response to calorie restriction in humans. Mol Cell Endocrinol. (2009) 299:129–36. 10.1016/j.mce.2008.10.014 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Garagnani P, Vitale G, Capri M, Salvioli S. Inflammaging and 'Garb-aging'. Trends Endocrinol Metab. (2017) 28:199–212. 10.1016/j.tem.2016.09.005 [PubMed] [CrossRef] [Google Scholar]
- Qian M, Liu B. Pharmaceutical Intervention of Aging. Adv Exp Med Biol. (2018) 1086:235–54. 10.1007/978-981-13-1117-8_15 [PubMed] [CrossRef] [Google Scholar]
- Baker DJ, Wijshake T, Tchkonia T, LeBrasseur NK, Childs BG, van de Sluis B, et al.. Clearance of p16Ink4a-positive senescent cells delays ageing-associated disorders. Nature (2011) 479:232–6. 10.1038/nature10600 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Derous D, Mitchell SE, Wang L, Green CL, Wang Y, Chen L, et al.. The effects of graded levels of calorie restriction: XI. Evaluation of the main hypotheses underpinning the life extension effects of CR using the hepatic transcriptome. Aging (2017) 9:1770–824. 10.18632/aging.101269 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Madeo F, Tavernarakis N, Kroemer G. Can autophagy promote longevity? Nat Cell Biol. (2010) 12:842–6. 10.1038/ncb0910-842 [PubMed] [CrossRef] [Google Scholar]
- Cevenini E, Monti D, Franceschi C. Inflamm-ageing. Curr Opin Clin Nutr Metab Care. (2013) 16:14–20. 10.1097/MCO.0b013e32835ada13 [PubMed] [CrossRef] [Google Scholar]
- Meydani SN, Das SK, Pieper CF, Lewis MR, Klein S, Dixit VD, et al.. Long-term moderate calorie restriction inhibits inflammation without impairing cell-mediated immunity: a randomized controlled trial in non-obese humans. Aging (2016) 8:1416–31. 10.18632/aging.100994 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Ott B, Skurk T, Hastreiter L, Lagkouvardos I, Fischer S, Büttner J, et al.. Effect of caloric restriction on gut permeability, inflammation markers, and fecal microbiota in obese women. Sci Rep. (2017) 7:11955. 10.1038/s41598-017-12109-9 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Unamuno X, Gómez-Ambrosi J, Rodríguez A, Becerril S, Frühbeck G, Catalán V. Adipokine dysregulation and adipose tissue inflammation in human obesity. Eur J Clin Invest. (2018) 48:e12997. 10.1111/eci.12997 [PubMed] [CrossRef] [Google Scholar]
- Liu M, Liu F. Regulation of adiponectin multimerization, signaling and function. Best Pract Res Clin Endocrinol Metab. (2014) 28:25–31. 10.1016/j.beem.2013.06.003 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Balaskó M, Soós S, Székely M, Pétervári E. Leptin and aging: Review and questions with particular emphasis on its role in the central regulation of energy balance. J Chem Neuroanat. (2014) 61–62:248–55. 10.1016/j.jchemneu.2014.08.006 [PubMed] [CrossRef] [Google Scholar]
- Arai Y, Nakazawa S, Kojima T, Takayama M, Abihara Y, Shimizu K, et al. High adiponectin concentration and its role for longevity in female centenarians. Geriatr Gerontol Int. (2006) 6:32–9. 10.1111/j.1447-0594.2006.00304.x [CrossRef] [Google Scholar]
- Bik W, Baranowska-Bik A, Wolinska-Witort E, Kalisz M, Broczek K, Mossakowska M, et al.. Assessment of adiponectin and its isoforms in Polish centenarians. Exp Gerontol. (2013) 48:401–7. 10.1016/j.exger.2013.01.015 [PubMed] [CrossRef] [Google Scholar]
- Meazza C, Vitale G, Pagani S, Castaldi D, Ogliari G, Mari D, et al.. Common adipokine features of neonates and centenarians. J Pediatr Endocrinol Metab. (2011) 24:953–7. 10.1515/JPEM.2011.373 [PubMed] [CrossRef] [Google Scholar]
- Baranowska B, Bik W, Baranowska-Bik A, Wolinska-Witort E, Szybinska A, Martynska L, et al.. Neuroendocrine control of metabolic homeostasis in Polish centenarians. J Physiol Pharmacol. (2006) 57 (Suppl. 6):55–61. [PubMed] [Google Scholar]
- Miura Y, Hashii N, Tsumoto H, Takakura D, Ohta Y, Abe Y, et al.. Change in N-glycosylation of plasma proteins in Japanese semisupercentenarians. PLoS ONE (2015) 10:e0142645. 10.1371/journal.pone.0142645 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Atzmon G, Pollin TI, Crandall J, Tanner K, Schechter CB, Scherer PE, et al.. Adiponectin levels and genotype: a potential regulator of life span in humans. J Gerontol A Biol Sci Med Sci. (2008) 63:447–53. 10.1093/gerona/63.5.447 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Mariotti S, Barbesino G, Caturegli P, Bartalena L, Sansoni P, Fagnoni F, et al.. Complex alteration of thyroid function in healthy centenarians. J Clin. Endocrinol Metab. (1993) 77:1130–4. 10.1210/jcem.77.5.8077303 [PubMed] [CrossRef] [Google Scholar]
- Maugeri D, Russo MS, Di Stefano F, Receputo G, Rosso D, Rapisarda R, et al.. Thyroid function in healthy centenarians. Arch Gerontol Geriatr. (1997) 25:211–7. 10.1016/S0167-4943(97)00012-5 [PubMed] [CrossRef] [Google Scholar]
- Ostan R, Monti D, Mari D, Arosio B, Gentilini D, Ferri E, et al.. Heterogeneity of thyroid function and impact of peripheral thyroxine deiodination in centenarians and semi-supercentenarians: association with functional status and mortality. J Gerontol A Biol Sci Med Sci. (2018). 10.1093/gerona/gly194. [Epub ahead of print]. [PubMed] [CrossRef] [Google Scholar]
- He Y, Chen X, Yan D, Xiao F, Liu Y, Lin R, et al.. Thyroid function decreases with age and may contribute to longevity in chinese centenarians' families. JAGS (2015) 63:1474–6. 10.1111/jgs.13553 [PubMed] [CrossRef] [Google Scholar]
- Corsonello A, Montesanto A, Berardelli M, De Rango F, Dato S, Mari V, et al.. A cross-section analysis of FT3 age-related changes in a group of old and oldest-old subjects, including centenarians' relatives, shows that a down-regulated thyroid function has a familial component and is related to longevity. Age Ageing (2010) 39:723–7. 10.1093/ageing/afq116 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Pereira da Silva A, Matos A, Valente A, Gil Â, Alonso I, Ribeiro R, et al.. Body composition assessment and nutritional status evaluation in men and women portuguese centenarians. J Nutr Health Aging (2016) 20:256–66. 10.1007/s12603-015-0566-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Ostan R, Santoro A. Nutrition and inflammation: are centenarians similar to individuals on calorie-restricted diets? Annu Rev Nutr. (2018) 38:329–56. 10.1146/annurev-nutr-082117-051637 [PubMed] [CrossRef] [Google Scholar]
- Gentilini D, Mari D, Castaldi D, Remondini D, Ogliari G, Ostan R, et al.. Role of epigenetics in human aging and longevity: genome-wide DNA methylation profile in centenarians and centenarians' offspring. Age (2013) 35:1961–73. 10.1007/s11357-012-9463-1 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Sgarbi G, Matarrese P, Pinti M, Lanzarini C, Ascione B, Gibellini L, et al.. Mitochondria hyperfusion and elevated autophagic activity are key mechanisms for cellular bioenergetic preservation in centenarians. Aging (2014) 6:296–310. 10.18632/aging.100654 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Emanuele E, Minoretti P, Sanchis-Gomar F, Pareja-Galeano H, Yilmaz Y, Garatachea N, et al.. Can enhanced autophagy be associated with human longevity? Serum levels of the autophagy biomarker beclin-1 are increased in healthy centenarians. Rejuvenation Res. (2014) 17:518–24. 10.1089/rej.2014.1607 [PubMed] [CrossRef] [Google Scholar]
- Raz Y, Guerrero-Ros I, Maier A, Slagboom PE, Atzmon G, Barzilai N, et al.. Activation-induced autophagy is preserved in CD4+ T-cells in familial longevity. J Gerontol A Biol Sci Med Sci. (2017) 72:1201–6. 10.1093/gerona/glx020 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Fontana L, Villareal DT, Weiss EP, Racette SB, Steger-May K, et al. Calorie restriction or exercise: effects on coronary heart disease risk factors. A randomized, controlled trial. Am J Physiol Endocrinol Metab. (2007) 293:E197–202. 10.1152/ajpendo.00102.2007 [PubMed] [CrossRef] [Google Scholar]
- Ravussin E, Redman LM, Rochon J, Das SK, Fontana L, et al.. A 2-year randomized controlled trial of human caloric restriction: feasibility and effects on predictors of health span and longevity. J Gerontol A Biol Sci Med Sci. (2015) 70:1097–104. 10.1093/gerona/glv057 [PMC free article] [PubMed] [CrossRef] [Google Scholar]
- Bruunsgaard H, Andersen-Ranberg K, Jeune B, Pedersen AN, Skinhoj P, Pedersen BK. A high plasma concentration of TNF-α is associated with dementia in centenarians. J Gerontol A Biol Sci Med Sci. (1999) 54:M357–64. 10.1093/gerona/54.7.M357 [PubMed] [CrossRef] [Google Scholar]
- Gangemi S, Basile G, Merendino RA, Minciullo PL, Novick D, et al.. Increased circulating interleukin-18 levels in centenarians with no signs of vascular disease: another paradox of longevity? Exp Gerontol. (2003) 38:669–72. 10.1016/S0531-5565(03)00061-5 [PubMed] [CrossRef] [Google Scholar]
- Gerli R, Monti D, Bistoni O, Mazzone AM, Peri G, et al.. Chemokines, sTNF-Rs and sCD30 serum levels in healthy aged people and centenarians. Mech. Ageing Dev. (2000) 121:37–46. 10.1016/S0047-6374(00)00195-0 [PubMed] [CrossRef] [Google Scholar]
- Franceschi C, Capri M, Monti D, Giunta S, Olivieri F, Sevini F, et al.. Inflammaging and anti-inflammaging: a systemic perspective on aging and longevity emerged from studies in humans. Mech Ageing Dev. (2007) 128:92–105. 10.1016/j.mad.2006.11.016 [PubMed] [CrossRef] [Google Scholar]
- Salvioli S, Monti D, Lanzarini C, Conte M, Pirazzini C, Bacalini MG, et al.. Immune system, cell senescence, aging and longevity–inflamm-aging reappraised. Curr Pharm Des. (2013) 19:1675–9. 10.2174/1381612811319090015