Sebelum memulai presentasi materi, saya ingin mengatakan beberapa kata tentang diri saya: seorang anggota komunitas yang menentang pengingkaran HIV terhadap HIV (“penentangan HIV / AIDS”): pada 2016-2018, “pembangkang HIV / AIDS dan anak-anak mereka”, dari 2018 - "Penolakan HIV / AIDS dan pengobatan alternatif."
Pendapat saya - dan bukan hanya pendapat saya - adalah bahwa kebanyakan kasus penolakan terhadap pengobatan HIV disebabkan oleh kesalahpahaman dangkal bahwa ini adalah infeksi kronis yang terkontrol, serta stigmatisasi orang yang hidup dengan HIV - penggunaan klise umum bahwa HIV - penyakit lapisan bawah masyarakat atau sebaliknya, "elit budaya". Ini tidak terjadi untuk waktu yang lama - di Rusia, sekitar 1% populasi hidup dengan HIV, dan situasinya tidak berencana untuk menjadi lebih baik.
Sekitar setahun yang lalu, beberapa artikel tentang sumber daya ini mendorong saya untuk menulis lima catatan tentang sejarah perang melawan virus. Tujuan artikel ini adalah untuk menjelaskan prinsip kerja berbagai jenis obat HIV (konsultan adalah ahli mikrobiologi dan spesialis penyakit menular). Saya harap Anda menikmati mengatur catatan ini.
Tentang virus
Jadi, beberapa kata tentang virus secara umum: mereka menempati posisi menengah antara dunia yang hidup dan tidak hidup; mereka tidak mampu reproduksi independen, untuk ini, sel-sel organisme inang diperlukan.
Virus ini tertata cukup sederhana: ia membawa kode genetik, kode ditutup dalam bentuk capsid, terkadang capsid dikelilingi oleh shell. Kode dapat disajikan dalam berbagai cara. Pengangkut kode adalah DNA atau RNA, mis. asam nukleat (NK). Rantai kode dapat satu atau dua: NK untai ganda dan untai tunggal. Rantai dapat ditutup dalam cincin atau linier. Pada tahun 1971, David Baltimore, menurut tanda-tanda ini, memecah virus menjadi 7 kelas. Klasifikasi ini masih digunakan sampai sekarang dan akan menjadi penting dalam menjelaskan bagaimana beberapa obat bekerja.
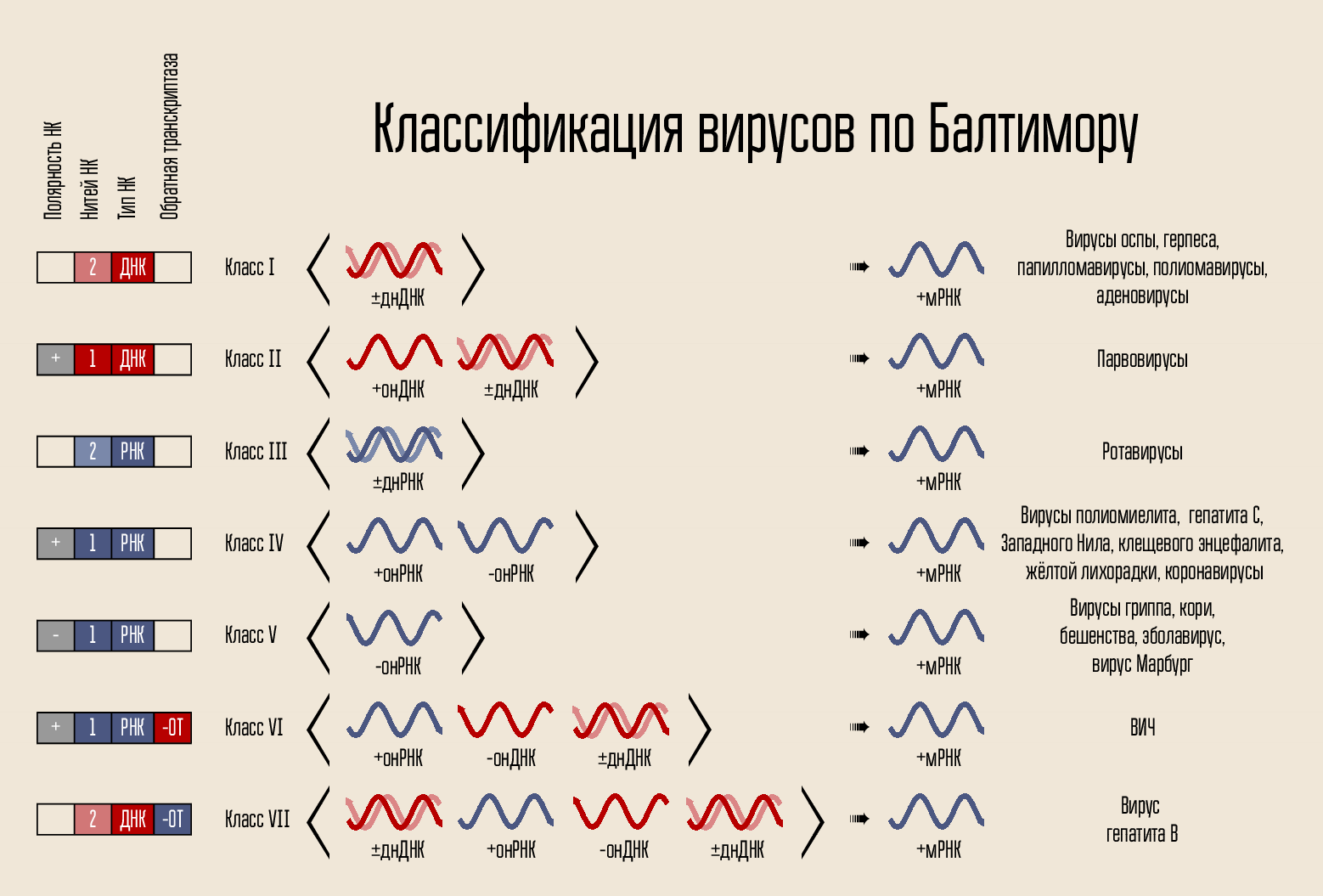
Kode itu sendiri untuk membangun virus baru tidak dapat menembus sel itu sendiri, itu membutuhkan mekanisme penetrasi. Karena itu, ada cangkang protein - kapsid, yang melindungi NK virus, dan membantu menembus ke dalam sel. Dalam beberapa kasus, virus mungkin memiliki membran lipid tambahan.
Penetrasi virus ke dalam sel

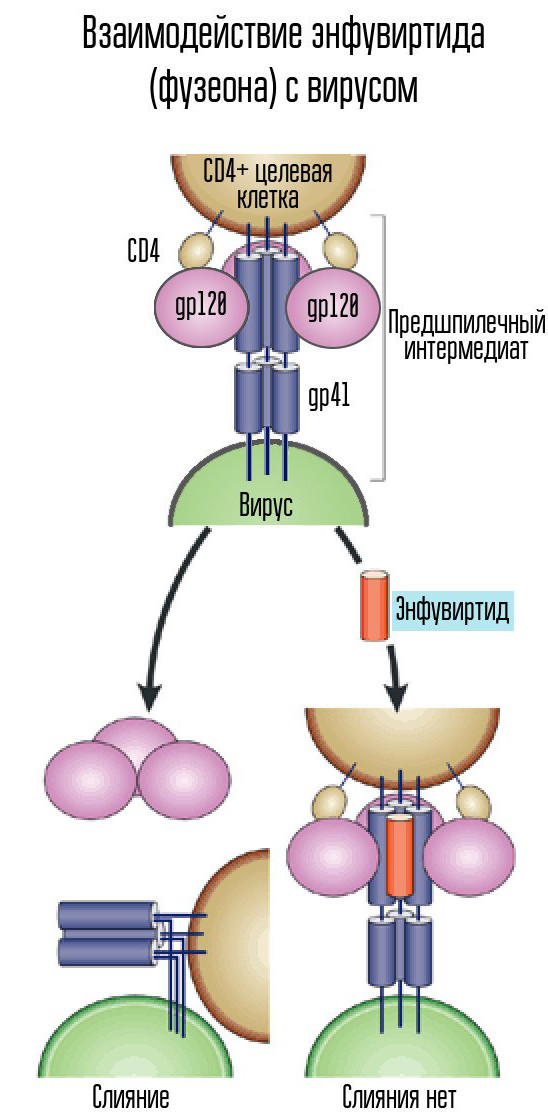
Untuk memasuki sel, virus harus terhubung ke membrannya. Untuk melakukan ini, ada protein di permukaan virus yang berikatan dengan protein reseptor sel inang - di tempat-tempat di permukaan dinding sel tempat virus dapat menempel. Dan mereka harus benar-benar sesuai dengan virus, jika tidak, ia tidak akan dapat menempel pada sel.
Untuk ini, HIV menggunakan reseptor CD4 (sel dengan reseptor seperti itu adalah sel kekebalan tubuh, termasuk T-limfosit, monosit, makrofag, dll.). CD4 saja tidak cukup - Anda perlu coreceptor lain, baik CCR5, atau CXCR4. HIV menggunakan protein selubung gp120 untuk bergabung. Setelah ini, bentuk protein amplop virus lain, gp41, berubah. Itu membungkuk ke samping, membentuk jepit rambut dan memungkinkan kapsid virus bergabung dengan sel.
Enfuvirtide (Fuzeon), penghambat protein gp41, adalah salah satu agen yang digunakan untuk melawan virus. Enfuvirtide bergabung dengan protein ini untuk mencegah pembentukan jepit rambut. Dengan demikian, kapsid virus tidak dapat bergabung dengan sel dan infeksi tidak terjadi. Obat ini adalah satu-satunya inhibitor fusi yang dikembangkan dan disetujui.
Retrovirus, yang termasuk dalam HIV, adalah target obat yang sangat tidak nyaman karena variabilitasnya. Sel manusia jauh lebih tidak stabil. Diketahui bahwa sekitar 1% populasi Eropa utara kebal terhadap HIV: mereka adalah pembawa mutasi CCR5-∂32, yang membuat bentuk reseptor CCR5 tidak cocok untuk digabungkan dengan HIV.
Sayangnya, mengubah bentuk reseptor ini selamanya, termasuk untuk sel-sel baru yang terus muncul dalam tubuh manusia, adalah tugas yang sangat sulit (walaupun telah ada upaya), tetapi mengembangkan inhibitor reseptor adalah obat yang akan menempel pada reseptor sel dan dengan demikian mencegah HIV dari bergabung kepadanya - sangat mungkin.
Beberapa inhibitor reseptor CCR5 dan CXCR4 sedang dikembangkan, tetapi satu-satunya yang disetujui hingga saat ini adalah maraviroc, inhibitor CCR5.
Membalik transkripsi
Apa yang terjadi setelah penggabungan virus dengan sel dalam kasus HIV?
HIV adalah virus Kelas VI Baltimore, ia menyimpan genomnya dalam RNA. Ada DNA di inti sel, jadi HIV perlu mengubah satu asam nukleat menjadi asam lain. Transkripsi semacam itu (NK → NK) dilakukan oleh enzim yang sesuai yang disebut polimerase. Untuk RNA-dependen (mis., Membaca informasi dari RNA) DNA polimerase (mis., Pada keluaran di mana DNA muncul) ada nama khusus - reverse transcriptase. Reverse transcriptase mengambil deoksinukleosida yang diinginkan (untuk kesederhanaan, sebenarnya melibatkan deoksinukleosida trifosfat) dan membangun DNA yang melengkapi RNA virus yang sesuai.
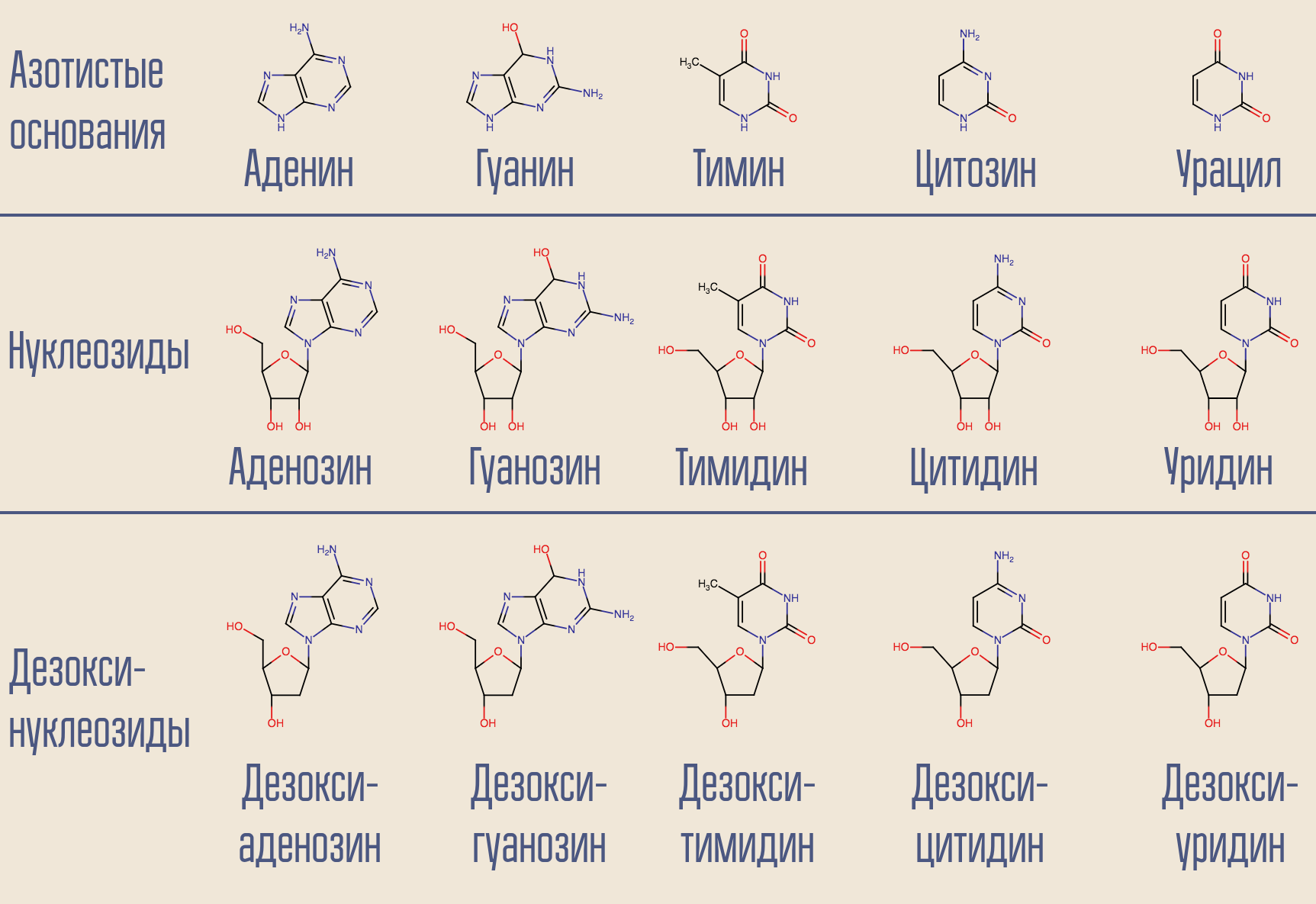
Apakah mungkin untuk menghentikan proses ini? Ya, untuk ini, Anda hanya perlu membalik transkriptase terbalik sesuatu yang menyerupai deoxynucleoside tetapi bukan satu. Ini adalah bagaimana obat HIV pertama, AZT (azidothymidine, AZT) bertindak. Ini mirip dengan deoxythymidine, tetapi tidak.
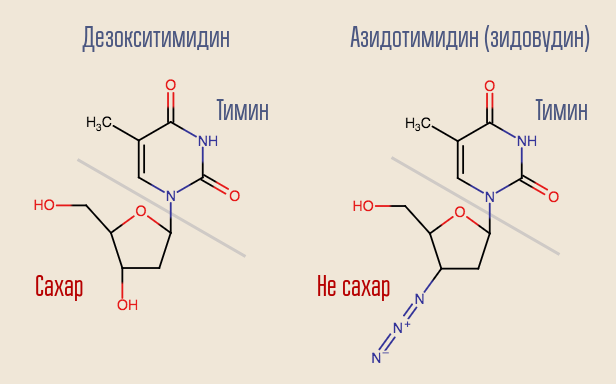
Azidothymidine dikembangkan sebagai bagian dari pencarian zat yang dapat melawan tumor. Diasumsikan bahwa ia akan tertanam dalam konstruksi DNA manusia biasa, memotongnya. Dengan demikian, obat itu akan paling kuat mempengaruhi sel-sel pembagi paling cepat - sel tumor. Ada alasan tertentu untuk berpikir demikian - yang sebelumnya disintesis obat lain dari kelompok ini, 6-mercaptopurine, efektif dalam pengobatan leukemia.
Sayangnya, dalam pengujian pada hewan, obat terbukti tidak efektif dan dilupakan selama beberapa waktu, sampai pada tahun 1984 ahli virus Marty St. Clair, yang bekerja di laboratorium Burroughs Wellcome Foundation, memulai penelitian untuk memeriksa semua zat yang tersedia untuk pilihan pengobatan. mereka memiliki penyakit baru - infeksi HIV.
Reverse transcriptase "mengenali" AZT sebagai deoxythymidine dan mencoba memasukkannya ke dalam DNA. Sintesis DNA di situs ini terputus karena obat itu hanya mirip dengan deoxythymidine. AZT benar-benar menekan reproduksi virus, dan uji coba manusia dimulai segera.
Relawan yang terinfeksi HIV dibagi menjadi dua kelompok, satu menerima plasebo, dan yang lain menerima AZT. Perbedaan antara kedua kelompok sangat mencolok sehingga pengujian lebih lanjut dianggap tidak manusiawi - obat tersebut menunjukkan kemanjuran yang menakjubkan.
Keberhasilan AZT telah mendorong studi tentang NRTI lain, dan banyak obat lain muncul dalam waktu singkat. Yang paling menarik dari obat pertama adalah lamivudine, analog deoxynucleoside lain, deoxycytidine. Kerugian lamivudine adalah bahwa dengan monoterapi dengan obat ini, resistensi berkembang sangat cepat, dalam waktu sekitar satu bulan. Ini karena mutasi satu titik HIV, M184V. Meskipun demikian, diinginkan untuk membiarkan lamivudine dalam skema. Faktanya adalah bahwa virus dengan mutasi ini hipersensitif terhadap AZT, dan mutasi itu sendiri mengurangi tingkat replikasi virus.
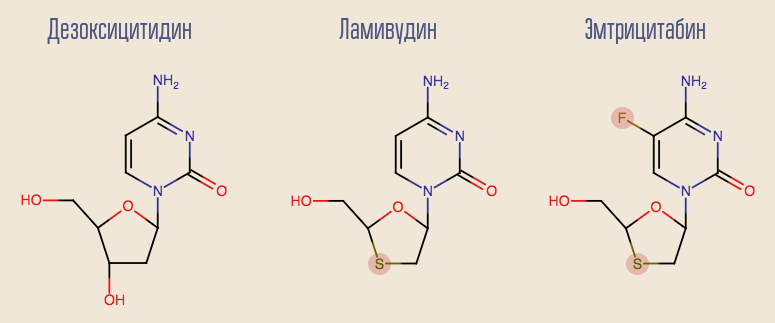
Saat ini, lamivudine secara bertahap mulai surut ke masa lalu, memberi jalan pada analog yang lebih modern, emtricitabine. Baik lamivudine dan analog deoxyadenosine, adefovir, menunjukkan hasil yang baik dalam pengobatan hepatitis B. Sayangnya, adefovir telah terbukti tidak efektif dalam mengobati HIV. Namun, setelah sedikit modifikasi pada molekulnya, versi yang diperbarui muncul - tenofovir. Tenofovir dan emtricitabine adalah bagian dari banyak lini terapi modern.
Kombinasi dari dua NRTI secara signifikan dapat memperpanjang kehidupan orang yang hidup dengan HIV, namun, jelas bahwa untuk sepenuhnya menekan virus, perlu untuk memasukkan setidaknya satu obat dari jenis tindakan yang berbeda, karena cepat atau lambat virus mengembangkan resistansi terhadap kombinasi NRTI. Salah satu zat pertama dari jenis tindakan yang berbeda adalah jenis lain dari reverse transcriptase inhibitor - non-nukleosida (NNRTI). Meskipun reverse transcriptase (RT) ingin bekerja dengan sesuatu yang mirip dengan nukleosida (nukleosida trifosfat), Anda dapat mencoba membuat zat yang akan berikatan dengan RT dan mengubah bentuknya sehingga tidak dapat lagi menjalankan fungsinya.
Pada tahun 1996 dan 1998, dua zat tersebut, nevirapine dan efavirenz, masing-masing, disetujui. Masing-masing dari mereka secara efektif menekan kerja PL, dan dalam kombinasi dengan dua NRTI, itu menciptakan skema lengkap terapi antiretroviral (ART) yang sangat aktif - cukup bagi seseorang yang hidup dengan HIV untuk menjalani kehidupan yang penuh, durasi yang tidak berbeda jauh dari kehidupan seseorang tanpa HIV .
Pada tahun 2006, obat kombinasi pertama untuk penggunaan tunggal per hari disetujui: Atripla. Atripla terdiri dari dua NRTI, emtricitabine dan tenofovir (dalam bentuk tenofovir disoproxil - sebuah prodrug, bentuk sediaan yang dimodifikasi secara kimiawi yang berubah menjadi obat langsung di dalam tubuh), dan satu NNRTI, efavirenza. Atripla telah menjadi langkah baru yang kualitatif untuk meningkatkan kualitas hidup pasien. Sampai saat ini, obat generik Atripla adalah salah satu obat yang paling umum digunakan di dunia (di negara berkembang).
Namun, hari ini NNRTI secara bertahap meninggalkan pasar - obat lama menyebabkan berbagai efek samping. Jadi, misalnya, dua bulan pertama setelah dimulainya penggunaan efavirenz dapat menyebabkan pusing dan efek serupa lainnya pada beberapa pasien (tidak semua!). Tentu saja, ini jauh lebih baik daripada kematian yang akan terjadi; Kondisi ini tidak berlangsung lama, dan mereka telah belajar bagaimana menghadapinya - namun, tren saat ini adalah transisi ke obat-obatan tersebut, pasien tidak melihat adanya efek samping dari mereka.
Integrasi
Jika reverse transcriptase telah melakukan tugasnya, apakah mungkin untuk menghentikan penggabungan DNA virus ke dalam DNA sel? Enzim khusus yang disebut integrase terlibat dalam proses ini.
Proses pengintegrasian DNA virus berlangsung dalam beberapa tahap. Awalnya, integrase berikatan dengan DNA virus, menghilangkan GT dinucleotide dari ujung 3'-masing-masing untai. Kemudian seluruh kompleks diangkut ke nukleus, di mana integrase mengkatalisasi tahap transfer rantai. Tahap ini adalah reaksi transesterifikasi (pertukaran radikal): nukleotida DNA sel tidak terhubung satu sama lain, tetapi dengan nukleotida DNA virus. Integrase menyerang ikatan internukleotida yang terletak pada jarak lima nukleotida. Dengan demikian, setelah integrasi, masih ada: pemrosesan 5'-ujung rantai DNA virus, penyelesaian 5 nukleotida yang hilang dan ligasi (hubungan dua untai NK dengan enzim ligase), yang dilakukan dengan partisipasi protein seluler [1].
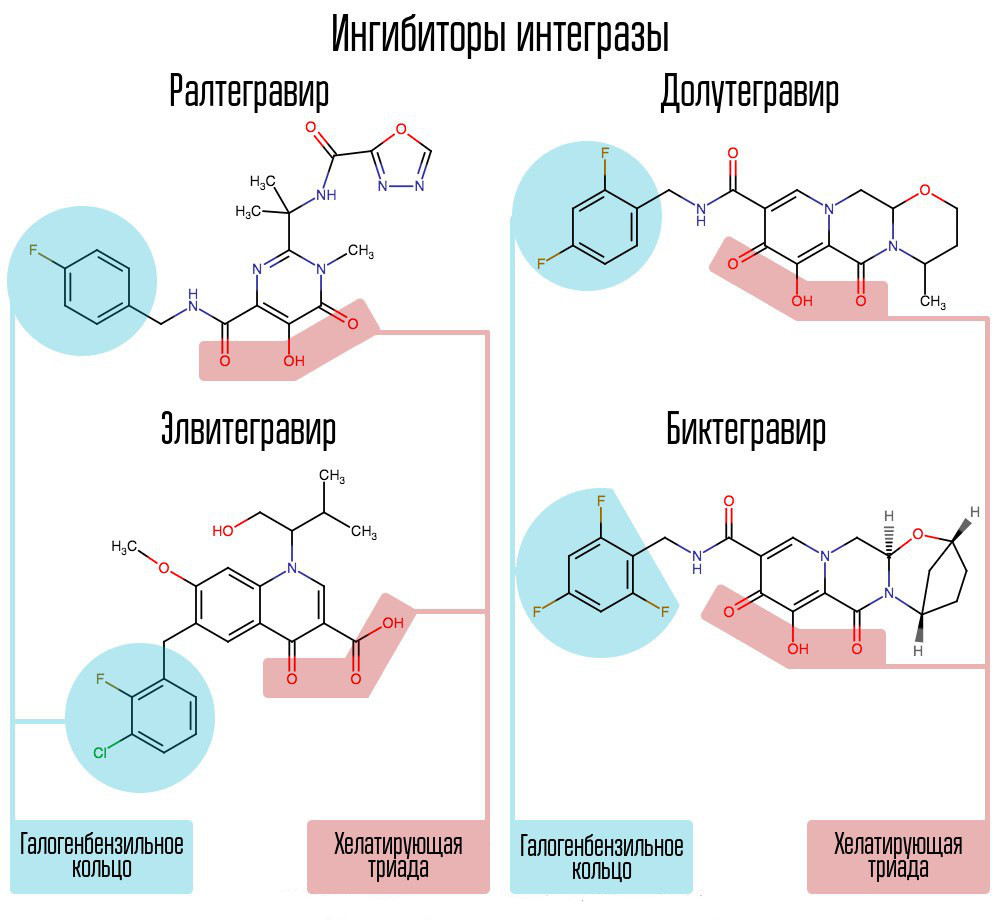
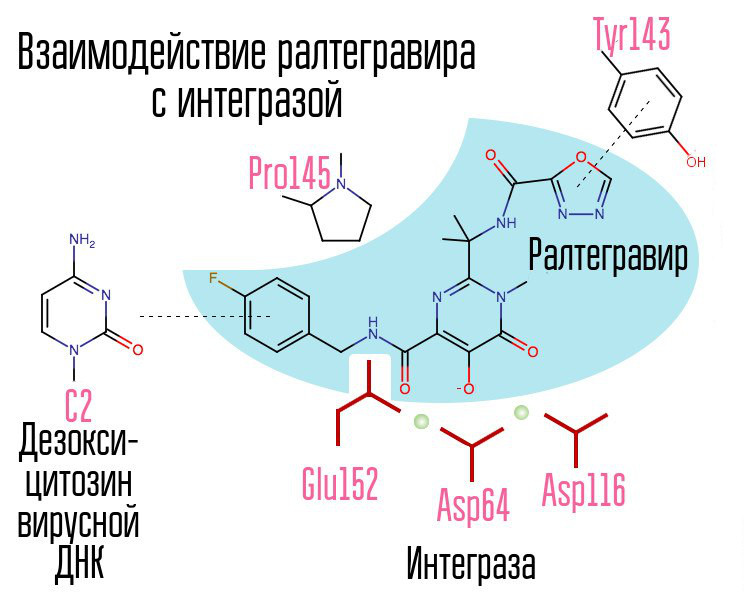
Skrining sekitar 250.000 zat di perpustakaan senyawa kimia mengungkapkan zat yang akan menghambat integrase HIV. Semuanya ternyata merupakan senyawa asam 2,4-dioxobutanoic. Mereka mengoordinasikan ion logam di pusat aktif integrase - di bagian itu, yang bertanggung jawab untuk transfer rantai. Upaya lebih lanjut untuk mengembangkan integrase inhibitor HIV-1 menyebabkan munculnya turunan N-pirimidinon, zat MK-0518, yang disebut raltegravir. [2]
Umum untuk raltegravir dan inhibitor integrase berikutnya adalah triad pengkelat (ion logam koordinasi) dan cincin halogen-benzil yang berinteraksi dengan deoxycytosine kedua dari belakang pada ujung 3 DNA dari DNA virus yang terikat pada enzim.
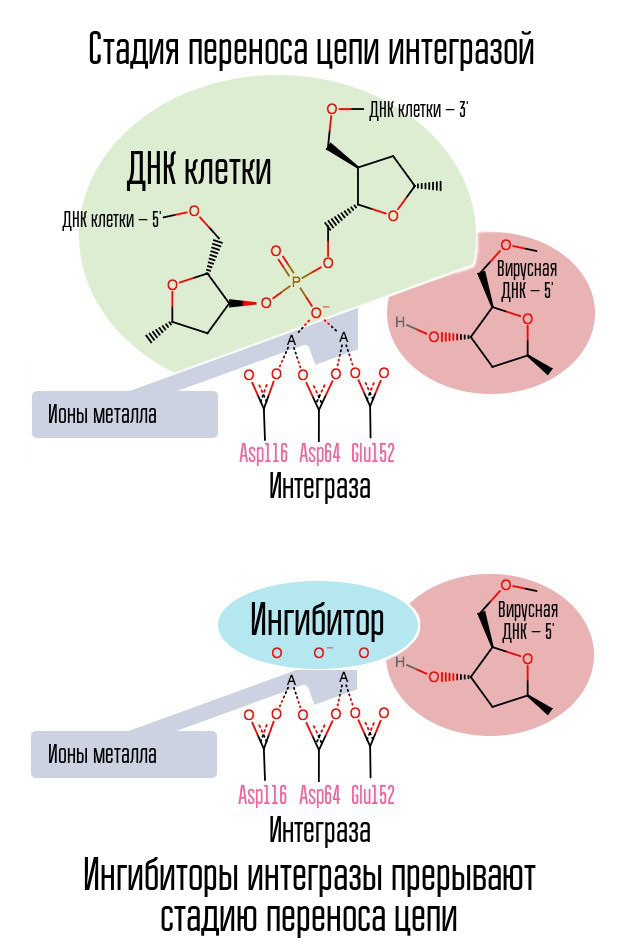
Proses mengintegrasikan virus ke dalam sel adalah langkah terakhir di mana profilaksis pascapajanan efektif. Setelah itu, sel-sel yang membawa DNA HIV dalam nukleusnya muncul di tubuh manusia. Jendela paling efektif untuk profilaksis pascapajanan adalah sekitar 6-10 jam.
Cincin halogenbenzyl dalam molekul integrase inhibitor berinteraksi dengan DNA virus, dan kelompok atom oksigen berinteraksi dengan dua atom logam. Virus integrase menggunakan atom-atom logam ini untuk memasukkan DNA virus ke dalam sel. Akibatnya, proses integrasi diblokir.
AI modern, seperti dolutegravir, telah mampu mengalahkan “penyakit anak” raltegravir yang terkait dengan pembentukan resistensi yang cepat.
Proteolisis
Setelah genom virus melewati tahap transkripsi, RNA virus yang dibuat dikirim untuk keluar dari sel. Dalam proses pembuatan virion, enzim virus lain yang disebut protease terlibat. Protease memotong poliprotein panjang menjadi protein fungsional individu, menghasilkan pembentukan enzim virus dan protein struktural virus.
Protease aktif tidak hanya melawan protein HIV, tetapi juga melawan protein sel inang, yang dapat menjelaskan efek sitotoksik HIV (kematian sel).
Jika protease diblokir, virion tidak akan dapat melewati tahap pematangan dan akan tetap sepenuhnya tidak berfungsi. Protein HIV-1 adalah protease aspartik retroviral khas yang memiliki urutan asam amino yang khas Asp25 Thr26 Gly27 (asam aspartat - treonin - glisin) di pusat aktif. Inhibitor protease pertama, saquinavir, disetujui oleh FDA pada 6 Desember 1995. Oleh karena itu, setelah pembuatan saquinavir, terapi antiretroviral yang sangat aktif menjadi tersedia untuk pertama kalinya.
Perwakilan tipikal lain dari kelompok obat ini adalah lopinavir (digunakan bersamaan dengan ritonavir - kaletra - salah satu obat HIV yang paling umum di Rusia). Ritonavir juga merupakan protease inhibitor, tetapi digunakan sebagai penguat - berkat aksinya, konsentrasi obat utama meningkat.
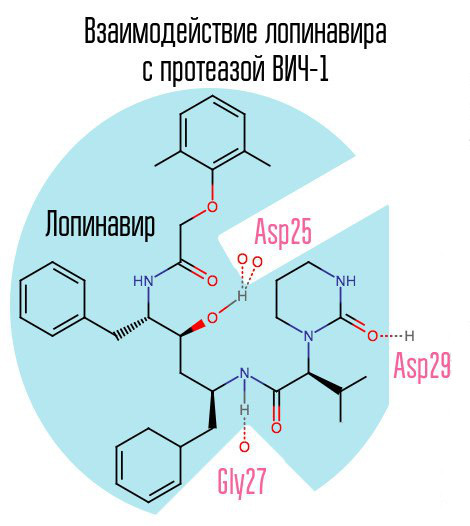
Karena saquinavir dan PI berikutnya ditujukan khusus pada pusat aktif enzim, dengan pengembangan resistansi terhadap satu PI, ada kemungkinan besar bahwa resistansi terhadap PI lain akan terjadi. Solusi untuk masalah ini dapat berupa pembuatan inhibitor yang diarahkan ke zona protease lainnya.
Obat darunavir (prezista), yang muncul pada tahun 2006, sedikit banyak mengurangi masalah akut dari jenis HIV yang kebal terhadap HIV, karena obat itu membentuk hubungan yang sebelumnya tidak digunakan dengan asam aspartat pada posisi 30.
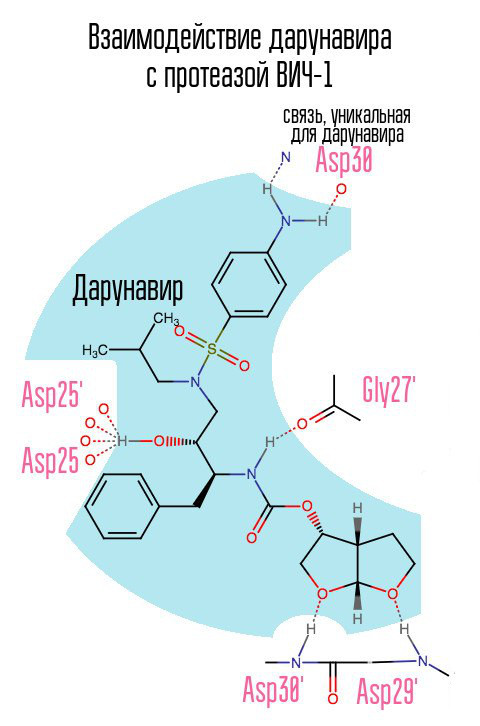
Tanpa protease, virus tidak dapat menjalani proses pematangan. Inhibitor mengikat ke pusat aktif protease dan mencegahnya bekerja.
Protease inhibitor sangat efektif pada viral load yang tinggi: karena pada saat ini banyak virion baru lahir di dalam tubuh, PI tidak memungkinkan mereka untuk matang, sehingga secara efektif mengurangi viral load dalam waktu singkat. Namun, saat ini, PI tidak digunakan dalam terapi lini pertama, memberikan jalan bagi integrase inhibitor (II).
Alasan untuk ini adalah efek samping: faktanya adalah bahwa, misalnya, kaletra yang sama menyebabkan penghambatan proteolisis protein dari makanan yang tidak spesifik, sebagai akibat dari protein ini memasuki usus kecil dan menyebabkan diare. Mengikuti diet tertentu atau menggunakan PI baru, seperti prezista, dapat mengurangi efek ini menjadi hampir nol, tetapi efek lain yang terkait dengan peningkatan kadar gula sering kali mencegah penggunaan protease inhibitor tanpa batas waktu.
Rejimen pengobatan modern
Sampai saat ini, skema yang paling modern dianggap terdiri dari inhibitor integrase dan satu atau dua NRTI (dolutegravir + abacavir + lamivudine; dolutegravir + lamivudine adalah skema dua komponen yang populer, namun, tidak cocok untuk semua orang). Skema ini memungkinkan seseorang untuk menjalani kehidupan penuh yang tidak berbeda dalam durasi dari kehidupan seseorang tanpa HIV.
Terlepas dari semua keberhasilan, penyembuhan total untuk HIV masih belum memungkinkan (transplantasi sel induk sumsum tulang dari donor dengan mutasi CCR5-∂32 memungkinkan mencapai hasil seperti itu, tetapi, tampaknya, hanya jika transplantasi versus reaksi inang terjadi, dalam sejumlah besar kasus yang menyebabkan kematian penerima).
Kesimpulan
Metode HIV yang dikembangkan telah membantu dalam memerangi penyakit menular lainnya: seperti yang disebutkan di atas, lamivudine dan tenofovir efektif terhadap virus hepatitis B (Baltimore kelas VII - hepatitis B polimerase dapat mentransfer RNA ke DNA, sehingga beberapa NRTI efektif dalam memerangi itu) . Pengetahuan yang diperoleh membantu mengembangkan obat aksi langsung terhadap hepatitis C, yang saat ini dapat sepenuhnya menyembuhkan penyakit ini (hepatitis C tidak memiliki fase laten, oleh karena itu, ketika menekan viral load, virion baru tidak memiliki tempat untuk datang - penyakit ini benar-benar sembuh).
[1] Korolev S. P., Agapkina Yu. Yu., Gottikh M. B. Masalah dan prospek penggunaan klinis inhibitor integrasi HIV-1
[2] Shahgildyan V.I. HIV integrase inhibitor - dasar terapi antiretroviral yang efektif dan aman