
Keberhasilan onkologi klinis modern tidak dapat disangkal. Semakin banyak operasi yang kompleks, obat-obatan baru, metode yang efektif untuk menghilangkan rasa sakit dan menghilangkan gejala yang menyakitkan. Kami di blog kami
berbicara cukup tentang bagaimana hari ini adalah mungkin untuk memperpanjang dan membuat hidup lebih mudah bagi pasien bahkan pada tahap terakhir penyakit.
Namun, bagaimanapun, ribuan pasien kanker di seluruh dunia setiap hari mengetahui bahwa tumor yang kemarin menyerah pada perawatan tertentu tumbuh lagi hari ini atau bermetastasis. Dokter secara teratur terhenti: semua obat yang diresepkan dan metode pengobatan telah dicoba, dan tidak ada obat yang tersisa untuk pasien ini.
Namun, bahkan jalan keluar dari jalan buntu ini dapat ditemukan. Dengan perkembangan genetika dan biologi molekuler, ahli onkologi telah menemukan cara baru untuk mempelajari tumor untuk menemukan kerentanan di dalamnya.
Untuk melakukan ini, gunakan pengujian genetik molekuler - menentukan karakteristik DNA sel kanker. Metode ini rumit secara teknis, mahal, memerlukan pengetahuan khusus dari dokter.
Studi ini memakan waktu 3 minggu, biaya 250 hingga 670 tr Akibatnya, dokter menerima laporan 30 halaman informasi yang kompleks, yang masih dapat digunakan. Tetapi bagi pasien yang sudah tidak lagi berharap, ini memberi waktu hidup tambahan.
Di
Medicine 24/7, kami secara teratur menggunakan riset genetika molekuler untuk merawat seseorang ketika "semua orang telah mencobanya - tidak ada yang bisa dilakukan." Dan para pasien, yang tampaknya tidak lebih membantu, terus hidup. Ada yang dua bulan, bukan dua minggu, dan yang lain bertahun-tahun bukan beberapa bulan.
Hari ini kami ingin berbicara tentang bagaimana pengujian genetik molekuler dilakukan, dalam kasus apa hal itu dapat membantu pasien dan pengetahuan apa yang diberikan dokter.
Kita semua adalah mutan, ini adalah norma. Tetapi beberapa mutasi menyebabkan kankerSel yang "layak" hidup tanpa mengganggu orang lain. Mereka menggunakan sejumlah sumber daya yang dialokasikan secara ketat, menjalankan fungsi biologisnya secara memadai, dan pada waktunya mereka mati, memberi jalan kepada generasi berikutnya (proses ini disebut apoptosis). Setiap 7-10 tahun, tubuh manusia benar-benar diperbarui.
Untuk melakukan ini, semua sel somatik (yang membentuk tubuh), kecuali sel darah merah, terus membelah.
Sebelum membelah, sel diisi dengan "salinan" informasi genetik herediter yang ada di intinya. Untai DNA yang "dilipat" menjadi kromosom di dalam nukleus direplikasi, mis. gandakan. Dan setelah itu, sel membelah, diam-diam mendistribusikan ke masing-masing sel anak satu set kromosom yang identik. Dari satu sel, keduanya benar-benar sama, dan bersama-sama dengan muatan genetik mereka masing-masing mendapat "pengetahuan" tentang bagaimana ia harus hidup, fungsi apa yang harus dilakukan, dan berapa kali dalam hidup untuk dibagikan.
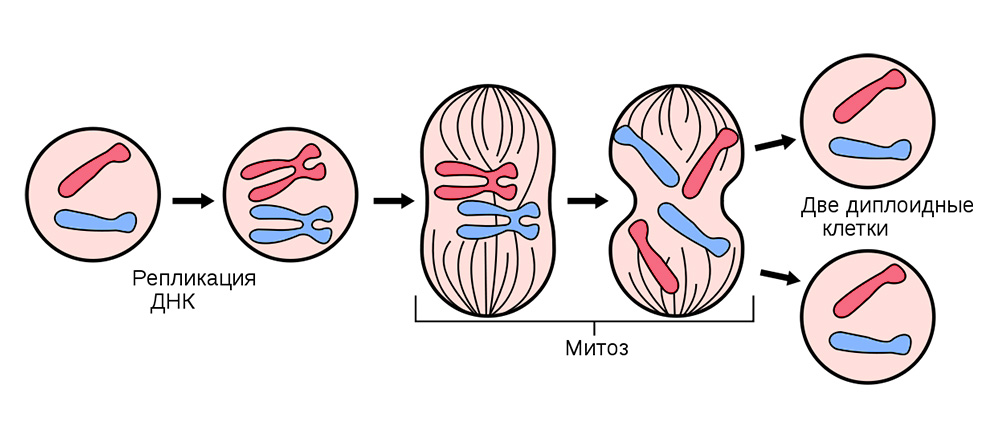 Pembelahan sel somatik terjadi di semua organ dan jaringan.
Pembelahan sel somatik terjadi di semua organ dan jaringan.Terkadang dalam proses kegagalan divisi - mutasi berubah. Baik untaian DNA akan terpecah, itu akan disalin dengan kesalahan, atau bagian-bagian kromosom akan dicampur. Ratusan faktor dapat memengaruhi hal ini: mulai dari stres dan asap tembakau hingga paparan radiasi.
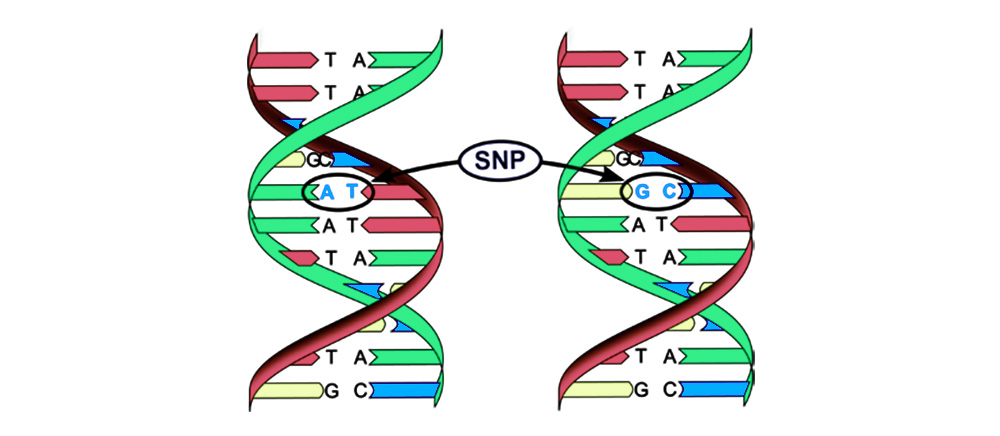
Mutasi dapat dibagi menjadi 4 jenis.1. Penggantian pasangan basa (Polimorfisme nukleotida-tunggal, SNP): satu nukleotida - "huruf" dari kode genetik - berubah menjadi yang lain. Struktur protein yang dikodekan oleh urutan nukleotida ini juga terganggu.
 2. Penyimpangan kromosom.Penghapusan
2. Penyimpangan kromosom.Penghapusan - hilangnya situs kromosom. Mereka terjadi karena penghentian bagian terminal atau pecahnya DNA di dua tempat sekaligus. Itu saja - gen ini tidak lagi diekspresikan pada kromosom.
Robek "potongan-potongan" DNA dapat dimasukkan ke dalam kromosom yang berdekatan -
penyisipan (atau inversi, jika penyisipan terjadi dalam urutan terbalik) akan
terjadi . Terkadang di antara kromosom ada "pertukaran timbal balik" bagian DNA -
translokasi . Hasilnya adalah satu: gen "ekstra"
diekspresikan .
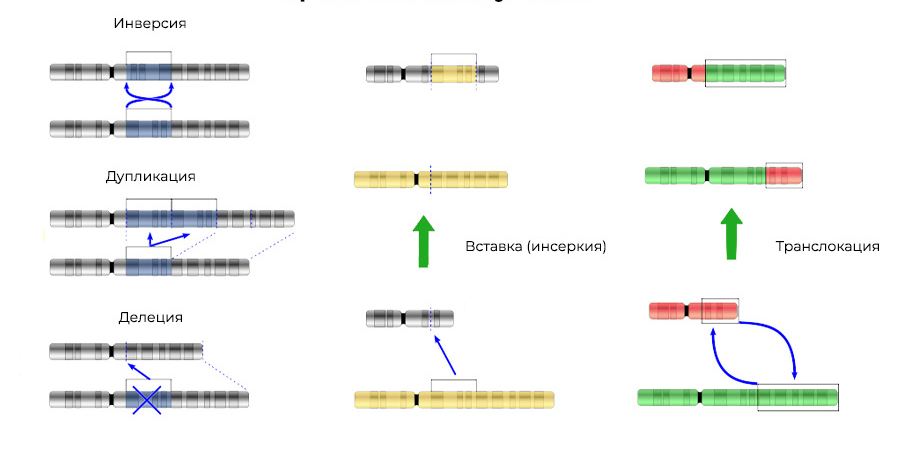 Mutasi tidak hanya mengubah struktur situs DNA, tetapi juga urutan situs-situs ini3. Penggabungan gen
Mutasi tidak hanya mengubah struktur situs DNA, tetapi juga urutan situs-situs ini3. Penggabungan gen - suatu gen "berkumpul" dari bagian-bagian gen lain dan diekspresikan (dipicu) secara keseluruhan. Protein dalam ekspresi gen chimeric seperti itu juga ternyata tidak biasa, hibrida, dengan sifat-sifat berbahaya.
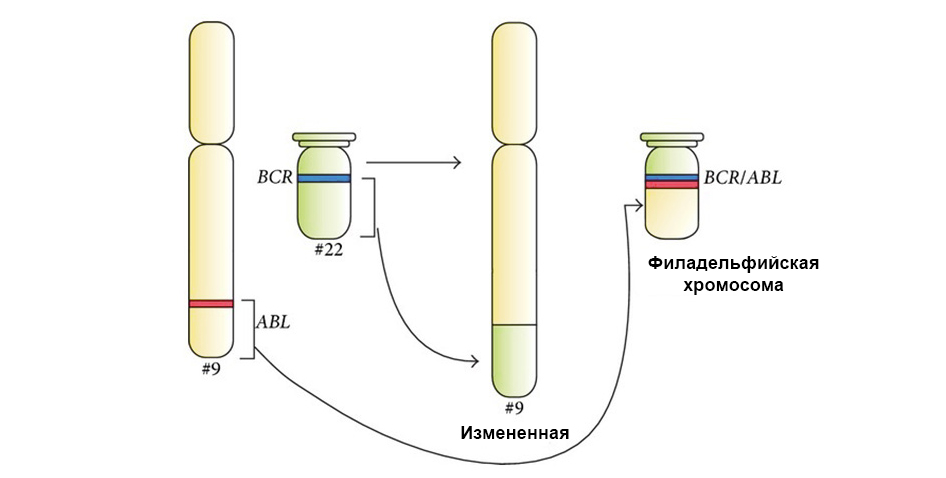 Dua gen "saling menempel" selama translokasi dan membentuk gen chimeric (menyebabkan leukemia)
Dua gen "saling menempel" selama translokasi dan membentuk gen chimeric (menyebabkan leukemia)Kami beruntung bahwa DNA penuh dengan bagian yang tidak terlalu signifikan yang tidak mengkodekan apa pun. Banyak mutasi terjadi di area ini - dan ternyata tidak signifikan, tidak berpengaruh pada kerja sel selanjutnya. Dan sel semacam itu, dengan sedikit perbedaan dari "standar", terus hidup dan berbagi secara normal.
Lebih dari 70 tahun, 100 triliun pembelahan sel terjadi dalam tubuh manusia. Ini adalah 1,4 triliun divisi per tahun - ada cukup banyak kasus untuk mengakumulasi "massa kritis" kesalahan dalam DNA dari waktu ke waktu, atau sehingga kegagalan lain masih bisa masuk ke bagian DNA yang mengkode sesuatu yang penting. Ini akan menghasilkan mutasi yang tidak berbahaya, karena sel akan menjadi ganas (ganas).
Sel ganas dibedakan dari kelainan siklus sel normal.Siklus sel (kehidupan sel dari divisi ke divisi / kematian) diatur secara ketat oleh
kerja protein khusus: kinase, cyclin, faktor pertumbuhan dan faktor transkripsi - ada lusinan dari mereka di setiap sel hidup, dan masing-masing memiliki fungsi tersendiri, tetapi penting.
Mereka mengirimkan sinyal di antara sel-sel organisme multiseluler, saling mengaktifkan satu sama lain, memulai proses pembelahan dan mengontrol kebenarannya, mempertahankan aktivasi gen yang benar, melakukan fungsinya oleh sel, "memeriksa" integritas genom, "memerintahkan" sel untuk memulai apoptosis jika tiba saatnya untuk mati, dan .p.
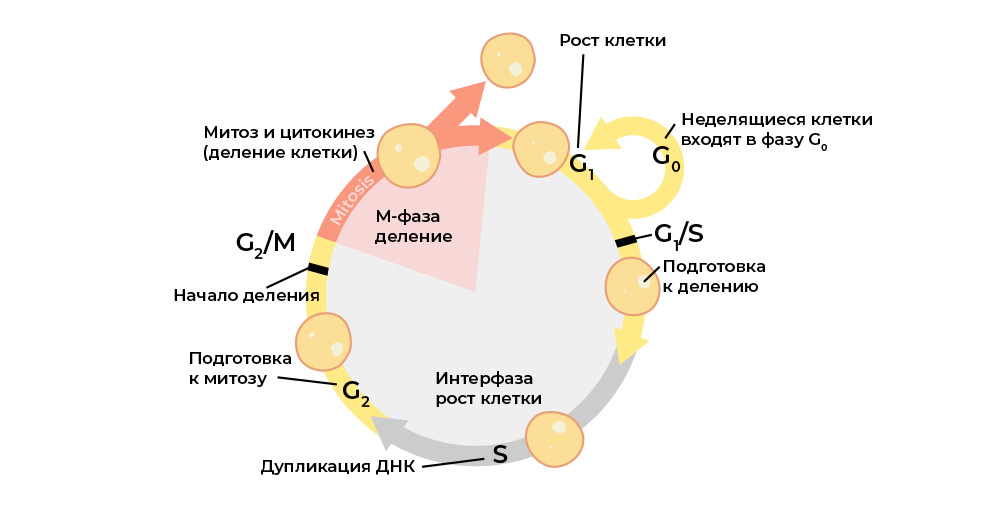 Setiap tahap siklus sel dikendalikan oleh protein pengatur.
Setiap tahap siklus sel dikendalikan oleh protein pengatur.Dan masing-masing protein ini dikodekan dalam
bagian spesifik dari DNA - gen. Jika gen semacam itu mengalami mutasi yang berbahaya, ia akan "mereproduksi" protein regulatori yang salah. Dan pengatur protein yang "salah" akan mengganggu siklus sel, dan dengan itu perilaku seluruh sel.
Sebagai contoh, gen untuk pengatur protein dari proliferasi (pertumbuhan massa sel) “rusak” - dan “mutan” mulai membelah lebih dari yang seharusnya, sel yang sehat “dihancurkan”.
Gen yang sedemikian signifikan, perubahan yang dapat menyebabkan karsinogenesis (timbulnya kanker) adalah dua kelompok besar.Protoonkogen adalah gen "normal" yang dapat menjadi
onkogen karena peningkatan atau perubahan fungsinya. Gen yang ekspresinya dapat menyebabkan keganasan sel dan perkembangan neoplasma disebut
onkogen . Jika mutasi berbahaya terjadi pada proto-onkogen, itu menjadi
onkogen dan dapat menyebabkan tumor.
Dari mereka yang paling
banyak dipelajari dan didengar secara luas:
- EGFR, ALK, BRAF - kanker paru-paru non-sel kecil;
- BRAF - melanoma;
- HER2 - kanker payudara (kanker payudara);
- KRAS - kanker kolorektal.
Selain itu, mutasi gen-gen ini ditemukan pada beberapa jenis tumor. Misalnya, peningkatan ekspresi HER2 ditemukan tidak hanya pada kanker payudara, tetapi juga pada kanker paru-paru dan lambung.
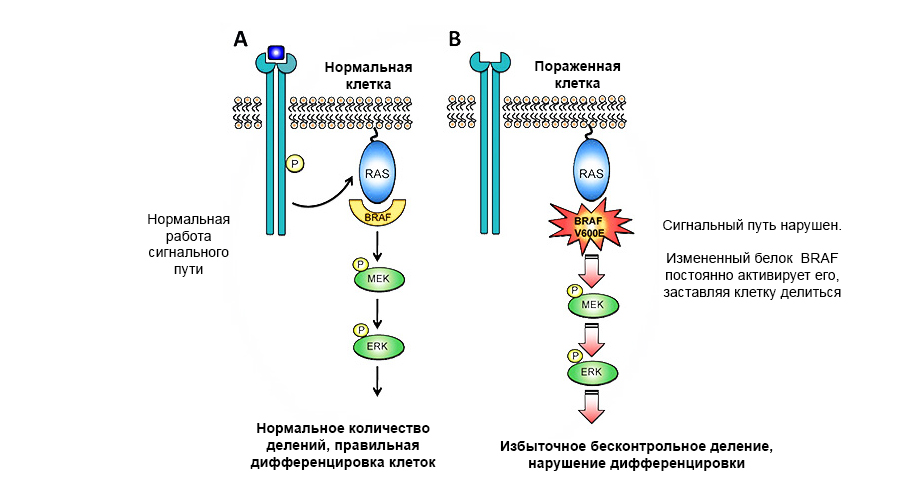 Mutasi pada proto-onkogen protein BRAF menyebabkan pertumbuhan tumor yang tidak terkontrol.
Mutasi pada proto-onkogen protein BRAF menyebabkan pertumbuhan tumor yang tidak terkontrol.Gen penekan tumor (anti-onkogen) - sebaliknya, dapat
menekan pertumbuhan sel tumor atau ikut serta dalam perbaikan (perbaikan) DNA yang rusak. Tetapi inaktivasi gen penekan akibat mutasi secara dramatis meningkatkan kemungkinan tumor ganas.
Sebagai contoh:
- mutasi BRCA1, BRCA2 - kanker kelenjar susu, ovarium;
- mutasi p53 - hingga 50% dari berbagai jenis tumor kanker, termasuk sarkoma;
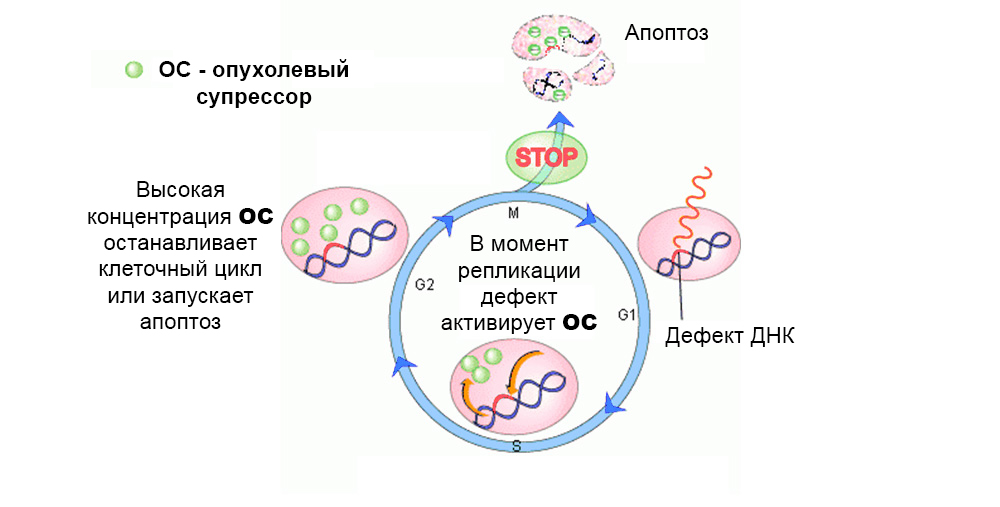 Biasanya, mekanisme perlindungan bertindak terhadap perkembangan sel yang bermutasi. Cacat pada gen penekan tumor “mematikan” mereka
Biasanya, mekanisme perlindungan bertindak terhadap perkembangan sel yang bermutasi. Cacat pada gen penekan tumor “mematikan” merekaSecara total, efek beberapa puluh proto-onkogen dan penekan tumor pada karsinogenesis dipelajari.
Mengapa ada begitu banyak kesulitan dan bagaimana mereka memperpanjang hidup pasienSetiap mutasi yang ditemukan pada gen proto-onkogen atau penekan adalah penyebab "kekuatan super" sel kanker, seperti pengabaian apoptosis dan kemampuan bersembunyi dari kekebalan. Tetapi pada saat yang sama - ini adalah titik kelemahan potensial.
Mengetahui apa alasan dari kekhasan mekanisme operasi tumor, orang dapat menemukan zat yang "memotong" mekanisme ini dan mengganggu rantai reaksi patologis dalam sel. Artinya, mutasi spesifik pada tumor - menunjukkan target di mana dokter "memukul" dengan obat. Prinsip ini memungkinkan pengembangan
terapi yang ditargetkan .
Terapi bertarget - nama seluruh cabang terapi obat yang efektif untuk kanker - lahir dari target kata Inggris. Obat target bertindak "ditargetkan" pada sel kanker - karena hanya mereka memiliki mutasi pada gen yang sesuai. Sel-sel yang sehat tidak memiliki mutasi seperti itu - dan obat-obatan tidak bekerja padanya.
Gambar di bawah ini menunjukkan mekanisme kerja obat yang ditargetkan Imatinib pada sel tumor dengan mutasi kromosom Philadelphia: gen fusi BCR-ABL. Mutasi ini mengarah pada fakta bahwa mekanisme apoptosis berhenti bekerja dalam sel - kesalahan dalam genom menumpuk, sel berdegenerasi menjadi yang bersifat kanker.
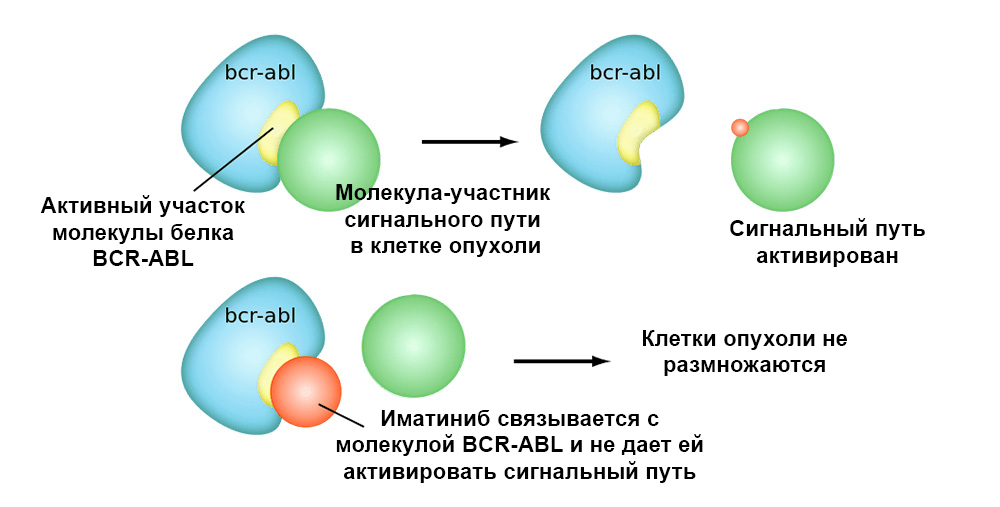 Imatinib berikatan dengan situs aktif molekul protein BCR-ABL, dan memblokir kemampuannya untuk berinteraksi dengan molekul lain di jalur sinyal.Jadi obat yang ditargetkan memiliki 2 keunggulan penting dibandingkan kemoterapi klasik.Efisiensi lebih tinggi.
Imatinib berikatan dengan situs aktif molekul protein BCR-ABL, dan memblokir kemampuannya untuk berinteraksi dengan molekul lain di jalur sinyal.Jadi obat yang ditargetkan memiliki 2 keunggulan penting dibandingkan kemoterapi klasik.Efisiensi lebih tinggi. Tindakan yang ditargetkan pada sel tumor memungkinkan mencapai "respons" tumor yang lebih baik terhadap pengobatan. Misalnya, dibandingkan dengan pengobatan klasik, penambahan obat yang ditargetkan Trastuzumab bersama dengan kemoterapi untuk kanker payudara dengan HER2 berlebih
meningkatkan frekuensi "tanggapan" - 81% berbanding 73%, dan frekuensi remisi morfologis lengkap (hilangnya tumor) - 43% berbanding 23%
Lebih sedikit efek samping. Kemoterapi klasik dengan efek sitotoksik. Intinya, zat beracun dapat membunuh atau setidaknya memperlambat pertumbuhan sel kanker. Kebanyakan dari mereka bertindak pada sel yang cepat membelah. Itulah sebabnya, misalnya, rambut rontok: itu juga merupakan jenis pembagi sel aktif, dan mereka “jatuh di bawah distribusi”. Karena tindakan yang tidak terlalu ditargetkan ini, obat-obat kemoterapi memberikan efek samping yang serius: saluran pencernaan dan organ-organ lain juga menderita.
Dalam praktik
Kedokteran 24/7, kami paling sering meresepkan obat yang ditargetkan sebagai bagian dari perawatan komprehensif: kami menggabungkan kemoterapi, target, dan imunoterapi.
Kesulitannya adalah bahwa setiap tumor unik dalam set mutasi "target"Sama seperti setiap orang memiliki kode DNA yang unik, tumor juga unik. Bagaimanapun, mereka "lahir" dari sel-sel tubuh sendiri. Tidak ada tumor dengan sifat molekul genetik yang sama. Karena itu, menciptakan "pil" universal untuk kanker pada dasarnya tidak mungkin. Kanker adalah penyakit yang terlalu individual.
Tetapi perawatan untuknya harus tepat - dipilih secara individual untuk pasien tertentu - berdasarkan fakta bahwa kami menentukan mutasi pada sel tumornya.
Di masa lalu, tumor ganas hanya dapat diklasifikasikan berdasarkan histologi, yaitu, tergantung pada organ mana mereka berasal dan apa yang tampak seperti sel-sel kanker di bawah mikroskop.
Untuk secara efektif menggunakan terapi yang ditargetkan, ini tidak cukup. Dokter harus tahu mutasi apa yang ada dalam sel tumor pasien tertentu, apakah ada "target" biomarker untuk obat ini atau itu. Obat pribadi seperti apa adanya.
Untuk ini, kami menggunakan studi genetik molekuler. Untuk menemukan "target" yang harus Anda pukul dengan obat yang ditargetkan dan immunotrerapevticheski - Anda perlu menentukan gen gen mana dari tumor yang dikumpulkan, dan gen mana di dalamnya yang "rusak". Sebagai hasilnya:
- kami mempelajari sensitivitas tumor terhadap obat-obatan;
- cari tahu apakah tumor tersebut memiliki resistensi terhadap obat-obatan tertentu;
- temukan karakteristik genetik yang memberikan hipersensitivitas terhadap obat-obatan;
- kami akan memilih perawatan baru jika tumor telah berhenti merespons terapi standar;
mendeteksi tumor / metastasis pada tahap yang sangat dini - dengan fragmen DNA dalam darah; - kita dapat memprediksi perjalanan penyakit yang menguntungkan atau agresif.
Sampel paling sering adalah jaringan tumor, baik diambil selama operasi untuk menghilangkan lesi primer, atau biopsi - potongan mikroskopis dari tumor diambil dengan jarum panjang khusus tipis.
Anda dapat mencari DNA sel tumor dalam darah - maka Anda memerlukan biopsi cair, dua tabung reaksi dengan darah masing-masing 8,5 ml.
Selama biopsi, kita sering menemukan fakta bahwa banyak pasien takut menyentuh tumor sama sekali - mereka takut ini akan memicu pertumbuhannya. Sampai saat ini, tidak ada studi yang tersedia yang akan menunjukkan hubungan seperti itu. Tentu saja, biopsi harus dilakukan dengan benar. Ketika kami mengambil biopsi, dokter paling sering menandai tempat masuknya jarum: apakah mereka membuat tato kecil (ada instrumen seperti itu ), atau mereka memasang braket (pembedahan). Jika suatu operasi diperlukan nanti, mereka akan memotong seluruh jalur dimana jarum berada - dari kulit ke tumor - jadi kami membuat kesempatan sel-sel kanker menyebar di luar tumor semakin berkurang.Selanjutnya, sampel dikirim ke laboratorium studi genetik molekuler.Di sana, DNA tumor diisolasi dari sampel dan diurutkan. Yaitu - mereka "membaca" urutan "huruf" -nukleotida. Dan kemudian mereka membandingkannya dengan panel diagnostik yang dipilih dari database perpustakaan - genom yang sudah didekripsi dari ribuan orang lain. Panel dipilih untuk setiap pasien - dengan mempertimbangkan riwayat dan data klinis. Semua ini, tentu saja, dilakukan oleh sequencer otomatis dan komputer.
Dan jika 20 tahun yang lalu "pembacaan" genom membutuhkan waktu berbulan-bulan, diperlukan dekripsi yang lambat dan kompleks, hari ini di laboratorium tempat kami bekerja, analisis dilakukan dalam beberapa hari kerja.
Selain itu, beberapa metode digunakan sekaligus:
sekuensing generasi baru (NGS), sekuensing Sanger dan metode hibridisasi fluoresensi (IKAN) . Bersama-sama, mereka memungkinkan Anda untuk membaca seluruh urutan DNA tumor, mencari tahu mutasi driver - yaitu, mereka yang meluncurkan proses ganas dan sekarang dapat ditargetkan dengan terapi yang ditargetkan - dan bahkan memvisualisasikan seluruh kariotipe (set kromosom).
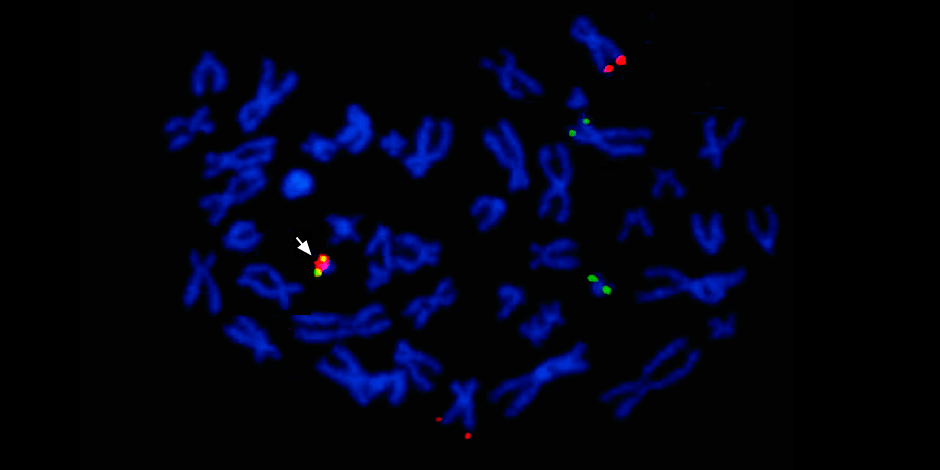 Di bawah panah ke kiri - perpaduan sinyal merah dan hijau - bukti perpaduan materi genetik kromosom 9 dan 22 dengan pembentukan kromosom Philadelphia chimeric.
Di bawah panah ke kiri - perpaduan sinyal merah dan hijau - bukti perpaduan materi genetik kromosom 9 dan 22 dengan pembentukan kromosom Philadelphia chimeric.Selain itu, studi genetik molekuler lengkap harus menentukan
ketidakstabilan mikrosatelit (MSI, ketidakstabilan mikrosatelit) - suatu pelanggaran terhadap mekanisme perbaikan DNA, yang mengarah pada akumulasi mutasi yang cepat dalam sel. Faktor ini memungkinkan Anda membuat perkiraan tentang perjalanan penyakit selanjutnya.
Setelah mendapatkan profil genetik molekuler tumor, analisisnya dimulaiProgram khusus memproses hasilnya dan membuat rekomendasi secara otomatis. Namun rekomendasi ini secara manual diawasi oleh tim ahli. Analisis ini melibatkan genetika, bioinformatika, ahli kanker, ahli imunologi dan ahli kemoterapi. Pada tahap ini, penyempurnaan dan penambahan harus terjadi.
Bergantung pada permintaan, studi seperti itu dapat berlangsung
dari 5 hingga 15 hari kerja : satu pasien hanya perlu menentukan jenis tumor dan mengklarifikasi terapi yang direkomendasikan - cukup periksa keberadaan set dasar 20 mutasi DNA sesuai dengan rekomendasi dari asosiasi kanker dunia. Dan yang lain, dengan diagnosis langka atau resistensi terhadap pengobatan standar - Anda perlu membuat "paspor molekuler" dari tumor, dan untuk ini - untuk mengurutkan 400 gen.
Akibatnya, pada bagian pertama laporan, semua mutasi yang ditemukan pada tumor pasien, dan obat-obatan yang ditargetkan akan paling efektif dalam kasus ini
terdaftar .
Terapi bertarget disetujui untuk jenis tumor ini dengan mutasi yang terdeteksi, dan terapi bertarget disetujui untuk pengobatan kanker jenis lain dengan mutasi yang sama. Dalam praktiknya, kami memiliki kasus ketika obat-obatan second-order, off-label, diresepkan dan bertindak dengan baik.
Selanjutnya, staf laboratorium melakukan pekerjaan yang baik untuk memantau penelitian ilmiah, yang mungkin signifikan dalam kasus pasien ini.
Bagian kedua dari laporan ini berisi tinjauan umum dari penelitian yang ada pada saat itu dengan data terperinci tentang frekuensi terjadinya mutasi ini, tentang efek dari berbagai obat dan tentang kemungkinan menggunakan satu atau lain jenis terapi yang ditargetkan untuk mutasi yang diidentifikasi. Ini membantu untuk membuat setidaknya prognosis kasar bagi pasien.
Bagian ketiga dari laporan ini berisi studi klinis yang relevan di mana pasien dapat berpartisipasi untuk menerima perawatan eksperimental. Ini adalah metode darurat terbaru, tetapi untuk mengetahui semua detail tentang hal itu berguna untuk ketenangan pikiran pasien.
Akibatnya, dari laporan ini, dokter menerima profil genetik molekuler paling lengkap dari tumor ganas. Dia memiliki informasi apa yang sebenarnya kita tangani, rincian spesifik apa dalam sebuah sel. Ada pemahaman "segar" tentang obat mana yang saat ini disetujui atau tersedia untuk digunakan dalam uji klinis.
 Laporan ini cukup berat - 30 halaman bacaan yang menakjubkan
Laporan ini cukup berat - 30 halaman bacaan yang menakjubkanSiapa yang butuh ini?
Mereka yang telah mengembangkan resistensi tumor atau intoleransi terhadap semua obat dari protokol pengobatan standar.
Situasi ketika "semua orang mencobanya - itu tidak membantu.", , (NCCN), « 24/7», – « » .
, 1- – , . . – – – 2- – , . – 3- , .. «» .
, , : , «» , . – . , , . – , , .
– «», . , off-label, . , ?
- , , . – .
. , . , , 80% , 20% – . , - , 80% , 20% .
- , , . , , . , : , , , . , , 10 – 10 .
30% – . , – : 600 . , , HER2/Neu.
. - – , – . , . 600 . ., 5 – , , , . .
- . . «» . , , , , ..
, . (, , ) – , .
, , «». – .
, , .
, 48 , ( ). , . , , . .
- . , 600 . , , 250, – , .
, . EGRF – .
4 . 5 , . , , 4 , .
,
« 24/7» , – .
.