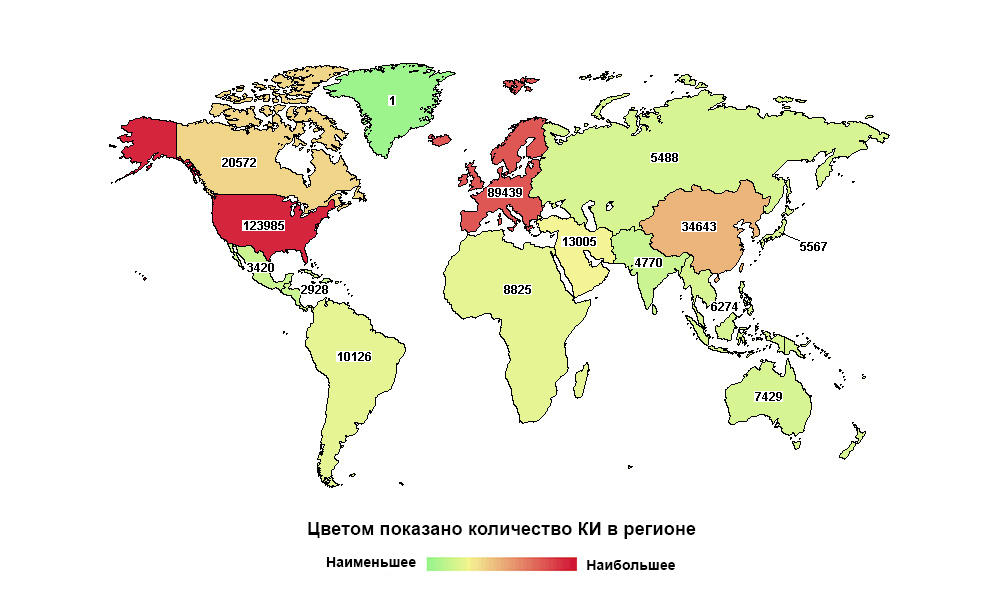
 Rusia jauh dari yang pertama di dunia, tetapi yang pertama dalam jumlah studi di negaranya
Rusia jauh dari yang pertama di dunia, tetapi yang pertama dalam jumlah studi di negaranyaObat apa pun hari ini, sebelum sampai ke pasien, harus melalui serangkaian uji klinis yang panjang. Penting untuk membuktikan bahwa ia mampu memecahkan masalah kesehatan tertentu, dan untuk melakukan ini lebih efektif dan, lebih disukai, lebih aman daripada pendahulunya.
Pemilihannya ketat - 98% dari semua obat yang diteliti tidak mencapai pasien. Pada 2% dari "yang beruntung", penelitian ilmiah tentang zat baru sebelum memasuki pasar membutuhkan lebih dari 12 tahun dan lebih dari 1,5 miliar dolar.
Kami di Klinik
24/7 Kedokteran terlibat langsung dalam uji klinis. Untuk tahun kedua berturut-turut, kami telah melakukan uji klinis obat antitumor asing. Dengan bantuan kami, obat-obatan baru mendapatkan akses ke Rusia lebih cepat, dan lebih dari 100 orang per tahun - kesempatan lain untuk perawatan, gratis.
Untuk klinik swasta, praktiknya tidak biasa: minimal manfaat komersial, terlalu banyak kesulitan dalam mengatur proses dan persyaratan ketat untuk institusi medis. Biasanya hanya pusat federal besar yang berhasil mematuhinya.
Tetapi bagi banyak pasien di Rusia, uji klinis obat adalah satu-satunya kesempatan untuk mendapatkan pengobatan gratis untuk penyakit mematikan. Tetapi di antara pasien kanker Rusia, 30% tidak tahu apa itu uji klinis, dan hanya sedikit yang ambil bagian di dalamnya.
Karena itu, kami ingin sebanyak mungkin orang belajar dan memeriksa: mungkin mereka memiliki kesempatan untuk mendapatkan obat yang dapat menyelamatkan hidup mereka.
Dalam artikel ini kami akan menjelaskan mengapa kami membutuhkan dan bagaimana uji klinis diatur, siapa dan bagaimana bisa sampai di sana.
Cerita sedih. Mengapa uji klinis diperlukan dan mengapa buruk tanpanya
Penelitian klinis / percobaan (selanjutnya disebut - CI) - sebuah studi ilmiah yang melibatkan orang-orang sebagai subjek, yang dilakukan untuk menilai efektivitas dan keamanan obat baru atau memperluas indikasi untuk penggunaan yang sudah diketahui. Selain obat-obatan, CI juga dapat mempelajari kemanjuran dan keamanan metode pengobatan dan diagnosis baru.
Kedokteran berkembang dan berubah menjadi ilmu pasti, yang tidak dapat dilakukan tanpa statistik.
Sebelumnya, dokter keluarga itu hafal kisah-kisah semua pasiennya, dokter itu bisa menjalani seluruh hidupnya di satu kota, menemukan dan mengingat pendekatan pribadi dalam merawat semua orang. Selain itu, pilihan ramuan itu kecil: ramuan obat, lintah, merkuri dan arsenik. Tanggung jawab selama postulat "semua kehendak Tuhan" pada para dokter kurang.
 Arsen dari akhir XVIII "memulihkan" potensi dan "menyembuhkan" arthritis ...
Arsen dari akhir XVIII "memulihkan" potensi dan "menyembuhkan" arthritis ... ... dan merkuri, misalnya, adalah pencahar dan "dari sifilis."
... dan merkuri, misalnya, adalah pencahar dan "dari sifilis."Ketika pengobatan menjadi luas, dokter perlu mengembangkan taktik perawatan yang benar-benar tidak salah lagi. Obat-obatan tertentu seharusnya membantu kebanyakan pasien dalam kondisi tertentu.
Idealnya, seorang dokter harus menggunakan hanya metode pencegahan, diagnosis dan perawatan yang memiliki probabilitas sangat rendah untuk mendapatkan "hasil acak", karena kegunaan dan efektivitasnya telah dibuktikan oleh banyak percobaan yang dilakukan dengan benar.
Ini adalah
obat berbasis bukti - satu-satunya pendekatan yang memadai untuk masalah serius seperti kesehatan manusia saat ini.
Dan itu adalah
penelitian klinis yang menjadi
dasar kedokteran berbasis bukti.
Sampai pertengahan abad ke-20 (!), Tidak ada regulasi penelitian tentang obat baru. Untuk memulihkan ketertiban, seperti yang sering terjadi, butuh beberapa tragedi.
Pada tahun 1937, 105 anak-anak dan satu orang dewasa meninggal, mengambil "ramuan" dari sulfonamide antiseptik dan ... dietilen glikol beracun. Ya, yang digunakan saat ini dalam antibeku. Kemudian perusahaan farmasi
ME Massengill tanpa sadar menggunakannya sebagai pelarut, eksipien. Tidak ada penelitian keamanan dari "koktail" yang dihasilkan untuk manusia telah dilakukan. Ketika mereka tiba-tiba menyadari dan menyita obat dari penjualan, sudah ada lebih dari seratus korban. Pada tahun 1938, Kongres AS mengeluarkan undang-undang tentang penelitian wajib obat sebelum mereka mulai dijual. Kontrol atas hal ini dipercayakan kepada FDA (
Administrasi Makanan dan Obat-obatan Inggris), Administrasi Makanan dan Obat-obatanSkandal yang bahkan lebih keras terjadi dengan
thalidomide pada akhir 1950-an dan awal 1960-an. "Pil penenang dan tidur, yang sangat membantu meracuniosis wanita hamil" terjual habis dengan cepat. Studinya hanya dilakukan pada tikus. Ternyata ini tidak cukup. Pada manusia, thalidomide menyebabkan cacat pada perkembangan janin. Di Eropa, Australia dan Jepang, sekitar 10.000 anak dilahirkan dengan malformasi (malformasi) pada tungkai. Obat ini dilarang di sebagian besar negara pada tahun 1961.
 Ibu dari anak-anak ini minum pil tidur, tidak diuji pada manusia
Ibu dari anak-anak ini minum pil tidur, tidak diuji pada manusiaSejak itu, obat-obatan telah dipelajari dengan cermat sebelum pendaftaran. Hal ini diatur oleh
Peraturan Tripartit Harmonisasi Internasional tentang Praktik Klinik yang Baik (Pedoman Tripartit Harmonisasi ICH untuk Praktik Klinik yang Baik, disingkat ICH GCP). Dari 1996-97, mereka beroperasi di Amerika Serikat, Jepang, dan UE, dan sejak 2003 mereka telah diperkenalkan di Rusia.Bagaimana penelitiannya dan mengapa begitu lama?
Seluruh proses pembuatan obat dapat dibagi menjadi 3 fase besar.
1. Cari ide dan studi praklinis - in vitro dan pada hewan.
2. Jika ini tidak berakhir di sana, maka studi klinis dimulai, dengan orang-orang: pertama hati-hati, kemudian lebih besar.
3. Obat tersebut kemudian terdaftar dengan otoritas pengawas untuk menjadi nama yang dikenal di direktori medis.
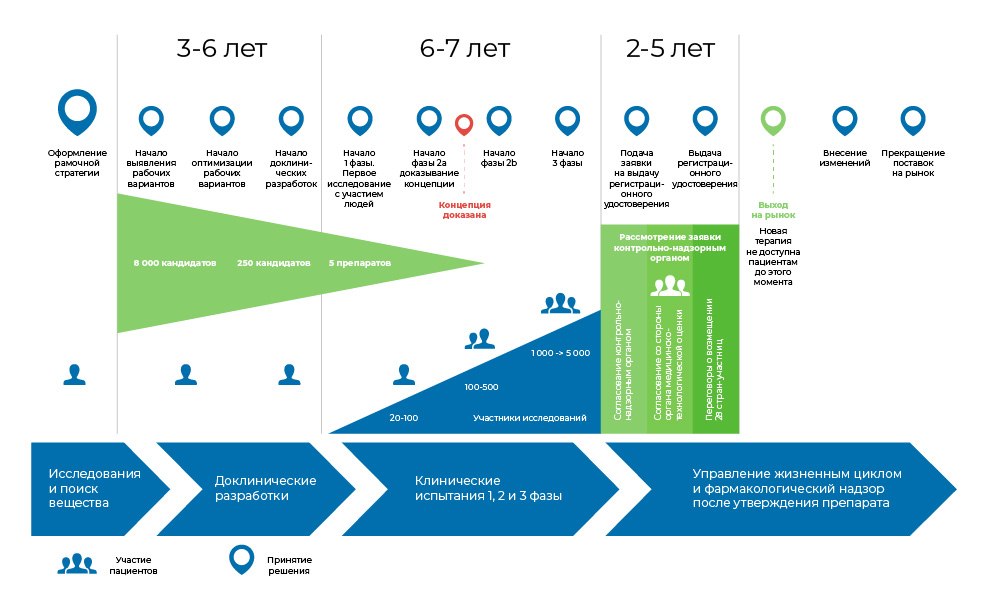 Proses pengembangan obat. Dari saat molekul dibuat sampai dimulainya penjualan obat, dibutuhkan dari 8 hingga 20 tahun.Jadi, adakah yang membutuhkan ini?
Proses pengembangan obat. Dari saat molekul dibuat sampai dimulainya penjualan obat, dibutuhkan dari 8 hingga 20 tahun.Jadi, adakah yang membutuhkan ini? Onkologi adalah salah satu bidang kedokteran yang paling mengerikan dalam hal kebutuhan obat yang tidak terpenuhi. Menurut Organisasi Kesehatan Dunia, pada 2018, kanker
menewaskan 9,6 juta orang. Tumor sering ditemukan pada tahap selanjutnya, ketika hanya perawatan paliatif yang tersisa.
Pada saat yang sama, penemuan di bidang biologi molekuler dan genetika memungkinkan untuk memahami mekanisme yang berkontribusi pada perkembangan dan perkembangan kanker, dan pemahaman tentang pekerjaan kekebalan antitumor meningkat.
Dan hari ini, pengembangan obat antitumor adalah salah satu bidang kedokteran yang paling intensif sains dan populer.
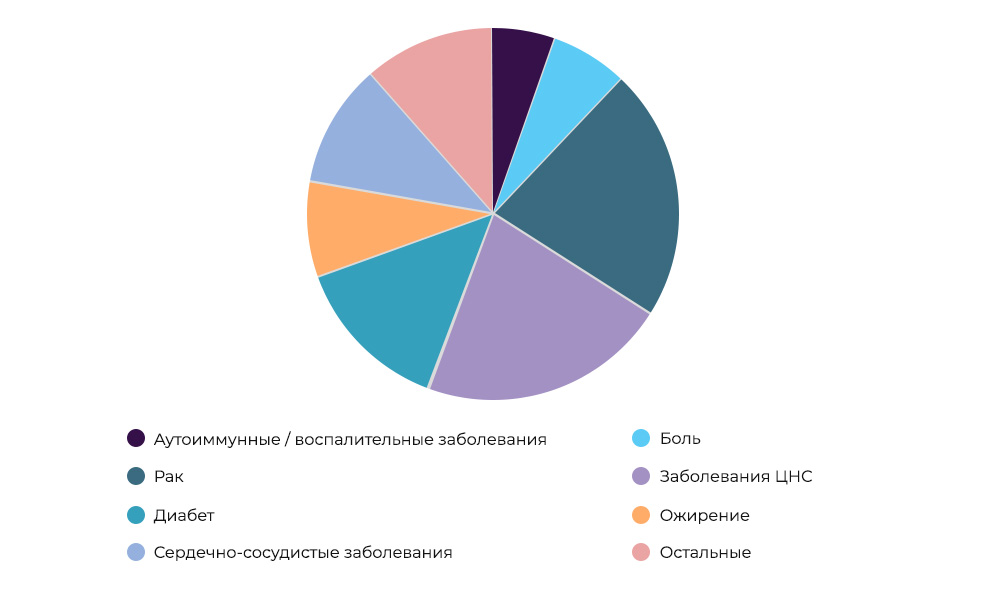 Penelitian tentang obat anti kanker - 23% dari semua CI di duniaSiapa yang membayar untuk penelitian ini.
Penelitian tentang obat anti kanker - 23% dari semua CI di duniaSiapa yang membayar untuk penelitian ini. Terkadang penyelenggara dan sponsor dapat menjadi organisasi penelitian. Tetapi lebih sering, para ilmuwan terlibat dalam penelitian ilmiah dengan mengorbankan perusahaan farmasi. Mereka berharap untuk memasuki pasar dengan obat yang sukses, mendapat untung dan mengganti biaya CI dan pengembangan. Ini seperti membeli film baru untuk disewa dalam film: distributor tidak tahu apakah dia akan "menembak" atau tidak. Memproduksi obat baru adalah bisnis yang sangat berisiko.
Sebelumnya, banyak perusahaan farmasi melakukan penelitian sendiri, menggunakan staf ilmuwan. Sekarang lembaga medis yang telah lulus akreditasi dan memenuhi persyaratan tertentu dapat menjadi platform dan pelaku percobaan.
Ini persis seperti
"Kedokteran 24/7" kami . Perusahaan farmasi siap membayar, tetapi keuangan dialokasikan pada akhir penelitian, berdasarkan fakta biaya yang dikeluarkan. Klinik tidak mendapatkan keuntungan super apa pun. Dan para peneliti riset umumnya tidak mendapatkan apa-apa selain gaji mereka yang biasa. Sebaliknya, ini adalah posisi kepala klinik: seseorang menganggapnya tepat untuk memajukan obat-obatan negara dan mengambil kesempatan untuk berpartisipasi dalam hal ini.
Pertama, sebuah ide muncul. Sebenarnya apa yang harus diselidiki? Dalam onkologi, "target" pertama kali ditemukan - titik lemah dari penyakit. Jika Anda mengganggu atau hanya "mematikan" molekul target, tumor "menderita". Banyak obat kanker modern,
bertarget atau
imunoterapi, dibangun berdasarkan prinsip ini.
 Mekanisme obat yang ditargetkan pada kanker kolorektal. Sel-sel kanker berhenti membelah, atau menumbuhkan pembuluh darah tambahan ke tumor, atau obat melindungi sel-sel tetangga agar tidak ganas
Mekanisme obat yang ditargetkan pada kanker kolorektal. Sel-sel kanker berhenti membelah, atau menumbuhkan pembuluh darah tambahan ke tumor, atau obat melindungi sel-sel tetangga agar tidak ganasUntuk menemukan zat seperti itu, dan kemudian memilih kandidat yang paling cocok, dibutuhkan banyak sumber daya dan waktu untuk penelitian
in vitro dan silicio - yaitu, in vitro atau menggunakan simulasi komputer.
Zat yang dipilih disimpan dalam jumlah yang tepat - diproduksi sesuai dengan aturan khusus (di Rusia itu adalah GOST R 52249-2009), tanpa kotoran dan pelanggaran teknologi. Dan dengan tabung reaksi ini, para ilmuwan pergi untuk menguji obat pada hewan.
Mouse adalah mesin kemajuan. Setelah menguji ide in vitro, seorang ilmuwan dengan pasokan obat potensial pergi ke vivarium - Anda perlu memeriksa bagaimana prototipe berperilaku dalam tubuh mamalia (in vivo).
Bahkan pada 1025, Avicenna menulis dalam "Canon of Medical Science" bahwa obat-obatan harus diperiksa. Selain itu, diinginkan - pada pasien potensial, seseorang. Bagaimanapun, hasil yang diperoleh pada singa dan kuda tidak menjamin bahwa obat tersebut akan mempengaruhi orang-orang dengan cara yang sama.
Dan masih dalam pengobatan, tanpa percobaan pada hewan - tidak bisa dilakukan. Namun, singa dan kuda dibiarkan sendirian. Studi praklinis di seluruh dunia terjadi terutama pada tikus, kelinci percobaan, dan kelinci.
 Tikus laboratorium bahkan meletakkan monumen di Akademi Novodibirsk
Tikus laboratorium bahkan meletakkan monumen di Akademi NovodibirskPada tahap ini, periksa seberapa berbahaya / aman obat tersebut:
- apakah itu menyebabkan alergi
- apakah itu memiliki efek toksik pada jaringan dan organ,
- bagaimana hal itu memengaruhi kemampuan hewan untuk bereproduksi dan perkembangan normal janin, dll.
Selain itu, mereka mengamati bagaimana calon obat berperilaku di dalam tubuh hewan (farmakokinetik):
- tingkat penyerapan dan peningkatan konsentrasi darah,
- berapa dosis maksimum dan minimum
- seberapa cepat dikeluarkan dari tubuh, dll.
Semua data ini diperlukan untuk memutuskan
apakah mungkin menggunakan zat uji untuk manusia. Dan jika demikian, berapa banyak yang dibutuhkan.
Kejahatan yang tak terhindarkan. Birokrasi Departemen Luar Negeri memantau kemajuan CI yang benar
. regulasi sirkulasi obat-obatan dari Departemen Kesehatan dan Layanan Federal untuk Pengawasan Kesehatan (Roszdravnadzor).Jika ilmuwan telah sampai pada saat ketika perlu untuk melanjutkan ke uji klinis pada manusia - sekarang saatnya untuk mempersiapkan aplikasi untuk melakukan CI. Untuk melakukan ini, ia memerlukan beberapa
dokumen .
- Berkas obat studi. Segala sesuatu yang telah diketahui tentang obat: data tentang farmakokinetik, efektivitas, toksisitas, dll.
- Protokol Studi Ini merinci rencana untuk penelitian masa depan dan metode untuk mengevaluasi hasil;
- Brosur Peneliti. Lembar contekan pendek untuk menjelaskan dengan jelas esensi penelitian kepada sukarelawan dan pasien dan mendapatkan persetujuan mereka.
Komite Etika. Tahap selanjutnya dari pencarian adalah untuk mendapatkan penilaian dan kesimpulan dari komite etika.
Komite Etika adalah kelompok independen dokter, ilmuwan, tenaga medis dan non-spesialis (anggota masyarakat). Mereka mempelajari protokol penelitian dan informed consent untuk memastikan bahwa ada kesepakatan antara pasien, peneliti, perusahaan farmasi dan otoritas peraturan nasional, bahwa tidak ada hak seseorang yang dilanggar, bahwa tidak ada yang dikenai paksaan, dan tidak ada yang dilanggar kehendak bebas.
Setelah efek samping yang parah dari satu obat pada tahun 2006, komite etika menjadi lebih ketat. Oleh karena itu, kadang-kadang penelitian dapat "membeku" pada tahap ini selama satu tahun atau lebih.
Setelah memeriksa semua dokumen dan persetujuan komite etika, obat potensial masuk ke tahap
uji klinis - pada manusia.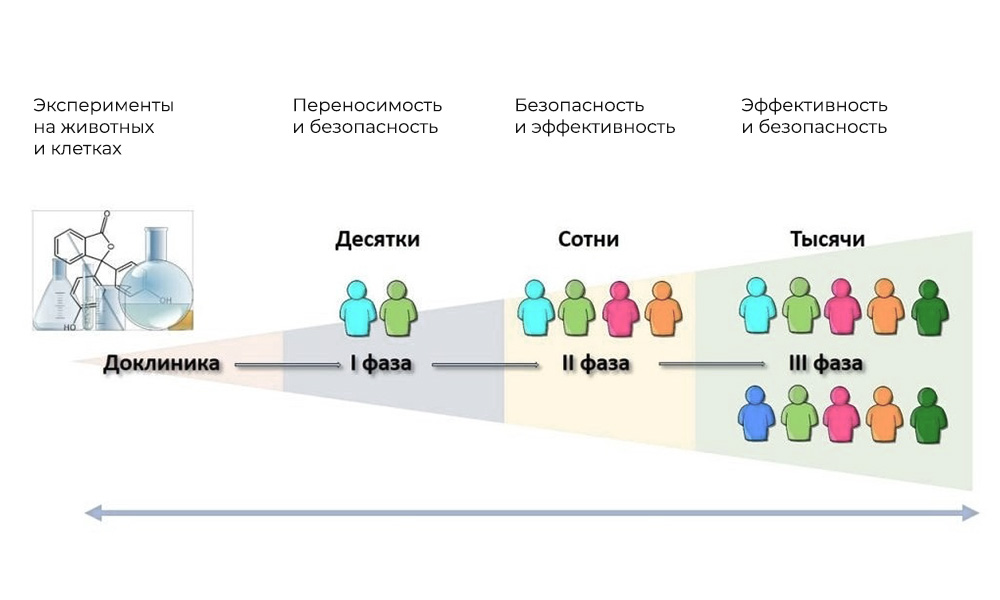 Fase utama uji klinis adalah pada manusia.
Fase utama uji klinis adalah pada manusia.Fase I. Menguji mekanisme aksi
Peserta: 20 - 100 orang.
Durasi: dari beberapa bulan hingga 1 tahun.
Tujuan: mempelajari toleransi, farmakodinamik, dan farmakokinetik.
Diperiksa apakah zat itu bekerja pada manusia dengan cara yang sama seperti pada hewan, apakah itu aman.
Pada fase pertama studi klinis, secara teoritis, sukarelawan yang sehat harus berpartisipasi, tetapi dalam pengujian onkologi zat kuat dalam tubuh yang sehat tidak dapat disebut etis. Oleh karena itu, orang dengan penyakit yang sesuai terlibat, yang dengannya obat masa depan dapat menjadi efektif.
Peserta secara bertahap disuntik dengan semua dosis obat yang lebih besar, mulai dari minimum hingga maksimum yang diijinkan. Setelah setiap pemberian, kondisi pasien dipantau.
Farmakokinetik dievaluasi : laju penyerapan dan ekskresi (ekskresi zat yang tidak berubah), distribusi ke jaringan dan organ.
Farmakodinamik juga dievaluasi: efek obat pada sel tumor, pada organ dan organ lain, efek samping. Aplikasi dan tingkat dosis yang lebih disukai sedang diklarifikasi.
Selain penelitian dengan peningkatan dosis, pada fase I periksa:
- efek makanan pada obat;
- interaksi dengan obat lain;
- efek penyakit lain yang dapat memengaruhi dosis obat yang diinginkan (misalnya, pada pasien dengan gagal ginjal).
Menurut
FDA , 70% obat berhasil melewati fase pertama CI.
Fase II Memeriksa tindakan untuk sasaran yang diberikan: jenis penyakit tertentu
Peserta: 100 hingga 500 pasien.
Durasi: dari beberapa bulan hingga 2 tahun.
Tujuan: untuk menguji efektivitas indikasi tertentu
Penting untuk mempelajari seberapa efektif obat baru dibandingkan dengan plasebo atau pengobatan yang ada. Plus, sejumlah besar peserta dapat mendeteksi efek samping yang lebih jarang yang tidak terdeteksi pada fase I.
Untuk berpartisipasi dalam fase CI ini, pasien dipilih berdasarkan kriteria yang jauh lebih besar daripada fase pertama. Misalnya, bukan hanya "kanker payudara", tetapi "kanker payudara, stadium T2N1M0, subtipe HER2-positif".
Biasanya, penelitian pada tahap ini dilakukan sebagai
double-blind, acak, terkontrol plasebo.Penyilauan ganda: baik dokter maupun pasien tidak tahu siapa yang menerima zat aktif dan siapa yang menerima plasebo atau pengobatan optimal yang ada saat ini.
Pengacakan menyiratkan bahwa pasien dibagi menjadi beberapa kelompok secara acak - menggunakan generator nomor acak. Baik dokter maupun peserta CI tidak dapat memengaruhi proses ini.
Kontrol plasebo berarti bahwa peserta dalam satu kelompok akan menerima plasebo dalam kondisi yang sama dengan peserta dalam kelompok lain yang diberi zat aktif.
 Semua orang - sama dalam penampilan, rasa dan aroma obat.
Semua orang - sama dalam penampilan, rasa dan aroma obat.Semua "teologi konspirasi" ini diperlukan untuk mengecualikan distorsi yang disengaja atau tidak sadar dari data eksperimen oleh peserta atau peneliti.
Jadi, pada fase pertama, di mana tidak ada persyaratan ketat seperti itu, ada hasil yang menakjubkan. Ini adalah statistik "kotor", pada fase II dibersihkan dari kelebihan dan hasilnya menjadi masuk akal.
Menurut FDA, hanya 33% obat yang mencapai fase II berhasil menjalani CI dan beralih ke fase berikutnya.
Fase III Studi pendukung
Jumlah peserta: 300 - 3.000 atau lebih.
Durasi: dari satu tahun hingga beberapa tahun.
Tujuan: konfirmasi keefektifan dan keamanan zat uji dalam sampel besar.
Ini adalah bagian terbesar dari proses pengembangan obat yang paling besar, paling kompleks, dan paling mahal. Tujuan dari penelitian tersebut adalah untuk mengkonfirmasi efektivitas dan keamanan zat uji ketika digunakan oleh sejumlah besar pasien.
Berdasarkan hasil fase ini, produsen obat menerima izin untuk membawanya ke pasar.
Pada fase III, ribuan pasien dari berbagai negara dapat mengambil bagian. Semuanya harus direncanakan dengan perincian terkecil, sehingga di semua tempat penelitian desain dan kondisinya yang signifikan sama persis.
Desain penelitian ini sangat sempit sehingga tidak hanya pasien yang sekarat, tetapi juga pasien dengan prognosis untuk remisi stabil dapat masuk ke dalamnya. Obat harus sangat aman sehingga dapat diberikan kepada orang yang praktis sehat - dan kualitas hidup tidak menurun.
Sebelum memulai fase III, ada banyak konsultasi dan diskusi antara peneliti dan pakar pihak ketiga: sangat penting untuk memikirkan desain percobaan agar tidak ketinggalan yang penting dan mendapatkan semua data yang diperlukan.
Selama fase III, kemanjuran dan keamanan obat baru dan hubungan dosis-respons akhirnya dikonfirmasi.
Korelasi antara keuntungan dan risiko dianalisis. Berdasarkan hasil, badan pengawas memutuskan apakah mungkin untuk membawa obat ke pasar. Untuk melakukan ini, kondisi berikut harus dipenuhi:
- obat ini lebih efektif daripada analog yang dikenal sebelumnya,
- memberikan lebih sedikit efek samping / lebih ditoleransi
- efektif ketika obat yang diketahui sebelumnya tidak bekerja,
- lebih menguntungkan secara ekonomi,
- lebih mudah digunakan.
Proses peninjauan aplikasi oleh pengawas membutuhkan waktu 12-18 bulan.
Menurut FDA, fase ketiga uji klinis berakhir dengan hasil positif hanya 25-30% dari semua kasus yang berada di awal fase ketiga.
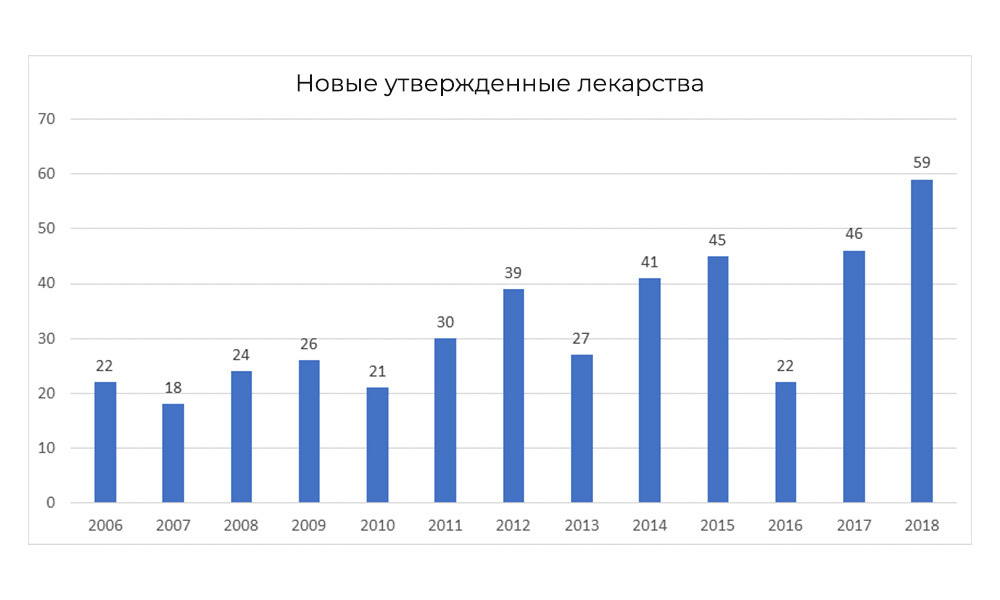 Namun, pada 2018, FDA memecahkan rekornya sendiri untuk jumlah obat yang disetujui.
Namun, pada 2018, FDA memecahkan rekornya sendiri untuk jumlah obat yang disetujui.Fitur penelitian nasional: fase tambahan CI di Rusia
Kontrol obat baru di Rusia memiliki bug sendiri (atau fitur, cara melihat). Menurut hukum, obat asing yang disetujui harus menjalani uji klinis tambahan di Rusia: diduga, ini akan meningkatkan kualitas obat asing.
3 , , . , , , 3 , , .
, 12 – 12 , . , 6 12. , , , , .
2-3 .
« 24/7» III.
. , « ». , . , – , , .
, III – – , «» .
, . .
-,
GCP, Good Clinical Practice.-, . , - : - . . .
-, . , , , , , , – . – : , .
 –
–, , , , .
1 200 , . : , , , , . « » – - .
2 3 , .
2 :
. , , , , .. —
. .
– , , .
, . «», : , , / , – .
. , – . , .
18 .
, – , , 3-4 . : 10 , – .
, , .
– – . , . , , .
, , , , – – . .
, .
–
RosOncoWeb ,
CTAgency .
« 24/7» – .