Ask Ethan No. 36: Um incrível elétron rotativo
O leitor pergunta:Quando li sua resposta sobre lasers, lembrei-me da minha antiga pergunta sobre o princípio de Pauli. Pelo que entendi, para dois elétrons em uma molécula de hidrogênio, os spins devem ser opostos. Isso significa que, durante a formação de uma molécula, os elétrons mudam de rotação ou apenas elétrons com giros opostos podem formar uma molécula?
Há muito a ser dito sobre isso, então vamos começar com o princípio da proibição de Pauli.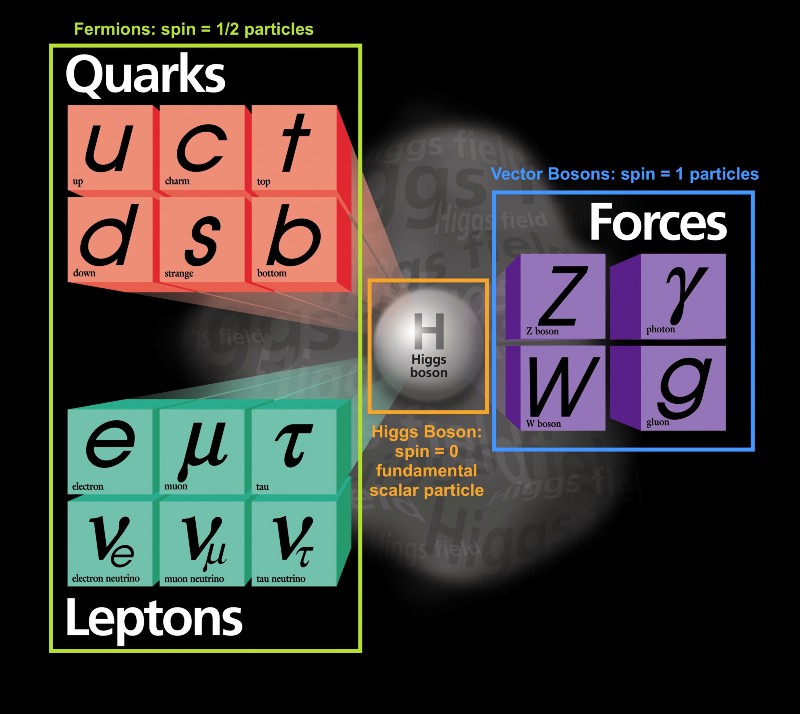 Apesar da grande variedade de tipos diferentes de partículas elementares que existem no Universo, elas podem ser divididas em dois tipos:
Apesar da grande variedade de tipos diferentes de partículas elementares que existem no Universo, elas podem ser divididas em dois tipos:- férmions são partículas com um spin meio inteiro: ± 1/2, ± 3/2, ± 5/2, ..
- bósons são partículas com um giro inteiro: 0, ± 1, ± 2, ..
Curiosamente, as partículas compostas também se comportam como férmions ou como bósons. Prótons e nêutrons se comportam como férmions com giros ± 1/2, como elétrons. Cada partícula tem um conjunto de estados quânticos que pode ocupar, com níveis discretos de energia, momento angular, direções de rotação, etc.A principal diferença entre férmions e bósons é que, se você tiver duas partículas idênticas, poderá enviar tantos bósons no mesmo estado quântico para lá, mas férmions idênticos não poderão ocupar o mesmo estado.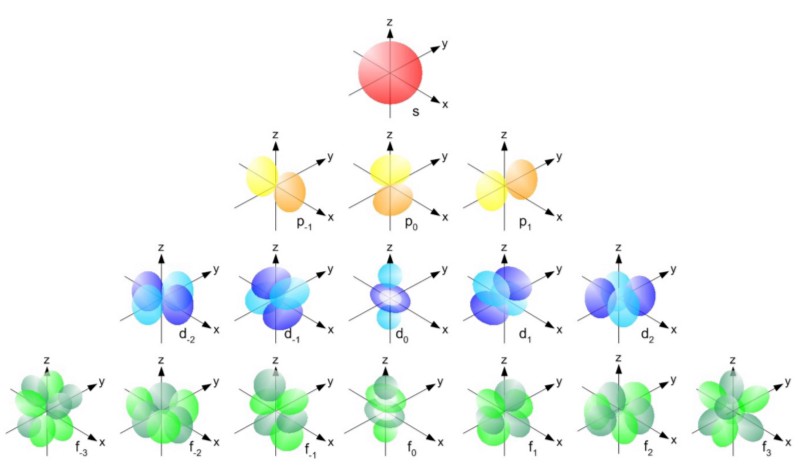 Se o elétron não fosse um férmion, mas um bóson, qualquer átomo poderia ser amontoado em qualquer átomo em qualquer nível de energia mais baixo (vermelho acima). Mas um elétron é um férmion, portanto obedece ao princípio da proibição. Dois elétrons podem atingir o nível mínimo de energia, já que podem ter giros +1/2 e -1/2, mas para adicionar um terceiro elétron, é necessário pular para outro estado quântico.Os estados quânticos em átomos são organizados de modo que você possa ir para um nível de energia mais alto (n na figura abaixo) e depois para estados com um momento angular mais alto (l).
Se o elétron não fosse um férmion, mas um bóson, qualquer átomo poderia ser amontoado em qualquer átomo em qualquer nível de energia mais baixo (vermelho acima). Mas um elétron é um férmion, portanto obedece ao princípio da proibição. Dois elétrons podem atingir o nível mínimo de energia, já que podem ter giros +1/2 e -1/2, mas para adicionar um terceiro elétron, é necessário pular para outro estado quântico.Os estados quânticos em átomos são organizados de modo que você possa ir para um nível de energia mais alto (n na figura abaixo) e depois para estados com um momento angular mais alto (l).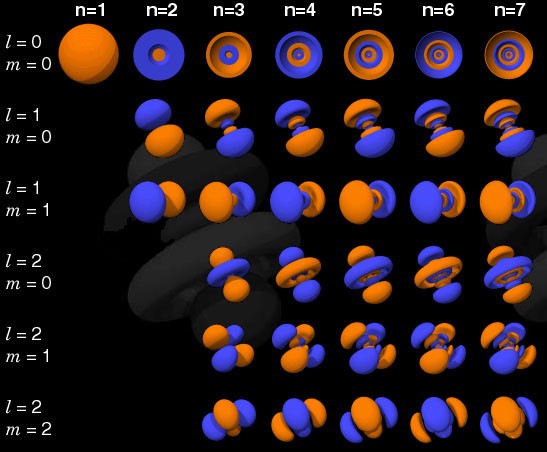 Portanto, os estados l = 0 são orbitais s, l = 1 são orbitais p, l = 2 são orbitais d e assim por diante. Portanto, a tabela periódica possui exatamente essa estrutura: com dois elementos na linha superior (n = 1, l = 0, m = 0 e rotação = ± 1/2), 8 elementos na segunda linha (n = 2, l = 0, m = 0 e spin = ± 1/2 en = 2, l = 1, m = 1,0 ou -1 e spin = ± 1/2), 18 elementos na terceira linha, etc.
Portanto, os estados l = 0 são orbitais s, l = 1 são orbitais p, l = 2 são orbitais d e assim por diante. Portanto, a tabela periódica possui exatamente essa estrutura: com dois elementos na linha superior (n = 1, l = 0, m = 0 e rotação = ± 1/2), 8 elementos na segunda linha (n = 2, l = 0, m = 0 e spin = ± 1/2 en = 2, l = 1, m = 1,0 ou -1 e spin = ± 1/2), 18 elementos na terceira linha, etc.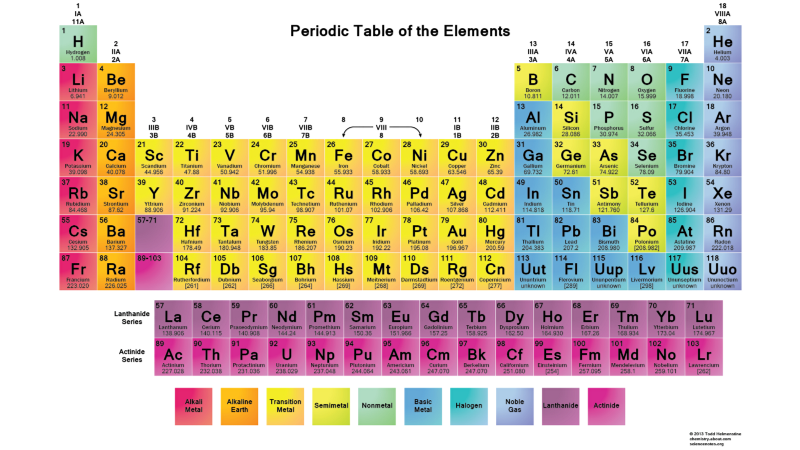 Portanto, adicionando 6, 10, 14, etc. adicionais as ocorrências com cada nova linha da tabela são devidas ao princípio de Pauli.E embora não possamos distinguir um elétron do outro, uma vez que são idênticos, cada sistema atômico é único. Em outras palavras, se você tiver quatro átomos de hidrogênio diferentes no estado fundamental, eles não precisarão ocupar diferentes níveis de energia.
Portanto, adicionando 6, 10, 14, etc. adicionais as ocorrências com cada nova linha da tabela são devidas ao princípio de Pauli.E embora não possamos distinguir um elétron do outro, uma vez que são idênticos, cada sistema atômico é único. Em outras palavras, se você tiver quatro átomos de hidrogênio diferentes no estado fundamental, eles não precisarão ocupar diferentes níveis de energia. Em geral, como os núcleos atômicos (prótons) são diferentes um do outro (não estão no mesmo núcleo ou estão em estados quânticos sobrepostos em qualquer sentido), e os elétrons estão ligados ao próton (ou seja, eles não estão em estados quânticos sobrepostos entre si), é provável que um sistema de átomos de hidrogênio livre seja organizado de tal forma que todos eles estejam em um estado básico, algo como isto:
Em geral, como os núcleos atômicos (prótons) são diferentes um do outro (não estão no mesmo núcleo ou estão em estados quânticos sobrepostos em qualquer sentido), e os elétrons estão ligados ao próton (ou seja, eles não estão em estados quânticos sobrepostos entre si), é provável que um sistema de átomos de hidrogênio livre seja organizado de tal forma que todos eles estejam em um estado básico, algo como isto: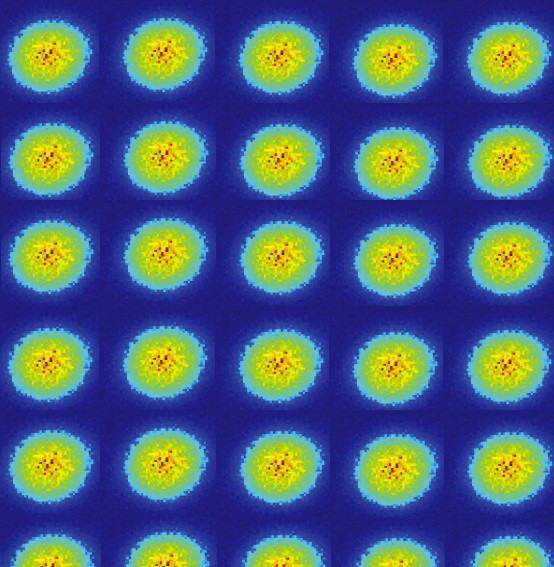 no mínimo, é aconselhável configurar seu sistema dessa maneira inicialmente. Mas se um par de átomos interage, eles se unem e formam uma molécula de hidrogênio. Assim como um átomo de hidrogênio em seu estado fundamental é um pouco mais leve (13,6 eV) do que um próton livre e um elétron livre devido à energia de ligação, uma molécula de hidrogênio é um pouco mais leve (4,52 eV) do que dois átomos de hidrogênio livre .Mas a pergunta foi feita corretamente. Como se dois átomos diferentes tentam se reconectar, as funções de onda dos elétrons tentam se sobrepor.
no mínimo, é aconselhável configurar seu sistema dessa maneira inicialmente. Mas se um par de átomos interage, eles se unem e formam uma molécula de hidrogênio. Assim como um átomo de hidrogênio em seu estado fundamental é um pouco mais leve (13,6 eV) do que um próton livre e um elétron livre devido à energia de ligação, uma molécula de hidrogênio é um pouco mais leve (4,52 eV) do que dois átomos de hidrogênio livre .Mas a pergunta foi feita corretamente. Como se dois átomos diferentes tentam se reconectar, as funções de onda dos elétrons tentam se sobrepor.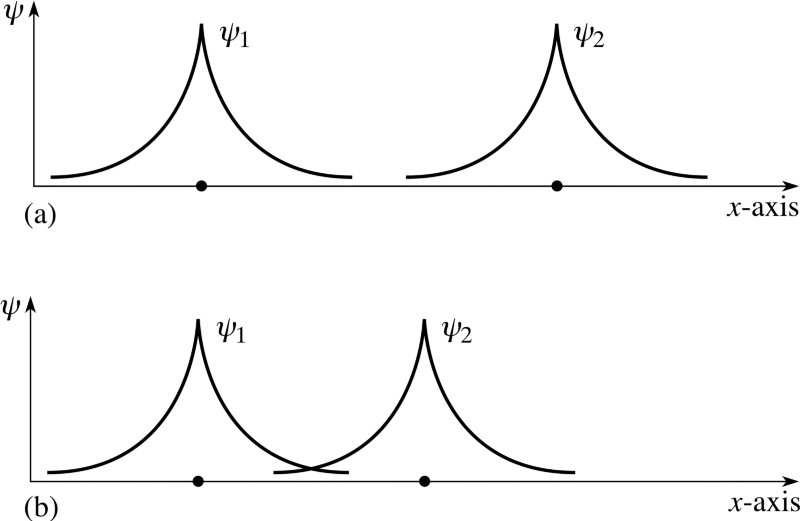 Mas os elétrons têm não apenas rotação, mas também funções de ondas espaciais. Isso significa que eles ocupam o espaço de uma maneira especial. Se eu juntar dois átomos de hidrogênio, suas funções de onda espacial podem ser simétricas, como no diagrama acima, ou antissimétricas, como no diagrama abaixo.
Mas os elétrons têm não apenas rotação, mas também funções de ondas espaciais. Isso significa que eles ocupam o espaço de uma maneira especial. Se eu juntar dois átomos de hidrogênio, suas funções de onda espacial podem ser simétricas, como no diagrama acima, ou antissimétricas, como no diagrama abaixo.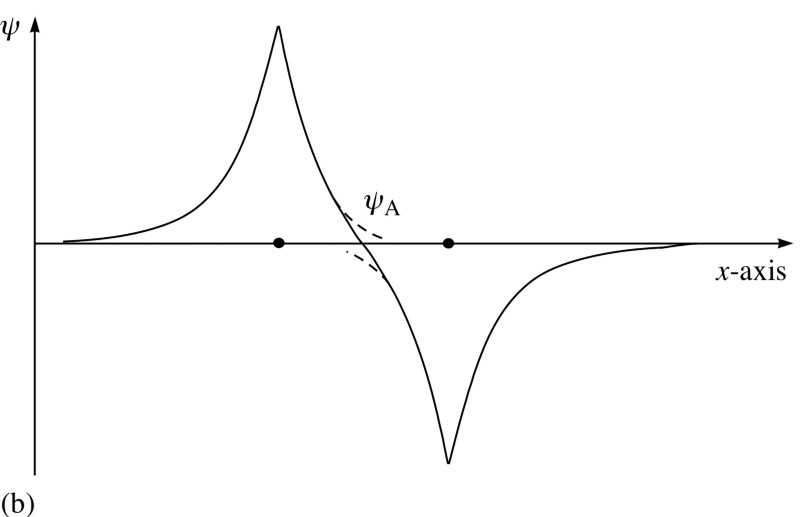 E aqui o princípio de Pauli entra em vigor.Se os átomos de hidrogênio se aproximam das funções de onda simétricas, os spins dos elétrons devem ser antidirecionais - se um deles gira +1/2, o segundo tem -1/2 e vice-versa.E se dois átomos estão se aproximando com funções de onda antissimétricas, então os spins dos elétrons devem estar alinhados: se o primeiro for +1/2, o segundo também deverá ter +1/2 e vice-versa.Portanto, os átomos de hidrogênio podem ser conectados de duas maneiras - com funções de onda simétricas e rotações antidirecionais, ou vice-versa.
E aqui o princípio de Pauli entra em vigor.Se os átomos de hidrogênio se aproximam das funções de onda simétricas, os spins dos elétrons devem ser antidirecionais - se um deles gira +1/2, o segundo tem -1/2 e vice-versa.E se dois átomos estão se aproximando com funções de onda antissimétricas, então os spins dos elétrons devem estar alinhados: se o primeiro for +1/2, o segundo também deverá ter +1/2 e vice-versa.Portanto, os átomos de hidrogênio podem ser conectados de duas maneiras - com funções de onda simétricas e rotações antidirecionais, ou vice-versa.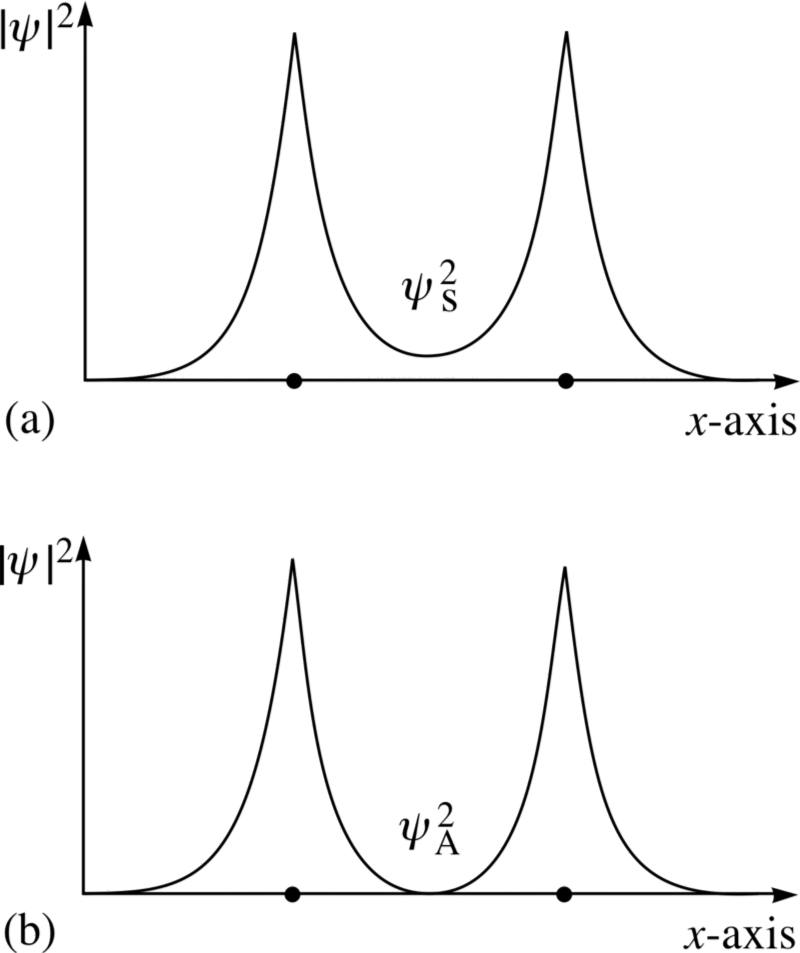 Dê uma olhada nessas duas combinações - na parte superior, as funções de onda se sobrepõem, denotando a conexão, e na parte inferior, elas não se sobrepõem, o que indica que esse estado não está conectado.Podemos calcular qual será a energia de ligação para esses dois estados.
Dê uma olhada nessas duas combinações - na parte superior, as funções de onda se sobrepõem, denotando a conexão, e na parte inferior, elas não se sobrepõem, o que indica que esse estado não está conectado.Podemos calcular qual será a energia de ligação para esses dois estados.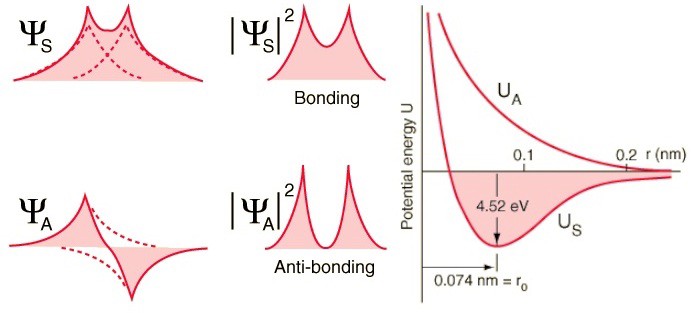 Em um estado anti-simétrico, onde os spins dos elétrons estão alinhados, os átomos não se formam. Somente em um estado simétrico, em que as funções das ondas espaciais são simétricas e as rotações são direcionadas de maneira oposta, pode-se formar uma molécula de hidrogênio.Portanto, para formar uma molécula, você precisa de dois átomos de hidrogênio com funções de onda espacial simétricas e rotações multidirecionais (+1/2 e -1/2). Além disso, você pode ver como a mecânica quântica proíbe que você empurre um terceiro átomo de hidrogênio nele - portanto, você pode criar um átomo H, uma molécula H2, mas nunca H3.
Em um estado anti-simétrico, onde os spins dos elétrons estão alinhados, os átomos não se formam. Somente em um estado simétrico, em que as funções das ondas espaciais são simétricas e as rotações são direcionadas de maneira oposta, pode-se formar uma molécula de hidrogênio.Portanto, para formar uma molécula, você precisa de dois átomos de hidrogênio com funções de onda espacial simétricas e rotações multidirecionais (+1/2 e -1/2). Além disso, você pode ver como a mecânica quântica proíbe que você empurre um terceiro átomo de hidrogênio nele - portanto, você pode criar um átomo H, uma molécula H2, mas nunca H3.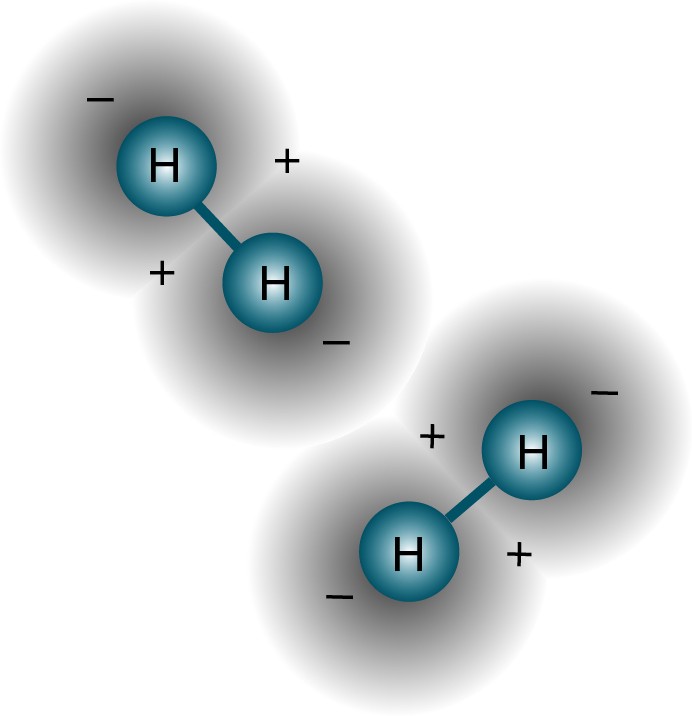
Source: https://habr.com/ru/post/pt386011/
All Articles