Expansão da frente bacteriana da arena de antibióticos: uma experiência espetacular na Harvard Medical School
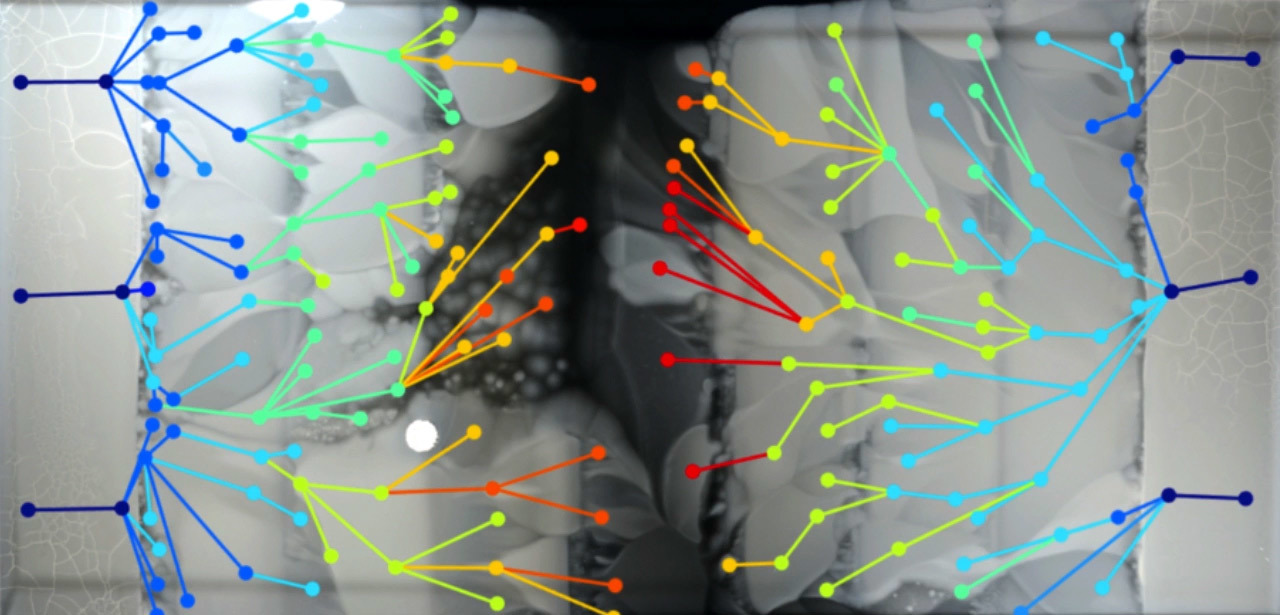 À medida que a resistência a antibióticos aumenta na população bacteriana, surgem linhas paralelas de evolução que diferem em fenótipo e genótipo. Filmado no vídeo de demonstração da Harvard Medical SchoolNormalmente, em experimentos de laboratório, as bactérias são criadas em um ambiente homogêneo. Cientistas da Harvard Medical School foram além. Eles organizaram um experimento incomum sobre a evolução de bactérias em um meio misto - em um enorme "prato" medindo 120 × 60 cm.O espaço foi dividido em zonas com diferentes concentrações do antibiótico, de modo que apenas gerações de bactérias com mutações adequadas passam para a próxima zona. Como resultado, os "supermicrobes" entram na rodada final no centro da arena, ou seja, na medida do possível, alterando seu genótipo e fenótipo como resultado da seleção evolutiva (veja isolamento de oportunistas no final do artigo).A arena da batalha de micróbios com antibióticos é chamada MEGA (evolução microbiana e arena de crescimento). Esse ambiente foi criado especialmente para que, com um crescimento exponencial no número de bactérias, elas não competissem entre si por recursos limitados, como é habitual na maioria dos experimentos científicos. Aqui, os recursos são praticamente ilimitados, e as bactérias são necessárias apenas para conquistar novos territórios e se adaptar às novas condições de vida, multiplicando seus números praticamente sem limites. Nesse sentido, o movimento da frente bacteriana se assemelha à expansão da espécie humana no planeta Terra na Idade Média com a colonização de novos territórios (presumivelmente, o desenvolvimento expansivo da raça humana continuará além das fronteiras do planeta natal, com a colonização de todos os territórios habitáveis na zona de alcance).
À medida que a resistência a antibióticos aumenta na população bacteriana, surgem linhas paralelas de evolução que diferem em fenótipo e genótipo. Filmado no vídeo de demonstração da Harvard Medical SchoolNormalmente, em experimentos de laboratório, as bactérias são criadas em um ambiente homogêneo. Cientistas da Harvard Medical School foram além. Eles organizaram um experimento incomum sobre a evolução de bactérias em um meio misto - em um enorme "prato" medindo 120 × 60 cm.O espaço foi dividido em zonas com diferentes concentrações do antibiótico, de modo que apenas gerações de bactérias com mutações adequadas passam para a próxima zona. Como resultado, os "supermicrobes" entram na rodada final no centro da arena, ou seja, na medida do possível, alterando seu genótipo e fenótipo como resultado da seleção evolutiva (veja isolamento de oportunistas no final do artigo).A arena da batalha de micróbios com antibióticos é chamada MEGA (evolução microbiana e arena de crescimento). Esse ambiente foi criado especialmente para que, com um crescimento exponencial no número de bactérias, elas não competissem entre si por recursos limitados, como é habitual na maioria dos experimentos científicos. Aqui, os recursos são praticamente ilimitados, e as bactérias são necessárias apenas para conquistar novos territórios e se adaptar às novas condições de vida, multiplicando seus números praticamente sem limites. Nesse sentido, o movimento da frente bacteriana se assemelha à expansão da espécie humana no planeta Terra na Idade Média com a colonização de novos territórios (presumivelmente, o desenvolvimento expansivo da raça humana continuará além das fronteiras do planeta natal, com a colonização de todos os territórios habitáveis na zona de alcance). MEGA Arena.Um quadro do vídeo de demonstração da Harvard Medical School Oexperimento tem um valor não apenas científico, mas também educacional. O amplo espaço da arena MEGA permite a observação visual de mutações e seleção natural durante a disseminação da frente da população bacteriana. Uma visão impressionante.Estudos anteriores mostraram que microambientes estruturados desse tipo aumentam a taxa de evolução em pequenas populações bacterianas com uma mudança no genótipo ( Q. Zhang et al., Science 333, 1764-1767 (2011) ). Mas até agora, a questão de como exatamente isso acontece em grandes populações permanece inexplorada.Para tal experimento, foi construída uma placa de Petri retangular de tamanho 120 × 60 cm, estruturada em zonas com aumento exponencial da concentração do antibiótico trimetoprim da periferia para o centro, além de nutrientes para a reprodução de bactérias. A grande área da arena não permitiu que as bactérias E. coli se misturassem, a fim de observar mais claramente as mutações ocorridas.O desenho da arena MEGA e o resultado da propagação da frente bacteriana por 12 dias são mostrados na Figura B. 182 espécies de bactérias mutadas são indicadas por círculos de cores diferentes; a cor indica a concentração de bactérias. As linhas entre as espécies correspondem à direção da mutação, com base no vídeo.
MEGA Arena.Um quadro do vídeo de demonstração da Harvard Medical School Oexperimento tem um valor não apenas científico, mas também educacional. O amplo espaço da arena MEGA permite a observação visual de mutações e seleção natural durante a disseminação da frente da população bacteriana. Uma visão impressionante.Estudos anteriores mostraram que microambientes estruturados desse tipo aumentam a taxa de evolução em pequenas populações bacterianas com uma mudança no genótipo ( Q. Zhang et al., Science 333, 1764-1767 (2011) ). Mas até agora, a questão de como exatamente isso acontece em grandes populações permanece inexplorada.Para tal experimento, foi construída uma placa de Petri retangular de tamanho 120 × 60 cm, estruturada em zonas com aumento exponencial da concentração do antibiótico trimetoprim da periferia para o centro, além de nutrientes para a reprodução de bactérias. A grande área da arena não permitiu que as bactérias E. coli se misturassem, a fim de observar mais claramente as mutações ocorridas.O desenho da arena MEGA e o resultado da propagação da frente bacteriana por 12 dias são mostrados na Figura B. 182 espécies de bactérias mutadas são indicadas por círculos de cores diferentes; a cor indica a concentração de bactérias. As linhas entre as espécies correspondem à direção da mutação, com base no vídeo.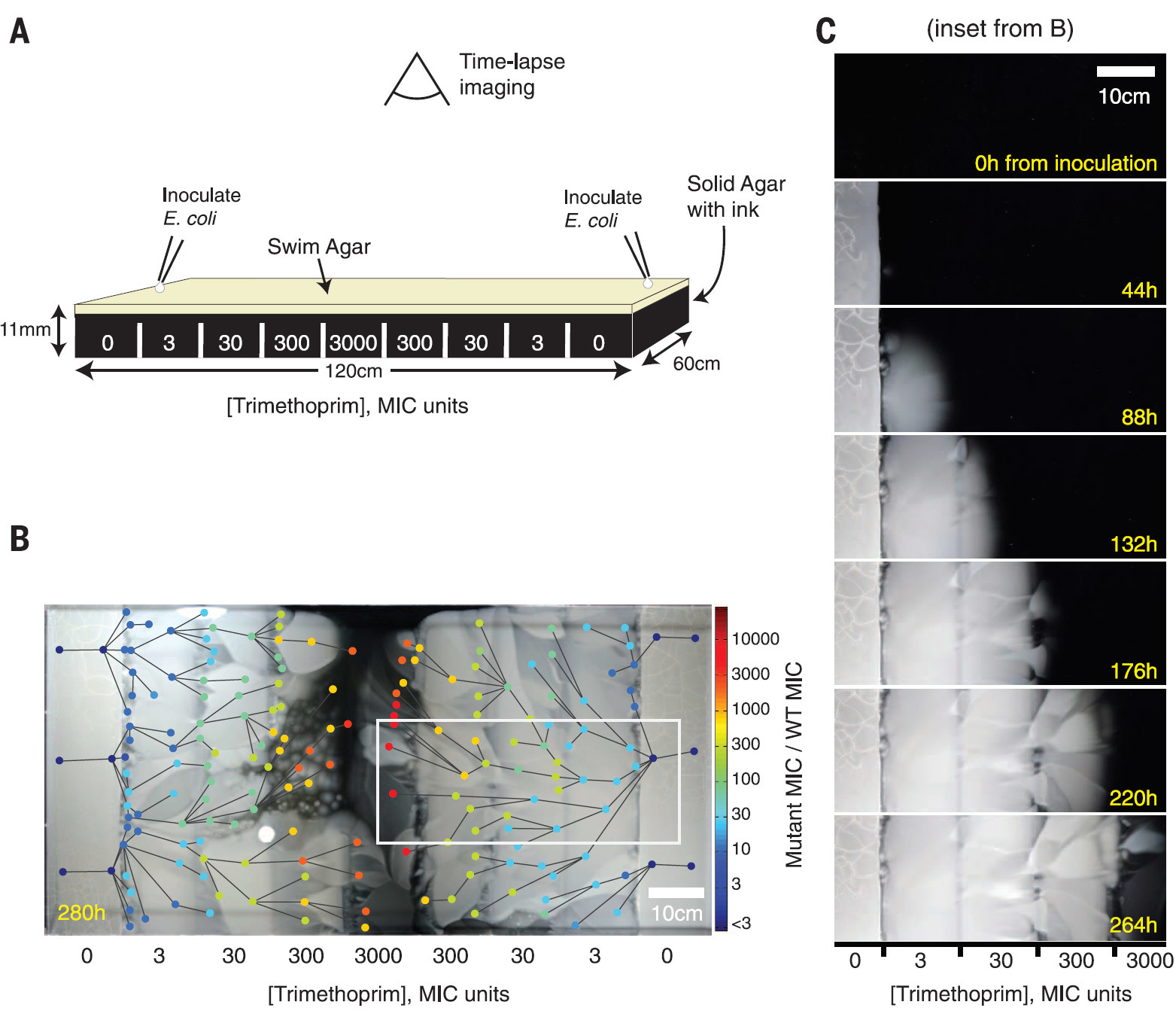 À medida que a resistência aos antibióticos aumenta constantemente, numerosas linhas evolutivas paralelas aparecem na população bacteriana, que diferem em fenótipo e genótipo.
À medida que a resistência aos antibióticos aumenta constantemente, numerosas linhas evolutivas paralelas aparecem na população bacteriana, que diferem em fenótipo e genótipo.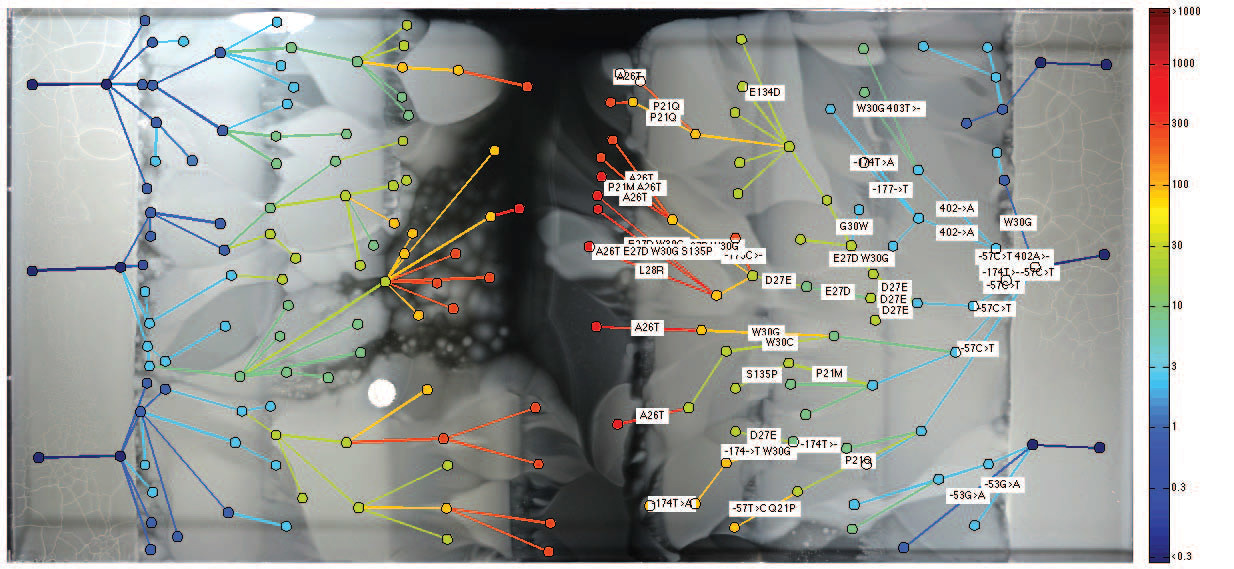 Tendo estudado bactérias na vanguarda e atrás da frente da população bacteriana, os cientistas descobriram várias coisas interessantes. Verificou-se que a evolução nem sempre é impulsionada por bactérias mais resistentes aos antibióticos. Curiosamente, às vezes as linhas hereditárias mais estáveis ficam presas atrás de bactérias mais sensíveis. Aparentemente, isso ocorre devido a mutações "prematuras", quando algumas bactérias estão prontas para sobreviver em uma concentração mais alta do antibiótico, que aparecerá no futuro, mas ainda não apareceu. Em tal situação, bactérias potencialmente mais adaptadas dão lugar a seus parentes na frente, que são adaptados especificamente à concentração atual que existe no momento.Para testar essa teoria, os cientistas coletaram amostras de colônias bacterianas isoladas com mutações "prematuras" e as colocaram à força na frente da frente. Como esperado, eles sobreviveram em condições nas quais a frente bacteriana principal não pode sobreviver.
Tendo estudado bactérias na vanguarda e atrás da frente da população bacteriana, os cientistas descobriram várias coisas interessantes. Verificou-se que a evolução nem sempre é impulsionada por bactérias mais resistentes aos antibióticos. Curiosamente, às vezes as linhas hereditárias mais estáveis ficam presas atrás de bactérias mais sensíveis. Aparentemente, isso ocorre devido a mutações "prematuras", quando algumas bactérias estão prontas para sobreviver em uma concentração mais alta do antibiótico, que aparecerá no futuro, mas ainda não apareceu. Em tal situação, bactérias potencialmente mais adaptadas dão lugar a seus parentes na frente, que são adaptados especificamente à concentração atual que existe no momento.Para testar essa teoria, os cientistas coletaram amostras de colônias bacterianas isoladas com mutações "prematuras" e as colocaram à força na frente da frente. Como esperado, eles sobreviveram em condições nas quais a frente bacteriana principal não pode sobreviver. A armadilha espacial das mutações compensatórias são as bactérias que estão tão adiantadas no tempo que, mesmo após o início de condições adequadas, elas já estão trancadas atrás da frente. Ilustração: Harvard Medical SchoolOs cientistas estudaram cuidadosamente o genótipo das espécies mais mutantes de bactérias que conseguiram sobreviver em solução com uma concentração máxima de trimetoprim. Verificou-se que nessas espécies, o gene folA, que codifica diidrofolato redutase (DHFR) e é o alvo do trimetoprim, era mais frequentemente mutado. Quanto maior a resistência da bactria a um antibiótico, maior o número de mutações nesse gene. Além disso, foram encontradas mutações em vários outros genes que não estão relacionados à ação de um antibiótico específico. Entre eles estavam os operons mar e sox , responsáveis pela reação ao estresse. Já se sabia que esses genes de "estresse" desempenham um papel importante no sucesso da resistência aos antibióticos.Os cientistas também descobriram que uma melhor adaptação ao efeito fraco do antibiótico acelera subsequentemente a adaptação a concentrações mais altas (na ilustração abaixo). É como as pessoas que conseguem se adaptar melhor à deterioração das condições de vida, se as mudanças ocorrerem de forma gradual e imperceptível.
A armadilha espacial das mutações compensatórias são as bactérias que estão tão adiantadas no tempo que, mesmo após o início de condições adequadas, elas já estão trancadas atrás da frente. Ilustração: Harvard Medical SchoolOs cientistas estudaram cuidadosamente o genótipo das espécies mais mutantes de bactérias que conseguiram sobreviver em solução com uma concentração máxima de trimetoprim. Verificou-se que nessas espécies, o gene folA, que codifica diidrofolato redutase (DHFR) e é o alvo do trimetoprim, era mais frequentemente mutado. Quanto maior a resistência da bactria a um antibiótico, maior o número de mutações nesse gene. Além disso, foram encontradas mutações em vários outros genes que não estão relacionados à ação de um antibiótico específico. Entre eles estavam os operons mar e sox , responsáveis pela reação ao estresse. Já se sabia que esses genes de "estresse" desempenham um papel importante no sucesso da resistência aos antibióticos.Os cientistas também descobriram que uma melhor adaptação ao efeito fraco do antibiótico acelera subsequentemente a adaptação a concentrações mais altas (na ilustração abaixo). É como as pessoas que conseguem se adaptar melhor à deterioração das condições de vida, se as mudanças ocorrerem de forma gradual e imperceptível.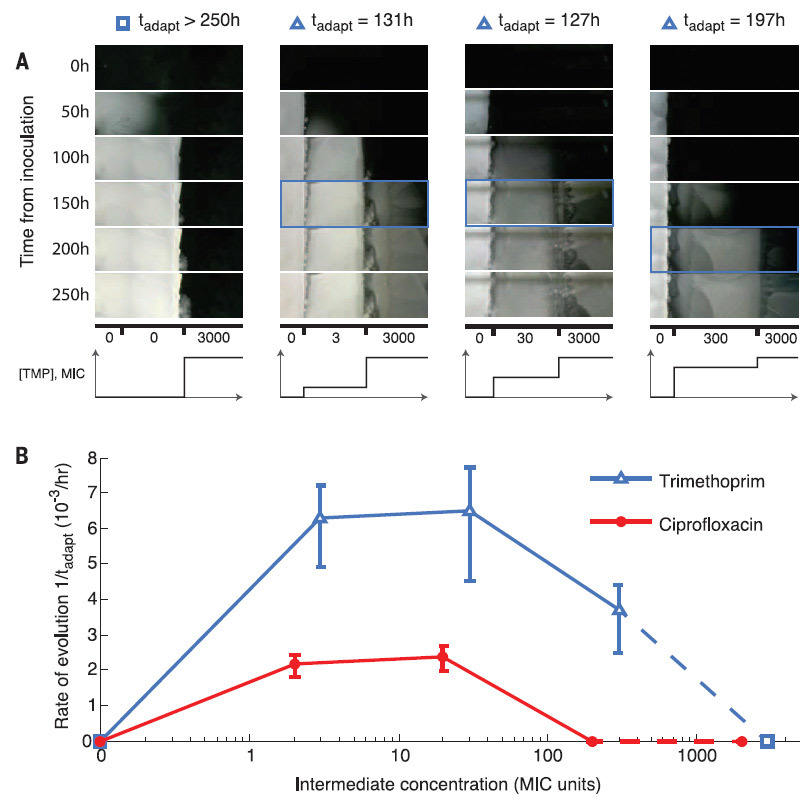 O experimento é descrito em um artigo científico publicado em 9 de setembro de 2016 na revista Science (doi: 10.1126 / science.aag0822).
O experimento é descrito em um artigo científico publicado em 9 de setembro de 2016 na revista Science (doi: 10.1126 / science.aag0822).Source: https://habr.com/ru/post/pt397303/
All Articles