O que causa as diferenças entre baterias e supercapacitores
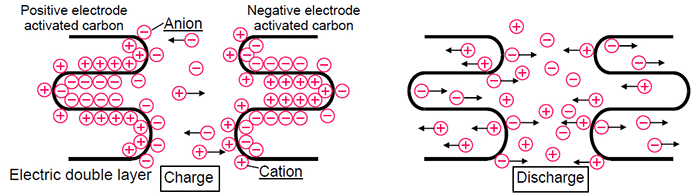
As fontes de energia eletroquímica são usadas em todos os lugares hoje em dia e têm características distintas: capacidade ou quantidade de energia armazenada, bem como energia, ou capacidade de transferir ou acumular rapidamente essa energia (descarga / carga em altas correntes). Além disso, segurança e longevidade são muito importantes para as baterias. Neste post, mostrarei como as baterias e supercapacitores diferem no nível químico e como isso afeta suas características técnicas.Eu vou começar com as baterias. Atualmente, as baterias de íon-lítio e hidreto de níquel-metal (NiMH) são mais comumente usadas, mas as baterias de íon-lítio estão substituindo gradualmente o NiMH por várias razões. Em primeiro lugar, as baterias de íon-lítio consomem mais energia. Isso se deve ao fato de que, em comparação aos eletrólitos alcalinos NiMH, que limitam a tensão da célula a 1,2 V, os eletrólitos das baterias à base de carbonato de íon lítio fornecem uma tensão de 3V. E isso significa menos células necessárias para atingir uma certa voltagem, além de tamanhos mais compactos, o que é simplesmente necessário para os modernos dispositivos eletrônicos portáteis. E, o mais importante, comparado ao NiMH, que usa ligas com metais de terras raras, as baterias de íon-lítio contêm materiais mais baratos.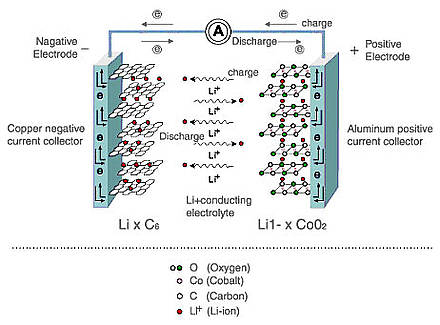
Manual de baterias de Linden, quarta edição
IEEE TRANSACTIONS ON POWER ELECTRONICS, vol. 24, N ° 2, 2009
J. Electrochem Soc., Vol. 145, N ° 10, 1998
BE Conway, Supercapacitores eletroquímicos: fundamentos científicos e aplicações tecnológicas, 1999
Source: https://habr.com/ru/post/pt397915/
All Articles