 Cristais líquidos na fase nemática
Cristais líquidos na fase nemáticaVocê provavelmente passou pela escola que uma substância pode estar em três
fases termodinâmicas : sólida, líquida e gasosa. (O termo "fase" é usado em conjunto com o termo "estado", e nenhum deles possui uma definição clara e universalmente aceita). Para os jovens estudantes, essa é uma simplificação útil, mas, na realidade, existem muito mais fases. Nos últimos cem anos, descobrimos a existência de centenas de diferentes fases sólidas - algumas delas são usadas para criar chips de silício no seu computador. Além disso, existem dezenas de fases de cristais líquidos - alguns deles criam imagens na tela. E nem tocamos em coisas verdadeiramente exóticas: fases quânticas, líquidos superfluídos, plasma de quarks e glúons, condensados de Bose-Einstein e assim por diante. "Fases topológicas".
Mas primeiro, de volta ao começo e discuta qual é a "fase". Como muitos conceitos fundamentais, é melhor explicado com um exemplo. Considere um copo de água no qual flutuam alguns cubos de gelo. Existe apenas uma substância em um copo: água. Muitas moléculas de H2O.
E embora as moléculas de gelo sejam idênticas às moléculas na água circundante, obviamente há uma grande diferença entre elas. O mais óbvio é que um deles é sólido, mantendo sua forma, enquanto o outro flui livremente e assume a forma de um vaso. Há também uma diferença de densidade, condutividade elétrica e várias outras propriedades. Portanto, dizemos que água líquida e gelo são fases diferentes da mesma substância. (A água é a única substância que uma pessoa encontra constantemente com três fases diferentes. Essa é uma das razões pelas quais a água é uma substância especial).
Como é que o gelo e a água exibem um comportamento completamente diferente? Você pode ficar tentado a dizer que tudo depende da temperatura: a água é quente, o gelo é frio e, por isso, as moléculas de água se comportam de maneira diferente. Mas a 0 ° C e a pressão atmosférica normal, o gelo e a água líquida são estáveis - ou seja, eles podem existir indefinidamente e não mudar.
Mas se a principal diferença não é a temperatura, então o que?
Grande e pequena escala
Os cientistas vêm discutindo há muito tempo a relação entre as propriedades macroscópicas de vários materiais e o arranjo microscópico das partículas das quais elas são feitas. Uma das primeiras tentativas foi feita em 1611 por Johannes Kepler no trabalho com o belo título: "Floco de neve hexagonal: presente de ano novo". Kepler argumentou que a simetria seis vezes maior dos flocos de neve pode ser explicada assumindo que o gelo é criado a partir de pequenas esferas empacotadas em conjuntos hexagonais.
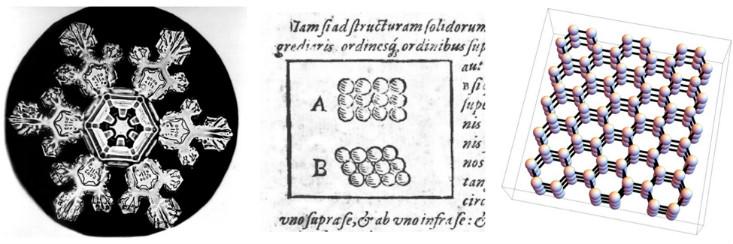
Agora sabemos que a suposição de Kepler sobre o arranjo especial de átomos estava levemente incorreta - seu esquema não reflete a forma tridimensional e a interação complexa das moléculas de água. (A seu favor, digamos que a química ainda não foi inventada e a existência de átomos finalmente foi comprovada quase 300 anos depois). No entanto, ele estava no caminho certo. A simetria de seis vezes dos flocos de neve vem do fato de que as moléculas de água se alinham em uma estrutura tridimensional com simetria de seis vezes (e também existem
cristais triangulares de neve e ninguém sabe exatamente por que).
Na linguagem da física moderna, Kepler sugeriu que a neve é um sólido cristalino, uma fase da matéria que obtém suas propriedades devido ao fato de seus átomos ou moléculas se alinharem em linhas periódicas, ou treliças de cristal. Os físicos usam a palavra "cristal" para descrever a estrutura microscópica, não importa se o material se parece com um diamante, um grão de areia ou um floco de neve. Portanto, para o físico, muitos metais e cerâmicas são cristais, porque seus átomos ou moléculas são arranjados em uma estrutura periódica - em uma certa versão tridimensional dos desenhos de Kepler de 1611.
Isso explica o gelo em um copo de água. E a água líquida? Em qualquer substância, a temperaturas acima de zero absoluto (-273 ° C), as moléculas constantemente se movem e ricocheteiam na palavra bolas de bilhar após um forte colapso. A temperatura de uma substância é uma medida da velocidade de movimento das moléculas.
Em um líquido, esse movimento térmico aleatório é forte o suficiente para superar as forças que retêm as moléculas na rede. E sem essa estrutura, as moléculas podem se mover muito mais livremente. Isso explica por que o líquido sucumbe quando você o empurra com o dedo, e o gelo não. É interessante notar que existem substâncias, em particular o vidro de janela, com uma microestrutura completamente aleatória, mas no nível macroscópico elas se comportam, no entanto, como sólidas. Compreender seu comportamento é a mais importante das questões em aberto da física dos materiais.
Fases fantásticas
Em materiais tridimensionais - como gelo real, e não como nos esboços de Kepler - tudo se torna mais complicado, porque em três dimensões existem muitas maneiras de organizar moléculas em estruturas periódicas. Por exemplo, existem aproximadamente 17 fases de gelo (aproximadamente porque esse número depende de como classificá-las), a mais recente das quais foi criada e estudada por cientistas italianos no ano passado. Diferentes fases ocorrem em diferentes temperaturas e pressões e, embora sejam todas sólidas, cada uma delas tem sua própria densidade, resistência, reação a campos elétricos e magnéticos, condutividade térmica, etc. Devido à existência dessas diferenças no comportamento macroscópico, as chamamos de fases diferentes. Sob condições "normais" - temperatura e pressão na superfície da Terra - o gelo geralmente está na forma de "gelo I
h ". Esta forma cristalina hexagonal estável é precisamente responsável pela simetria de seis vezes dos flocos de neve.
De acordo com os rótulos das várias fases do gelo, o gelo IX realmente existe. Felizmente, à temperatura e pressão na superfície da Terra, é muito mais frágil que os outros "gelo nove" - a fase estável, por causa da qual os oceanos foram catastroficamente endurecidos no romance de Kurt Vonnegut, "Cradle for the Cat".
E isso não é tudo, mesmo com uma substância tão familiar. Outras fases de gelo ainda não descobertas podem existir a pressões ultra altas nos centros de gigantes gasosos como Urano e Netuno. Em condições tão extremas, a uma pressão de 10 milhões de atm. e mais, a água deve formar fases sólidas cristalinas muito estranhas. Entre eles, há uma fase condutora de metal, que deve parecer brilhante se você descobrir como polir.
Opções intermediárias
A conexão entre microestrutura e macropropriedades é a principal idéia da ciência e da engenharia, utilizada no desenvolvimento de muitos materiais. Por exemplo, cristais líquidos são um componente essencial de laptops, televisões e telas de smartphones. As moléculas de cristal líquido têm uma estrutura incomumente longa que se assemelha a um bastão. Por esse motivo, eles podem estar em várias fases diferentes, com propriedades não encontradas em materiais convencionais.
Por exemplo, em altas temperaturas, as moléculas estão desorganizadas. Cada "bastão" está em um local aleatório, como moléculas em água líquida, e é orientado em uma direção arbitrária. Esta é uma fase isotrópica. Em temperaturas mais baixas, as moléculas podem entrar na fase nemática, na qual estão localizadas aleatoriamente, como na água líquida, mas direcionadas na mesma direção. Como nenhuma rede é formada, a fase nemática flui como um líquido, mas como as hastes são direcionadas em uma direção, ela tem uma ordem microscópica. Portanto, eles são chamados de "cristais líquidos".
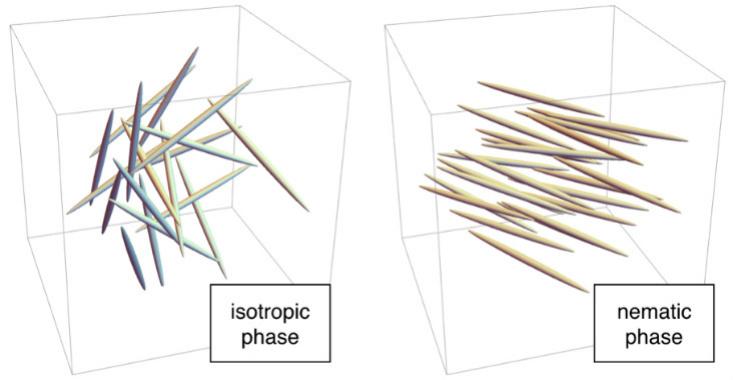
Felizmente para os humanos modernos, a fase nemática tem propriedades incomuns associadas à direção. Quando atingidas em um campo elétrico, as moléculas se alinham ao longo dele. Nas telas de LCD, as moléculas na fase nemática se comportam como um filtro polarizador: um dispositivo que transmite luz quando as moléculas são orientadas de maneira especial (por exemplo, de cima para baixo) e atrasa quando orientadas perpendicularmente. Como um filtro polarizador é necessário para esse trabalho, o filtro é colocado entre a fonte de luz e a tela nos telefones e telas. No LCD, pequenos eletrodos próximos a cada pixel criam um campo elétrico que controla a posição das moléculas dentro dele e, portanto, a emissão de luz. Esse esquema de trabalho é usado nos monitores IPS (“comutação no plano”). Existem outras opções, por exemplo, displays TN que usam uma fase nemática ainda mais exótica e distorcida.
Modelando uma miniatura
É claro que a microestrutura ajuda a explicar as propriedades dos materiais que encontramos e criamos. Mas podemos ver a ordem microscópica na vida real? Para substâncias comuns, como gelo, sal ou metal, isso é difícil porque átomos e moléculas são muito pequenos. Uma molécula de água tem menos de um bilionésimo de metro - ela não pode ser vista em um microscópio óptico convencional e é muito difícil de ver, mesmo usando técnicas microscópicas modernas.
Felizmente, não apenas átomos e moléculas são capazes de se organizar independentemente em fases. No laboratório de Chaikin no Centro de pesquisa de materiais macios da Universidade de Nova York, usamos pequenas esferas rígidas para estudar as fases da matéria. Eles são chamados colóides e podem ser feitos de vários materiais, como vidro, plástico ou metal. Os colóides no laboratório são 3.000 vezes maiores que as moléculas de água - eles são comparáveis em tamanho a bactérias ou núcleos de células animais. Para especialistas em materiais, os colóides são algo como “partículas ideais” - grandes o suficiente para serem visíveis ao microscópio e pequenas o suficiente para formar fases, como os materiais comuns.
 Esta foto mostra colóides plásticos revestidos com uma composição química, devido à qual eles se repelem, estando na superfície da água
Esta foto mostra colóides plásticos revestidos com uma composição química, devido à qual eles se repelem, estando na superfície da águaEm nosso laboratório, fabricamos colóides com um revestimento especial que lhes permite aderir à superfície da água. Quando grudam nas gotículas, podemos tirar belas microfotografias - como esta. Você pode ver a estrutura microscópica das várias fases nelas e como sua orientação leva ao aparecimento de propriedades macroscópicas como dureza. Por exemplo, agora estamos estudando como o comportamento de nossas partículas muda dependendo do uso de gotículas esféricas ou superfícies planas de água. A presença de partículas em uma esfera ajuda ou dificulta a formação de cristais e a aparência de sistemas como um sólido? Isso pode nos ajudar a entender as propriedades de estruturas importantes que têm uma forma esférica ou mais complexa. Se, por exemplo, soubermos mais sobre os revestimentos protéicos que protegem os genes do HIV, podemos aprender como decompô-los e derrotar o vírus.
Quando os cristais vão mal
Uma das etapas mais importantes do estudo da ordem microscópica é estudar as condições sob as quais a ordem é perturbada. Por exemplo, se você observar a imagem dos colóides na rede cristalina, notará que a ordem deles é heterogênea. Você pode ver imperfeições e irregularidades, defeitos.
 A imagem foi tirada com um microscópio confocal - uma tinta fluorescente é adicionada à amostra, que é iluminada por um laser
A imagem foi tirada com um microscópio confocal - uma tinta fluorescente é adicionada à amostra, que é iluminada por um laserDefeitos semelhantes ocorrem em cristais de átomos ou moléculas e desempenham um papel importante. Por exemplo, eles determinam a fragilidade de um material - que tipo de carga ele pode suportar antes de quebrar. Além disso, como os defeitos podem afetar a condutividade elétrica de um material, os fabricantes de semicondutores gastam bilhões de dólares na produção de cristais únicos de silício - blocos gigantes de silício quase sem defeitos. Por outro lado, às vezes essas falhas microscópicas são muito úteis. Pesquisas recentes se concentraram no gerenciamento e controle de defeitos no grafeno para otimizá-lo como um filtro para dessalinização.
Usamos cristais coloidais para observar como os defeitos aparecem, se movem e interagem entre si. Como os estudos de fase, o estudo de cristais coloidais pode nos ajudar a entender defeitos em outros materiais. Como em muitas áreas da vida, às vezes as imperfeições são a parte mais interessante.