
Quando uma certa temperatura é excedida, a célula se torna inutilizável e morre. Uma das explicações mais simples para essa intolerância ao calor é que as proteínas necessárias para a vida são aquelas que extraem energia dos alimentos ou da luz solar, se defendem de intrusões, destroem resíduos, etc. - geralmente têm uma forma surpreendentemente precisa. Começando como fios longos, eles são torcidos na forma de espirais, "grampos de cabelo" e outras formas ditadas pela sequência de seus componentes. E essas formas desempenham um papel enorme em suas atividades. Mas quando a temperatura começa a subir, os vínculos que mantêm as estruturas das proteínas são quebrados: primeiro os mais fracos e depois os mais fortes. É lógico que a perda de espalhamento da estrutura da proteína seja letal, mas até recentemente, os detalhes de como exatamente isso mata as células superaquecidas não eram claros.
Agora, biofísicos da Escola Técnica Suíça de Zurique estudaram o comportamento de cada proteína nas células de quatro organismos diferentes com o aumento da temperatura. Este estudo e a rica coleção de dados coletados
na revista Science mostraram que, a uma temperatura suficiente para a morte de uma célula - humana, ou células de Escherichia coli E. coli - apenas algumas proteínas importantes são destruídas. Além disso, a abundância de proteínas nas células foi inesperadamente associada à sua estabilidade. Estudos permitiram que os cientistas se familiarizassem rapidamente com as regras fundamentais pelas quais o trabalho das proteínas e sua ordenação são construídas, e cujas conseqüências, como ficou claro, se estendem muito além da simples morte pelo calor.
Paola Piccotti , a biofísica que dirigiu o trabalho, explicou que os experimentos foram conduzidos por perguntas antigas e não resolvidas: por que algumas células sobrevivem a altas temperaturas, enquanto outras morrem? A bactéria Thermus thermophilus vive feliz em fontes termais e em aquecedores domésticos [a uma temperatura ideal de 65 ° C - aprox. trans.], enquanto as células de E. coli definham a temperaturas acima de 40 ° C. Evidências convincentes sugerem que o ponto aqui é a diferente estabilidade das proteínas desses organismos. Mas acompanhar a proteína em uma célula viva, o que seria um método ideal de estudo, é muito inconveniente. O isolamento da proteína em um tubo de ensaio não fornece todas as respostas, porque, no interior do corpo, as proteínas ficam presas e afetam a química umas das outras, ou se apoiam na forma necessária. Para entender o que exatamente e por que está desmoronando, é necessário observar as proteínas no momento em que elas ainda estão se afetando.
Como o calor destrói proteínas
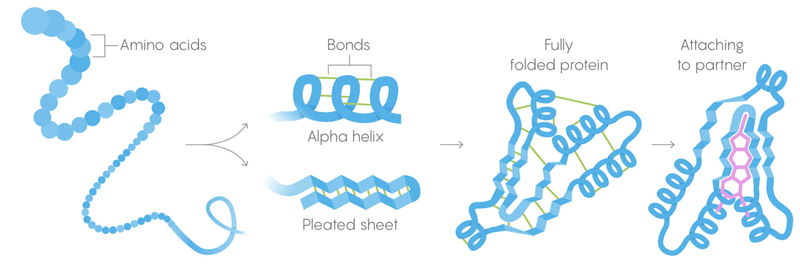 1) A estrutura primária das proteínas são longas cadeias de aminoácidos, combinadas em sequências dadas pelos genes.
1) A estrutura primária das proteínas são longas cadeias de aminoácidos, combinadas em sequências dadas pelos genes.
2) A estrutura secundária é um aminoácido que também se dobra em configurações mantidas por ligações intermoleculares fracas.
3) Estrutura terciária - ligações fracas estabilizando a localização de seções retas e torcidas da estrutura tridimensional da proteína. Sua localização permite que a proteína se ligue às moléculas desejadas.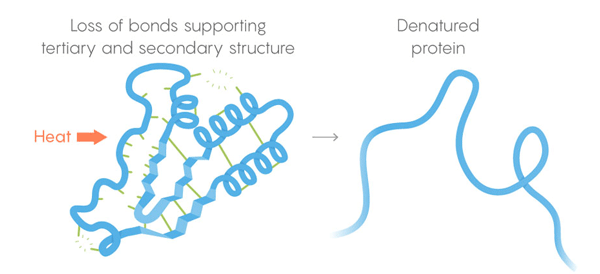 Morte térmica. Os laços fracos perdem sua capacidade de reter estruturas terciárias e secundárias, e as desnaturações das proteínas, isto é, se desdobram. Mas nem todas as proteínas se desenvolvem na mesma temperatura - o ambiente da proteína na célula pode proporcionar estabilização adicional.
Morte térmica. Os laços fracos perdem sua capacidade de reter estruturas terciárias e secundárias, e as desnaturações das proteínas, isto é, se desdobram. Mas nem todas as proteínas se desenvolvem na mesma temperatura - o ambiente da proteína na célula pode proporcionar estabilização adicional.Para resolver a tarefa, a equipe desenvolveu um procedimento de monitoramento automatizado. Eles cortam as células e aquecem seu conteúdo em etapas, liberando em cada etapa as enzimas que separam as proteínas. Essas enzimas são especialmente boas no corte de proteínas desdobradas, de modo que pesquisadores baseados nos remanescentes das proteínas cortadas poderiam julgar quais proteínas se separaram a uma determinada temperatura. Assim, eles foram capazes de construir curvas de desnaturação para cada uma das milhares de proteínas estudadas. Os arcos das curvas vão da estrutura intocada da proteína a uma temperatura confortável para um estado totalmente desenvolvido a alta temperatura. Para procurar diferenças entre as curvas de diferentes espécies de seres vivos, foram realizadas experiências nas células humanas, E. coli, T. thermophilus e levedura. "O estudo foi lindo", disse
Alan Drummond , biólogo da Universidade de Chicago, referindo-se à escala e à precisão do processo.
Durante as observações, foi visto claramente que as proteínas de todos os seres vivos não se desenrolam de uma só vez com o aumento da temperatura. "Vimos que apenas um pequeno subconjunto de proteínas entrou em colapso nos estágios iniciais", disse Piccotti, "e essas eram proteínas-chave". Em um diagrama com entrelaçamento de ligações proteína-proteína, as proteínas mais frágeis desse pequeno subconjunto geralmente tinham um grande número de ligações, o que significa que elas afetam muitos processos que ocorrem nas células. "Sem essas proteínas, as células não podem funcionar", disse Piccotti. "Quando eles desaparecem, toda a rede é destruída." E com isso, obviamente, a vida da célula pára.
Esse paradoxo - as proteínas mais importantes acabam sendo as mais frágeis - pode ser um reflexo de como a evolução as criou para executar as tarefas correspondentes. Se uma proteína tem muitos papéis, sua instabilidade e sua tendência a se expandir e colapsar podem ser uma vantagem, pois pode permitir que assuma formas diferentes, adequadas para tarefas diferentes. "Muitas dessas proteínas-chave têm grande flexibilidade, o que as torna menos estáveis", mas ao mesmo tempo lhes confere a capacidade de se ligar a várias moléculas-alvo na célula, explicou Piccotti. “Provavelmente, é assim que eles lidam com suas funções. Isso é um compromisso. ”
Depois de estudar cuidadosamente a E. coli, para a qual os dados coletados eram da mais alta qualidade, os pesquisadores descobriram uma relação entre a abundância de proteínas - o número de cópias na célula - e sua estabilidade. Quanto mais cópias uma proteína produz de uma célula, mais temperatura é necessária para destruí-la. Acontece que um grande número de cópias não se correlaciona com a criticidade da proteína para a sobrevivência. Algumas proteínas-chave são muito raras. Essa conexão entre abundância e confiabilidade confirma a idéia apresentada por Drummond há dez anos - o sistema celular que produz proteínas tem a tendência de cometer erros de tempos em tempos. Erro geralmente desestabiliza a proteína. Se essa proteína for considerada abundante e aparecer na célula cem ou mil vezes por dia, cópias dobradas incorretamente produzidas em grandes quantidades podem entupir a célula. Assim, seria benéfico para o corpo evoluir para que as proteínas mais abundantes também sejam as mais estáveis, o que é confirmado pelos dados obtidos pela equipe de Piccotti.
Para entender quais qualidades de uma proteína a tornam estável, os pesquisadores compararam dados de E. coli e T. Thermophilus. As proteínas de E. coli começaram a desmoronar a 40 ° C e quase completamente degradadas a 70 ° C. Mas a essa temperatura, as proteínas do T. thermophilus estavam começando a sentir desconforto - algumas delas mantiveram a forma mesmo a 90 ° C. A equipe descobriu que o T. thermophilus geralmente possuía proteínas mais curtas, e alguns tipos de formas e componentes de proteínas eram mais comuns nos mais estáveis.
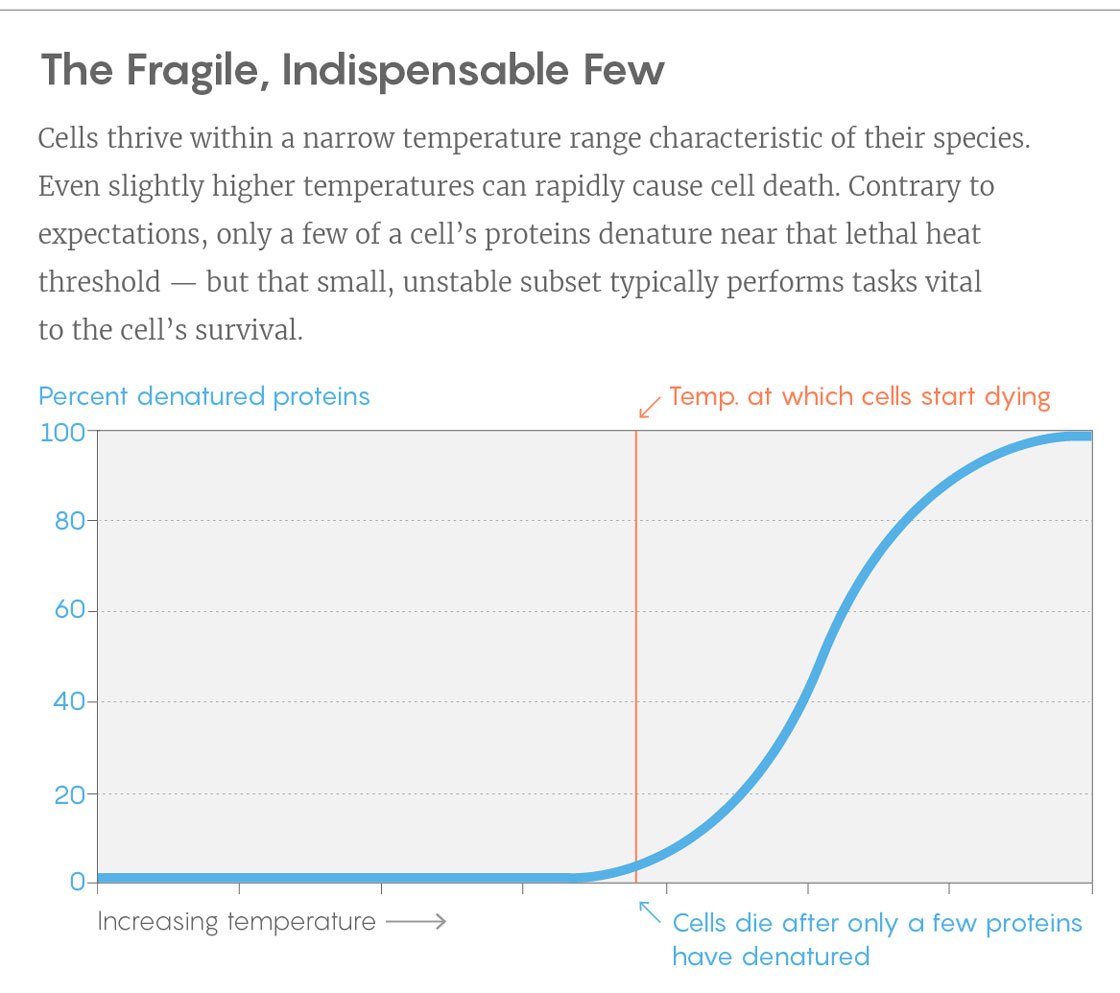 Um exemplo de curva de um experimento. Vertical - porcentagem de proteínas desdobradas, horizontal - temperatura. A barra vertical é a temperatura na qual as células começam a morrer. Para fazer isso, vire apenas algumas proteínas-chave.
Um exemplo de curva de um experimento. Vertical - porcentagem de proteínas desdobradas, horizontal - temperatura. A barra vertical é a temperatura na qual as células começam a morrer. Para fazer isso, vire apenas algumas proteínas-chave.As descobertas podem ajudar os pesquisadores a desenvolver proteínas cuja estabilidade é adaptada às suas necessidades. Em muitos processos industriais em que as bactérias são usadas, aumentar a temperatura aumenta o retorno - mas logo as bactérias começam a morrer devido ao calor. Seria interessante saber se podemos estabilizar bactérias, tornando as principais proteínas mais resistentes à temperatura, disse Piccotti.
A abundância de informações sobre a facilidade com que certas proteínas se desenvolvem agradou muito alguns biólogos. A probabilidade de sua agregação depende diretamente da estabilidade da proteína: o aparecimento de pedaços de proteínas não desenvolvidas aderindo uma à outra. Os agregados de proteínas podem se transformar em um pesadelo para as células e interferir na implementação das principais tarefas. Por exemplo, eles são acusados de causar alguns problemas neurológicos sérios, como a doença de Alzheimer, na qual placas de proteínas desdobradas obstruem o cérebro.
 Paola Piccotti
Paola PiccottiMas isso não significa que a agregação ocorra apenas em organismos que sofrem de certas doenças. Pelo contrário, os pesquisadores perceberam que é possível que isso aconteça o tempo todo e que células saudáveis tenham métodos pelos quais eles lidam com isso. "Acho que esse fenômeno está se tornando cada vez mais comum", disse Michele Vendruscolo, bioquímico da Universidade de Cambridge. “A maioria das proteínas não se dobra adequadamente e se agrega nas células. A coisa mais importante que a equipe de Piccotti estabeleceu é o período de tempo em que qualquer proteína selecionada está no estado expandido. Esse tempo determina o grau de possível agregação de proteínas. ” Algumas proteínas quase nunca se voltam e não se agregam, outras se comportam em determinadas condições, enquanto outras o fazem o tempo todo. Segundo o bioquímico, uma descrição detalhada das proteínas no novo trabalho facilitará muito o estudo e a compreensão dessas diferenças entre as proteínas. Algumas das curvas de desnaturação indicam que suas proteínas se agregam após serem desdobradas. "Eles conseguiram rastrear os dois estágios - implantação e agregação subsequente", disse Vendruscolo. "Essa é a beleza deste estudo."
E embora muitos cientistas estejam interessados em agregados por causa dos danos que causam, alguns encaram esse fenômeno de um ponto de vista diferente. Drummond diz que está ficando claro que alguns agregados não são apenas pedaços de lixo pendurados em uma gaiola. Eles contêm proteínas ativas que continuam a desempenhar suas funções.
Imagine de longe você vê fumaça subindo de um prédio, diz Drummond. Ao redor do prédio, você vê algumas figuras e imagina que são corpos extraídos das ruínas. Mas se você se aproximar, poderá descobrir que são pessoas vivas que escaparam de um prédio em chamas, aguardando o término do incidente. É o caso do estudo dos agregados, diz Drummond: os pesquisadores descobrem que as proteínas presentes nos agregados não são vítimas, mas sobreviventes. "Agora, um novo campo da ciência está crescendo em um ritmo explosivo", diz ele.
O aglomerado de proteínas pode não ser um sinal de dano, mas uma maneira de a proteína manter suas funções em uma situação difícil. Pode, por exemplo, protegê-los do meio ambiente. E quando as condições melhoram, as proteínas podem deixar os agregados e dobrar novamente. "A forma deles muda com a temperatura de tal maneira que, à primeira vista, parece ser uma dobra inadequada", diz Drummond. "Mas isso faz algum outro sentido." Em um
artigo na revista Cell de 2015, ele e seus colegas identificaram 177 proteínas de levedura que mantiveram suas funções após a inserção nos agregados. Em um
artigo publicado em março, essa equipe descreveu que, se uma das proteínas fosse alterada para não se agregar, isso levaria a sérios problemas no funcionamento da célula.
Em geral, o trabalho afirma que as proteínas são estruturas surpreendentemente dinâmicas. A princípio, podem parecer máquinas rígidas trabalhando em tarefas fixas para as quais uma forma específica é adequada. Mas, de fato, as proteínas podem assumir várias formas diferentes durante o seu funcionamento normal. E no momento certo, sua forma pode mudar tanto que parece que eles estão se deteriorando, embora na verdade eles estejam se fortalecendo pelo contrário. No nível molecular, a vida pode ser conexões permanentes e desconexões de ligações.