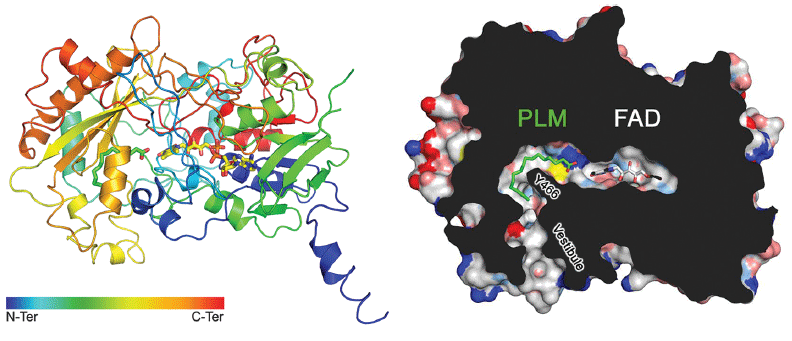
 Características estruturais de uma fotoenzima chamada fotodecarboxilase de ácidos graxos (FAP) com um elemento fotossensível do FAD
Características estruturais de uma fotoenzima chamada fotodecarboxilase de ácidos graxos (FAP) com um elemento fotossensível do FADA luz está envolvida em muitos processos biológicos que ocorrem em organismos vivos, independentemente da presença de fotossíntese. São processos como crescimento, desenvolvimento, metabolismo e biorritmos diários. Na maioria dos casos, a luz afeta a fisiologia celular através de "intermediários" - proteínas fotoativas, incluindo canais de íons fotossensíveis, fotorreceptores, complexos de captação de luz e enzimas dependentes de luz. O último pode ser dividido em dois tipos: 1) enzimas com fotoativação, que precisam apenas de uma pequena rajada de luz para entrar em estado ativo; 2) fotoenzimas que requerem um fluxo constante de fótons para manter a função catalítica. De fato, estes últimos operam em fótons como combustível.
As fotoenzimas são um tipo raro de catalisador. Na natureza, existem apenas duas famílias de proteínas desse tipo: DNA fotolase, que em muitos organismos repara o campo de danos no DNA pela luz ultravioleta e protoclorofilida.
As fotoenzimas são ferramentas muito úteis em biotecnologia. Eles são usados para observar processos enzimáticos rápidos em tempo real, como um elo auxiliar no design de outras enzimas e na
optogenética , quando conexões neurais específicas no cérebro são suprimidas ou ativadas por um comando de luz.
Ao mesmo tempo, os cientistas são conhecidos por microalgas, como
Chlorella variabilis NC64A ou
Chlamydomonas reinhardtii 137C, que convertem longas cadeias de ácidos graxos em alcanos (hidrocarbonetos saturados) ou hidrocarbonetos insaturados, e esse processo depende da presença de luz.
Um grupo de cientistas do Instituto de Biociência e Biotecnologia da Universidade de Aix-Marselha (França) conseguiu isolar uma fotoenzima específica que sintetiza alcanos na microalga verde
Chlorella variabilis .
A importância da descoberta dificilmente pode ser superestimada porque nenhum outro fator é necessário para a síntese de alcanos na coenzima, exceto a gordura e a luz solar. Essa enzima pode ser introduzida em outros organismos vivos, incluindo bactérias, e usada na indústria.
Um estudo da fotosensibilidade da enzima mostrou que ela é mais sensível à luz com um comprimento de onda de 450-500 nm (luz azul), com um máximo de 467 nm.
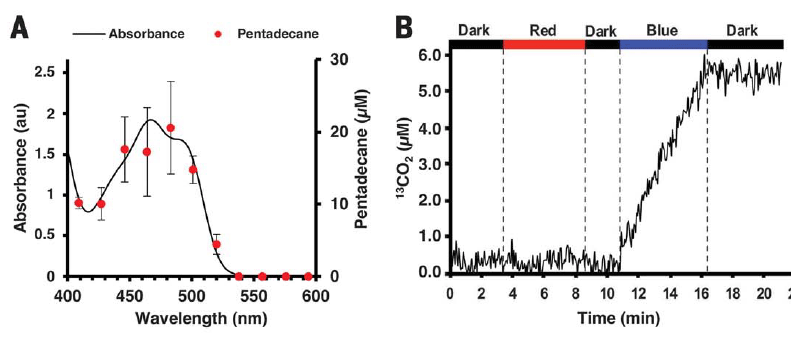
A atividade enzimática aumenta em proporção direta à exposição à luz. O gráfico no canto inferior esquerdo mostra a dependência da iluminação com luz branca e o canto inferior direito mostra a dependência da quantidade de hidrocarbonetos nas células de
C. reinhardtii cultivadas em um biorreator sob a influência da luz azul e vermelha.

Os autores do trabalho científico deram à nova enzima o nome de FAP - fotodecarboxilase de ácidos graxos, ou seja, fotodecarboxilase de ácidos graxos. A descarboxilação é o processo de clivagem do grupo carboxila dos aminoácidos na forma de CO
2 , portanto essa enzima é uma verdadeira descarboxilase.
O lugar da FAP em evolução é mostrado em uma árvore filogenética.
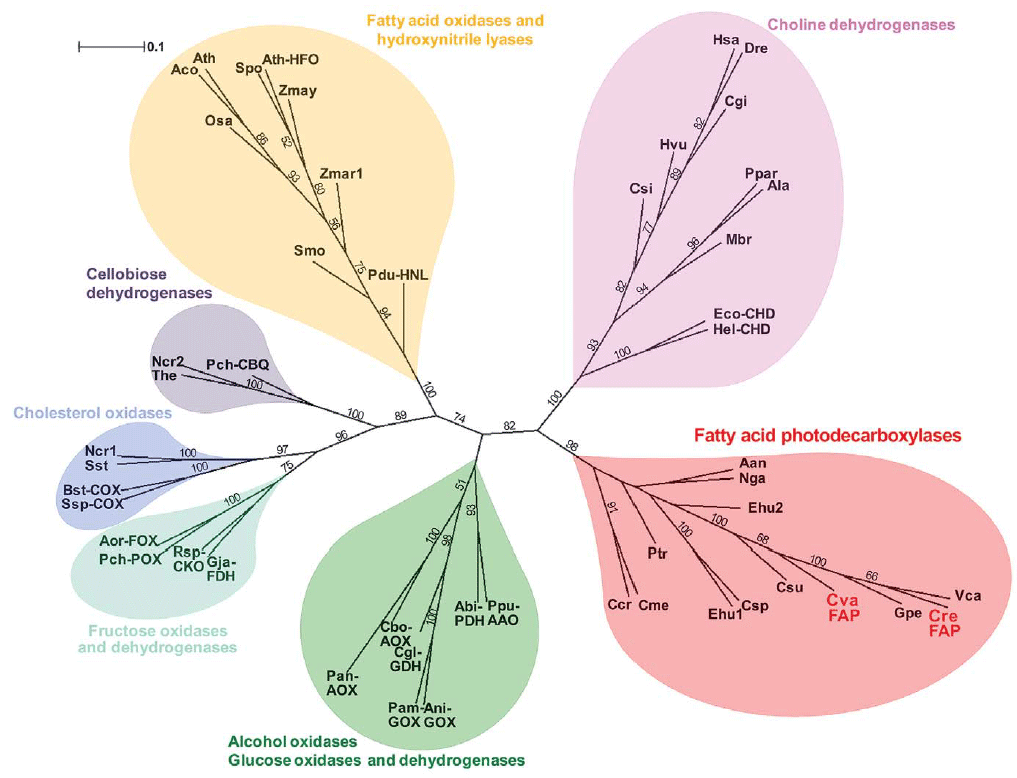
Assim, foi descoberta outra enzima que forma hidrocarbonetos no decorrer de sua vida. Até agora, um número de enzimas com essa funcionalidade era conhecido: oxidoredutases e policetídeos em cianobactérias, proteínas do tipo dessaturase CER1 e CER3 em plantas, citocromo P450s na bactéria
Jeotgalicoccus sp. ATTC8456 e em insetos, bem como oxidoredutases diabéticas na bactéria
Pseudomonas aeruginosa . Novas fotoenzimas se juntam a eles. Enzimas deste tipo podem ser bastante raras, porque a evolução não incentiva reações químicas dependentes da luz.
Os cientistas enfatizam que, a partir da variedade de enzimas que formam hidrocarbonetos, fica claro que a luz não é necessária para essa reação. Portanto, resta apenas supor por que o FAP funciona precisamente em fótons. Talvez isso se deva à função intracelular das enzimas. Provavelmente, essa função apareceu após endossimbiose primária, permaneceu após endossimbiose secundária, mas foi perdida nas plantas. Sua conservação em algas indica uma certa função específica inerente exatamente a esses organismos.
A descoberta de uma nova coenzima mostra que, nos organismos vivos, a catálise sob a influência da luz não se limita apenas aos processos de absorção da luz e reparo do DNA. Os fótons também são adequados para a produção de hidrocarbonetos.
Além disso, os autores sugerem que a coenzima pode ser ligeiramente modificada para realizar outras reações químicas - este é um grande campo de atividade para os biohackers.
O artigo científico foi
publicado em 1 de setembro de 2017 na revista
Science (doi: 10.1126 / science.aan6349,
pdf ).