Com esta revisão, estamos iniciando uma série de artigos que descrevem potenciais biomarcadores para o painel de diagnóstico de envelhecimento do SENS.
O conceito de SENS (Estratégias para senescência negligenciável projetada, uma estratégia para alcançar um envelhecimento desprezível por métodos de engenharia) foi proposto pelo gerontologista britânico Aubrey di Gray. A idéia do conceito é a necessidade de desenvolver e aplicar tecnologias para combater o envelhecimento e doenças relacionadas à idade, a fim de "reparar" os danos acumulados no corpo. O objetivo de nossa análise de possíveis biomarcadores é criar um painel de diagnóstico SENS para o envelhecimento.
Por que preciso do diagnóstico SENS?
- Permitir que uma pessoa avalie objetivamente o que acontece com seu corpo durante o envelhecimento, do ponto de vista do SENS.
- Veja os riscos individuais de certos tipos de danos associados ao envelhecimento.
- Avaliar a eficácia dos métodos desenvolvidos de rejuvenescimento. Veja como a atividade física, dieta, rotina diária, suplementos nutricionais e medicamentos funcionam em termos de uma estratégia para retardar o envelhecimento.
- Compare com outros painéis de diagnóstico de envelhecimento e complemente o seu desenvolvimento.
- Forneça dados sobre alterações de parâmetros para pesquisa.
- Tomar uma decisão sobre o financiamento de pesquisas com base nos riscos mais interessantes e sensíveis.
- Encontre pessoas com idéias semelhantes para resolver problemas biológicos que surgiram como resultado da compreensão de seu próprio estado do corpo em termos de SENS.
O conceito SENS inclui 7 seções. O primeiro item a ser considerado foi a disfunção mitocondrial (ou MitoSENS).
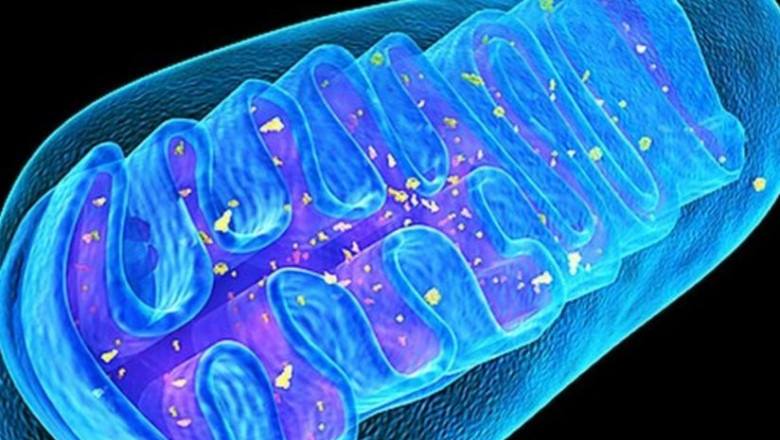
As mitocôndrias são minúsculas organelas de organismos eucarióticos (com exceção da lamblia que habita o intestino das chinchilas), que geram energia para todos os processos bioquímicos. De acordo com a versão mais popular, as mitocôndrias já foram unidades de vida independentes, bactérias fotossintéticas roxas, mas no processo de evolução foram absorvidas por microorganismos antigos, arquéias, e começaram a gerar energia para elas. Cada célula pode conter mais de mil mitocôndrias, por exemplo, as células do músculo cardíaco têm até 5000 mitocôndrias. Motores moleculares, ATP sintase, incorporados na membrana interna das mitocôndrias, giram e sintetizam a principal fonte de energia, o ácido adenosina trifosfórico, ATP, sob a influência de um fluxo de prótons. Estima-se que o corpo adulto sintetize e consuma cerca de 40 kg de ATP por dia.
As mitocôndrias, ao contrário de outras organelas, têm suas próprias 2-10 cópias do DNA, mtDNA. No processo de produção de energia, as mitocôndrias geram “resíduos” tóxicos - espécies reativas de oxigênio (ERO), que podem danificar outras moléculas e várias estruturas celulares e, acima de tudo, as próprias mitocôndrias, que podem causar mutações no DNA mitocondrial e afetar adversamente o ambiente geral. balanço energético do corpo. Assim, os mtDNAs com deleções (perda de locais) são capazes de se multiplicar rapidamente e preencher o espaço celular consigo mesmos, causando sarcopenia e neurodegeneração. As mitocôndrias “corrompidas” começam a produzir quantidades ainda maiores de EROs, levando a um aumento do estresse oxidativo, que, por sua vez, pode causar o desenvolvimento de várias patologias, envelhecimento prematuro e morte celular.
Um fato interessante relacionado ao estresse oxidativo. Verificou-se que existe uma clara correlação entre o nível de saturação de ácidos graxos nas membranas e a vida útil dos animais: quanto mais ácidos insaturados na membrana, menor a vida útil do animal. Os biólogos espanhóis traçaram essa sequência, mostrando um aumento no tempo de vida e reduzindo o conteúdo de ácido graxo docosahexaenóico ω-3 nas membranas: rato → rato → coelho → humano → baleia [1].
Esse padrão é fácil de explicar, porque os ácidos graxos insaturados são as principais "vítimas" da peroxidação lipídica. Assim, a composição lipídica das membranas celulares dos animais, caracterizada por uma vida útil mais longa, demonstra a média de ouro: uma pequena quantidade de ácidos graxos docosahexaenóicos 22: 6 ω-3 completamente insaturados e a predominância de ácidos graxos linolênicos menos insaturados 18:03 ω-3, que cria o mesmo equilíbrio que fornece proteção contra os efeitos do ROS e a preservação da fluidez necessária da membrana.
Além da composição lipídica das membranas celulares dos animais, a proporção de guanina e citosina termodinamicamente estáveis entre todos os resíduos de nucleotídeos do mtDNA também se correlaciona com a vida útil máxima das espécies de mamíferos [2].
Os criadores do conceito SENS veem uma solução para o problema da disfunção mitocondrial transferindo “cópias de backup” dos genes mitocondriais para o núcleo, onde não podem ser danificados pelos ROS gerados nas mitocôndrias. Assim, mesmo que os genes originais do mtDNA sejam danificados, os backups no DNA nuclear poderão fornecer as proteínas necessárias para manter a produção de energia normal. Essa abordagem é chamada expressão alotópica de proteínas. O mtDNA humano contém um total de 37 genes, dos quais apenas 13 codificam proteínas necessárias para as mitocôndrias, as restantes (mais de 1000) proteínas que coordenam o trabalho das mitocôndrias são codificadas no DNA nuclear. Segundo os autores do SENS, a transferência dos principais genes mitocondriais para o núcleo foi realizada pela evolução precisamente para esse fim - para protegê-los do efeito prejudicial da ERO.
A ideia dos autores do SENS sobre a transferência evolutiva do DNA mitocondrial para o nuclear, a fim de proteger o mtDNA de fatores nocivos e, assim, prolongar a vida, é confirmada em estudos dedicados à análise do NUMT (segmento de DNA mitocondrial nuclear). O termo NUMT refere-se a fragmentos de mtDNA transferidos para o DNA nuclear. Uma análise comparativa de 17 espécies de animais com genomas mitocondriais e nucleares completamente seqüenciados mostrou uma correlação positiva significativa entre a expectativa de vida e o número de seqüências NUMT [3]. Agora resta encontrar uma solução de engenharia para transferir backups dos 13 genes restantes do mtDNA.
Mas existem abordagens alternativas para melhorar a função mitocondrial. E um deles é o transplante de mitocôndrias do lado de fora. É descrita a bem-sucedida “subpopulação” de mitocôndrias estrangeiras em experimentos com animais. Assim, a transferência mitocondrial foi usada em modelos animais para lesão pulmonar aguda, doença cardiovascular e doença de Parkinson. O implante mitocondrial pode ser realizado de várias maneiras: primeiro, a injeção direta de mitocôndrias isoladas (injeção local), quando mitocôndrias isoladas são injetadas diretamente nas células da área danificada; segundo, a administração sistêmica, quando as mitocôndrias são introduzidas na corrente sanguínea geral e depois são distribuídas por todo o corpo. Os resultados obtidos indicam as perspectivas de transplante mitocondrial no tratamento de várias doenças [4].
Junto com isso, seria lógico encontrar biomarcadores em potencial para determinar o estresse oxidativo causado pela disfunção mitocondrial.
O estresse oxidativo é um desequilíbrio entre oxidantes (espécies reativas de oxigênio) e a defesa antioxidante do organismo em relação aos agentes oxidantes. Nas células, os oxidantes interagem ativamente com as biomoléculas (fosfolipídios, proteínas e ácidos nucléicos). Como resultado, essas biomoléculas são irreversivelmente danificadas, o que leva à disfunção celular e, como resultado, várias patologias no corpo e na morte celular. Uma das teorias mais populares do envelhecimento, o radical livre proposto por D. Harman na década de 1950, vê isso como o principal mecanismo do envelhecimento.
Moléculas formadas durante a oxidação podem servir como biomarcadores. Sua análise é usada para quantificar o estresse oxidativo em humanos. Altas concentrações de biomarcadores de estresse oxidativo são determinadas não apenas em doenças relacionadas à idade ou degenerativas, como doença de Alzheimer, hipertensão, diabetes tipo 2 ou vários tipos de câncer, mas também em doença pulmonar obstrutiva crônica, tabagismo e vida em áreas ecologicamente desfavorecidas.
Um dos biomarcadores mais significativos do estresse oxidativo é a 8-iso prostaglandina F2α (8-isoprostano). O 8-isoprostano é formado durante a oxidação não enzimática de fosfolipídios das biomembranas celulares, ou seja, ácido araquidônico. Essa substância semelhante à prostaglandina causa estreitamento dos vasos sanguíneos e brônquios, reduz o fluxo sanguíneo nos rins, afeta a agregação plaquetária e, portanto, está envolvida na patologia de várias doenças. Os valores normais de 8-isoprostano em pessoas saudáveis são considerados 11 ± 4 pg / ml [5].
Também reconhecido como um biomarcador de oxidação lipídica é o malondialdeído (MDA), formado pela peroxidação lipídica por radicais livres e pela quebra de moléculas de ácidos graxos poliinsaturados. Um aumento da concentração de MDA no soro serve como um marcador não apenas do estresse oxidativo, mas também do grau de intoxicação endógena. Portanto, é observado um aumento na concentração de MDA no plasma em fumantes, bem como em pessoas que abusam de álcool. O MDA forma bases Schiff com grupos amino da proteína, resultando na formação de complexos lipídico-protéicos insolúveis (usar pigmentos ou lipofuscina). O MDA é determinado em amostras de muitos fluidos biológicos: soro, plasma, urina, condensado do ar expirado. A concentração de MDA no soro em pessoas saudáveis (normal) é inferior a 1 μmol / L [6].
Durante a oxidação dos aminoácidos que compõem as proteínas, são formados vários biomarcadores potenciais de estresse oxidativo: o-tirosina, 3-clorotirosina e 3-nitrotirosina.
Fisiologicamente no corpo, a tirosina endógena é formada pela oxidação enzimática da fenilalanina pela fenilalanina hidroxilase. o-tirosina (o-Tyr) e m-tirosina (m-Tyr) são formadas durante a oxidação pelas formas ativas da fenilalanina de oxigênio. o-Tyr e m-Tyr não são aminoácidos naturais e são considerados biomarcadores do estresse oxidativo. Foram encontradas altas concentrações de o-Tyr e m-Tyr em pacientes com catarata, e o-Tyr elevado foi encontrado no plasma sanguíneo e na urina de pacientes com diabetes tipo 2. A 3-clorotirosina (3-ClTyr) é formada nos processos de radicais livres durante a reação do ácido hipocloroso (HClO, um derivado do peróxido de hidrogênio) e da p-tirosina.
A formação de 3-ClTyr desempenha um papel importante no sistema cardiovascular, pois está associada ao desenvolvimento da aterosclerose. O 3-ClTyr promove a migração das células do músculo liso da aorta humana (o principal mecanismo para a formação de lesões vasculares), e níveis elevados de 3-ClTyr em condições de inflamação podem contribuir para doenças vasculares. A 3-nitrotirosina (3-Notyr) é formada durante o estresse oxidativo pela nitração da tirosina com uma proteína fagocítica mieloperoxidase (MPO) agressiva. Essa nitração afeta negativamente a função da proteína. Foram encontradas concentrações mais elevadas de 3-Notyr no líquido cefalorraquidiano de pacientes com doença de Alzheimer (11,4 ± 5,4 nM em pacientes e 1,6 ± 0,4 nM no grupo de voluntários saudáveis), bem como em pessoas com artrite, aterosclerose e hipertensão [5].
Além disso, sob a ação de ROS e HClO em proteínas, vários produtos de oxidação de proteínas (AOPP) são formados. Tais proteínas não cumprem suas funções e podem causar danos significativos. AOPPs são produzidos pelo sistema de mieloperoxidase-peróxido de hidrogênio. Maiores concentrações de AOPP foram encontradas no plasma ou na urina de pacientes com síndrome coronariana aguda ou colite ulcerativa ativa. Níveis plasmáticos de 60-70 nM são considerados indicadores normais de AORP em pessoas saudáveis [5].
Os biomarcadores bem conhecidos para a oxidação de ácidos nucléicos são a 8-hidroxiguanosina (8-OHG) e a 8-hidroxi-2'-desoxiguanosina (8-OHdG). 8-OHdG é o principal produto da oxidação do DNA. 8-OHG é formado pela oxidação do RNA. Uma concentração mais alta de 8-OHdG é encontrada em pacientes com doença de Alzheimer, artrite, aterosclerose, catarata, hipertensão, osteoporose e diabetes tipo 2. O 8-OHdG também é considerado um potencial biomarcador de câncer relacionado ao tabagismo (por exemplo, câncer de pulmão). O 8-OHG pode ser encontrado em pacientes com doença de Alzheimer e foi demonstrado que o dano oxidativo ao RNA é maior que o dano ao DNA. As concentrações de 8-OHdG no sangue em pessoas saudáveis são 1,09 ± 0,52 nM, e os níveis de 8-OHG (no líquido cefalorraquidiano) são de 97 ± 32 pM [5].
Outro biomarcador que determina a disfunção mitocondrial e o estresse oxidativo é o número de cópias do mtDNA celular (também existe mtDNA extracelular que entra na corrente sanguínea quando as células se deterioram e seu nível aumenta com a idade). Assim, sabe-se que, com a idade, a quantidade de mtDNA celular diminui, além disso, nos homens mais do que nas mulheres. Uma contagem mais baixa de mtDNA também está significativamente associada ao desenvolvimento de astenia senil (senilidade, fragilidade). O número de cópias do mtDNA também pode ser um marcador prognóstico eficaz da mortalidade por todas as causas, de doenças cardiovasculares, oncológicas e respiratórias [7].
Antioxidantes endógenos, como glutationa, cisteína, ácido úrico e ubiquinol, também têm o potencial de usar a disfunção mitocondrial e o estresse oxidativo como biomarcadores. Ao interagir com espécies reativas de oxigênio, os antioxidantes endógenos são oxidados, mas depois restaurados novamente usando enzimas especiais. Portanto, no organismo, moléculas antioxidantes estão presentes em duas formas: forma reduzida (antioxidante) ou oxidada (após reação com oxidantes). Usando o método cromatográfico, é possível fixar a proporção de formas reduzida e oxidada de antioxidantes e, assim, determinar o grau de estresse oxidativo [8].
Biomarcadores de disfunção mitocondrial e estresse oxidativo:
1,8-isoprostano.
2. Malondialdeído
3. O-tirosina, 3-clorotirosina, 3-nitrotirosina.
4. Produtos de oxidação de proteínas (AOPP).
5,8-hidroxiguanosina (8-OHG)
6. 8-hidroxi-2'-desoxiguanosina (8-OHdG).
7. MtDNA celular (seu número e a presença de variantes mutadas com deleções)
8. Antioxidantes endógenos (glutationa, cisteína, ácido úrico, ubiquinol).
Autores da revisão: Denis Odinokov, Alexey Rzheshevsky.
Lista de literatura usada:1. Pamplona, R., Portero_Otnn, M., Ruiz, C., Gredilla, R., Herrero, A. e Barja, G. (2000) O teor de ligações duplas de fosfolipídios e peroxidação lipídica correlaciona-se negativamente com a longevidade máxima no coração de mamíferos, Mech. Aging Dev., 112, 169-183.
2. Lehmann G1, Segal E, Muradian KK, Fraifeld VE. O DNA mitocondrial e a taxa metabólica se complementam na determinação da longevidade máxima dos mamíferos? Rejuvenation Res. Abr. 2008; 11 (2): 409-17.
3. Muradian KK1, Lehmann G, Fraifeld VE. Hipótese NUMT ("novo poderoso") de longevidade. Rejuvenation Res. 2010 Abr-Jun; 13 (2-3): 152-5.
4. Gollihue, Jenna L., Samir P. Patel e Alexander G. Rabchevsky. Estratégias de transplante mitocondrial como potencial terapêutica para trauma do sistema nervoso central. Pesquisa de regeneração neural13.2 (2018): 194.
5. Kamila Syslová, Adéla Böhmová, Miloš Mikoška, Marek Kuzma, Daniela Pelclová e Petr Kačer. Triagem multimarcas do estresse oxidativo no envelhecimento. Oxid Med Cell Longev. 2014; 562860. Publicado online em 16 de julho de 2014.
6. Yashin A., Yashin Y. Cromatografia líquida de alta eficiência de marcadores de estresse oxidativo. 2011. Analytics. No. 1, 34-43.
7. Foram N. et al. Associação dos níveis de DNA mitocondrial com fragilidade e mortalidade por todas as causas. J. Mol Med (Berl). 2015 fev; 93 (2): 177-186.
8. Goon A.A. Subbotina T.F., Alekseevskaya E.S., Moiseeva O.M., Gaviallyuk N.D., Irtyuga O.B. Marcadores metabólicos e proteicos da disfunção mitocondrial em pacientes com doença cardiovascular Diagnóstico clínico laboratorial. 2015; 60 (7): 35–41.