As proteínas desempenham um papel crucial em todos os organismos vivos, desempenhando muitas funções diferentes. Como você sabe, eles são compostos de aminoácidos. Para cumprir suas funções, as proteínas não devem ser apenas uma cadeia de certos aminoácidos, mas devem ter uma certa forma espacial, ou seja, se encaixar adequadamente no espaço. Por várias razões, pode ocorrer um mau funcionamento na dobra normal da proteína na estrutura desejada. Então, em vez de proteínas dobradas incorretamente, que tendem a se unir em aglomerados, agregados de proteínas são fibrilas amilóides. O mais famoso desses agregados é o β-amilóide (Aβ, Abeta), presumivelmente associado ao desenvolvimento de neuropatologias, além de alguns tipos de câncer e uma das causas de demência em pessoas com síndrome de Down.
Essas estruturas proteicas têm um diâmetro de cerca de 5 a 10 nm e um comprimento de até 800 nm e consistem em dois ou mais filamentos multidirecionais paralelos que formam uma estrutura específica - a conformação com dobras cruzadas beta. É essa estrutura que determina a propriedade óptica específica do amilóide - a capacidade de birrefringência. E a descoberta dessa propriedade é a base para o diagnóstico de amiloidose. A microscopia de corantes com preparações de corante vermelho do Congo em amilóide de luz polarizada altera a cor vermelha para um brilho verde [1].
Acumuladores de proteínas anormais são chamados pelos autores do conceito SENS de "detritos extracelulares" (lixo extracelular) e determinam uma das causas do envelhecimento, o que parece bastante justo. As fibrilas amilóides, devido à sua estrutura, não estão sujeitas à ação de enzimas especiais que quebram proteínas (proteases) e, portanto, têm a propriedade de se acumular nos tecidos do corpo, interrompendo seu trabalho. As propriedades estruturais e físico-químicas do amilóide dependem da principal proteína precursora, cujo conteúdo na fibrila é de cerca de 80%, e isso determina uma característica específica para cada tipo de amiloidose. O termo amiloidose refere-se a um grupo de doenças hereditárias ou adquiridas associadas à deposição extracelular de fibrilas de proteínas insolúveis que causam distúrbios estruturais dos tecidos e disfunções orgânicas. Atualmente, são conhecidas mais de 20 proteínas precursoras amiloidogênicas e o mesmo número de variantes clínicas da amiloidose. Além do bem conhecido β-amilóide, existe um amilóide AA associado à artrite reumatóide, doença cardíaca, doença renal e inflamação intestinal, amilóide AIAPP envolvido na patogênese do diabetes mellitus tipo 2 e outros [2].
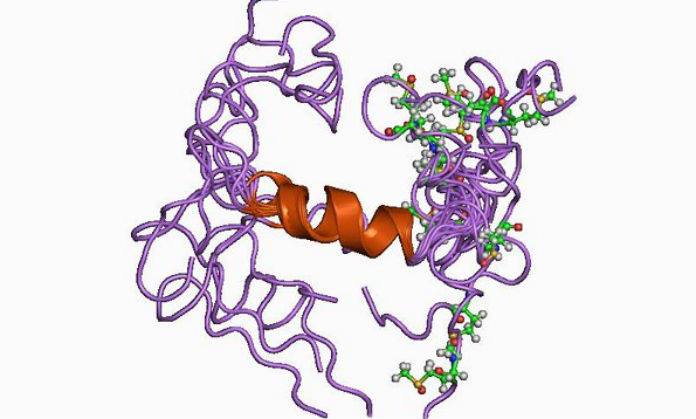 p-amilóide.
p-amilóide.Os autores do SENS veem uma maneira de resolver o problema de acumulação de agregados de proteínas no uso de anticorpos especializados cataliticamente ativos, as chamadas enzimas (enzima inglesa, enzima anticorpo), que são selecionadas especificamente para amiloides e as removem do tecido. Recentemente, um método promissor foi desenvolvido como parte dessa abordagem. Foi descoberto um subconjunto de anticorpos humanos que possui atividade catalítica contra um antígeno específico, quebrando-o em fragmentos menores e menos prejudiciais, em vez de capturá-lo para remoção ou destruição por outras células imunológicas. O uso desses novos anticorpos catalíticos como terapias de direcionamento de amilóide oferece vantagens potenciais sobre o seqüestro de anticorpos usados em outras vacinas amilóides. A primeira é que é necessária uma redução da dose para remover efetivamente os agregados extracelulares dos tecidos. Isso ocorre porque o seqüestro de anticorpos pode capturar e transportar apenas uma molécula amilóide de cada vez. Enquanto as enzimas se ligam à molécula amilóide, triture-a e depois passe para a próxima após a outra, permitindo que cada molécula de anticorpo destrua rapidamente várias moléculas amilóides. Outra é que os anticorpos catalíticos pertencem a uma classe que é mais eficientemente transportada através da barreira hematoencefálica que protege nosso cérebro, enquanto que seqüestrar anticorpos é mais difícil de superar essa barreira [3].
O amilóide mais famoso e mais estudado atualmente é o β-amilóide, que muitos pesquisadores atribuem à doença de Alzheimer. Essa patologia foi descrita há mais de um século por A. Alzheimer, que foi o primeiro a indicar o principal sintoma patomorfológico dessa doença - placas senis insolúveis encontradas no cérebro dos mortos que sofriam com essa doença. Hoje, no mundo, existem mais de 40 milhões de pessoas com diagnóstico de doença de Alzheimer - a probabilidade de desenvolver essa patologia dobra a cada cinco anos, após 65 anos. E as estimativas de longo prazo da OMS sobre o aumento maciço desses pacientes nas próximas décadas são extremamente pessimistas.
Sabe-se que as placas insolúveis no cérebro dos pacientes são formadas principalmente pelo peptídeo β-amilóide (Aβ), que tem um peso molecular de 4 kDa e um comprimento de cerca de 40 resíduos de aminoácidos. Aβ é um fragmento da proteína transmembranar da proteína precursora de amilóide (proteína precursora de amilóide, APP), encontrada em muitos tecidos do corpo, inclusive nas sinapses dos neurônios. A APP está envolvida em alguns processos fisiológicos associados à neuroplasticidade, formação de sinapses e neuroproteção (sobrevivência das células nervosas) [4].
Diferentemente de seu antecessor, o Aβ é tóxico para as células nervosas, contribuindo para sua degeneração e morte. É formado separando o domínio N-terminal extracelular (sAPP) da proteína precursora. Esse processo pode ser realizado por duas secretases diferentes - α-secretase e β-secretase, que possuem uma diferença fundamental em sua ação. No primeiro caso, a fragmentação ocorre entre os resíduos de aminoácidos na sequência Aβ, o que impede a formação subsequente de um peptídeo amilóide. Em segundo lugar, patológico, sob a influência da β-secretase, o processo de fragmentação devido às suas características termina na formação de Aβ. Essa segunda via associada ao desenvolvimento de neuropatologias é mais rara, e por que a fragmentação da proteína precursora segue, ela ainda não está completamente esclarecida [5].
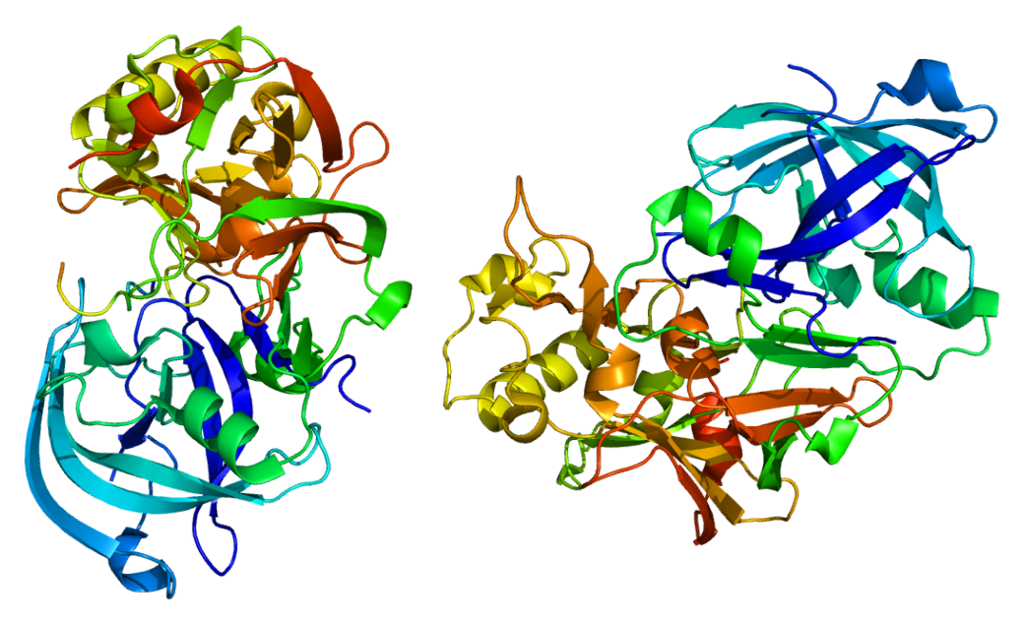 p-secretase.
p-secretase.A neurotoxicidade de Aβ está associada a uma violação da homeostase do cálcio, excitotoxicidade, processos inflamatórios, estimulação do estresse oxidativo e apoptose. A opinião predominante era que o acúmulo de Aβ no cérebro é um processo puramente patológico devido à impossibilidade de remover Aβ do tecido cerebral. Hoje se sabe que o Aβ pode ser eliminado do cérebro de pelo menos duas maneiras: perivascular (através da linfa) e proteolítico (clivagem por várias enzimas) [6, 7]. Portanto, a formação na velhice da doença de Alzheimer com o acúmulo associado de fibrilas amilóides insolúveis pode estar associada a vários fatores estimulantes. Que pode ser de natureza genética e pode estar associado a estresse, hipóxia, isquemia e derrames passados [8].
O β-amilóide oxida o colesterol e os ácidos graxos poliinsaturados, formando as formas mais tóxicas das espécies reativas de oxigênio - radical hidroxila e peróxido de hidrogênio. A racemização do ácido L-aspártico em proteínas de longa duração promove a formação de β-amilóide e α-sinucleína. Acumulações patológicas são observadas na doença de Parkinson, na doença de Alzheimer, na doença de Levy e em outras doenças neurodegenerativas.
Outro sinal patomorfológico de neurodegeneração na doença de Alzheimer são agregados de proteína tau hiperfosforilada (proteína τ): filamentos helicoidais emparelhados (PHF) e emaranhados neurofibrilares (NFT). Fisiologicamente, a proteína τ está envolvida na estabilização de microtúbulos de neurônios, que garantem a transferência através do citoplasma de neurônios de organelas celulares, glicoproteínas e outras substâncias. Na doença de Alzheimer, a proteína τ é hiperfosforilada, perde sua capacidade normal de estabilizar microtúbulos e se acumula na célula com estruturas neurotóxicas insolúveis. O que acontece anteriormente durante a formação da patologia - a formação de agregados amilóides ou de proteínas τ - não é uma questão clara. Mas, obviamente, esses dois processos estão interconectados e se estimulam. Assim, ambas as proteínas patológicas exibem propriedades de prions semelhantes à proteína de prions PrPsc: formas de proteínas dobradas incorretamente pelo tipo de reação em cadeia estimulam a transformação de proteínas normais em irregulares em neurônios saudáveis. Entre si, Aβ e a proteína τ também interagem pelo tipo de príons: é descrito como Aβ ativa a proteína quinase GSK3, fosforilando a proteína τ e causando a sua formação inadequada [5].
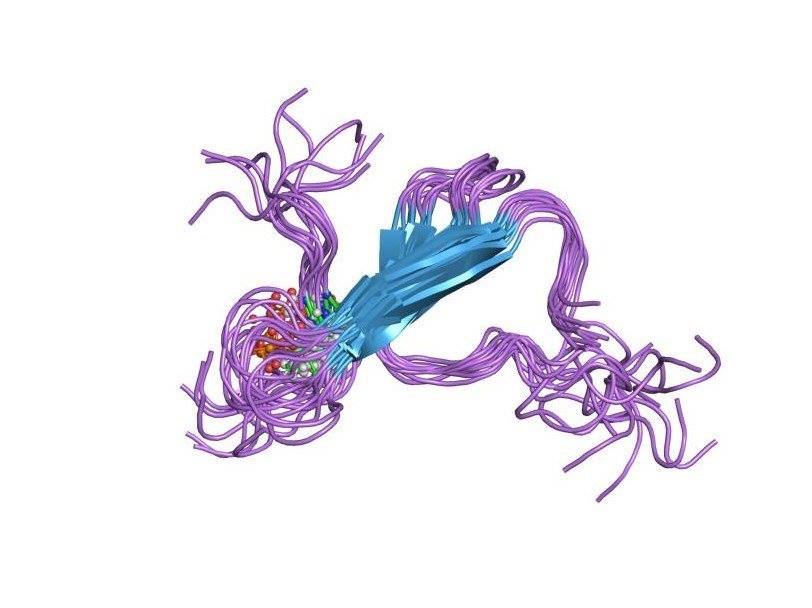 proteína τ.
proteína τ.Mais recentemente, acreditava-se que, embora as doenças de príons e a doença de Alzheimer tenham certas semelhanças bioquímicas, a segunda patologia, ao contrário da primeira, não é infecciosa e não é transmitida de um organismo para outro. Mas em 2015, a primeira notícia perturbadora apareceu. Na revista Nature, um artigo foi publicado por neurologistas britânicos, no qual eles conversavam sobre a possível rota de transmissão de Aβ de uma pessoa para outra. Os autores realizaram um estudo de autópsia do cérebro de oito pessoas que morreram da doença de Creutzfeldt-Jakob. Nos seis mortos, além das lesões associadas à doença subjacente, foram encontradas extensas acumulações de amiloides no cérebro. O que não é característico nem para a tenra idade dos mortos, nem para esta patologia. Também não foram encontrados defeitos associados à amiloidogênese e neuropatologias em seus genomas. Os pesquisadores sugeriram que o Aβ foi introduzido no corpo do falecido durante a injeção do hormônio do crescimento infectado com amilóide. Da mesma forma que várias centenas de pessoas foram previamente infectadas e morreram por injeções de hormônio do crescimento contendo príons [9].
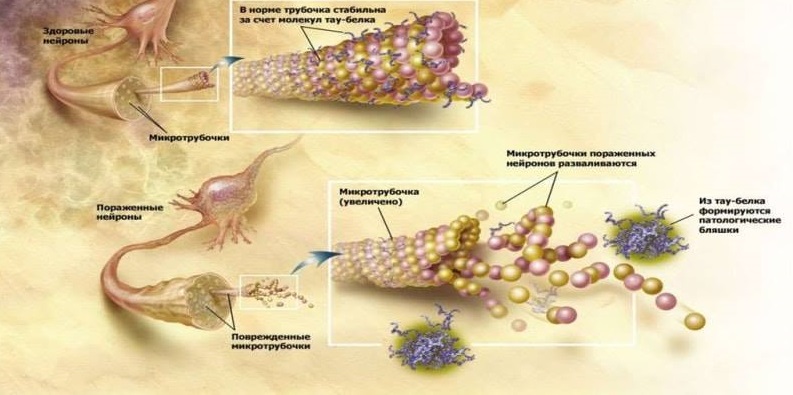 As funções da proteína τ são normais e patológicas.
As funções da proteína τ são normais e patológicas.A confirmação da infecciosidade da doença de Alzheimer pode ser outro estudo em que ratos de laboratório com aumento da amiloidogênese e ratos normais foram cirurgicamente combinados com o fluxo sanguíneo. Como resultado, camundongos saudáveis começaram a acumular Aβ no cérebro, o que não é típico para esses roedores. Este estudo mostrou pela primeira vez o potencial para a penetração de Aβ com sangue no cérebro e subsequente participação no desenvolvimento da neurodegeneração [10].
A relação entre o acúmulo de β-amilóide e proteína τ em tecidos com neuropatologias relacionadas à idade determina a necessidade de buscar métodos eficazes para identificar esses agregados de proteínas como biomarcadores da futura neuropatologia e envelhecimento acelerado. Hoje, vários desses métodos já são conhecidos.
Depósitos amilóides no tecido cerebral podem ser detectados usando tomografia por emissão de pósitrons, quando o β-amilóide é determinado pelo isótopo radioativo introduzido no corpo e conectado ao amilóide.
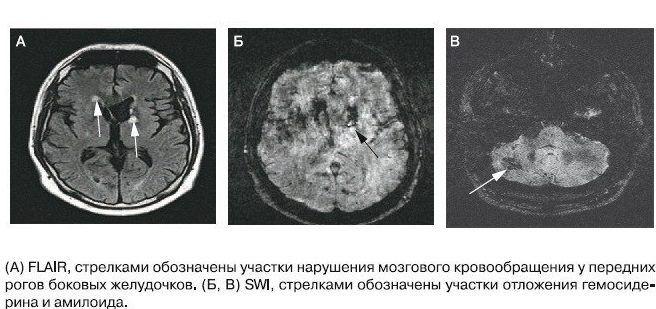
Um dos biomarcadores mais sensíveis no diagnóstico precoce da doença de Alzheimer e nos Distúrbios Congestivos Moderados (UKI) na transição para a fase de patologia hoje é considerado os níveis de amilóide Aβ-42, proteína τ total e proteína τ fosforilada no líquido cefalorraquidiano (LCR). Além disso, os amiloides com patologia mostram uma diminuição no nível, e os níveis no líquido cefalorraquidiano da proteína τ, total e fosforilada, aumentam. Isso se deve ao fato de que em pessoas saudáveis não há acúmulo de amilóide na forma de placas e, portanto, uma grande quantidade de amilóide livre é encontrada no líquido cefalorraquidiano. Valores baixos da proteína τ mostram a ausência de destruição do citoesqueleto neuronal.
Foi encontrada uma correlação significativa entre a idade e uma desaceleração na excreção de β-amilóide do sistema nervoso, que pode estar associada à esclerose dos vasos linfáticos e à diminuição da capacidade de drenagem. A restauração da drenagem é um dos tratamentos promissores para a doença de Alzheimer, proposto por Leucadia, cuja entrevista com o fundador foi traduzida e publicada em
habr.com/post/371513Portanto, a concentração Aβ-42 no líquido cefalorraquidiano no nível de 716,9 ± 94,2 ng / ml pode ser considerada um indicador normal para uma pessoa saudável. E o nível de Aβ-42, mostrando um risco aumentado de neuropatologia, é <209 ng / ml. Para uma proteína τ, níveis de 73,9 ± 51,7 ng / ml são considerados valores normais no líquido cefalorraquidiano. Um aumento nos níveis de proteína-τ para 231,6 ± 158,5 ng / ml já pode indicar a presença de um processo neurodegenerativo ativo. Segundo as idéias de hoje, um estudo combinado dos níveis de proteína β-42 e τ no líquido cefalorraquidiano mostra alta sensibilidade no diagnóstico precoce de neuropatologias - 94% da probabilidade de diagnosticar a doença de Alzheimer [11].
Em breve, é esperado o surgimento de métodos imunológicos e espectrométricos de massa ultra-sensíveis para o diagnóstico de amiloidose (proporções das proteínas Aβ42 / 40 ou APP669-711 / Aβ42) e neurodegeneração (proteínas τ e neurofilamentos) no plasma sanguíneo [12]. Existem também métodos "sem marcas" para detectar proteínas dobradas incorretamente no plasma [13].
Autores da revisão: Denis Odinokov, Alexey Rzheshevsky.
Lista de literatura usada- Rameev V., Kozlovskaya L. Amiloidose: métodos modernos de diagnóstico e tratamento. Farmacoterapia eficaz. Urologia e Nefrologia. 2012. No. 11, p.6-15.
- Butler L.I., Karpova O.Yu., Alexandrova E.N., Petrova S.Yu. Amiloidose do coração em idosos. Arquivo de Medicina Interna. 2015. No. 6 (26), p. 28-36.
- AmyloSENS: Removendo lixo eletrônico entre as células.
- 4Lee, V., Goedert, M., Trojanowski, J. (2001) Tauopatias neurodegenerativas, Annu. Rev. Neurosci., 24, 1121-1159.
- Tatarnikova O.G., Orlov M.A., Babkova N.V. Proteína beta amilóide e proteína Tau: estrutura, interação e propriedades semelhantes a príons. Advances in Biological Chemistry, volume 55, 2015, p. 351-390.
- Weller, R., Yow, H., Preston, S., Mazanti, I., Nicoll, J. (2002) A doença cerebrovascular é um fator importante no fracasso da eliminação da beta amilóide do envelhecimento do cérebro humano, Ann. NY Acad. Sei., 977, 162-168.
- Nalivaeva, N., Fisk, L., Belyaev. N., Turner, A. (2008) Enzimas degradantes de amilóide como alvos terapêuticos na doença de Alzheimer, Curr. Alzheimer Res., 5, 212-224.
- Fisk, L., Nalivaeva, N., Boyle, J., Peers C., Turner A. (2007) Efeitos da hipóxia e estresse oxidativo na expressão de neprilysin em células de neuroblastoma humano e neurônios corticais de ratos e astrócitos, Neurochem. Res. 32, 1741-1748.
- Jaunmuktane Z., Mead S., Ellis M., Wadsworth JDF, Nicoll AJ, Kenny J., et al .. (2015). Evidências para transmissão humana da patologia β-amilóide e angiopatia amilóide cerebral. Nature 525, 247-250.
- XL Bu, Y Xiang, WS Jin, J Wang, LL Shen, ZL Huang, K Zhang, YH Liu, F Zeng, JH Liu, HL Sun, ZQ Zhuang, SH Chen, XQ Yao, B Giunta, YC Shan, J Tan , XW Chen, ZF Dong, HD Zhou, XF Zhou, W Song e YJ Wang. A proteína β-amilóide derivada do sangue induz patologias da doença de Alzheimer. Psiquiatria Molecular. 2017.
- V.Yu. Lobzin, A.Yu. Emelin, L.A. Alekseeva. Biomarcadores liquorológicos da neurodegeneração no diagnóstico precoce de comprometimento cognitivo. Boletim da Academia Médica Militar da Rússia. 2013, n. 4, p. 15-20.
- Blennow, Kaj e Henrik Zetterberg. "Biomarcadores para a doença de Alzheimer - status atual e perspectivas para o futuro." Jornal de medicina interna (2018).
- Nabers, Andreas, et al. "O biomarcador de sangue amilóide detecta a doença de Alzheimer". Medicina molecular EMBO (2018).