O desenvolvimento da terapia do envelhecimento não é possível sem um diagnóstico confiável do envelhecimento. Não parece razoável esperar a morte de uma pessoa ou o aparecimento de uma doença mortal para entender: desaceleramos ou não o processo de envelhecimento, com esta ou aquela terapia. Devemos ver imediatamente a imagem objetiva causada por nossas intervenções antienvelhecimento.
Na prática clínica, ainda não existe um "grande diagnóstico de envelhecimento". Ou seja, não é possível ao paciente e ao médico assistente detectar alterações relacionadas à idade no nível molecular que precede o início das doenças. Queremos preencher essa lacuna descrevendo, em primeiro lugar, todos os principais marcadores de mudanças relacionadas à idade e o nível tecnológico disponível para medi-las.
Continuaremos a apresentação do conceito de diagnóstico SENS do envelhecimento, com base no fato de que hoje o programa SENS (alcançar um envelhecimento desprezível por métodos de engenharia) descreve mais detalhadamente abordagens para aumentar a vida útil do ser humano.
Muitos já ouviram falar sobre glicosilação de proteínas, produtos finais de glicação (GNC, IDADE) e os danos que causam ao organismo. Mas, note-se que a adição de açúcares a outras moléculas está longe de ser sempre uma patologia. A glicosilação em si é um processo fisiológico muito comum e importante em organismos vivos. Assim, uma parte significativa de todas as proteínas sintetizadas nas células sofre glicosilação enzimática, necessária para o seu funcionamento normal.
Basicamente, dois glicanos (a parte de carboidrato do ligamento é uma molécula orgânica) participam da glicosilação: N-glicanos (ligados ao grupo amida da asparagina) e O-glicanos (ligados ao grupo hidroxil da serina ou treonina). Devido ao envelhecimento, estamos mais interessados em N-glicanos. É descrito que, com o envelhecimento, o espectro das cadeias de açúcar muda, que se liga às proteínas imunes durante a N-glicosilação. E essa mudança desempenha um papel fundamental no aumento relacionado à idade na inflamação geral no corpo. Assim, o nível de anticorpos IgG glicosilados pode prever a idade biológica de uma pessoa com ainda mais precisão do que o comprimento dos telômeros [1].
Além disso, mais dois glicanos, NGA2F e N2AF, provaram ser biomarcadores de envelhecimento promissores. Como parte do programa de pesquisa europeu MARK - AGE sobre biomarcadores de envelhecimento, que terminou em 2013, o teste GlycoAgeTest foi desenvolvido para determinar a idade biológica de uma pessoa. Baseia-se na proporção do número de glicanos NGA2F (aumentando com a idade) e N2AF (cujo nível diminui com a idade). Outro potencial biomarcador de doenças relacionadas ao envelhecimento e à idade (cardiovascular e diabetes) descrito no estudo MARK - AGE foi a glicoproteína clusterina, que está envolvida na estabilização das estruturas proteicas [2].
Passamos agora à consideração da parte patológica desse fenômeno. Além da glicosilação enzimática regulada pelo organismo, existe uma forma não enzimática desse processo, o chamado Reação de Maillard, cujo resultado é o aparecimento no corpo de uma variedade de produtos de glicação. Deve-se notar que o processo de glicosilação não enzimática praticamente não é regulado. Embora exista a possibilidade de "restringir" a glicosilação por transglicação, na qual são consumidos glutationa, poliaminas, tióis, aminoácidos livres, por exemplo, taurina e lisina. E também através da inativação do metilglioxal pelo sistema glioxalase: a glioxalase I converte metilglioxal e glutationa reduzida em lactoilglutationa, que é então metabolizada em D-lactato pela glioxalase II.
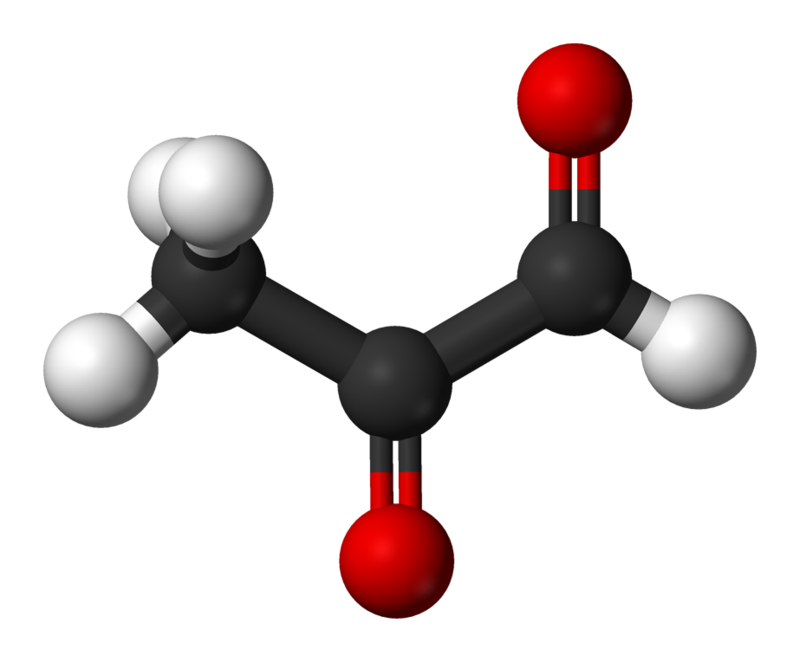 Estrutura metilglioxal
Estrutura metilglioxalEntre os produtos de glicação, destacam-se produtos de glicação precoce (produtos de Amadori) e tardios (ou finais). A glicosilação não enzimática ocorre em várias etapas. Esse processo começa com o fato de que a glicose e outros açúcares simples se combinam com o grupo amino e desencadeiam uma cadeia de reações adicionais. No início, durante a reação entre o grupo aldeído de açúcares e o grupo amino, um grupo instável de aldimina (base Schiff) é formado, o que pode se transformar em vários outros compostos mais estáveis, produtos de glicosilação precoce, os chamados Produtos Amadori. Um dos primeiros produtos da adição de glicose à proteína é a Ne-fructosil-lisina, que, por sua vez, degradando forma vários produtos finais da glicação (GNC). Hidroimidazolonas, derivados de resíduos de arginina modificados por glioxal, metilglioxal e 3-desoxiglucosona (3-DG), são produzidos em maiores quantidades como GNC. Outros CNGs bem estudados são Nδ - carboximetil - lisina (CML) e Nδ - carboxietil - lisina (CEL), bem como glicose e pentosidina, características da reticulação de proteínas [3]. Um dos tipos de GNC mais facilmente definidos é a pentosidina, que se acumula, por exemplo, nos tendões dos grandes músculos de uma pessoa (ou seja, onde a velocidade da renovação do colágeno é mais lenta) a partir dos 20 anos e sua concentração aumenta linearmente para a velhice.
Até recentemente, acreditava-se que a glicose é a principal substância para a formação de GNV. Mas o estabelecimento exato de diferentes taxas de formação intra e extracelular de GNC mostrou que não é assim. Açúcares como frutose, glicose-6-fosfato e gliceraldeído-3-fosfato têm uma taxa mais alta de formação intracelular de GNC. O efeito negativo do gliceraldeído na molécula da principal proteína contrátil e da proteína citoesquelética actina foi descrito, o que leva à formação de ligações cruzadas com pentosidina e bitirosina e perda da funcionalidade da actina [4].
 Reticulação de moléculas de colágeno com glucosepan.
Reticulação de moléculas de colágeno com glucosepan.Pensa-se agora que a glicosilação não enzimática e o GNV estejam intimamente associados a uma série de doenças dependentes da idade, como diabetes, artrite reumatóide, aterosclerose, doença de Parkinson e Alzheimer, esclerose lateral amiotrófica, catarata e câncer [5]. As proteínas sujeitas a glicação na reação de Maillard tornam-se reticuladas aphisiologicamente, perdendo suas propriedades. Isso apresenta um problema particularmente grande para proteínas de vida longa (por exemplo, as moléculas de colágeno da pele, de acordo com vários estudos, têm meia-vida de 15 anos e cartilagem mais de 100 anos), que constituem uma parte significativa de todas as proteínas do corpo - cerca de um terço. A ligação cruzada adicional resultante entre as moléculas viola as funções dessas proteínas, o que leva a uma perda de elasticidade do tecido e é frequentemente observada com o envelhecimento e as patologias. A glicação também faz com que a proteína de colágeno, que já é lentamente renovada, se torne ainda mais longa - após a glicação, ela adquire resistência à ação fisiológica das colagenases endógenas, que propiciam a renovação do tecido.
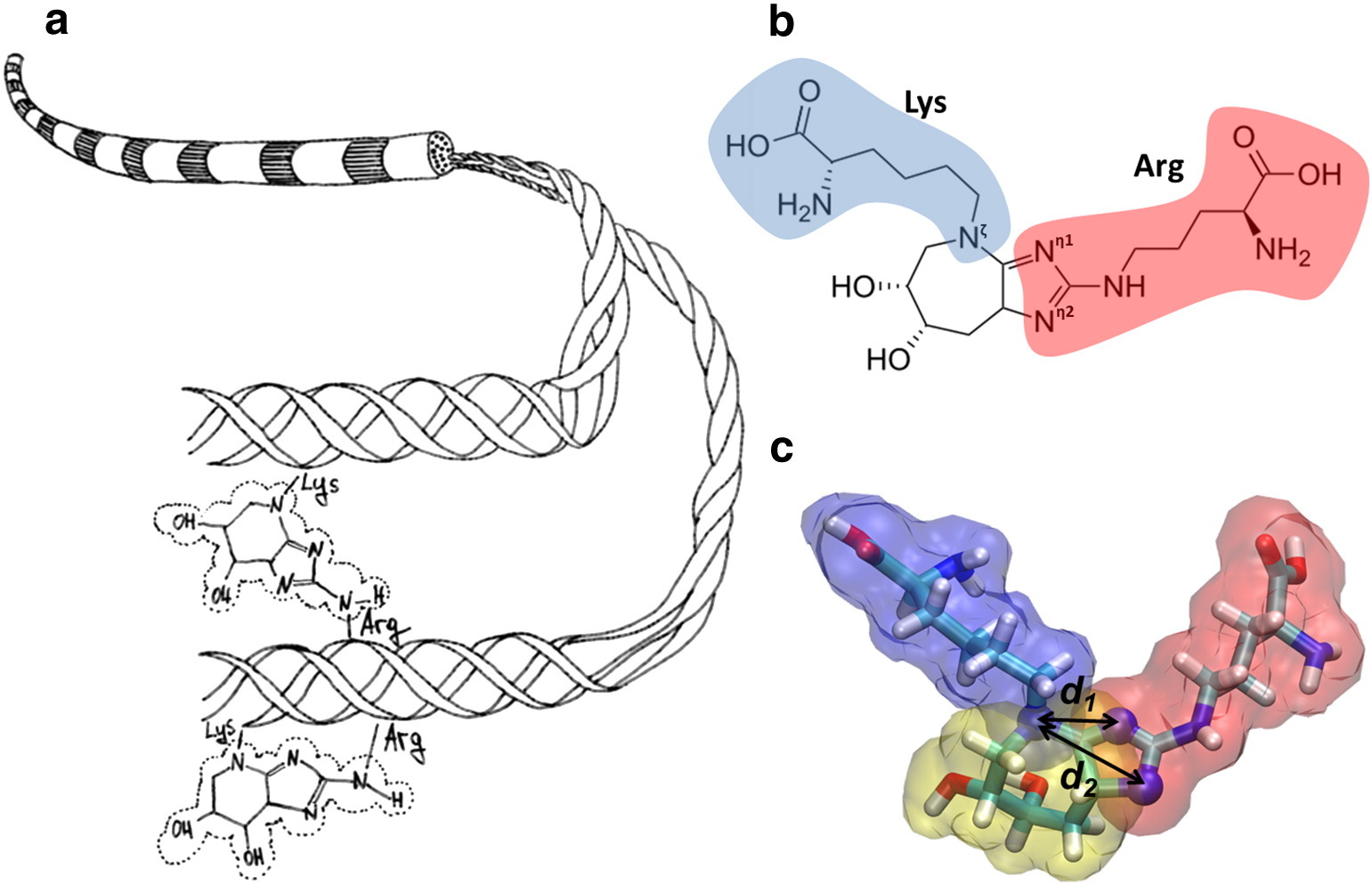 A Figura (a) mostra um diagrama de fibrilas de colágeno e a formação de glucoseepan, que liga covalentemente as cadeias laterais de lisina e arginina. (b) É mostrada a estrutura química do glucosopan, que reticula a lisina (azul) com a arginina (vermelha). (c) Um modelo molecular de glucosopano é mostrado.
A Figura (a) mostra um diagrama de fibrilas de colágeno e a formação de glucoseepan, que liga covalentemente as cadeias laterais de lisina e arginina. (b) É mostrada a estrutura química do glucosopan, que reticula a lisina (azul) com a arginina (vermelha). (c) Um modelo molecular de glucosopano é mostrado.É descrita a participação do fator de crescimento de fibroblastos glicado β-FGF na formação de fibrose. A glicação da sequência arg-gli-asp da proteína fibronectina leva a uma violação da capacidade regenerativa vascular e à progressão de patologias vasculares. Os CNGs se acumulam na lente e na retina com a idade. As cristalinas, as principais proteínas estruturais das lentes oculares, são suscetíveis à glicação e à reticulação. A glicação das proteínas do cristalino leva à catarata. A hemoglobina glicada, usada para determinar o nível médio de glicemia nos últimos 3 meses, perde a capacidade de transferir oxigênio para os tecidos, o que afeta negativamente muitos processos químicos.
Sabe-se também que a glicação proteica e a formação de GNC são acompanhadas por um aumento da atividade de radicais livres e peroxidação lipídica, o que contribui para o desenvolvimento de doenças relacionadas à idade. Isso se deve ao fato de que, no processo de glicação protéica, são iniciados os processos de auto-oxidação do açúcar, acompanhados de um aumento na produção de espécies reativas de oxigênio (ERO). Além disso, a ligação do GNC ao receptor de GNC (RAGE) também leva à formação de ERO reativa e à subsequente ativação do fator de transcrição NF-kB sensível ao estresse oxidativo associado à inflamação e aterogênese.
Por sua vez, a ativação de NF-κB aumenta a expressão de RAGE, criando um ciclo de feedback positivo que melhora a produção de promotores inflamatórios. Além disso, a interação CNG-RAGE ativa a NADPH oxidase (um complexo de enzimas que produz superóxido), o que aumenta o estresse oxidativo intracelular. E o aumento do estresse oxidativo pela NADPH oxidase em resposta à interação da AGE-RAGE ativa, por sua vez, o NF-κB. E aqui podemos observar uma série de "círculos viciosos" - ciclos com feedback positivo.
A glicação das proteínas da cadeia respiratória mitocondrial também contribui para esse processo: a ruptura da cadeia respiratória serve como uma fonte constante de radicais superóxido. Além disso, a formação nas mitocôndrias e em outras estruturas sob a influência da glicação de GNCs indecomponíveis pode ser responsável pela implementação de um fenômeno como “memória metabólica”. Quando em pacientes com diabetes tipo 2, o controle glicêmico estrito não impede mais o desenvolvimento de complicações associadas à doença cardiovascular. Supõe-se que os GNCs indecomponíveis desempenhem um papel importante nesse fenômeno [6].
Além disso, com a glicação, ocorre um aumento nos processos inflamatórios. Assim, durante a glicosilação do colágeno, os produtos finais desse processo se acumulam na matriz extravascular, que o corpo percebe como estranha. Por esse motivo, surgirá uma resposta imune durante a qual as células imunes - macrófagos - aumentarão a secreção de citocinas pró-inflamatórias (TNF-α, interleucina-6 etc.), conhecidas por sua capacidade de afetar negativamente a resistência à insulina e a aterogênese [7].
Além disso, as proteínas "reticuladas" alteram a estrutura (nanotopografia) e aumentam a rigidez da matriz extracelular e, por meio de mecanorreceptores de membrana e do citoesqueleto celular, juntamente com moléculas de sinalização, afetam a expressão gênica, a função das células, tecidos e o corpo como um todo. Além disso, graças ao prolina, as moléculas de colágeno conduzem ondas eletromagnéticas fracas geradas por células e tecidos e, possivelmente, além de sinais mecânicos e químicos, formam um único sistema de sinais bioelétricos do corpo. É interessante notar que, alterando a topografia da radiação média ou eletromagnética, você pode não apenas controlar o ciclo celular, mas também transformar células somáticas adultas em células-tronco sem a ajuda de vírus com o vetor de fatores Yamanaka.
Mesmo pequenas alterações no módulo de cisalhamento e viscoelasticidade do meio intercelular têm um forte efeito sobre as células - a matriz extracelular "antiga" pode limitar significativamente a eficácia do uso de senolíticos e terapia com células-tronco. Assim, os fibroblastos "jovens" envelhecem rapidamente na matriz antiga e vice-versa - as células "velhas" perdem sinais de um fenótipo secretor relacionado ao envelhecimento na matriz "jovem".
Quais são as causas das proteínas glicadas e do GNV? Acredita-se que o principal para o homem moderno hoje seja junk food. A crosta marrom-preta frita sobre os produtos representa a coleta de GNV, formada devido ao processamento térmico de produtos (fritar carne, batatas, etc.) a altas temperaturas. O bacon frito é considerado o recordista do número de GNCs formados. Além disso, o consumo de alimentos que contêm muitos carboidratos rápidos (confeitaria, bebidas açucaradas, etc.) também pode contribuir para a glicação de proteínas e a formação de GNV. Existem produtos conhecidos que, pelo contrário, ajudam a resistir ao acúmulo de GNC - rabanete preto, rabanete, brócolis, graças à substância sulforafano contida neles. Não é de surpreender, mas junto com os gourmets, os fumantes fornecem regularmente doses elevadas de GNV. A fumaça do tabaco contém glicotoxinas que reagem com os resíduos de lisina e arginina para formar o GNV. É provavelmente por isso que os fumantes têm inflamação crônica dos órgãos respiratórios [8].
Como já mencionado, além da influência de fatores externos, a formação de GNC também normalmente ocorre endogenamente (isto é, dentro do corpo) sob condições fisiológicas. Embora esse processo seja lento e insignificante, ele aumenta significativamente com o aumento da concentração de radicais livres, com resistência à insulina, diabetes mellitus e aumento da glicemia. Acumulando no corpo, o GNC puxa uma pessoa para o "pântano" de processos patológicos, dos quais não é tão fácil sair disso.
Na expressão figurativa dos autores do SENS, a reticulação de proteínas atua como "algemas" moleculares que ligam as moléculas de proteínas, violando assim sua função. Os autores do SENS veem uma solução para esse problema no desenvolvimento de medicamentos que podem reagir com reticulação e quebrá-los sem destruir outras características estruturais das moléculas. Na sua opinião, uma circunstância favorável nesse processo é que as ligações cruzadas que ocorrem como acidentes químicos nas estruturas de nossas moléculas de proteína têm uma estrutura química muito incomum, que normalmente não ocorre em substâncias produzidas pelo organismo. O que deve facilitar a busca e criação de agentes terapêuticos.
Além disso, os autores do SENS identificam várias abordagens promissoras para resolver esse problema. Como encontrar ou desenvolver enzimas, em vez de drogas, para quebrar ligações cruzadas. Assim como o desenvolvimento de proteínas "descartáveis" que destruiriam a reticulação e, então, elas mesmas seriam destruídas no processo. Sabe-se que essas proteínas existem para outros fins, por exemplo, proteína regeneradora de DNA MGMT [9]. A favor de uma abordagem para a busca de enzimas, diz o fato de que as enzimas desidratantes são descritas em organismos vivos. Assim, em fungos e bactérias, foram encontradas as enzimas amadoríase resistentes à glicação, frutossolisina-6-quinase frlD e deglycase frlB-frutossolisina-6-fosfato frlB, atuando em compostos de aminoácidos de baixo peso molecular com açúcares [10]. Nos vertebrados, foram encontradas as enzimas fructosamina-3-cinase (FN3K) e sua proteína relacionada FN3K-RP, que são capazes de decompor produtos de glicação intracelularmente em processos dependentes de ATP [11].
Acredita-se que a glucoseepane tenha o maior efeito no curso de doenças em idosos e, portanto, seja um alvo prioritário da terapia antienvelhecimento.
Infelizmente, a glicose não foi escolhida como alvo de medicamentos anti-reticulação desenvolvidos anteriormente, como Alagebrium / ALT-711 (Wolffenbuttel et al., 1998), C36 (Cheng et al., 2007), TRC4149 (Pathal et al., 2008 ), e ele só precisa provar seu papel nos mecanismos do envelhecimento. Essas substâncias visavam neutralizar a carboximetililina, o produto da reação tardia de Maillard mais comum que se acumula no corpo com diabetes.
No momento, um grupo de David Spiegel da Universidade de Yale está trabalhando na síntese de anticorpos contra proteínas contendo glucoseepan. Aubrey de Gray confirma a importância da pesquisa com glucoseepane e anunciou recentemente o registro do Revel, com base no qual a pesquisa iniciada na universidade provavelmente continuará.
No entanto, é provável que nem anticorpos nem enzimas, devido ao seu tamanho, sejam capazes de penetrar entre as fibrilas de colágeno. Além disso, a reticulação rasgada do colágeno é restaurada após o uso do medicamento, o que exigirá um segundo curso de terapia.
Portanto, catalisadores artificiais semelhantes a enzimas, cujos tamanhos podem ser várias vezes menores que os tamanhos das enzimas originais, parecem ser uma alternativa mais interessante. Moléculas similares com uma determinada atividade catalítica, espiroligômeros, estão sendo desenvolvidas por um grupo de Christian Schaffmeister da Temple University.
Como observado anteriormente, como os produtos finais da glicação se acumulam durante o envelhecimento, sua quantificação pode ser um biomarcador preciso e confiável do envelhecimento. No entanto, tanto a detecção de GNC no corpo quanto o diagnóstico precoce de alterações na composição e estrutura da matriz intercelular são difíceis devido à natureza das alterações, limitada por órgãos e sistemas, e à necessidade de múltiplas biópsias. Mesmo em um organismo, os resultados variam muito, dependendo da localização da biópsia e do tipo de produto final da glicação final sendo examinado.
Os métodos disponíveis para determinar os produtos finais de glicação na pele, como a autofluorescência, ou seja, sem o uso de corantes especiais (o dispositivo AGE-READER fabricado pela empresa holandesa DiagnOptics BV) não fornecem dados precisos e muitos fatores podem influenciar os resultados das medições, por exemplo, alterações na água - .
Atualmente, o método principal e mais preciso para quantificar o GNC no organismo é o método de cromatografia em combinação com a detecção espectrométrica de massa. A espectrometria de massa permite identificar proteínas com um alto grau de certeza e determinar suas quantidades em misturas complexas de proteínas.. ( , .). , –. . ( , ) .
, , , - (). , , . , , (RAGEs). RAGE , Nf-κB (, -, -6 C- ). , . , - , [12].
, - , . 6- Invecchiare in Chianti, 1.013 65 , , , , , , [13]. 2018 , D1-B2, , . [14]
- (, DOGDIC, MODIC GODIC), [15]. , – GOLD MOLD [16].
: , .
:- Krištić J, Vučković F, Menni C, Klarić L, Keser T, Beceheli I, Pučić-Baković M. et al. Glycans are a novel biomarker of chronological and biological ages.Gerontol A Biol Sci Med Sci. 2014 Jul;69(7):779-89.
- Bürkle A, Moreno-Villanueva M, Bernhard J, Blasco M, Zondag G, Hoeijmakers JH6, Toussaint O, Grubeck-Loebenstein B, Mocchegiani E, Collino S, Gonos ES, Sikora E. et al. MARK-AGE biomarkers of ageing. Mech Ageing Dev. 2015 Nov;151:2-12.
- Ahmed N., Thornalley PJ . . 2009. №9, . 642-51.
- . ., . ., . ., . . in vitro , . . 2006, №2, . 51-59.
- .., . : . , 2010, : 56(2), 168-178.
- .. «» . . . 2011. № 4.
- Bernheim J, Rashid G, Gavrieli R, Korzets Z, Wolach B. In vitro effect of advanced glycation end-products on human polymorphonuclear superoxide production. Eur J Clin Invest. 2001. Dec;31(12):1064-9.
- Mullick AE, McDonald JM, Melkonian G, Talbot P, Pinkerton KE, Rutledge JC. Reactive carbonyls from tobacco smoke increase arterial endothelial layer injury. Am J Physiol Heart Circ Physiol. 2002 Aug;283(2):H591-7.
- GlycoSENS: Breaking extracellular crosslinks.
- Monnier VM, Sell DR. Prevention and repair of protein damage by the Maillard reactionin vivo. Rejuvenation Res. 2006;9(2):264–273.
- Szwergold BS1, Bunker RD, Loomes KM. The physiological substrates of fructosamine-3-kinase-related-protein (FN3KRP) are intermediates of nonenzymatic reactions between biological amines and ketose sugars (fructation products). Med Hypotheses. 2011 Nov;77(5):739-44.
- Semba RD, Najjar SS, Sun K, et al. Serum carboxymethyl-lysine, an advanced glycation end product, is associated with increased aortic pulse wave velocity in adults. Am J Hypertens. 2009;22:74–79
- Semba, RD, Bandinelli, S., Sun, K., Guralnik, JM, & Ferrucci, L. (2009). Plasma Carboxymethyl-Lysine, an Advanced Glycation End Product, and All-Cause and Cardiovascular Disease Mortality in Older Community-Dwelling Adults. Journal of the American Geriatrics Society, 57(10), 1874–1880.
- Wendel U, Persson N, Risinger C, Bengtsson E, Nodin B, Danielsson L, Welinder C, Nordin Fredrikson G, Jansson B, Blixt O. A novel monoclonal antibody targeting carboxymethyllysine, an advanced glycation end product in atherosclerosis and pancreatic cancer. PLoS One. 2018 Feb 8;13(2):e0191872.
- Biemel KM, Fried DA, Lederer MO. Identification and quantification of major maillard cross-links in human serum albumin and lens protein. Evidence for glucosepane as the dominant compound. J Biol Chem. 2002 Jul 12;277(28):24907-15. Epub 2002 Apr 26.
- Chellan P, Nagaraj RH. Protein crosslinking by the Maillard reaction: dicarbonyl-derived imidazolium crosslinks in aging and diabetes. Arch Biochem Biophys. 1999 Aug 1;368(1):98-104.